修回日期: 2006-07-06
接受日期: 2006-07-19
在线出版日期: 2006-09-08
目的: 探讨SKP2在大肠癌中的表达和预后作用.
方法: 采用SP免疫组化法检测68例大肠癌手术切除组织标本中SKP2和P27的表达, 用Kaplan-Meier和Cox回归分析法进行生存分析.
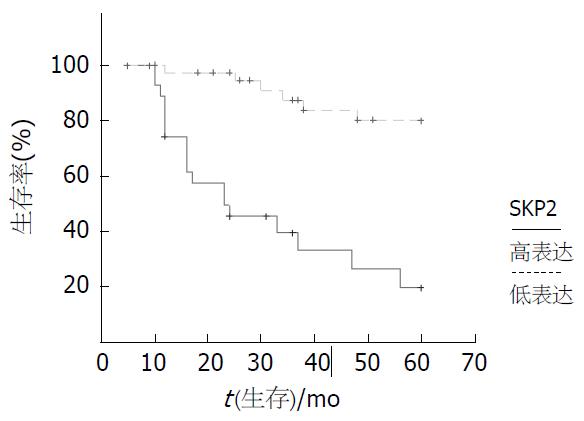
结果: 在68例大肠癌组织中, SKP2和P27的阳性表达率分别为41.2% (n = 28)和52.9% (n = 36). SKP2的表达与组织分级显著相关(χ2 = 14.073, P = 0.001). SKP2表达与年龄、性别和AJCC分期无关(P>0.05). SKP2和P27负相关(r = -0.528, P = 0.0001). SKP2高表达组的总生存期较SKP2低表达组短(31.5±4.0 mo vs 54.5±2.1 mo, P<0.01). 多因素Cox回归分析表明, SKP2表达是大肠癌的独立预后因素(RR = 6.227, P = 0.033).
结论: SKP2表达可以作为大肠癌患者预后的指标.
引文著录: 孙立春, 隋广杰, 刘亚琴. SKP2在大肠癌组织中的表达及预后意义. 世界华人消化杂志 2006; 14(25): 2516-2520
Revised: July 6, 2006
Accepted: July 19, 2006
Published online: September 8, 2006
AIM: To detect the expression of S-phase kinase associated protein 2 (SKP2) and assess its prognostic value in human colorectal carcinoma.
METHODS: SP immunohistochemical method was used to detect the expression of SKP2 P27 proteins in the tissues of colorectal carcinoma (n = 68). Survival analyses were performed using the Kaplan-Meier method and Cox regression model.
RESULTS: Of 68 cases with colorectal carcinoma, the positive rates of SKP2 and P27 expression were 41.2% (n = 28) and 52.9% (n = 36). The expression of SKP2 was significantly correlated with the differentiation of carcinoma (χ2 = 14.073, P = 0.001), but it had no significant correlation with tumor AJCC staging, the gender and ages of patients (P > 0.05). There was a negative correlation between SKP2 and P27 expression (r = -0.528, P = 0.0001). With regard to prognosis, the overall survival rate for patients with the high-SKP2 expression was significantly lower as compared with that for the ones with low-SKP2 expression (31.5 ± 4.0 mo vs 54.5 ± 2.1 mo, P < 0.01). Furthermore, the expression of SKP2 was an independent predictor of prognosis by multivariate Cox regression model analysis (RR = 6.227, P = 0.033).
CONCLUSION: SKP2 expression can serve as a useful prognostic marker in colorectal carcinoma patients.
- Citation: Sun LC, Sui GJ, Liu YQ. Expression and prognostic significance of S-phase kinass-associated protein 2 in colorectal carcinoma tissues. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2516-2520
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2516.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2516
细胞周期调节异常是恶性肿瘤形成的机制之一. P27是真核细胞的细胞周期抑制蛋白, 抑制细胞周期G1-S的进展[1-2]. P27功能的缺失使细胞周期进展, 细胞恶性转化. 在许多恶性肿瘤组织中其表达减少, 如: 肺癌[3]、乳腺癌[4]、大肠癌[5]、垂体瘤[6]、淋巴瘤[7]、神经胶质瘤[8]等, 且与预后差相关. P27蛋白表达减少是由于依赖泛素的蛋白分解增加. SKP2是泛素连接酶中F-Box蛋白的一种, 能特异识别P27, 将之分解[9-11]. SKP2在多种恶性肿瘤中高表达且与许多恶性肿瘤预后差相关[12-15]. 最近发现, SKP2在大肠癌中高表达, 但其预测预后作用尚不清楚. 我们通过对SKP2表达水平的检测, 分析其与临床病理学特征间的关系, 探讨SKP2在大肠癌发生、发展过程中的作用.
我院2000-10/2003-06新鲜手术原发大肠癌患者标本68例, 所有标本经病理证实, 术前未治疗. 男35例, 女33例, 平均年龄(52.6±9.7)岁. 随访5-60(中位33.5) mo, 其中24位患者死于大肠癌. 标本经40 g/L甲醛固定后常规制作石蜡包埋切片, 切片厚4 μm. HE染色复述病理组织学特征, 其他切片行SP免疫组化染色. 鼠抗人SKP2和P27 mAb购自Santa Cruz, 鼠SP试剂盒及DAB-HCL显色试剂盒均购自北京中杉金桥生物公司.
SKP2和P27表达染色均为常规SP免疫组化法, 具体步骤按试剂说明书进行. 染色结果判断标准: 400倍显微镜下每张切片计数5个视野, 每个视野100个肿瘤细胞, 取阳性细胞数百分比的平均值. SKP2阳性细胞为棕黄色颗粒, 主要位于细胞核或细胞核伴细胞质内. 以每张切片阳性细胞数超过20%为高表达. P27阳性反应产物主要位于细胞核, 阳性判断标准为该位置出现了明确的棕黄色颗粒, 小于50%为低表达, 大于50%为高表达. 以北京中杉金桥生物公司提供的阳性切片作为阳性对照, 以0.01 mol/L PBS液(pH 7.4)替代一抗作为阴性对照.
统计学处理 应用SPSS 10.0统计软件. SKP2和P27与临床因素比较用χ2检验或t检验. 用Kaplan-Meier和COX回归分析法进行生存分析. 生存率比较采用Log rank检验. P<0.05有统计学意义.
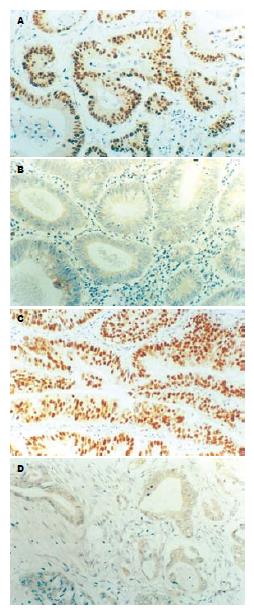
随机选择5个高倍视野, 计数100个肿瘤细胞, 计算阳性细胞百分率. SKP2阳性染色呈棕黄色, 主要位于细胞核或细胞核伴细胞质内. SKP2阳性细胞数<5%为(-), 5%-20%为(+), >20%为(++). 分析中将(-)、(+)归为低表达组, (++)归为高表达组(图1A-B). 在68例大肠癌中, SKP2和P27的阳性表达率分别为41.2% (n = 28), 52.9% (n = 36). SKP2高表达与年龄、性别和AJCC分期无关(P>0.05); 与组织分级显著相关(P<0.05, 表1). P27蛋白阳性染色呈棕黄色, 定位于细胞核(图1C-D). P27阳性细胞数<10%为(-), 10%-50%为(+), >50%为(++). 将(-)、(+)归为低表达组, (++)归为高表达组. P27高表达与年龄、性别无关(P>0.05); 与AJCC分期、组织分级显著相关(P<0.05, 表1).
SKP2蛋白表达与P27蛋白表达呈负相关(r = -0.528, P<0.05, 表2).
| P27表达 | SKP2表达 | r | P | |
| 高 | 低 | |||
| 高 | 10 | 22 | -0.528 | 0.0001 |
| 低 | 30 | 6 | ||
为了确定SKP2表达与大肠癌患者预后的关系, 我们绘制了Kaplan-Meier生存曲线(图2). 在60 mo随访期内, SKP2高表达组平均生存时间显著低于SKP2低表达组, 分别为31.5±4.0 mo和54.5±2.1 mo (P<0.001). 单因素COX回归分析示: SKP2高表达、癌组织分化差、临床分期高与生存期短显著相关(P<0.001). 将SKP2表达、分期、肿瘤分化、P27、年龄、性别经多因素COX回归分析(表3)发现, SKP2高表达、临床分期高、癌组织分化差显著增加患者的死亡风险(P<0.05, P<0.05, P<0.01). SKP2表达是大肠癌的独立预后因素.
| 变量 | r | SEM | Wald | P | RR | OR值95%可信限 | |
| 下限 | 上限 | ||||||
| SKP2 | 1.829 | 0.859 | 4.535 | 0.033 | 6.227 | 1.157 | 33.519 |
| 分期 | 1.754 | 0.784 | 5.002 | 0.025 | 5.776 | 1.242 | 26.856 |
| 组织分级 | 3.234 | 0.801 | 16.298 | 0.000 | 25.388 | 5.281 | 122.059 |
| P27 | 0.085 | 0.721 | 0.014 | 0.907 | 1.088 | 0.265 | 4.473 |
| 年龄 | 0.041 | 0.029 | 2.009 | 0.156 | 1.042 | 0.984 | 1.102 |
| 性别 | 0.429 | 0.475 | 0.815 | 0.367 | 1.535 | 0.605 | 3.896 |
我们的研究发现SKP2蛋白在41.2%的手术切除的大肠癌组织中高表达. SKP2高表达与组织分化差显著相关, 表明其与大肠癌高侵袭性有关. SKP2对正常或异常细胞进入S相是必需的, 所以在正常细胞中SKP2少量表达. SKP2在许多恶性肿瘤中高表达, 其表达水平及活性与肿瘤的发生、发展及生物学性状均有关[12-16]. 目前认为SKP2蛋白在转录和转录后水平调节[17]. SKP2在肿瘤中过度表达的机制尚不清楚. APC/CCdh1(anaphase promoting complex/cyclosome in complex with its activator Cdh1)泛素连接酶分解G0/G1期SKP2[17-18]. 在某些癌组织中, SKP2的过度表达由于基因的扩增, Cdh1失活或表达减少, 可能提高SKP2蛋白水平. APC/CCdh1复合体的其他成分的改变也可能导致SKP2的稳定. 在结肠癌细胞, APC/C的2个主要功能亚基, Apc6/Cdc16和Apc8/Cdc23变异失去活性[19]. 此外, SKP2可能包含阻碍SKP2和APC/CCdh1物理作用的变异, 这些变异可能主要影响N末端的D Box或Cdh1结合位点, 使SKP2抗拒APC/CCdh1的泛素化.
SKP2是Skp1-Cullin-F-Box (SCF复合体)E3连接酶中的一种F-Box蛋白, 他特异识别P27蛋白使之经蛋白酶体途径分解[20]. 许多肿瘤中SKP2蛋白与P27蛋白呈负相关[21]. 我们发现68例大肠癌组织中SKP2蛋白与P27蛋白呈负相关. 在标本中有10例同时高表达SKP2与P27, 6例同时低表达SKP2与P27, 表明除了SKP2尚有其他的机制调节P27表达. Cks1是高度保守的Suc1/Cks家族成员之一, SKP2泛素连接酶复合体降解的靶点是CDK抑制剂P27, 这个过程需要Cks1. 研究表明, 在体内体外, SKP2只有结合Cks1后才能识别P27, 并进行泛素化蛋白酶降解. P27在胞质内可能存在多种泛素化降解途径. P27从细胞核到细胞质的运输可能是由jun激活结构域结合蛋白1(Jab1)调节的. Cks1, Jab1, SKP2和其他因子可能在分解P27中发挥作用. P27与SKP2, Cks1, Jab1之间的关系尚需进一步研究[22].
SKP2与许多恶性肿瘤预后差相关, 例如肺癌[22]、口腔鳞状细胞癌[14]、胃癌[13]. 有关SKP2在大肠癌中与预后的相关性国内外研究较少. 本研究中, SKP2高表达的大肠癌患者生存期短; 而SKP2低表达生存期较长. 多因素分析表明: SKP2表达是大肠癌的独立预后因素. SKP2尚参与许多细胞周期调节因子及转录因子泛素化降解, 如: CyclinA, CyclinB, CyclinE, CyclinD1, CDC25B, P21, P130, P53, P57, E2F, hOrclP等[23-26]. 这些底物的变化可能与恶性肿瘤预后差有关. 我们的研究结果与Shapira et al[19]的结果一致. 总之, SKP2高表达与大肠癌高侵袭性有关, SKP2可能作为大肠癌的预后指标和治疗的新靶点.
发现和寻找大肠癌新的预后标志物和治疗靶点是提高大肠癌疗效的策略之一. SKP2在多种恶性肿瘤中高表达且与许多恶性肿瘤预后差相关.
SKP2在大肠癌中高表达, 与P27负相关. Shapira et al报道过度表达 SKP2与大肠癌预后差显著相关, SKP2可能是大肠癌总生存的预后标志物.
本文采用SP免疫组化法探讨SKP2在大肠癌中的表达和预后作用, 首次在国内报道SKP2与大肠癌预后相关性.
泛素蛋白酶体途径: 细胞内特异降解蛋白质的途径. 通过连续地将激活的泛素连接至与底物蛋白结合的泛素上, 形成多聚泛素链. 26S蛋白酶复合体识别多聚泛素链标记的蛋白, 将之降解为多肽, 释放出的泛素被重新利用.
本文提出将SKP2作为大肠癌的独立预后因素的观点有一定的临床意义, 对大肠癌预后的判断有一定的帮助, 结论可靠.
电编: 张敏 编辑:潘伯荣
| 1. | Philipp-Staheli J, Payne SR, Kemp CJ. p27(Kip1): regulation and function of a haploinsufficient tumor suppressor and its misregulation in cancer. Exp Cell Res. 2001;264:148-168. [PubMed] [DOI] |
| 2. | Slingerland J, Pagano M. Regulation of the cdk inhibitor p27 and its deregulation in cancer. J Cell Physiol. 2000;183:10-17. [PubMed] [DOI] |
| 3. | Esposito V, Baldi A, De Luca A, Groger AM, Loda M, Giordano GG, Caputi M, Baldi F, Pagano M, Giordano A. Prognostic role of the cyclin-dependent kinase inhibitor p27 in non-small cell lung cancer. Cancer Res. 1997;57:3381-3385. [PubMed] |
| 4. | Chiarle R, Pagano M, Inghirami G. The cyclin dependent kinase inhibitor p27 and its prognostic role in breast cancer. Breast Cancer Res. 2001;3:91-94. [PubMed] [DOI] |
| 5. | Loda M, Cukor B, Tam SW, Lavin P, Fiorentino M, Draetta GF, Jessup JM, Pagano M. Increased proteasome-dependent degradation of the cyclin-dependent kinase inhibitor p27 in aggressive colorectal carcinomas. Nat Med. 1997;3:231-234. [PubMed] [DOI] |
| 6. | Nakayama K, Ishida N, Shirane M, Inomata A, Inoue T, Shishido N, Horii I, Loh DY, Nakayama K. Mice lacking p27(Kip1) display increased body size, multiple organ hyperplasia, retinal dysplasia, and pituitary tumors. Cell. 1996;85:707-720. [PubMed] [DOI] |
| 7. | Chiarle R, Budel LM, Skolnik J, Frizzera G, Chilosi M, Corato A, Pizzolo G, Magidson J, Montagnoli A, Pagano M. Increased proteasome degradation of cyclin-dependent kinase inhibitor p27 is associated with a decreased overall survival in mantle cell lymphoma. Blood. 2000;95:619-626. [PubMed] |
| 8. | Piva R, Cancelli I, Cavalla P, Bortolotto S, Dominguez J, Draetta GF, Schiffer D. Proteasome-dependent degradation of p27/kip1 in gliomas. J Neuropathol Exp Neurol. 1999;58:691-696. [PubMed] [DOI] |
| 9. | Gstaiger M, Jordan R, Lim M, Catzavelos C, Mestan J, Slingerland J, Krek W. Skp2 is oncogenic and overexpressed in human cancers. Proc Natl Acad Sci USA. 2001;98:5043-5048. [PubMed] [DOI] |
| 10. | Latres E, Chiarle R, Schulman BA, Pavletich NP, Pellicer A, Inghirami G, Pagano M. Role of the F-box protein Skp2 in lymphomagenesis. Proc Natl Acad Sci USA. 2001;98:2515-2520. [PubMed] [DOI] |
| 11. | Hershko D, Bornstein G, Ben-Izhak O, Carrano A, Pagano M, Krausz MM, Hershko A. Inverse relation between levels of p27(Kip1) and of its ubiquitin ligase subunit Skp2 in colorectal carcinomas. Cancer. 2001;91:1745-1751. [PubMed] [DOI] |
| 12. | Signoretti S, Di Marcotullio L, Richardson A, Ramaswamy S, Isaac B, Rue M, Monti F, Loda M, Pagano M. Oncogenic role of the ubiquitin ligase subunit Skp2 in human breast cancer. J Clin Invest. 2002;110:633-641. [PubMed] [DOI] |
| 13. | Masuda TA, Inoue H, Sonoda H, Mine S, Yoshikawa Y, Nakayama K, Nakayama K, Mori M. Clinical and biological significance of S-phase kinase-associated protein 2 (Skp2) gene expression in gastric carcinoma: modulation of malignant phenotype by Skp2 overexpression, possibly via p27 proteolysis. Cancer Res. 2002;62:3819-3825. [PubMed] |
| 14. | Kudo Y, Kitajima S, Sato S, Miyauchi M, Ogawa I, Takata T. High expression of S-phase kinase-interacting protein 2, human F-box protein, correlates with poor prognosis in oral squamous cell carcinomas. Cancer Res. 2001;61:7044-7047. [PubMed] |
| 15. | Ma XM, Liu Y, Guo JW, Liu JH, Zuo LF. Relation of overexpression of S phase kinase-associated protein 2 with reduced expression of p27 and PTEN in human gastric carcinoma. World J Gastroenterol. 2005;11:6716-6721. [PubMed] [DOI] |
| 16. | Wirbelauer C, Sutterluty H, Blondel M, Gstaiger M, Peter M, Reymond F, Krek W. The F-box protein Skp2 is a ubiquitylation target of a Cul1-based core ubiquitin ligase complex: evidence for a role of Cul1 in the suppression of Skp2 expression in quiescent fibroblasts. EMBO J. 2000;19:5362-5375. [PubMed] [DOI] |
| 17. | Wei W, Ayad NG, Wan Y, Zhang GJ, Kirschner MW, Kaelin WG Jr. Degradation of the SCF component Skp2 in cell-cycle phase G1 by the anaphase-promoting complex. Nature. 2004;428:194-198. [PubMed] [DOI] |
| 18. | Wang Q, Moyret-Lalle C, Couzon F, Surbiguet-Clippe C, Saurin JC, Lorca T, Navarro C, Puisieux A. Alterations of anaphase-promoting complex genes in human colon cancer cells. Oncogene. 2003;22:1486-1490. [PubMed] [DOI] |
| 19. | Shapira M, Ben-Izhak O, Linn S, Futerman B, Minkov I, Hershko DD. The prognostic impact of the ubiquitin ligase subunits Skp2 and Cks1 in colorectal carcinoma. Cancer. 2005;103:1336-1346. [PubMed] [DOI] |
| 20. | Osoegawa A, Yoshino I, Tanaka S, Sugio K, Kameyama T, Yamaguchi M, Maehara Y. Regulation of p27 by S-phase kinase-associated protein 2 is associated with aggressiveness in non-small-cell lung cancer. J Clin Oncol. 2004;22:4165-4173. [PubMed] [DOI] |
| 22. | Takanami I. The prognostic value of overexpression of Skp2 mRNA in non-small cell lung cancer. Oncol Rep. 2005;13:727-731. [PubMed] [DOI] |
| 23. | Nakayama K, Nagahama H, Minamishima YA, Matsumoto M, Nakamichi I, Kitagawa K, Shirane M, Tsunematsu R, Tsukiyama T, Ishida N. Targeted disruption of Skp2 results in accumulation of cyclin E and p27(Kip1), polyploidy and centrosome overdupli-cation. EMBO J. 2000;19:2069-2081. [PubMed] [DOI] |
| 24. | Yu ZK, Gervais JL, Zhang H. Human CUL-1 associates with the SKP1/SKP2 complex and regulates p21(CIP1/WAF1) and cyclin D proteins. Proc Natl Acad Sci USA. 1998;95:11324-11329. [PubMed] [DOI] |
| 25. | Yokoi S, Yasui K, Iizasa T, Takahashi T, Fujisawa T, Inazawa J. Down-regulation of SKP2 induces apoptosis in lung-cancer cells. Cancer Sci. 2003;94:344-349. [PubMed] [DOI] |
| 26. | Kamura T, Hara T, Kotoshiba S, Yada M, Ishida N, Imaki H, Hatakeyama S, Nakayama K, Nakayama KI. Degradation of p57Kip2 mediated by SCFSkp2-dependent ubiquitylation. Proc Natl Acad Sci USA. 2003;100:10231-10236. [PubMed] [DOI] |