修回日期: 2006-06-20
接受日期: 2006-06-23
在线出版日期: 2006-09-08
目的: 探讨肠上皮细胞基质金属蛋白激酶(MMPs)对中性白细胞化学趋化物NAP-2的影响及其与炎症性肠病炎症发生的关系.
方法: 培养Caco-2高分化人结肠癌上皮细胞和CCD-18细胞, 分别加入人重组MMP-3、IL-1β、MMP抑制剂强力霉素、CT1399、CT1487和抗人NAP-2中性白细胞mAb, Caco-2和CCD-18细胞于37 ℃含50 mL/L CO2条件下培养24 h, 进行化学趋化性试验. 取克罗恩病(CD)和溃疡性结肠炎(UC)的肠黏膜切除标本作实验组. 用RT-PCR方法检测Caco-2细胞和CD和UC的肠黏膜组织的PBP mRNA和MMPs mRNA; 用ELISA和Western blot法分别检测Caco-2细胞和CD和UC的肠黏膜组织的NAP-2蛋白.
结果: MMP-3明显增加IL-1β刺激的Caco-2细胞吸引外周中性白细胞的能力(U = 24.60, P = 0.005; U = 37.22, P = 0.002); 50 μmol强力霉素和0.1 μmol CT1847能显著抑制Caco-2细胞对中性白细胞的趋化性(U = 15.18, P = 0.01; U = 34.73, P = 0.002); 1 mg/L抗人NAP-2中性白细胞mAb能显著抑制Caco-2细胞对中性白细胞的化学趋化性(U = 156.04, P = 0.000). RT-PCR分析表明, MMP-1 mRNA, MMP-2 mRNA, MMP-3 mRNA和MMP-10 mRNA被CCD-18细胞表达; PBP mRNA被Caco-2细胞和UC患者的肠黏膜表达. ELISA和Western blot法分析表明, NAP-2蛋白在活动性UC患者的肠黏膜明显增高, 与CD的结果比较有显著性差异(U = 28.57, P = 0.005).
结论: MMP能激发肠上皮细胞对中性白细胞的趋化反应, MMP通过激活中性白细胞化学趋化物NAP-2产生的免疫调节机制引起炎症性肠病肠上皮细胞炎症发生.
引文著录: 吕小平, 詹灵凌, 姜海行, 唐国都. 炎症性肠病肠上皮细胞基质金属蛋白激酶对NAP-2的影响. 世界华人消化杂志 2006; 14(25): 2510-2515
Revised: June 20, 2006
Accepted: June 23, 2006
Published online: September 8, 2006
AIM: To investigate the effect of matrix metalloproteinases (MMPs) on the neutrophil chemokine neutrophil activating peptide-2 (NAP-2) of intestinal epithelial cells and its relationship with the pathogenesis of inflammatory bowel disease (IBD).
METHODS: Caco-2 human colonic carcinoma cells and human CCD-18 colonic myofibroblast cells were incubated for 24 h at 37 ℃ with 50 mL/L CO2 before being treated with human recombinant MMP-3, IL-1β, the MMP inhibitors doxycyclin, CT1399, CT1847 and monoclonal anti-human NAP-2 neutralizing antibody, respectively. The cultured cells were tested by chemotaxis assay. PBP mRNA and MMPs mRNA in Crohn's disease and ulcerative colitis tissues and cultured cells were examined by reverse transcription-polymerase chain reaction (RT-PCR). The expression of NAP-2 protein in Crohn's disease and ulcerative colitis tissues and cultured cells was detected by enzyme-linked immunosorbent assay (ELISA) and Western blot.
RESULTS: Chemotaxis assays indicated that neutrophil chemoattraction of Caco-2 cells stimulated by IL-1β was significantly increased by MMP-3 (U = 24.60, P = 0.005; U = 37.22, P = 0.002); 50 μmol doxycyclin and 0.1 μmol CT1847 obviously inhibited the neutrophil chemoattractant response of Caco-2 cells (U = 15.18, P = 0.01; U = 34.73, P = 0.002), respectively; 1 mg/L monoclonal anti-human NAP-2 neutralizing antibody significantly inhibited neutrophil chemoattraction of Caco-2 cells (U = 156.04, P = 0.000). RT-PCR showed that MMP-1, MMP-2, MMP-3, and MMP-10 mRNA were expressed in CCD-18 cells; PBP mRNA was expressed in Caco-2 cells and intestinal mucosa of ulcerative colitis. ELISA and Western blot found that the expression of NAP-2 protein in intestinal mucosa of ulcerative colitis was significantly higher than that in intestinal of Crohn's disease (U = 28.57, P = 0.005).
CONCLUSION: MMPs can activate the neutrophil chemokine NAP-2 of intestinal epithelial cells, which indicates that intestinal epithelial immune activation may require the involvement of lamina propria stromal cells.
- Citation: Lv XP, Zhan LL, Jiang HX, Tang GD. Effect of matrix metalloproteinase on the neutrophil chemokine neutrophil activating peptide-2 of intestinal epithelial cells in inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2510-2515
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2510.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2510
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD), 为非特异性肠炎, 其病情反复迁延, 治疗困难. 最近的研究发现IBD炎症组织的基质金属蛋白激酶(MMPs)表达增高, 但其与IBD炎症发生的确切机制仍未完全阐明[1]. 因此, 我们研究肠上皮细胞MMPs对中性白细胞化学趋化物NAP-2的影响及其与IBD发生的关系, 进一步探讨IBD炎症发生的机制.
Caco-2为高分化人结肠癌上皮细胞株(由英国伦敦大学皇后玛丽医学和牙科学院消化病研究中心Ian R Sanderson教授惠赠)保存于加入100 mL/L FCS(Invitrogen,英国)的DMEM液中. Caco-2细胞以3×105/孔接种于聚碳酸酯培养盘中, 然后置于6孔板中, 每孔加入4 mL(膜两侧各2 mL)含有100 mL/L胎牛血清的培养基中培养18-22 d. 以同样方法培养CCD-18人结肠肌纤维原细胞(CRL-1459, Manassas, 美国). 把CCD-18细胞加入Caco-2细胞, 然后分别加入0.5-50 nmol/L人重组MMP-3(San Diego, 美国)、1 mg/L人重组IL-1β(R&D, Systems, 英国)、MMP抑制剂50 μmol/L强力霉素、1 μmol/L CT1399、0.1 μmol/L CT1847和1 mg/L抗人NAP-2中性白细胞mAb(R&D Systems, 英国), Caco-2细胞和CCD-18细胞于37 ℃含50 mL/L CO2培养箱内培养24 h. 19例CD和20例UC患者的肠黏膜切除标本作实验组, 对照组为18例结肠癌的正常肠黏膜标本. 其中CD 9例、UC 10例和对照组9例的肠黏膜切除标本按Flint et al[2]报道的方法分离肠上皮细胞, 其余标本立即放入液氮灌中, 然后再放入-70 ℃的冰箱中保存备用.
1.2.1 化学趋化性试验: 在96孔化学趋化性试验板中加入上述各种细胞培养悬液, 盖上每孔5 μm大小的滤膜. 分别加入通过梯度离心方法从健康人外周血中分离出5×108/L中性分叶核细胞和单核细胞, 放入50 mL/L CO2的培养箱内于37 ℃温度培养1 h, 用显微镜计数通过滤膜的细胞, 计算出化学趋化反应指数.
1.2.2 RT-RCR检测PBP, MMPs mRNA表达: 采用NCBI BLAST软件设计, 所有引物购自Invitrogen公司, 引物序列如下: PBP: F5'-TCACCCTCACTCAGAGGTCTT-3', R5'-AGTGGGTTGAAACCAGGCTTA-3', 片段长度为666 bp; MMP-1: F5'-ATGCACAGCTTTCCTCCACT-3', R5'-CAGGGTTTCAGCATCTGGTT-3', 片段长度252 bp; MMP-2: F5'-CACTTTCCTGGGCAACAAAT-3', R5'-GGACAGACGGAAGTTCTTGG-3', 片段长度244 bp; MMP-3: F5'-AATCAATTCTGGGCCATCAG-3', R5'-AGTGCCCATATTGTGCCTTC-3', 片段长度395 bp; MMP-8: F5'-CTGCAAGGTTATCCCAAGGA-3', R5'-TTGGTCCACTGAAGACATGG-3', 片段长度250 bp; MMP-9: F5'-TTCATCTTCCAAGGCCAATC-3', R5'-TGTCGCTGTCAAAGTTCGAG-3', 片段长度2747 bp; MMP-10: F5'-GCAGCGGACAAATACTGGAG-3', R5'-CCCTATCTCGCCTAGCAATG-3', 片段长度230 bp; MMP-12: F5'-GCTGTCACTACCGTGGGAAA-3', R5'-TTGGGATAATTTGGCTCTGG-3', 片段长度230 bp; β-actin: F5'-GATGCAGAAGGAGATCACTG-3', R5'-TAGTCCGCCTAGAAGCATTTG-3', 片段长度201 bp. 用TRIzol(Invitrogen 英国)从上述各组培养细胞和各组标本组织匀浆中提取总RNA, 测A260nm/A280nm值, 计算RNA浓度. 取RNA 2 μg加入随机引物及M-MLV逆转录酶合成cDNA. 再用逆转录反应液2 μL作为模板, 加入引物和Taq酶后用PCR仪扩增, 循环步骤如下: 变性94 ℃ 30 s, 退火55 ℃ 30 s, 延伸45 s, 共32个循环; 72 ℃延伸5 min终止反应. 以β-actin作为内参照. 扩增引物用15 g/L的琼脂凝胶电泳, 紫外线自动凝胶成像系统照相.
1.2.3 Western blotting检测NAP-2蛋白: 收集上述各组的病理标本, 加入溶解缓冲液(25 mmol/L TBS, pH7.5, 加入0.1 mmol/L EDTA, 5 g/L deoxycholate, 10 g/L IPEGAL, 1 g/L SDS), 并把组织制成匀浆, 在4 ℃温度下以10 000 g离心15 min, 用BCA法(试剂购自Sigma公司)测定上清液的NAP-2蛋白质含量. 再取20 μg加到Nupage 120 g/L Bis-Tris凝胶中(Invitrogen, 英国), 加入移动缓冲液, 通过电泳作用, 把蛋白转移到PVDF膜上(Millipore, 英国), 取出膜加入10 g/L牛奶TBS(含0.1 g/L Tween), 在4 ℃下固定3 h, 然后加入200 mg/L多抗山羊抗人NAP-2抗体(R&D systems, 英国)孵育1晚, 用包含0.1 g/L Tween的TBS反复洗膜, 用2.5 μg/L过氧化酶兔抗山羊抗体(Glostrup, 丹麦)在4 ℃下孵育1 h, 杂交带被高敏感化学发光系统显像.
1.2.4 ELISA检测NAP-2: 按药盒说明书操作, 试剂购自R&D Systems公司(英国), 操作完毕后, 测样品及标准品450 nm吸光度(A值), 以标准品A值做出标准曲线, 根据标准曲线计算出上述各组培养细胞和各组病理标本组织匀浆上清液的样品值.
统计学处理 所有结果用平均数±标准值表示, 采用SPSS 10.0软件进行数据分析, 对相关资料进行U检验, P<0.05为差异有统计学意义.
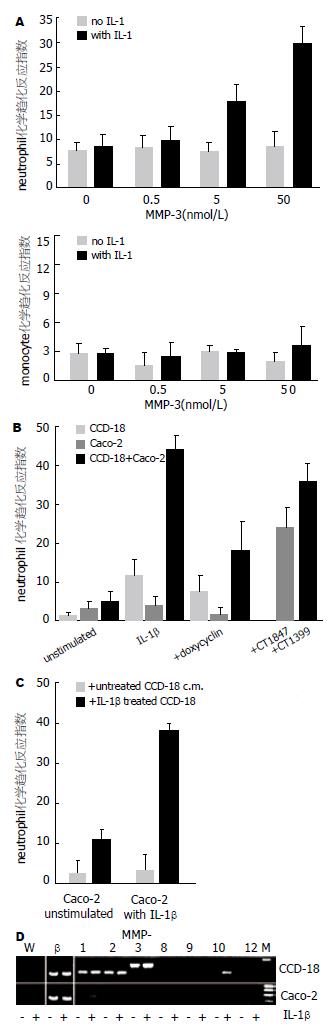
Caco-2细胞对中性白细胞和单核细胞趋化反应试验, 加入不同浓度的MMP-3, 前者在有和缺乏IL-1β刺激情况下, 二者表现显著性差异(19.5±4.1, 8.3±2.2, U = 24.60, P = 0.005<0.05; 32.5±4.4, 9.6±4.2, U = 37.22, P = 0.002<0.05); 而对单核细胞却无此现象. Caco-2细胞和CCD-18细胞共同培养, 在有IL-1β或加入IL-1β后, 再加入MMP抑制剂强力霉素、CT1847和CT1399, Caco-2细胞对中性白细胞趋化试验表明, 二者表现显著性差异(17.5±7.5, 5.5±2.5, U =15.18, P =0.01<0.05; 22.5±5.0, 3.8±2.0, U =34.73, P =0.002<0.05). Caco-2细胞在有和缺乏IL-1β刺激的CCD-18细胞的共同培养液中分别作中性白细胞趋化试验. 用RT-PCR分析在有和缺乏IL-1β处理的Caco-2和CCD-18细胞共同培养液中的各种MMPs mRNA的表达, 结果表明, 在有IL-1β存在的条件下MMP-1 mRNA, MMP-2 mRNA, MMP-3 mRNA和MMP-10 mRNA在CCD-18细胞中表达阳性(图1).
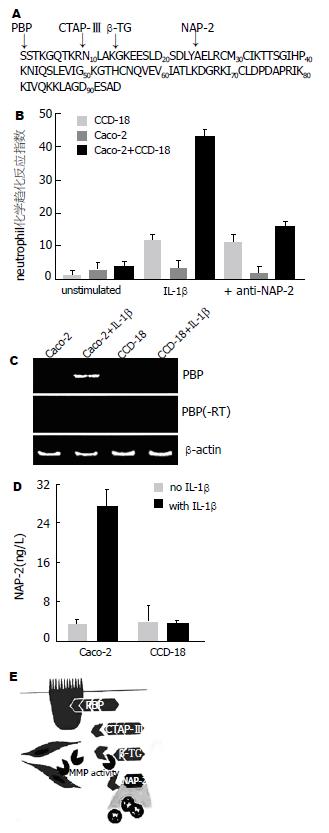
血小板基础蛋白(platelet basic protein, PBP), CTAP-Ⅲ(connectine tissue-activatig peptide-Ⅲ), β-血栓球蛋白(β-thromboglobulin, β-TG)及NAP-2的氨基酸序列(图2), 箭头所指的是他们的断裂位点. Caco-2细胞和CCD-18细胞的共同培养液缺乏IL-1β或加入IL-1β, 再加入抗人NAP-2中性白细胞mAb的条件下对中性白细胞趋化反应, 二者有显著性差异(43.2±2.6, 14.9±2.2, U =156.04, P = 0.000<0.05). RT-PCR分析PBP mRNA表达, 结果表明, PBP mRNA在有IL-1β刺激的Caco-2细胞中有阳性表达. 用ELISA性检测Caco-2和CCD-18细胞培养液在有或缺乏IL-1β条件下的NAP-2蛋白, 结果表明, 在有IL-1β刺激的Caco-2细胞中的NAP-2比CCD-18的明显增高, 二者相比有显著性差异(26.5±3.3 ng/L, 3.4±0.8 ng/L, U =68.32, P = 0.001<0.05). 肠上皮细胞MMP介导的通过PBP和NAP-2的炎症反应的模型见图2E.
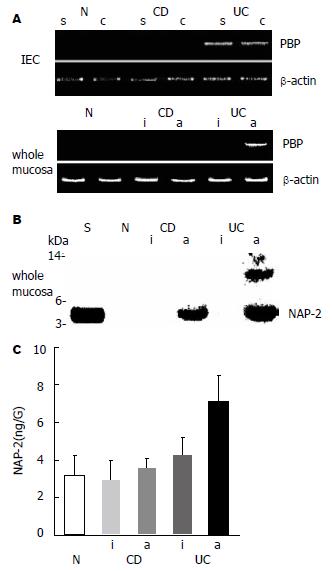
RT-PCR分析CD和UC的PBP mRNA在孤立上皮细胞(isolated epithehial cells, IEC)和整层黏膜切除标本的表达, 结果表明, PBP mRNA在UC肠黏膜IEC的表面及隐窝(crypt)和活动性的UC整层肠黏膜均阳性表达. Western blotting测定NAP-2蛋白在正常肠黏膜组织和CD及UC肠黏膜组织的整层黏膜表达, 结果表明, NAP-2蛋白在正常肠黏膜和活动性的CD及UC整层黏膜均阳性表达. 用ELIAS法分析 NAP-2蛋白在正常的黏膜组织和在CD及UC的肠黏膜组织的表达, 活动性UC炎与CD的结果比较, 二者有显著性差异(7.6±1.3 ng/G, 3.6±0.52 ng/G, U = 28.57, P = 0.002<0.05, 图3).
MMPs主要来源于发生炎症的肠黏膜间质细胞, 他和肠黏膜的炎症损害及组织再生密切相关[3-4]. 人结肠癌Caco-2肠上皮细胞加入MMP-3, 分别在有和缺乏IL-1β的条件下培养24 h后, 进行的趋化性试验, 结果示MMP-3明显增加IL-1β刺激的Caco-2细胞吸引外周中性白细胞的能力, 但对单核细胞无任何影响. 据报道, IL-1β不能直接诱导Caco-2细胞的化学趋化性, 可能由于不同的细胞的基因转录抑制有关[5]. 肠黏膜的MMPs主要在间质细胞的胞浆被激活[6-7]. Caco-2细胞和CCD-18人结肠肌纤维原细胞共同培养24 h后的化学趋化性试验, 在IL-1β存在的情况下, Caco-2细胞显著提高对中性白细胞的吸引能力. 为了进一步证实这种变化是否由于MMPs的介导, 在上述培养基中加入广谱的MMP抑制剂强力霉素、CT1847、MMP-2和MMP-8的抑制剂CT1399[4], 50 μmol/L强力霉素和0.1 μmol/L CT1847能显著抑制Caco-2细胞对中性白细胞的趋化性. 当用IL-1β刺激CCD-18细胞和Caco-2细胞, 化学趋化性结果与上述的相似. RT-PCR实验表明, 在有IL-1β存在的条件下MMP-1 mRNA, MMP-2 mRNA, MMP-3 mRNA和MMP-10 mRNA被CCD-18细胞表达. 这表明此化学趋化性现象是由MMPs诱导的, 对肠黏膜炎症起上调作用[3-8].
肠黏膜上皮细胞的肌纤维原细胞MMPs能诱导某些蛋白转变成对中性白细胞有潜在趋化作用的活性蛋白. 我们找到一些对中性白细胞有趋化性的物质, NAP-2(CXCL-7, 是具有高度潜在趋化性ELRCXC家族中的一种)、IL-8、某些致癌基因、巨噬细胞炎症蛋白-2(macrophage inflammatory protein-2, MIP-2)和上皮细胞性中性白细胞趋化物-78(epthelial cell-derived neutrophil attractant-78, ENA-78)[9]. NAP-2是唯一一种已知的具有对中性白细胞潜在趋化性PBP[10], PBP(94 aa, 10.3 kDa)来源于人类血小板α-颗粒. PBP在NH2端紧靠CTAP-Ⅲ, β-TG和NAP-2, 在这些物质中, 只有NAP-2具有化学趋化性. 在IL-1β刺激的条件下于Caco-2细胞和CCD-18细胞共同培养基中加入1 mg/L抗人NAP-2中性白细胞mAb, 结果显示化学趋化性几乎全部抑制, 这表明NAP-2是一种重要的诱导Caco细胞对中性白细胞趋化性物质. 实际上, PBP mRNA和PBP/NAP-2存在于有IL-1β刺激的Caco-2细胞中, 但不存在于缺乏IL-1β刺激的Caco-2或CCD-18细胞中, 在18例的正常结肠黏膜组织有2例(1例是整层黏膜切除组织, 另1例是从黏膜切除组织中分离的上皮细胞)和19例CD的4例黏膜组织(整层黏膜切除组织)分别检测出低水平的PBP mRNA. 20例UC的黏膜组织有16例(10例是整层黏膜切除组织, 6例是从黏膜切除组织中分离的上皮细胞)检测出高水平的PBP mRNA. 活动性UC的整层黏膜组织NAP-2比同组的CD高出约2倍. 据报道, 化学趋化物质作为MMPs的主要目标[11-12]. 基于我们的研究, 我们提出了一个由MMP活动介导的IBD的肠黏膜上皮细胞发生炎症的新模式. 对于损害或免疫反应的刺激, 肠黏膜上皮细胞合成和分泌PBP, PBP可能有抵抗病原微生物的功能[13], 但他并不影响白细胞运动功能[14]. 黏膜下层的肌纤维原细胞释放有活性的MMP, 将分解上皮细胞的PBP变成有化学趋化活性的NAP-2, 增加对中性白细胞的趋化性, 从而造成肠道上皮的炎症损害. 这种炎症发生机制可能支持UC发生时中性白细胞聚集、PBP/NAP-2明显增加. 因此, 我们推断这可能是肠道的一种免疫调节机制, 因为中性白细胞在肠黏膜上皮层的聚集和活动不仅需要来自上皮细胞的信号, 而且可能还依靠来自黏膜固有层的信号.
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD), 为非特异性肠炎. 最近的研究发现IBD炎症组织的基质金属蛋白激酶(MMPs)表达增高, 但其与IBD炎症发生的确切机制仍未完全阐明.
IBD炎症免疫反应机制是目前研究的热点. 本文研究了MMPs对中性白细胞化学趋化物NAP-2的影响, 提出了由MMPs活动介导的IBD肠黏膜上皮细胞发生炎症的新模式, 提示免疫反应需要有肠黏膜固有层间质细胞的参与.
本文探讨了炎症性肠病发生过程中肠上皮细胞基质金属蛋白激酶对中性白细胞化学趋化物NAP-2的影响, 提出了由基质金属蛋白激酶活动介导的炎症性肠病的肠粘膜上皮细胞发生炎症的新模式, 提示免疫反应需要有肠粘膜固有层间质细胞的参与, 对进一步了解溃疡性结肠炎的发生机制有较重要的意义. 文章的科学性、创新性和可读性能较好地反映我国胃肠病学基础研究的先进水平.
电编: 张焕兰 编辑:潘伯荣
| 2. | Flint N, Cove FL, Evans GS. A low-temperature method for the isolation of small-intestinal epithelium along the crypt-villus axis. Biochem J. 1991;280:331-334. [PubMed] [DOI] |
| 3. | Baugh MD, Perry MJ, Hollander AP, Davies DR, Cross SS, Lobo AJ, Taylor CJ, Evans GS. Matrix metalloproteinase levels are elevated in inflammatory bowel disease. Gastroenterology. 1999;117:814-822. [PubMed] [DOI] |
| 4. | Pender SL, Tickle SP, Docherty AJ, Howie D, Wathen NC, MacDonald TT. A major role for matrix metalloproteinases in T cell injury in the gut. J Immunol. 1997;158:1582-1590. [PubMed] |
| 5. | Wen X, Wu GD. Evidence for epigenetic mechanisms that silence both basal and immune-stimulated transcription of the IL-8 gene. J Immunol. 2001;166:7290-7299. [PubMed] [DOI] |
| 6. | McKaig BC, McWilliams D, Watson SA, Mahida YR. Expression and regulation of tissue inhibitor of metalloproteinase-1 and matrix metalloproteinases by intestinal myofibroblasts in inflammatory bowel disease. Am J Pathol. 2003;162:1355-1360. [PubMed] [DOI] |
| 7. | Pender SL, Quinn JJ, Sanderson IR, MacDonald TT. Butyrate upregulates stromelysin-1 production by intestinal mesenchymal cells. Am J Physiol Gastrointest Liver Physiol. 2000;279:G918-924. [PubMed] |
| 8. | Salmela MT, MacDonald TT, Black D, Irvine B, Zhuma T, Saarialho-Kere U, Pender SL. Upregulation of matrix metalloproteinases in a model of T cell mediated tissue injury in the gut: analysis by gene array and in situ hybridisation. Gut. 2002;51:540-547. [PubMed] [DOI] |
| 9. | Dwinell MB, Johanesen PA, Smith JM. Immunobiology of epithelial chemokines in the intestinal mucosa. Surgery. 2003;133:601-607. [PubMed] [DOI] |
| 10. | Brandt E, Petersen F, Ludwig A, Ehlert JE, Bock L, Flad HD. The beta-thromboglobulins and platelet factor 4: blood platelet-derived CXC chemokines with divergent roles in early neutrophil regulation. J Leukoc Biol. 2000;67:471-478. [PubMed] |
| 11. | McQuibban GA, Gong JH, Tam EM, McCulloch CA, Clark-Lewis I, Overall CM. Inflammation dampened by gelatinase A cleavage of monocyte chemoattractant protein-3. Science. 2000;289:1202-1206. [PubMed] [DOI] |
| 12. | Van den Steen PE, Proost P, Wuyts A, Van Damme J, Opdenakker G. Neutrophil gelatinase B potentiates interleukin-8 tenfold by aminoterminal processing, whereas it degrades CTAP-III, PF-4, and GRO-alpha and leaves RANTES and MCP-2 intact. Blood. 2000;96:2673-2681. [PubMed] |
| 13. | Tang YQ, Yeaman MR, Selsted ME. Antimicrobial peptides from human platelets. Infect Immun. 2002;70:6524-6533. [PubMed] [DOI] |