修回日期: 2006-06-26
接受日期: 2006-07-19
在线出版日期: 2006-09-08
目的: 研究单甲氧基聚乙二醇(mPEG 5000)对Wistar大鼠胰岛表面抗原的掩蔽作用及对胰岛素分泌功能的影响.
方法: 分离Wistar大鼠的胰岛, 对照组不进行任何处理, 处理组分别用200, 300, 400 g/L mPEG包裹, 培养24 h后分别用双硫腙染色检测胰岛细胞活性、葡萄糖刺激实验检测胰岛的分泌功能改变, 取SD大鼠脾淋巴细胞分别与上述各组胰岛进行混合培养, 通过杀伤实验检测胰岛免疫原性.
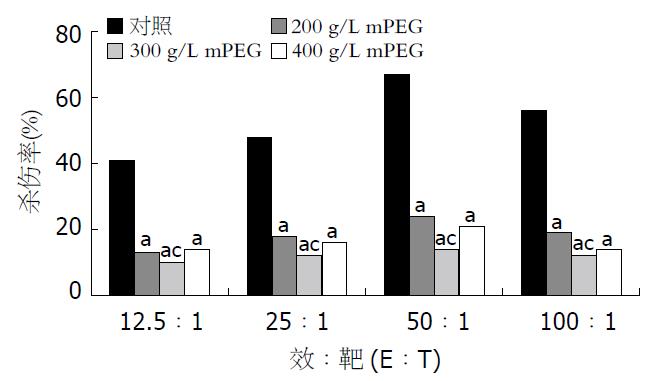
结果: 与对照组相比, 不同浓度mPEG包裹对大鼠胰岛活性及胰岛素分泌功能无明显影响, 不同浓度处理组的胰岛细胞杀伤率均明显低于对照组(24.7%, 14.8%, 21.4% vs 69.5%, t = 2.378, 2.584, 2.472, P均<0.05), 但300 g/L mPEG处理组的杀伤率最低(14.8% vs 24.7%, 21.4%, t = 2.285, 2.383, P均<0.05).
结论: mPEG有效掩蔽大鼠胰岛表面抗原, 且不影响胰岛细胞的活性及胰岛素分泌功能, 具有较好的免疫修饰作用.
引文著录: 赵刚, 崔静, 黎少山, 殷涛, 胡伟国, 吴河水, 王春友. 单甲氧基聚乙二醇对大鼠胰岛的免疫修饰作用. 世界华人消化杂志 2006; 14(25): 2480-2483
Revised: June 26, 2006
Accepted: July 19, 2006
Published online: September 8, 2006
AIM: To investigate the insulin secretion changes of rat islets after immune modification of methoxy-polyethylene glycol (mPEG).
METHODS: The islets isolated from Wistar rats were divided into control group and mPEG-treated groups (with 200, 300 and 400 g/L mPEG, respectively). After culture for 24 h, the viability of islets was detected by dithizone staining, and insulin secretion function was examined by glucose stimulation test. The islets from different groups were mixed with splenic lymphocyte from SD rats to evaluate the immunogenicity.
RESULTS: The viability of islets or the insulin secretion function in the three treatment groups was not significantly different from that in the control group. However, the cytoxicity rates in mPEG-treated groups were markedly lower than those in the control group (24.7%, 14.8%, 21.4% vs 69.5%, t = 2.378, 2.584, 2.472, all P < 0.05). Furthermore, the cytoxicity in the islets treated with 300 g/L mPEG was the lowest (14.8% vs 24.7%, 21.4%, t = 2.285, 2.383, both P < 0.05).
CONCLUSION: mPEG can mask the immunogenicity of rat islets while hardly affect the viability and insulin secretion.
- Citation: Zhao G, Cui J, Li SS, Yin T, Hu WG, Wu HS, Wang CY. Immune modification of rat islet by methoxy-polyethylene glycol. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2480-2483
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2480.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2480
胰岛移植由于简单易行和安全性高的特点, 近年来在糖尿病的细胞治疗中受到愈来愈多的关注, 但强烈的移植排斥反应限制了胰岛移植在临床中的应用[1]. 我们采用有机高分子材料单甲氧基聚乙二醇(methoxy-polyethylene glycol, mPEG)包裹大鼠胰岛细胞, 利用mPEG对细胞表面抗原免疫掩蔽作用, 观察其对胰岛免疫原性及胰岛细胞生物活性的影响, 以探讨其用于胰岛移植时免疫修饰的可行性.
Wistar和SD♂大鼠, 体质量250-300 g, 由华中科技大学同济医学院实验动物中心提供; mPEG (Mr 5000, mPEG-SPA)、Ⅴ型胶原酶、链脲佐菌素(STZ)、RPMI 1640购自Sigma公司; Ficoll 400购自Pharmacia公司; 小牛血清购自Gibico公司. 125I2-胰岛素放射免疫分析试剂盒购自北京原子能研究所. Wistar大鼠进行胰管原位插管, 灌注Ⅴ型胶原酶(38 ℃, 0.5 g/L, 含7.5 mmol/L Ca2+的Hanks液, pH 7.8) 4 mL, 使胰腺充分膨胀, 原位消化5 min. 处死并完整摘除胰腺, 置于上述Ⅴ型胶原酶溶液6 mL中, 将胰腺剪碎, 38 ℃水浴振荡消化30 min. 用Ficoll 400进行不连续密度梯度(250, 230, 200, 110 g/L)离心, 吸取23%-20%, 20%-11%界面细胞, 即为纯化的胰岛细胞. 经Ⅴ型胶原酶消化分离, Ficoll 400密度梯度纯化, 制备的胰岛纯度为95%, 光镜下DTZ 染色后, 胰岛细胞团染成腥红色或红色, 外分泌组织不着色, 呈圆形、椭圆形或不规则形. 分离纯化后的组织悬液用双硫腙(双硫腙10 mg, 无水乙醇3 mL, 250 g/L氨水50 mL)进行染色, 挑取100个当量(每1个胰岛当量相当于直径150 mm的胰岛细胞团)的胰岛细胞, 置于37 ℃, 50 mL/L CO2培养箱中培养[1].
1.2.1 mPEG包裹胰岛: 将培养1 d的胰岛用PBS洗涤2次. 将洗涤后的胰岛悬浮于含有11 mmol/L葡萄糖的PBS 500 μL中(pH 8.0). 分别称取mPEG 0.10, 0.15, 0.20 g, 完全溶于上述悬液中, 使mPEG的终浓度为200 g/L(A组), 300 g/L(B组), 400 g/L (C组), 置于CO2的培养箱中反应1 h, PBS洗涤1次后继续培养.
1.2.2 葡萄糖刺激实验: 将不同组胰岛分别置低糖(含2.8 mmoL/L葡萄糖)和高糖(含16.7 mmoL/L葡萄糖+10 mmoL/L氨茶碱), CO2的培养箱中孵育4 h, 放射免疫法检测培养液中的胰岛素含量.
1.2.3 同种异体脾脏淋巴细胞对胰岛杀伤实验: 无菌取出SD大鼠脾脏组织, 碾磨法获取细胞悬液后用Tris-NH4Cl溶解红细胞, 多次洗涤后获取淋巴细胞悬液并计数, 调节细胞浓度至1×108/L. 以对照组和不同浓度mPEG处理组胰岛为靶细胞进行细胞毒实验, 分别以不同效靶比(12.5:1, 25:1, 50:1, 100:1)培养72 h, 倒置显微镜动态观察胰岛及淋巴细胞形态改变, 终止反应后加入100 μL乳酸脱氢酶(LDH)室温反应10-30 min, 在酶标仪570 nm处测A值以评定细胞杀伤率(%) = (杀伤组A值-阴性对照组A值)/(最大释放组A值-阴性对照组A值)×100%[2].
统计学处理 应用SPSS软件对各组试验数据进行统计学分析.
培养3 d, 用葡萄糖刺激实验检测表明, 不同组胰岛细胞的胰岛素分泌功能无明显差异(表1).
| 糖相 | 对照组 | mPEG | ||
| 200 g/L | 300 g/L | 400 g/L | ||
| 低 | 6.63±1.74 | 5.49±1.56 | 5.91±1.80 | 5.54±1.27 |
| 高 | 25.85±5.22 | 24.23±4.86 | 25.29±4.77 | 23.43±4.31 |
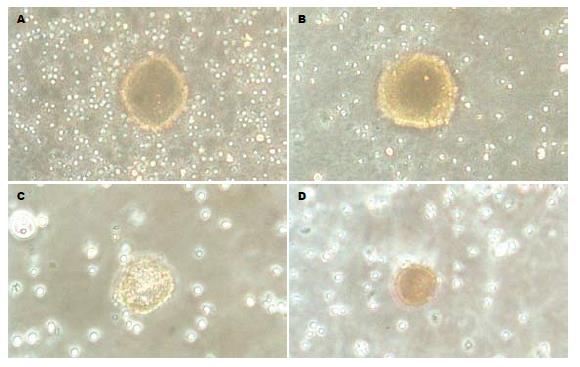
对照组16 h后胰岛周围出现明显的淋巴细胞聚集现象, 24 h后出现胰岛破坏, 48 h被破坏胰岛逐渐增多; 实验组16 h后胰岛周围未出现明显的淋巴细胞聚集现象. 连续观察72 h以上, 仅出现少量被破坏胰岛(图1). 细胞杀伤实验表明各处理组的最大杀伤率分别为24.7%, 14.8%, 21.4%, 均显著低于对照组(69.5%, t = 2.378, 2.584, 2.472, P<0.05); 其中300 g/L mPEG组杀伤率最低(P<0.05, 图2).
胰岛移植作为治疗糖尿病的有效措施之一, 正受到愈来愈多的关注, 然而移植排斥反应限制其在临床广泛应用. 近来研究表明, 利用生物材料制成免疫隔离装置如中空纤维、血管内装置、以海藻酸钠-聚赖氨酸为基础的大包囊或微包囊, 可有效隔离胰岛细胞与免疫细胞, 使免疫细胞不能直接损伤胰岛, 从而避免或缓解排斥反应的发生. 但他仍然存在着诸多缺陷: (1)材料的生物相容性不够, 使巨噬细胞在局部聚集发生纤维化进而造成隔离装置的降解; (2)尽管隔离装置为生物半透膜, 仍然在一定程度上存在着物质交换和胰岛素分泌障碍; (3)免疫球蛋白和补体仍然可能穿透生物材料并对胰岛造成损伤. 因此需要发展新的生物材料以进一步改善胰岛移植效果[3-4]. 最近研究发现, 有机高分子化合物mPEG具有与蛋白质大分子结合后遮蔽其抗原性的特点. mPEG是以聚乙二醇为骨架的线性高分子化合物, 具有许多优良的化学特性, 无免疫原性、低毒, 其惰性基团-甲氧基, 可与不同的氨基酸残基通过胺酯键形成稳定的化学连接[5], 在细胞表面形成一层由线性单链mPEG构成的水化膜具有屏障作用, 可在细胞表面的受体与其相应的配体间形成空间位阻, 阻断受体与配体的结合和识别. 文献报道, 将mPEG衍生物用于修饰红细胞的ABH血型抗原和淋巴细胞的HLA抗原, 有效降低红细胞和淋巴细胞的免疫原性, 但对于mPEG对胰岛免疫修饰的研究则甚少[6-8].
我们通过同种异体胰岛淋巴细胞混合反应模拟体内胰岛移植模型, 观察到SD大鼠淋巴细胞对mPEG修饰的Wistar大鼠胰岛的杀伤效应明显降低, 表明mPEG通过其甲氧基团与胰岛表面MHC抗原分子的氨基酸残基结合, 使同种异体淋巴细胞不能识别胰岛表面MHC抗原分子, 从而避免诱导免疫排斥反应. 为探讨mPEG包裹的最佳反应浓度, 我们采用200, 300, 400 g/L 3种不同浓度的mPEG进行包裹. 结果显示300 g/L mPEG包裹后的胰岛的免疫原性最弱, 表明mPEG浓度过高或过低均可能使mPEG与表面抗原氨基酸残基不能达到饱和连接, 从而仍有可能诱导不同程度的免疫排斥反应. 为进一步探讨mPEG用于体内胰岛移植的安全性, 我们还检测了mPEG包裹后胰岛活性及胰岛素分泌功能的改变. 结果表明, 对照组与各实验组在培养不同时间细胞存活率无明显改变, 同时低糖相、高糖相的胰岛素分泌水平无显著性差异. 提示mPEG与以往的免疫隔离材料不同, 他并非在胰岛表面形成一层包膜, 因而不影响胰岛与外环境的物质交换以及胰岛素分泌和释放. 本研究结果表明, mPEG对胰岛细胞具有较好的免疫修饰作用, 化学性质稳定且不影响胰岛的生物活性, 但应对不同残基衍生物及反应条件进一步优化以有效缓解胰岛移植排斥反应.
胰岛移植作为治疗糖尿病的有效措施之一, 是目前细胞移植研究的热点之一. 特别是胰岛干细胞培养及分化研究的迅速进展, 使得免疫排斥反应成为胰岛移植临床应用的主要限制因素.
目前多用生物材料制成免疫隔离装置如中空纤维, 血管内装置, 或以海藻酸钠-聚赖氨酸为基础的大包囊或微包囊, 通过免疫隔离作用有效地延长了胰岛移植物存活时间, 但仍然存生物相容性不够, 物质交换和胰岛素分泌障碍等缺陷. 新型高分子生物材料mPEG给胰岛移植带来新的希望.
文献报道, 将mPEG衍生物用于修饰红细胞的ABH血型抗原和淋巴细胞的HLA抗原, 有效降低红细胞和淋巴细胞的免疫原性, 但对于mPEG对胰岛免疫修饰的研究则甚少.
与以往应用生物材料包裹胰岛细胞从而产生免疫隔离效应不同, 该研究应用mPEG的甲氧基团与胰岛表面MHC抗原分子的氨基酸残基结合, 使同种异体淋巴细胞不能识别胰岛表面MHC抗原分子, 从而发挥免疫修饰作用. 同时证实mPEG对与胰岛细胞的生物活性没有显著影响, 为mPEG的临床应用提供理论基础.
本研究从反应浓度的角度, 初步探讨了最佳反应条件. 为进一步改善免疫修饰作用, 则应从反应时间, 并以mPEG为基本基团加上不同改构残基等角度进行深入研究.
1 免疫隔离: 是指通过生物材料包裹胰岛细胞, 有效隔离胰岛细胞与免疫细胞, 使免疫细胞不能直接损伤胰岛, 从而避免或缓解排斥反应的发生.
2 免疫修饰: 是指mPEG的惰性基团-甲氧基, 可与不同的氨基酸残基通过胺酯键形成稳定的化学连接, 在细胞表面形成一层由线性单链mPEG构成的水化膜具有屏障作用, 可在细胞表面的受体与其相应的配体间形成空间位阻, 阻断受体与配体的结合和识别, 使免疫细胞不能识别胰岛素表面的MHC抗原, 从而避免排斥反应的发生.
糖尿病是人类常见多发病, 其发病机制及治疗的研究是医学研究的难点之一. 最近, 异体或异种胰岛细胞移植是治疗糖尿病新探索. 本研究立足于研究单甲氧基聚乙二醇(mPEG 5000)对Wistar大鼠胰岛表面抗原的掩蔽作用及对胰岛素分泌功能的影响, 以解决胰岛细胞异体移植的排斥反应. 该研究选题新颖, 具有很强的科研价值.
电编: 张敏 编辑:潘伯荣
| 3. | Sutherland DE. Current status of beta-cell replacement therapy (pancreas and islet transplantation) for treatment of diabetes mellitus. Transplant Proc. 2003;35:1625-1627. [PubMed] [DOI] |
| 4. | de Vos P, van Hoogmoed CG, van Zanten J, Netter S, Strubbe JH, Busscher HJ. Long-term biocompatibility, chemistry, and function of microencapsulated pancreatic islets. Biomaterials. 2003;24:305-312. [PubMed] [DOI] |
| 5. | Chen AM, Scott MD. Current and future applications of immunological attenuation via pegylation of cells and tissue. BioDrugs. 2001;15:833-847. [PubMed] [DOI] |
| 6. | Murad KL, Gosselin EJ, Eaton JW, Scott MD. Stealth cells: prevention of major histocompatibility complex class II-mediated T-cell activation by cell surface modification. Blood. 1999;94:2135-2141. [PubMed] |
| 7. | Jang JY, Lee DY, Park SJ, Byun Y. Immune reactions of lymphocytes and macrophages against PEG-grafted pancreatic islets. Biomaterials. 2004;25:3663-3669. [PubMed] [DOI] |