修回日期: 2006-04-08
接受日期: 2006-04-16
在线出版日期: 2006-08-28
目的: 探讨c-Fos, c-Jun, Bcl-2在胃癌中的表达与胃癌的发生、发展及生物学行为的关系.
方法: 应用免疫组织化学SABC法, 检测54例胃癌及癌旁组织中c-Fos, c-Jun, Bcl-2蛋白的表达, 结果采用SPSS统计软件包及χ2检验分析.
结果: 胃癌组织中c-Fos, c-Jun, Bcl-2的表达显著高于癌旁组织(68.5% vs 27.8%, χ2 = 17.95, P<0.01; 63.0% vs 24.1%, χ2 = 16.61, P<0.01; 64.8% vs 25.9%, χ2 = 16.48, P<0.01). c-Fos, c-Jun的表达在胃癌不同组织学分级间有显著性差异(P = 0.018; P = 0.032), 在淋巴结转移、TNM分期间无显著性差异; Bcl-2的表达在胃癌不同组织学分级、淋巴结转移、TNM分期间有显著性差异(P = 0.035; P = 0.032; P = 0.009). 胃癌及癌旁组织中Bcl-2与c-Fos、c-Jun (r = 0.336, 0.688, P<0.05; r = 0.318, 0.512, P<0.05)及c-Fos与c-Jun (r = 0.719, 0.586, P<0.001)之间的表达呈正相关.
结论: c-Fos, c-Jun, Bcl-2的表达与胃癌的发生、发展以及组织学分级密切相关.
引文著录: 侯仁好, 初晓艺, 刘希双. c-Fos, c-Jun与Bcl-2蛋白在胃癌组织中的表达及意义. 世界华人消化杂志 2006; 14(24): 2448-2451
Revised: April 8, 2006
Accepted: April 16, 2006
Published online: August 28, 2006
AIM: To detect the expression of c-Fos, c-Jun and Bcl-2 protein in gastric carcinoma and explore their correlations with the development and biological behavior of gastric carcinoma.
METHODS: SABC immunohistochemistry was used to detect the expressions of c-Fos, c-Jun and Bcl-2 protein in specimens (n = 54) from gastric carcinoma and the corresponding cancer-adjacent tissues. The data were analyzed by Chi-Square test using SPSS software.
RESULTS: The positive rates of c-Fos, c-Jun and Bcl-2 expression were significantly higher in cancer tissues than those in cancer-adjacent ones (68.5% vs 27.8%, χ2 = 17.95, P < 0.01; 63.0% vs 24.1%, χ2 = 16.61, P < 0.01; 64.8% vs 25.9%, χ2 = 16.48, P < 0.01). The significant difference was present in the expression of c-Fos and c-Jun among different histological types (P = 0.018; P = 0.032), but wasn't among different status of regional lymph node metastasis and TNM stages. Bcl-2 expression was markedly different among different histological types, status of regional lymph node metastasis and TNM stages (P = 0.035; P = 0.032; P = 0.009). There was a positive correlation between expression of Bcl-2 and c-Fos (r = 0.336, 0.688, P < 0.05), Bcl-2 and c-Jun (r = 0.318, 0.512, P < 0.05) as well as between c-Fos and c-Jun (r = 0.719, 0.586, P < 0.001).
CONCLUSION: The expression of c-Fos, c-Jun and Bcl-2 are closely correlated with the carcinogenesis, development, and histological types.
- Citation: Hou RH, Chu XY, Liu XS. Expression of c-Fos, c-Jun and Bcl-2 and their significances in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(24): 2448-2451
- URL: https://www.wjgnet.com/1009-3079/full/v14/i24/2448.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i24.2448
胃癌的发生与胃黏膜上皮细胞凋亡、增殖调控失衡有关. 细胞凋亡是指在一定的生理或病理条件下, 由基因编程控制的细胞主动性死亡过程. 越来越多的研究表明, 细胞凋亡与细胞增殖一样, 与肿瘤的发生、发展以及临床治疗有密切的关系. bcl-2可对多种因素诱导的细胞凋亡起抑制作用, 使细胞生存期延长, 又称"存活基因". c-fos, c-jun作为核内原癌基因, 参与细胞增殖和凋亡的调控[1], 其表达异常增加可促进肿瘤形成. 我们应用免疫组织化学方法检测胃癌及癌旁组织中c-Fos, c-Jun和Bcl-2蛋白的表达, 探讨他们之间的关系以及在由癌旁组织向胃癌演变过程中的意义.
选择临床及病理资料完整的手术切除并经病理证实为胃管状腺癌的标本54例, 全部病例术前均未经过放化疗. 男34例, 女20例, 年龄38-78(平均59.6)岁. 高、中、低分化腺癌分别是19例、16例、19例, 无淋巴结转移的19例, 有转移的35例. 根据1997年国际抗癌联盟(UICC)制定的TNM分期标准[2]进行临床分期: Ⅰ期10例, Ⅱ期11例, Ⅲ期12例, Ⅳ期21例.
采用免疫组织化学SABC法, 切片经常规脱腊至水后, 浸入30 mL/L H2O2溶液中灭活内源性过氧化物酶, 微波抗原修复. 一抗c-Fos, c-Jun和Bcl-2均为美国Santa Cruz公司产品(购自武汉博士德公司). 用已知阳性的切片作阳性对照, 正常小鼠、兔血清和PBS代替一抗作阴性对照. 具体操作按说明书进行. 以细胞内出现均匀棕黄色颗粒为阳性细胞, 结果参照文献[3]根据染色阳性细胞数和染色强度分别评分, 两者积分乘积≥2分确定为阳性. 阳性细胞数: 0分为阴性, 1分为阳性细胞数≤10%, 2分为11%-50%, 3分为51%-75%, 4分为>75%. 染色强度: 根据染色强度划分为4级: 0分为无色, 1分为淡黄色, 2分为棕黄色, 3分为棕褐色.
统计学处理 应用SPSS软件进行统计学处理, 各项指标间的差别应用χ2检验, 应用等级相关计数检验三者之间的相关性, P<0.05有统计学意义.
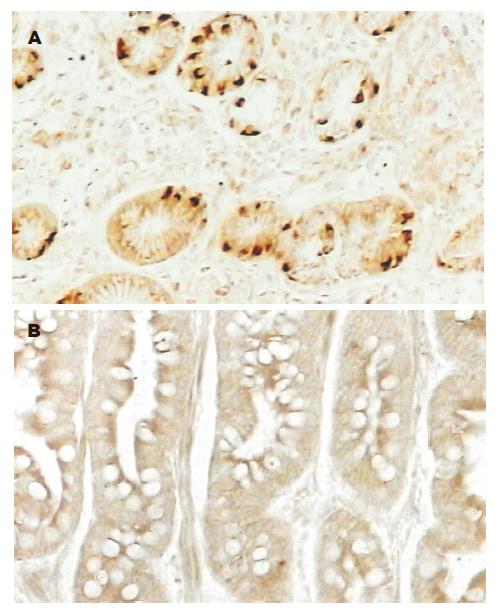
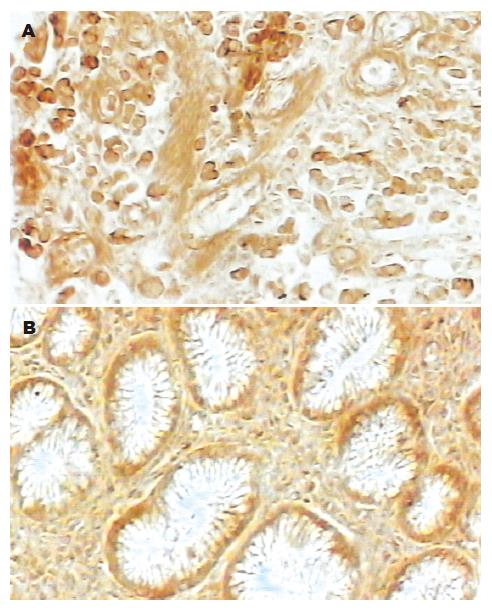
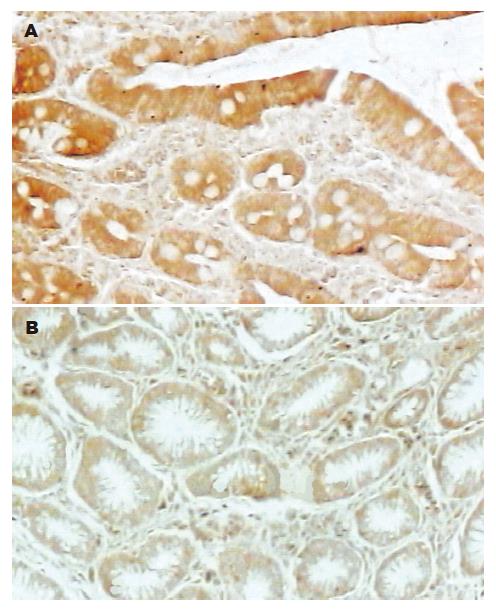
c-Fos, c-Jun蛋白表达阳性者染色主要定位于细胞核中, 在肿瘤细胞中呈高表达, 在正常细胞中呈低表达; Bcl-2蛋白表达阳性者染色主要定位于细胞质中, 在肿瘤细胞中呈高表达, 在正常细胞中呈低表达; 阳性表达均为粗细不一的棕黄色颗粒(图1-3). 胃癌与癌旁组织中c-Fos, c-Jun, Bcl-2的表达均有显著性差异(P< 0.01, 表1)
c-Fos, c-Jun, Bcl-2在高分化胃癌中阳性表达率高于中分化胃癌, 在中分化胃癌中阳性表达率高于低分化胃癌; c-Fos, c-Jun蛋白的阳性表达率在淋巴结转移、TNM分期间无差别; Bcl-2在淋巴结转移组的阳性表达率低于非淋巴结转移组; 在胃癌TNM分期Ⅰ, Ⅱ期的阳性表达率明显高于Ⅲ, Ⅳ期(P<0.05, 表1).
c-Fos, c-Jun, Bcl-2在胃癌中的表达均高于癌旁组织, 胃癌及癌旁组织中c-Fos, c-Jun, Bcl-2三者之间两两呈正相关(表2, 3).
| 组织 | Bcl-2 | r | P值 | ||
| (+) | (-) | ||||
| 胃癌 | c-Fos(+) | 28 | 9 | 0.336 | 0.013 |
| (-) | 7 | 10 | |||
| c-Jun(+) | 26 | 8 | 0.318 | 0.019 | |
| (-) | 9 | 11 | |||
| 癌旁组织 | c-Fos(+) | 11 | 4 | 0.688 | <0.001 |
| (-) | 3 | 36 | |||
| c-Jun(+) | 8 | 5 | 0.512 | <0.001 | |
| (-) | 6 | 35 | |||
| 组织 | c-Fos | r | P | ||
| (+) | (-) | ||||
| 胃癌 | c-Jun(+) | 32 | 2 | 0.719 | <0.001 |
| (-) | 5 | 15 | |||
| 癌旁组织 | c-Jun(+) | 9 | 4 | 0.586 | <0.001 |
| (-) | 6 | 35 | |||
细胞凋亡又称为细胞程序性死亡(PCD), 其调控障碍与肿瘤的发生密切相关. 肿瘤的发生与控制细胞增殖的癌基因的过度表达有关, 也与抑制细胞凋亡的基因的高表达及诱导细胞凋亡的抗癌基因的变异失活有关[4]. 细胞凋亡机制被不适当的终止后, 为细胞癌变提供了重要前提. 凋亡过程的受抑对肿瘤的发生发展起重要作用. 现已证明bcl-2是最重要的抑制肿瘤细胞凋亡的基因, Bcl-2的过度表达并不影响细胞增殖和加速细胞分裂, 而是延长肿瘤细胞生存、阻止细胞凋亡的发生[5]. bcl-2基因功能在于与细胞色素c和caspase-9相互作用, 干扰凋亡的正常进行. 研究发现, 从正常胃黏膜→萎缩性胃炎→肠化生→不典型增生→胃癌, Bcl-2表达逐渐增强, 而细胞凋亡指数逐渐下降, 提示Bcl-2蛋白表达与细胞凋亡指数呈负相关[6]. 另有研究表明Bcl-2在高、中分化胃癌中表达率高于低分化胃癌, 在淋巴结未受侵犯者中表达率高于有淋巴结转移者, 且Bcl-2阳性患者常表现出较好的存活趋势, 尤其在有2组以上淋巴结转移的患者, Bcl-2阳性者的生存期明显长于Bcl-2阴性者, 提示Bcl-2阳性表达与肿瘤的较好分化程度及低度恶性行为有关[7], 这些研究表明, Bcl-2可为临床提供一个重要的预后参数. 本实验显示Bcl-2在胃癌组织中呈高表达, 癌旁组织中呈低表达, 由癌旁组织向胃癌演变过程中, Bcl-2表达阳性率明显升高. 随着肿瘤组织分化程度的降低、淋巴结转移及TNM分期发展到Ⅲ, Ⅳ期, Bcl-2表达阳性率降低. 提示bcl-2蛋白可能通过抑制细胞凋亡过程进而促进肿瘤发生, 且Bcl-2基因表达异常可能是早期事件, 其表达强度可能与肿瘤的恶性程度有关. 这与上述研究基本相符.
胃癌的发生、发展及转归与细胞增殖、凋亡平衡失调以及细胞增殖和细胞凋亡的相互消长有关. 在正常机体内, 细胞增殖和细胞凋亡处于一种动态平衡. 当受到外来刺激或/及内在基因发生突变, 细胞凋亡下降, 增殖的表达增强, 使本应进入凋亡程序的细胞没有被识别, 从而允许分裂细胞的累积和阻止驱除带有恶性潜能基因的改变, 从而促进肿瘤的发生[8]. c-fos, c-jun为核内原癌基因, 属即刻早期应答基因(immediate early response gene), 其编码的蛋白为重要的转录因子, 可诱导其下游基因mRNA转录和蛋白表达, 参与细胞增殖和凋亡的调控. 其表达异常增加可诱发细胞转化和肿瘤形成[1]. 研究表明Bcl-2通过抑制细胞凋亡的方式参与了胃癌的形成与发展, c-Fos, c-Jun则通过促进细胞增殖的方式参与了其中. 我们证实了Bcl-2与c-Fos, c-Jun的表达有相关性, 提示他们可能由一种或多种共同的因素介导而参与了胃癌的形成与发展. 有文献报告在癌前病变及早期癌中c-Fos和c-Jun的表达高于中、晚期癌[9], 提示c-Fos和c-Jun的异常表达在癌变早期的作用大于中、晚期癌, 其表达异常可能是胃癌发生过程中的一个早期分子事件, 检测c-Fos, c-Jun表达状况有助于胃癌的早期诊断. 我们的实验结果与之相符. 本研究显示c-Fos, c-Jun在胃癌组织中的表达明显高于癌旁组织, 随肿瘤组织分化程度的降低, c-Fos, c-Jun表达阳性率降低, 其与肿瘤组织淋巴结转移、TNM分期无相关性. 上述结果说明了c-Fos, c-Jun基因蛋白表达变化发生在肿瘤细胞形态变化之前, 可作为胃癌早期诊断的分子病理学指标.
总之, c-Fos, c-Jun和Bcl-2蛋白在胃癌的发生和演化中呈高表达, 三者间呈正相关, 且与胃癌的发生、发展及生物学行为有关, 揭示了癌基因蛋白与胃癌的内在联系.
研究表明, 胃癌的发生与胃黏膜上皮细胞凋亡、增殖调控失衡关系密切. c-fos, c-jun作为原癌基因, 参与细胞增殖和凋亡的调控, 其表达异常增加可促进肿瘤形成; bcl-2作为重要的抑制肿瘤细胞凋亡的基因, 通过延长肿瘤细胞生存、阻止细胞凋亡发生而参与肿瘤的发生、发展过程.
细胞凋亡是一个复杂的生理病理过程, 受多种基因的控制. 许多证据表明肿瘤的发生与细胞凋亡的调节紊乱有着密切的关系. 有关学者认为, 通过改变重要的执行死亡基因的表达改变细胞的存活能力, 以达到治疗疾病的目的. 由此看来恶性肿瘤的细胞凋亡的研究对认识肿瘤的发病机制有着非常重要的意义, 而且在肿瘤治疗及预后评价方面都有重要意义.
王理伟et al研究了c-fos, bcl-2基因表达与肠型、弥漫型胃癌的关系. 该研究应用免疫组织化学方法检测原癌基因c-fos和bcl-2在肠型和弥漫型胃癌表达及特点, 探讨两型胃癌的发生与c-Fos、Bcl-2蛋白表达的关系及特点, 为胃癌的分型、早期诊断提供了分子病理学指标.
胃癌组织中c-Fos, c-Jun, Bcl-2的表达与胃癌临床病理行为之间的关系及三者表达相关性的研究较少, 本研究对c-Fos, c-Jun, Bcl-2的检测可用于胃癌的诊断, 对于胃癌患者的预后具有提示作用, 同时为胃癌的诱导凋亡治疗提供部分理论依据, 具有较强的理论与临床意义.
研究表明bcl-2通过抑制肿瘤细胞凋亡的方式参与了胃癌的形成与发展, c-fos, c-jun则通过促进肿瘤细胞增殖的方式参与了其中. 因此对c-Fos, c-Jun, Bcl-2蛋白的检测可用于胃癌的诊断, 对于胃癌患者的预后具有提示作用. 对有关疾病产生细胞凋亡独特机制的深入了解, 有可能用于疾病的治疗, 从而开辟基因治疗的新领域.
该文应用免疫组织化学方法研究了c-Fos, c-Jun, Bcl-2等癌基因蛋白与胃癌发生的内在关系, 证实了国外的研究结果, 对早期胃癌的分子病理学诊断有一定意义. 虽然国外已有相关研究报道, 但国内迄今尚未见同时观测上述三种癌基因蛋白与胃癌关系的研究报告, 因此研究内容较新颖
电编: 李琪 编辑:张焕兰
| 1. | Wagstaff SC, Bowler WB, Gallagher JA, Hipskind RA. Extracellular ATP activates multiple signalling pathways and potentiates growth factor-induced c-fos gene expression in MCF-7 breast cancer cells. Carcinogenesis. 2000;21:2175-2181. [PubMed] |
| 2. | Yoo CH, Noh SH, Kim YI, Min JS. Comparison of prognostic significance of nodal staging between old (4th edition) and new (5th edition) UICC TNM classification for gastric carcinoma. International Union Against Cancer. World J Surg. 1999;23:492-497; discussion 497-498. [PubMed] |
| 3. | Iseki K, Tatsuta M, Uehara H, Iishi H, Yano H, Sakai N, Ishiguro S. Inhibition of angiogenesis as a mechanism for inhibition by 1alpha-hydroxyvitamin D3 and 1,25-dihydroxyvitamin D3 of colon carcinogenesis induced by azoxymethane in Wistar rats. Int J Cancer. 1999;81:730-733. [PubMed] |
| 4. | Haldar S, Negrini M, Monne M, Sabbioni S, Croce CM. Down-regulation of bcl-2 by p53 in breast cancer cells. Cancer Res. 1994;54:2095-2097. [PubMed] |
| 5. | 侯 宝华, 卿 三华, 董 凤英, 赵 峰, 姚 学清, 彭 明, 齐 德麟. 热疗联合DDP诱导大肠癌细胞凋亡和bcl-2表达的实验研究. 湖北医科大学学报. 2000;21:133-135. |
| 6. | Staunton MJ, Gaffney EF. Apoptosis: basic concepts and potential significance in human cancer. Arch Pathol Lab Med. 1998;122:310-319. [PubMed] |
| 7. | Krajewska M, Fenoglio-Preiser CM, Krajewski S, Song K, Macdonald JS, Stemmerman G, Reed JC. Immunohistochemical analysis of Bcl-2 family proteins in adenocarcinomas of the stomach. Am J Pathol. 1996;149:1449-1457. [PubMed] |
| 8. | Aizawa K, Ueki K, Suzuki S, Yabusaki H, Kanda T, Nishimaki T, Suzuki T, Hatakeyama K. Apoptosis and Bbcl-2 expression in gastric carcinomas: correlation withclinicopathological variables, p53 expression, cell proliferation and prognosis. Int J Oncol. 1999;14:85-91. [PubMed] |
| 9. | Kogan EA, Shtabskii AB, Sekamova SM, Mazurenko NN, Kiselev FL. Nuclear oncoprotein expression in lung precancer and cancer at various stages of tumor progression studies at the level of light- and electron-immunohistochemistry. Arkh Patol. 1994;56:44-49. [PubMed] |