修回日期: 2006-07-02
接受日期: 2006-07-10
在线出版日期: 2006-08-18
目的: 探讨凋亡抑制因子Survivin在食管鳞癌(ESC)组织中的表达及其肿瘤细胞进行体视学分析.
方法: 应用免疫组织化学SP法检测52例不同分化食管鳞癌Survivin蛋白的表达, 运用图像分析系统在显微镜下测量Survivin阳性肿瘤细胞的体视学参数, 依据有关体视学公式计算出参数核的体密度(Vvn)、核的表面积密度(Svn)、核的平均体积(V)、核的平均表面积(S)、核的平均自由程(λ)、核的数密度(Nv)、核的平均曲度密度(Kv), 比较这些参数在不同分化肿瘤的差异.
结果: Survivin蛋白在ESC组织中阳性表达率为57.7 %, 其表达越强, 组织分化程度越低(χ2 = 6.1099, P = 0.0471). 参数Vvn, Svn, V, S的大小是依高、中、低分化的顺序增加, 而Kv, Nv, λ依高、中、低分化的顺序减小, 其中Vvn (F = 3.8368, P = 0.0342), Svn (F = 3.7143, P = 0.0376)参数有显著性差异(P<0.05).
结论: ESC组织Survivin蛋白的表达与其分化程度有密切关系, 肿瘤细胞Vvn, Svn参数是肿瘤细胞分化重要指标, 且为临床形态学诊断提供了依据.
引文著录: 韩永, 徐燕杰, 余琦, 杨敏, 赵敏, 周会芹. 食管鳞癌癌细胞Survivin蛋白及其体视学参数的测定. 世界华人消化杂志 2006; 14(23): 2315-2318
Revised: July 2, 2006
Accepted: July 10, 2006
Published online: August 18, 2006
AIM: To investigate the expression of Survivin in esophageal squamous carcinomas (ESC) and measure the stereology parameters of ESC cells.
METHODS: SP immunohistochemistry was used to detect the expression of Survivin protein in 52 ESC patients. Thirty Survivin-positive ESC cells were measured with image analyze system under microscope. The data for the stereological analysis include the body density of nucleus (Vvn), the surface area density of nucleus (Svn), the mean volume of nucleus (V), the surface area of nucleus (S), the mean free path of nucleus (λ), the number density of nucleus (Nv), and the mean curvature density of nucleus (Kv). The differences of the parameters were compared among the tumors with different degrees.
RESULTS: The positive rate of Survivin protein was 57.7% in ESC, and up-regulated expression of Survivin was strongly associated with poor differentiation (χ2 = 6.1099, P = 0.0471). The values of Vvn, Svn, V and S were increased, but those of Kv, Nv, and λ were decreased ordinally in well, moderately and poorly differentiated tumor cells, of which the values of Vvn (F = 3.8368, P = 0.0342) and Svn (F = 3.7143, P = 0.0376) had significant differences (P < 0.05).
CONCLUSION: The expression of Survivin protein is correlated with the differentiation in ESC. Vvn and Svn were important indexes of cellular abnormity, which provides evidences for clinical morphological diagnosis.
- Citation: Han Y, Xu YJ, Yu Q, Yang M, Zhao M, Zhou HQ. Expression of Survivin protein and measurements of stereology parameters in esophageal squamous carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(23): 2315-2318
- URL: https://www.wjgnet.com/1009-3079/full/v14/i23/2315.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i23.2315
传统的形态研究方法容易使人们对组织结构的认识局限在二维空间, 并且缺乏组织结构的数量概念. 随着电子计算机的普及、图象分析仪器的产生和体视学原理、方法的发展等, 生物形态研究正由定性向定量、由二维向三维方向发展, 充分展现了体视学发展和应用的广阔前景[1-2]. 应用体视学方法能使人们从三维水平定量地阐明组织、细胞结构. 体视学的基本原理就是通过定量分析切片图像与组织结构的关系, 用几何学、概率论、数理统计、微积分、曲线、曲面理论和拓扑学等数学方法准确地揭示这种关系以实现对三维结构的定量分析[3-4]. Survivin是凋亡抑制因子家族的新成员, 选择性表达于常见的恶性肿瘤, 而在癌旁正常组织和成人分化组织中不表达或低表达[5-6]. Survivin对某些肿瘤凋亡抑制的程度是影响其预后的关键[7-9]. 目前, 国内外文献中对其在食管鳞癌(ESC)中的表达报道甚少[10]. 我们采用免疫组化SP法检测ESC组织中Survivin的表达, 应用体视学技术, 对食管鳞癌不同分化的癌细胞的Survivin的表达体视学参数进行定量研究, 从量化角度进一步探讨ESC不同分化机制.
1997-2005手术切除的ESC 52例, 均经病理学确诊, 高分化15例, 中分化17例, 低分化20例. 同时取非癌食管组织作为对照. 男38例, 女14例, 平均年龄50岁, Survivin阳性30例, 非癌食管组织均为阴性.
标本经40 g/L甲醛固定, 常规石蜡包埋, 切片厚4 μm, HE染色进行组织学分类. 免疫组化采用SP法. Survivin购自Santa Cruz公司, 试剂盒为北京中山公司产品. 苏木素复染. 空白对照以PBS取代一抗, 阳性对照为已知阳性片. 阳性判断标准: 阳性染色主要位于细胞质, 呈棕黄色颗粒状, 背景清晰. 阴性对照无着色. 应用北京天地百年科技有限公司TD-2000真彩色病理细胞显微分析系统, 显微镜下选取阳性细胞集中的视野, 调整图像效果, 经彩色CCD摄像机将图像输入计算机病理图像分析系统, 转化为数字图像. 注意输入图像的背底灰度(即每张载玻片上没有细胞或组织区域的灰度)一致, 以消除载玻片透光度及背底灰度等的影响. 每个图像选取30个阳性细胞, 选择测量指标, 由系统自动测量相应数据. 选用的参数有: Vvn, 核的体密度; Svn, 核的表面积密度; V, 核的平均体积; S, 核的平均表面积; λ, 核的平均自由程; Nv, 核的数密度; Kv, 核的平均曲度密度.
统计学处理 Survivin蛋白采用定性资料的R×C表资料的Pearson检验, 体视学参数采用单因素多水平完全随机设计的方差分析. 以上统计分析均在计算机上由统计软件包SPSS 10.0进行.
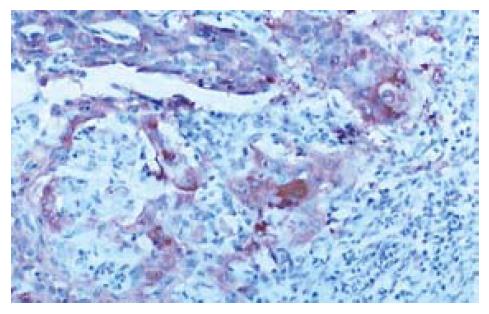
ESC组织中Survivin蛋白阳性表达率为57.7%(30/52, 图1). ESC的组织分化程度越低, Survivin蛋白的表达越强, 低、中、高分化ESC阳性表达率明显降低(表1), R×C表资料的Pearson χ2检验, χ2 = 6.1099, 自由度 = 2, P = 0.0471(P<0.05).
| 分化 | Survivin | 小计 | |
| Positive | Negative | ||
| 高 | 5 | 10 | 15 |
| 中 | 10 | 7 | 17 |
| 低 | 15 | 5 | 20 |
| 合计 | 30 | 22 | 52 |
Survivin蛋白表达体视学参数 参数Vvn, Svn, V, S是依高、中、低分化的顺序增加Kv, Nv, λ是依高、中、低分化的顺序减小(表2), 完全随机设计的方差分析, Vvn, Svn参数的比较有显著差异(P<0.05, 表3, 表4).
| 分化 | 参数 | ||||||
| Vvn | Svn | λ(×103) | Kv | Nv | V(×106) | S(×106)) | |
| 高 | 0.471±0.030 | 0.187±0.013 | 90±28 | 0.067±0.014 | 0.0012±0.0003 | 4.9±0.6 | 2.1±0.2 |
| 中 | 0.509±0.037 | 0.212±0.031 | 90±29 | 0.066±0.006 | 0.0011±0.0001 | 5.0±0.7 | 2.1±0.3 |
| 低 | 0.530±0.047 | 0.230±0.035 | 88±29 | 0.065±0.003 | 0.0010±0.0003 | 5.1±0.7 | 2.1±0.3 |
| 变异来源 | SS | df | MS | F | P |
| 总 | 0.0602 | 29 | |||
| 组间 | 0.0133 | 2 | 0.0067 | 3.8368 | 0.0342 |
| 组内 | 0.0468 | 27 | 0.0017 |
| 变异来源 | SS | df | MS | F | P |
| 总 | 0.0338 | 29 | |||
| 组间 | 0.0073 | 2 | 0.0036 | 3.7143 | 0.0376 |
| 组内 | 0.0265 | 27 | 0.001 |
Survivin是Duperray et al[11]利用效应细胞蛋白酶受体cDNA在人体基因组库中筛选克隆出的新基因, 该基因定位于人染色体17q25, 是凋亡抑制基因家族的一个新成员, 通过级联式激活并溶解蛋白质, 主要抑制Caspase-3, Caspase-7的活性, 阻断细胞的凋亡, Survivin蛋白是迄今发现的最强的凋亡抑制因子[12]. 在胚胎发育期组织和人类大多数肿瘤组织可见阳性表达, 但在正常成熟组织中不表达(胸腺、生殖腺除外)[13-14]. 而在大多数肿瘤组织内却有Survivin蛋白的表达, 其参与肿瘤的发生发展, 并与肿瘤的分级密切相关. Survivin表达与肿瘤的组织学类型、分化程度、TNM分期及淋巴结转移的关系各家报道不一. 多数研究表明, Survivin的表达与多种肿瘤的生物学特性, 分期密切相关[15]. Kawasaki et al[16]的资料显示, Survivin表达与胃癌的组织学类型及淋巴管浸润有关. Lo et al[17-18]的研究显示, Survivin在口腔及皮肤鳞癌组织中的表达与肿瘤的分化程度和淋巴结转移有密切关系. 少数研究认为Survivin的表达与上述临床病理因素无关[19]. 我们发现Survivin蛋白在食管鳞癌组织中的阳性表达率为57.7%, 且低、中、高分化组阳性表达有显著性差异. 提示在肿瘤组织中的Survivin蛋白能够抑制正常的细胞凋亡过程, 使癌细胞获得永生性(immartality). Survivin蛋白在肿瘤细胞中的表达越高, 其对癌细胞凋亡抑制的能力越强, 癌细胞的生存能力和肿瘤的恶性程度也随之增高. 提示Survivin是一个有研究价值的肿瘤标志物及判断ESC预后的参考指标, 他可能会成为评估食管鳞癌侵袭进展情况的参考指标和肿瘤治疗的新靶点. 体视学是从二维平面上测得的图像数据, 获取三维空间内结构的定量信息的科学. 他是根据结构的随机截面(切片), 定量研究结构的几何特征的方法学. 已应用于肝癌, 大肠癌[20]等疾病的研究中. 癌巢的表面积密度(Sv)为肿瘤单位体积内癌巢的表面积, 癌实质的体积密度(Vv)为肿瘤单位体积内癌实质的体积. Sv值越大, 表明癌与间质接触面积越大, 侵袭血管的机会越大; Vv值大, 说明癌实质的量多, 间质的量少, 癌与间质接触面积少[21]. 细胞分子水平的变化必然引致细胞形态的改变, 从我们的实验结果可以看出, 参数Vvn, Svn, V, S的大小是依高、中、低分化的survivin蛋白阳性细胞的顺序增加, λ, Nv, K得参数大小则依高、中、低分化的Survivin蛋白阳性细胞得顺续减少, 说明细胞分化越低部分体视学参数也呈现出规律性的量化改变, 其中Vvn, Svn参数得比较差异显著. 可以说明Vvn, Svn两项参数是细胞分化的重要指标, 他们为临床形态学诊断及预后提供了依据.
我国是世界上食管癌发病率和死亡率最高的国家, 对人们健康构成极大威胁. 近年来Survivin在恶性肿瘤组织中的表达已有较多报道, 且与ESC的分化程度有密切关系; 但体视学参数用于ESC的报道国内未见.
体视学参数用于ESC的研究比较新颖, 该文提示是肿瘤细胞分化的重要指标, 可为临床形态学诊断提供依据.
体视学: 是从二维平面上测得的图像数据, 获取三维空间内结构的定量信息的科学. 他是根据结构的随机截面(切片), 定量研究结构的几何特征的方法学.
本文研究了食管 鳞癌细胞Survivin蛋白表达及其与体视学参数的关系. 课题新颖, 有创新性, 设计合理, 推理正确, 有参考价值.
电编: 李琪 编辑:潘伯荣
| 1. | Pickett J, London E. The neuropathology of autism: a review. J Neuropathol Exp Neurol. 2005;64:925-935. [PubMed] |
| 2. | Stark AK, Pelvig DP, Jorgensen AM, Andersen BB, Pakkenberg B. Measuring morphological and cellular changes in Alzheimer's dementia: a review emphasizing stereology. Curr Alzheimer Res. 2005;2:449-481. [PubMed] |
| 3. | De Paepe ME, Mao Q, Powell J, Rubin SE, DeKoninck P, Appel N, Dixon M, Gundogan F. Growth of pulmonary microvasculature in ventilated preterm infants. Am J Respir Crit Care Med. 2006;173:204-211. [PubMed] |
| 4. | Okur A, Kantarci M, Akgun M, Alper F, Cayir K, Koc M, Onbas O. Unbiased estimation of tumor regression rates during chemoradiotherapy for esophageal carcinoma using CT and stereology. Dis Esophagus. 2005;18:114-119. [PubMed] |
| 5. | Wang W, Luo H, Wang A. Expression of survivin and correlation with PCNA in osteosarcoma. J Surg Oncol. 2006;93:578-584. [PubMed] |
| 6. | Chang Q, Qin R, Huang T, Gao J, Feng Y. Effect of antisense hypoxia-inducible factor 1alpha on progression, metastasis, and chemosensitivity of pancreatic cancer. Pancreas. 2006;32:297-305. [PubMed] |
| 7. | Altieri DC. Targeted therapy by disabling crossroad signaling networks: the survivin paradigm. Mol Cancer Ther. 2006;5:478-482. [PubMed] |
| 8. | Liu JJ, Huang RW, Lin DJ, Peng J, Zhang M, Pan X, Hou M, Wu XY, Lin Q, Chen F. Ponicidin, an ent-kaurane diterpenoid derived from a constituent of the herbal supplement PC-SPES, Rabdosia rubescens, induces apoptosis by activation of caspase-3 and mitochondrial events in lung cancer cells in vitro. Cancer Invest. 2006;24:136-148. [PubMed] |
| 9. | Deng H, Wu RL, Zhou HY, Huang X, Chen Y, Liu LJ. Significance of Survivin and PTEN expression in full lymph node-examined gastric cancer. World J Gastroenterol. 2006;12:1013-1017. [PubMed] |
| 10. | Warnecke-Eberz U, Hokita S, Xi H, Higashi H, Baldus SE, Metzger R, Brabender J, Bollschweiler E, Mueller RP, Dienes HP. Overexpression of survivin mRNA is associated with a favorable prognosis following neoadjuvant radiochemotherapy in esophageal cancer. Oncol Rep. 2005;13:1241-1246. [PubMed] |
| 11. | Duperray A, Languino LR, Plescia J, McDowall A, Hogg N, Craig AG, Berendt AR, Altieri DC. Molecular identification of a novel fibrinogen binding site on the first domain of ICAM-1 regulating leukocyte-endothelium bridging. J Biol Chem. 1997;272:435-441. [PubMed] |
| 12. | Lu CD, Altieri DC, Tanigawa N. Expression of a novel antiapoptosis gene, survivin, correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas. Cancer Res. 1998;58:1808-1812. [PubMed] |
| 13. | Adida C, Crotty PL, McGrath J, Berrebi D, Diebold J, Altieri DC. Developmentally regulated expression of the novel cancer anti-apoptosis gene survivin in human and mouse differentiation. Am J Pathol. 1998;152:43-49. [PubMed] |
| 14. | Adida C, Ambrosini G, Plescia J, Crotty PL, Costa J, Altieri DC. Protease receptors in Hodgkin's disease: expression of the factor Xa receptor, effector cell protease receptor-1, in Reed-Sternberg cells. Blood. 1996;88:1457-1464. [PubMed] |
| 15. | Altieri DC, Marchisio PC. Survivin apoptosis: an interloper between cell death and cell proliferation in cancer. Lab Invest. 1999;79:1327-1333. [PubMed] |
| 16. | Kawasaki H, Altieri DC, Lu CD, Toyoda M, Tenjo T, Tanigawa N. Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer. Cancer Res. 1998;58:5071-5074. [PubMed] |
| 17. | Lo Muzio L, Staibano S, Pannone G, Mignogna MD, Mariggio A, Salvatore G, Chieffi P, Tramontano D, De Rosa G, Altieri DC. Expression of the apoptosis inhibitor survivin in aggressive squamous cell carcinoma. Exp Mol Pathol. 2001;70:249-254. [PubMed] |
| 18. | Lo Muzio L, Pannone G, Mignogna MD, Staibano S, Mariggio MA, Rubini C, Procaccini M, Dolci M, Bufo P, De Rosa G. P-cadherin expression predicts clinical outcome in oral squamous cell carcinomas. Histol Histopathol. 2004;19:1089-1099. [PubMed] |
| 19. | Tanaka K, Iwamoto S, Gon G, Nohara T, Iwamoto M, Tanigawa N. Expression of survivin and its relationship to loss of apoptosis in breast carcinomas. Clin Cancer Res. 2000;6:127-134. [PubMed] |
| 20. | Wu LP, Chen LH, Zhang JS, Sun L, Zhang YQ. Protective effect of rhIL-1beta on pancreatic islets of alloxan-induced diabetic rats. World J Gastroenterol. 2004;10:3353-3355. [PubMed] |
| 21. | Zhang DS, Liu L, Jin LQ, Wan ML, Li QH. Effect of phosphorus-32 glass microspheres on human hepatocellular carcinoma in nude mice. World J Gastroenterol. 2004;10:1551-1554. [PubMed] |