修回日期: 2006-07-02
接受日期: 2006-07-10
在线出版日期: 2006-08-18
目的: 在山东胃癌高发区人群中观察增生型和普通型肠化的预后转归, 结合分子标记物的检测比较其进展为异型增生或胃癌的危险性.
方法: 采用前瞻性研究方法, 分析增生型和普通型肠化进展为异型增生或胃癌的危险性. 进展组(n = 27)的肠化病变选自1992-2001年对山东胃癌高发区的随访研究, 对照病例(n = 60)随机选自无进展的肠化病变. 根据Padova国际分型, 将所选肠化病变重新分为增生型和普通型. 用免疫组化法检测pS2, MUC5AC, MUC6, Ki-67在不同肠化病变中的表达.
结果: 增生型肠化进展为异型增生或癌的危险性为普通型肠化的7.23倍(95%CI: 2.59-20.20). MUC5AC, pS2与肠化进展为异型增生或胃癌的危险性呈负相关, OR值分别为0.27 (95%CI: 0.10-0.73), 0.33 (95%CI: 0.12-0.90). Ki-67标记指数在进展组中明显高于未进展组(28.5%±14.3% vs 16.4%±9.8%, P<0.01). MUC5AC表达阴性的增生型肠化进展为异型增生或胃癌的危险性上升为10.40倍(95%CI: 2.99-36.21). MUC6的表达在进展组中略高于未进展组(OR = 1.56, 95%CI: 0.53-4.60), 但差异无统计学意义.
结论: 增生型肠化进展为异型增生或胃癌的风险明显高于普通型肠化. 肠化病变的病理分型如同时结合Ki-67, MUC5AC, pS2等分子标记物的检测, 将有助于评估其预后转归.
引文著录: 张阳, 张联, 潘凯枫, 游伟程, 李吉友. 山东省胃癌高发区人群胃黏膜肠化的预后与标记物表达. 世界华人消化杂志 2006; 14(23): 2306-2310
Revised: July 2, 2006
Accepted: July 10, 2006
Published online: August 18, 2006
AIM: To investigate the relationship between the expression of biomarkers and the prognosis of hyperproliferative intestinal metaplasia (HIM) and usual intestinal metaplasia (UIM) in Padova and Vienna international classification.
METHODS: The risk of progression to dysplasia or gastric cancer in patients with UIM or HIM was estimated in a prospective study in Chinese populations at high risk area of gastric cancer from 1992 to 2001 in Shandong province. The cases included 2 groups: progressive group (n = 27) and non-progressive group (n = 60). Immunohistochemistry was used to detect the expressions of pS2, MUC5AC, MUC6 and Ki-67 in both groups.
RESULTS: HIM had a higher risk of dysplasia or gastric cancer than UIM (OR = 7.23, 95%CI: 2.59-20.20). The risk of dysplasia or gastric cancer was reduced in IM with the expression of MUC5 (OR = 0.27, 95%CI: 0.10-0.73) or pS2 (OR = 0.33, 95%CI: 0.12-0.90). Ki-67 labeling index was elevated in progressive IM in comparison with that in non-progressive one (28.5% ± 14.3% vs 16.4% ± 9.8%, P < 0.01). An elevated risk of dysplasia or gastric cancer was observed in patients with HIM and negative expression of MUC5AC (OR = 10.40, 95%CI: 2.99-36.21). The expression of was also higher in progressive IM than that in non-progressive one (OR = 1.56, 95%CI: 0.53-4.60), but the difference was not significant.
CONCLUSION: HIM has a higher risk of progression to dysplasia or gastric cancer than UIM. It may be helpful to evaluate the prognosis of IM by combining the histological classification and the detection of some biomarkers, such as Ki-67, MUC5AC and pS2.
- Citation: Zhang Y, Zhang L, Pan KF, You WC, Li JY. Prognosis of intestinal metaplasia and expressions of biomarkers in high-risk populations of gastric cancer in Shangdong province. Shijie Huaren Xiaohua Zazhi 2006; 14(23): 2306-2310
- URL: https://www.wjgnet.com/1009-3079/full/v14/i23/2306.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i23.2306
Padova[1]和Vienna[2]国际分类将胃黏膜病变划分为5组: (1)无异型增生(Negative for dysplasia); (2)不确定的异型增生(indefinite for dysplasia); (3)非浸润性肿瘤(non-invasive neoplasia), 又称异型增生(dysplasia); (4)可疑浸润性癌; (5)浸润性癌. 在这2个分类标准中, 肠化病变被分为2类: 普通的肠化(本研究称为普通型肠化)属于第1组病变, 且包括完全型和不完全型2种类型; 而增生型肠化(hyperproliferative intestinal metaplasia)归类于第2组病变. Padova和Vienna国际分类从组织形态学上描述了增生型肠化的组织和细胞异型性都明显高于普通型肠化, 但2类肠化预后转归的前瞻性研究以及病变相关分子标记物研究, 国内外尚未报道. 自1989年, 北京大学临床肿瘤学院和美国国家肿瘤研究所合作在山东省临朐县胃癌高发区开展对胃癌前病变的一系列前瞻性研究. 我们报道Padova国际分类中普通型和增生型肠化的预后转归, 以及病变相关标记物(包括增殖相关标志物Ki-67和胃黏膜分化相关标志物pS2, MUC5AC, MUC6)与病理形态学和预后的关系.
标本选自在山东省临朐县胃癌高发区进行的队列研究[3-4]. 即1989-1990年在临朐县随机挑选了14个村庄的3399名35-64岁居民进行胃镜检查, 在胃体、胃角、胃窦7个标准部位取活检组织经病理诊断, 确定胃黏膜病变. 以7个部位病理检查诊断后的任意最严重病理病变为该病例的最高诊断. 1992年对其中689例胃癌前病变(包括深度肠化和异型增生)进行胃镜复查[5], 并分别于1994和1999年对所有受试者进行胃镜随访, 监测胃黏膜病变的进展情况. 在随访过程中, 对发现有凝血功能障碍、高血压、肝脏疾病和慢性阻塞性肺病等情况的受试者退出随访, 失访者的基础病变与整体人群的病变构成相似. 至2001年, 从随访人群中按照肠化病变是否进展至异型增生或胃癌挑选进展和非进展2组. 活检组织标本用40 g/L甲醛固定、石蜡包埋、HE染色. 多次复查中病理诊断标准、方法相同. 3位对全部病理进行诊断的病理医师, 用盲法对1992年确定为肠化的病理切片进行复阅, 按照Padova国际分类将肠化分为增生型和普通型. 分子标记物的免疫组化检测组织标本选自进展和非进展组病例在1992年的随访胃镜检查病理标本.
免疫组化采用卵白素-生物素-过氧化物酶染色系统[6]. 组织切片常规脱蜡、复水, 30 g/L H2O2阻断内源性过氧化物酶10 min, 用枸橼酸钠抗原修复液微波抗原修复, 滴加非免疫小牛血清封闭, 37 ℃孵育30 min, 弃去封闭液后滴加相应的mAb稀释液, 4 ℃冰箱过夜. 选用的mAb为抗pS2[BC04(7). GenTech], MUC5AC (45M1. NeoMarker 1:100), MUC6 (MCN6.01. NeoMarker 1:100), Ki-67 (MIB-1 MaximBiotec 1:100). 滴加通用型IgG抗体(Fab段)-HRP多聚体(PV-6000 PicTureTM Kits)水浴37 ℃. 1 g/L DAB-H2O2显色后苏木素染色, 常规脱水封片. pS2, MUC5AC, MUC6染色以>5%的细胞胞质或胞膜染为棕黄色至深棕黄色为阳性. Ki-67以细胞核呈棕黄色至深棕黄色为阳性细胞, Ki-67标记指数(labeling index)是以3-5个高倍视野(40倍)内计数500个上皮细胞, 计算阳性细胞的百分比[7].
统计学处理 运用SPSS 10.0统计分析软件包分析数据. χ2检验用于分析肠化病理类型和MUC5AC, MUC6, pS2的免疫组化结果, t检验用于分析Ki-67标记指数, P<0.05被认为具有显著性.
1992年进行胃镜复查的胃癌前病变中, 病理诊断确定434例胃黏膜肠化. 经10年(1992-2001)随访, 共27例病变进展(进展组), 其中22例为胃癌, 5例为异型增生; 在407例未进展的肠化病变中, 随机挑选60例对照作为"非进展组". 在27例进展组中有22例为男性, 平均年龄67.6±10.1岁; 在60例非进展组中有40例为男性, 平均年龄65.8±10.6岁, 2组在年龄和性别分布中未见统计学明显差异, P>0.05.
病变进展组中20例(74.1%)基线病变为增生型肠化, 7例(25.9%)为普通型肠化(其中完全型7.4%, 不完全型18.5%). 非进展组的60例肠化病例中, 有17例(28.3%)为增生型肠化, 43例(71.7%)为普通型肠化(完全型46.7%, 不完全型25.0%). 两组相比, 增生型肠化进展为异型增生或胃癌的OR值为7.23 (95%CI: 2.59-20.20, 表1). 将普通型肠化进一步分为完全型和不完全型肠化进行比较, 不完全型肠化病变进展的OR值为4.67 (95%CI: 0.81-27.01, P>0.05). 将增生型肠化与完全型肠化比较, 增生型肠化进展为异型增生或胃癌的OR值上升为16.47 (95%CI: 3.42-79.45).
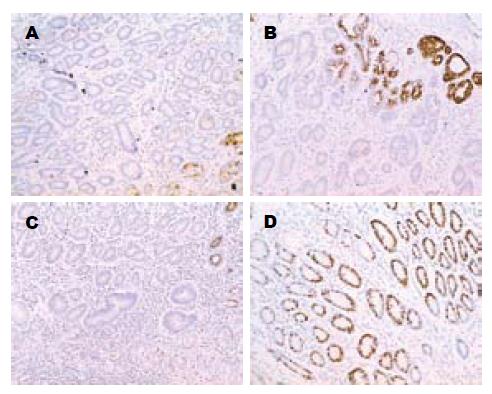
MUC5AC, pS2在进展组的肠化病例中表达(24.1%, 55.2%)明显低于非进展肠化(56.7%, 81.7%), OR值分别为0.27(95%CI: 0.10-0.73), 0.33(95%CI: 0.12-0.90). Ki-67标记指数在进展的肠化中(28.5%±14.3%)显著高于非进展的肠化组织(16.4%±9.8%, P<0.01). MUC6的表达在进展组中(24.1%)略高于未进展组(18.3%), OR = 1.56 (95%CI: 0.53-4.60), 但差异无统计学意义(表2, 图1).
单独MUC5AC表达缺失或病理类型为增生型的肠化进展为异型增生或胃癌的OR值分别为0.61(95%CI: 0.11-3.52)和1.30(95%CI: 0.21-8.03). 而当上述两种因素同时存在时肠化病变进展的OR值明显升高为10.4(95%CI: 2.99-36.21). 单独pS2表达缺失或病理类型为增生型肠化的OR值分别为3.42(95%CI: 0.27-43.7)和8.54(2.41-30.24), 而两种因素同时存在时的OR值为7.59(95%CI: 2.19-26.31), 未见显著上升(表3).
在山东省临朐县胃癌高发区人群进行的前瞻性研究结果显示, 根据Padova国际分类将胃黏膜肠化病变划分为增生型和普通型, 并结合病变相关分子标记物的检测, 对于了解肠化病理分类的分子机制、提示预后判断具有科学和应用的价值. 以往对胃黏膜肠化病变的研究显示, 人群中近40%有胃黏膜肠化[8], 根据累及范围将其分为浅表和深度肠化. 以浅表性或萎缩性胃炎为参照组, 浅表肠化进展为异型增生或癌的危险性为2.2倍; 而深度肠化的危险性增至4.7倍[4]. 不完全型肠化(13.3%)进展为胃癌的比例高于完全型肠化(1.9%)[4], 与许多文献报道一致[9-11]. 2000年, Padova和Vienna国际分类对胃黏膜病变重新划分后, 提出增生型肠化是一些在黏膜深部排列紧密、分化不太成熟的腺体, 细胞大且不规则, 细胞异型性明显. 增生型肠化的细胞和结构特点是从黏膜基底部到表层呈一种逐级演变的趋势, 即底层腺体幼稚, 异型性明显, 到表层呈"渐进性成熟". 其形态学特征提示增生型肠化可能与胃癌, 尤其是肠型胃癌的关系密切. 我们进一步证实, 增生型肠化发展为更严重病变的风险显著高于普通型肠化. 与普通型肠化中的完全型肠化相比, 不完全型肠化向异型增生或胃癌发展的危险性上升3.67倍(统计学差异不显著, 可能是由于2组肠化病例数偏少); 增生型肠化进展的危险性增加15.47倍. 因此我们从预后转归的差异水平证实, 增生型肠化是比普通型肠化更容易发生进展的高危癌前病变. Padova国际分型对胃黏膜肠化病变进行重新划分后, 增强了其与胃癌发生的关联强度, 能够帮助更好地预警胃癌的发生.
为了解肠化病变发展过程中的生物学基础, 我们检测了Ki-67, MUC5AC, pS2, MUC6的表达状况. Ki-67标记指数作为反映细胞增殖状态的敏感指标, 在进展组肠化中明显升高, 提示旺盛的细胞增殖是肠化病变向异型增生或胃癌发展的危险因素. MUC5AC, pS2是胃黏膜分化成熟的标志[6,12], 且pS2可能是胃特异的肿瘤抑制因子, 其表达从正常胃黏膜到肠化、腺瘤逐渐下降[13]. 这些观点与本研究的结果相符, 即MUC5AC和pS2的高表达是肠化病变进展为异型增生或胃癌的保护性因素, 可使其危险性降低为约30%. MUC6可能与胃型黏膜的分化有关[14], 正常表达于胃窦基底部腺体[15], 在胃癌组织中降低[16-18], 在不完全型肠化中高于完全型肠化[19]. MUC6的表达在进展组略高于未进展组, 但其在肠化进展过程中的作用尚需进一步大样本研究探讨. 结果显示, MUC5AC, pS2和Ki-67在肠化病变的进展过程中可能发挥重要作用, 其检测结果可以帮助我们客观评价肠化病变的预后转归. 将MUC5AC和pS2表达与肠化病变的病理类型综合分析显示, 增生型肠化中同时伴随MUC5AC的表达缺失, 该病变进展为异型增生或胃癌的危险性显著升高; 而伴随有pS2表达缺失的增生型肠化进展的危险性则没有明显的上升. 这一现象提示, MUC5AC的表达缺失与增生型肠化的组织类型在肠化病变进展过程中可能存在协同关系. 两种因素综合考虑, 可能提高对肠化病变预后转归评估的准确性.
本研究的优点在于, 在胃癌高发区代表性人群中进行胃镜和病理学诊断, 按照最新的Padova国际分类前瞻性观察不同病理类型肠化的转归, 并综合讨论了多种病变相关标记物的表达, 结果可靠. 但由于所选标本均来自自然人群的随访研究, 因此观察到的进展肠化病例数偏少, 从而限制了多因素的综合分析能力, 今后还有待于扩大随访病例数和延长随访时间. 总之, 本研究结果显示, 增生型肠化比普通型肠化进展为异型增生或胃癌的风险更高. 将肠化划分为增生型和普通型两种类型, 同时结合Ki-67, MUC5AC, pS2等分子标记物的检测, 将有助于评估肠化病变的预后转归.
Padova和Vienna国际分类在形态学上将胃黏膜肠化病变分为增生型和普通型两类, 并提出增生型肠化在病变发展过程中属于不确定的异型增生, 可能与胃癌的发生有关. Padova和Vienna国际分类对胃癌及癌前病变详细的病理学划分, 帮助各国的病理医生对复杂多样的胃黏膜病变统一归类, 指导胃癌的预防和治疗. 同时与胃癌发生相关的分子标记物研究也在国内外有大量报道. 但对胃癌各阶段癌前病变的生物学特性及其预后转归, 尚缺乏系统的人群研究.
在2000年分别发表的Padova和Vienna国际分类中, 详细描述了增生型肠化的病理学特征, 指出其细胞和组织分化水平均明显低于普通型肠化.另外, You et al在1989-2003年进行的随访研究, 介绍了本文选取的高 发区人群的基础病变构成, 癌前病变进展状况以及可能的相关因素.
本文首次将近年来国际认可的胃黏膜病变分类标准应用于长期、大样本的自然人群队列研究中, 对病变的预后转归及可能相关的分子标记物进行了系统的研究. 结果提示, 增生型肠化进展为异型增生或胃癌的危险性明显高于普通型肠化, 并且结合Ki-67等标记物的检测有助于评估肠化病变的预后转归, 预警胃癌的发生.
增生型肠化: 在Padova国际分类中增生型肠化属于不确定的异型增生, 表现为腺体分化不太成熟、排列紧密、核呈假复层排列、细胞大且不规则、核大深染、可见核分裂象. 从黏膜基底部到顶层呈"渐进性成熟", 即底层腺体幼稚, 异型性明显, 到表层逐渐变得成熟, 分化程度高.
本文选题新颖, 具有重要的理论和实际意义; 本研究工作基础较好, 研究结果可靠、可信; 研究对象来自自然人群队列研究, 样本量大, 随访时间相对比较长, 在恶性肿瘤病因和预后研究中实属不易.
电编: 张敏 编辑:潘伯荣
| 1. | Rugge M, Correa P, Dixon MF, Hattori T, Leandro G, Lewin K, Riddell RH, Sipponen P, Watanabe H. Gastric dysplasia: the Padova international classification. Am J Surg Pathol. 2000;24:167-176. [PubMed] |
| 2. | Schlemper RJ, Riddell RH, Kato Y, Borchard F, Cooper HS, Dawsey SM, Dixon MF, Fenoglio-Preiser CM, Flejou JF, Geboes K. The Vienna classification of gastrointestinal epithelial neoplasia. Gut. 2000;47:251-255. [PubMed] |
| 3. | Gail MH, You WC, Chang YS, Zhang L, Blot WJ, Brown LM, Groves FD, Heinrich JP, Hu J, Jin ML. Factorial trial of three interventions to reduce the progression of precancerous gastric lesions in Shandong, China: design issues and initial data. Control Clin Trials. 1998;19:352-369. [PubMed] |
| 4. | You WC, Li JY, Blot WJ, Chang YS, Jin ML, Gail MH, Zhang L, Liu WD, Ma JL, Hu YR. Evolution of precancerous lesions in a rural Chinese population at high risk of gastric cancer. Int J Cancer. 1999;83:615-619. [PubMed] |
| 5. | Riecken B, Pfeiffer R, Ma JL, Jin ML, Li JY, Liu WD, Zhang L, Chang YS, Gail MH, You WC. No impact of repeated endoscopic screens on gastric cancer mortality in a prospectively followed Chinese population at high risk. Prev Med. 2002;34:22-28. [PubMed] |
| 6. | Reis CA, David L, Nielsen PA, Clausen H, Mirgorodskaya K, Roepstorff P, Sobrinho-Simoes M. Immunohistochemical study of MUC5AC expression in human gastric carcinomas using a novel monoclonal antibody. Int J Cancer. 1997;74:112-121. [PubMed] |
| 7. | Krecicki T, Jelen M, Zalesska-Krecicka M, Rak J, Szkudlarek T, Jelen-Krzeszewska J. Epidermal growth factor receptor (EGFR), proliferating cell nuclear antigen (PCNA) and Ki-67 antigen in laryn-geal epithelial lesions. Oral Oncol. 1999;35:180-186. [PubMed] |
| 8. | You WC, Blot WJ, Li JY, Chang YS, Jin ML, Kneller R, Zhang L, Han ZX, Zeng XR, Liu WD. Precancerous gastric lesions in a population at high risk of stomach cancer. Cancer Res. 1993;53:1317-1321. [PubMed] |
| 9. | Huang CB, Xu J, Huang JF, Meng XY. Sulphomucin colonic type intestinal metaplasia and carcinoma in the stomach. A histochemical study of 115 cases obtained by biopsy. Cancer. 1986;57:1370-1375. [PubMed] |
| 10. | Jass JR, Filipe MI. A variant of intestinal metaplasia associated with gastric carcinoma: a histochemical study. Histopathology. 1979;3:191-199. [PubMed] |
| 11. | Jass JR. Role of intestinal metaplasia in the histogenesis of gastric carcinoma. J Clin Pathol. 1980;33:801-810. [PubMed] |
| 12. | Hanby AM, Poulsom R, Singh S, Elia G, Jeffery RE, Wright NA. Spasmolytic polypeptide is a major antral peptide: distribution of the trefoil peptides human spasmolytic polypeptide and pS2 in the stomach. Gastroenterology. 1993;105:1110-1116. [PubMed] |
| 13. | Fujimoto J, Yasui W, Tahara H, Tahara E, Kudo Y, Yokozaki H, Tahara E. DNA hypermethylation at the pS2 promoter region is associated with early stage of stomach carcinogenesis. Cancer Lett. 2000;149:125-134. [PubMed] |
| 14. | De Bolos C, Garrido M, Real FX. MUC6 apomucin shows a distinct normal tissue distribution that correlates with Lewis antigen expression in the human stomach. Gastroenterology. 1995;109:723-734. [PubMed] |
| 15. | Buisine MP, Devisme L, Maunoury V, Deschodt E, Gosselin B, Copin MC, Aubert JP, Porchet N. Developmental mucin gene expression in the gastroduodenal tract and accessory digestive glands. I. Stomach. A relationship to gastric carcinoma. J Histochem Cytochem. 2000;48:1657-1666. [PubMed] |
| 16. | Reis CA, David L, Carvalho F, Mandel U, de Bolos C, Mirgorodskaya E, Clausen H, Sobrinho-Simoes M. Immunohistochemical study of the expression of MUC6 mucin and co-expression of other secreted mucins (MUC5AC and MUC2) in human gastric carcinomas. J Histochem Cytochem. 2000;48:377-388. [PubMed] |
| 17. | Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Mucin gene expression in normal, preneoplastic, and neoplastic human gastric epithelium. Cancer Res. 1995;55:2681-2690. [PubMed] |
| 18. | Lee HS, Lee HK, Kim HS, Yang HK, Kim YI, Kim WH. MUC1, MUC2, MUC5AC, and MUC6 expressions in gastric carcinomas: their roles as prognostic indicators. Cancer. 2001;92:1427-1434. [PubMed] |
| 19. | Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, Clausen H, Sobrinho-Simoes M. Intestinal metaplasia of human stomach displays distinct patterns of mucin (MUC1, MUC2, MUC5AC, and MUC6) expression. Cancer Res. 1999;59:1003-1007. [PubMed] |