修回日期: 2006-04-13
接受日期: 2006-04-20
在线出版日期: 2006-08-18
目的: 探索人骨髓来源多能成体祖细胞(ZHJ-MAPCs)在与人肝细胞系L02在体外共培养条件下诱导分化为肝细胞的可行性.
方法: (1)间接共培养: 将第4代ZHJ-MAPCs和人肝细胞系L02仅培养液相通行间接共培养. 分别于培养第1、3、5、7天应用免疫细胞化学法鉴定ZHJ-MAPCs的ALB、AFP、CK-18、CK-19等肝细胞特征性表型表达情况, 并设阳性对照和阴性对照, 计数阳性细胞比率; (2)直接共培养: 将CFSE荧光(绿色)标记的第4代ZHJ-MAPCs与L02(密度均为1×107/L)按照各50%比例混合行直接共培养. 5 d后用SABC-Cy3免疫荧光(红色)双标后在激光共聚焦显微镜下分别观察ZHJ-MAPCs表达ALB, AFP, CK-18的情况. 同样设阳性对照和阴性对照.
结果: (1)间接共培养: AFP在ZHJ-MAPCs间接共培养第1天即表现为强阳性, 随后表达逐渐减弱. ALB在共培养第1天有可疑阳性, 第3天出现较强的阳性, 第5天达到高峰. CK-18在培养第1、3天检测均为阴性, 至第5天开始出现阳性, 第7天表达较前增强. CK-19在各时间点均为阴性着色. (2)直接共培养: 胞质内呈黄色荧光ALB和CK18的阳性细胞即向肝细胞分化的ZHJ-MAPCs在共培养5 d时出现较多, 而AFP阳性表达则仅出现在极个别细胞, 该结果与阳性对照细胞荧光表达类似.
结论: 人骨髓来源的ZHJ-MAPCs与人肝细胞系L02行间接或直接共培养均能够诱导其向成熟肝样细胞定向分化,且直接共培养有提前趋势.
引文著录: 王海澜, 高毅, 蒋泽生, 慕宁. 人骨髓来源多能成体祖细胞ZHJ-MAPCs与人肝细胞系L02体外共培养向肝样细胞的分化. 世界华人消化杂志 2006; 14(23): 2294-2300
Revised: April 13, 2006
Accepted: April 20, 2006
Published online: August 18, 2006
AIM: To investigate the feasibility that ZHJ-multipotent adult progenitor cells from bone marrow (ZHJ-MAPCs) differentiate into hepatocytes as co-cultured with human liver cell line L02 in vitro.
METHODS: Co-culture without cell-to-cell contact: ZHJ-MAPCs and L02 hepatocytes were speared on coverslip separately, and then were put in a culture dish. The levels of albumin (ALB), alpha-fetoprotein (AFP), cytokeratin-18 (CK-18), and cytokeratin-19 (CK-19) expression in ZHJ-MAPCs were detected by immunocytochemistry at different time points. Separated culture of L02 hepatocytes served as positive controls and separated culture of ZHJ-MAPCs served as negative controls. Co-culture with cell-to-cell contact: ZHJ-MAPCs labelled with carboxyfluorescein diacetate succidimidyl ester (CFSE) were mixed with L02 hepatocytes (both with cell density of 1×107/L), and then the mixed cells were seeded on special dish for detection by laser scanning confocal microscopy (LSCM). Five days later, the cells were doubly stained with SABC-Cy3 fluorescent reagent. The levels of ALB, AFP, and CK-18 in ZHJ-MAPCs were observed under LSCM. Similarly, the positive and negative controls were designed.
RESULTS: Co-culture without cell-to-cell contact: High level of AFP expression appeared in ZHJ-MAPCs at the 1st day, and then AFP expression tapered daily. The expression of ALB was very weak at the 1st day, but increased a lot at the 3rd day, and reached the peak at the 5th day. The initial expression of CK18 appeared at the 5th day, and reached a higher level at the 7th day. The expression of CK19 was always negative. Co-culture with cell-to-cell contact: Yellow cells were ZHJ-MAPCs differentiated into hepatocytes; Green cells were undifferentiated ZHJ-MAPCs; Red cells were L02 hepatocytes. At the 5th day, many ZHJ-MAPCs with positive expression of ALB and CK18 appeared, while just few ZHJ-MAPCs with positive expression of AFP were observed.
CONCLUSION: ZHJ-MAPCs can be induced to differentiate into mature hepatocyte-like cells by co-culture with L02 hepatocytes, either with or without cell-to-cell contact, but the former may be more effective.
- Citation: Wang HL, Gao Y, Jiang ZS, Mu N. ZHJ-multipotent adult progenitor cells differentiate into hepatocyte-like cells as co-cultured with human liver cell line L02. Shijie Huaren Xiaohua Zazhi 2006; 14(23): 2294-2300
- URL: https://www.wjgnet.com/1009-3079/full/v14/i23/2294.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i23.2294
人骨髓来源多能成体祖细胞(multipotent adult progenitor cells, MAPCs)具有向肝细胞分化潜能[1-3], 由于其取材方便, 可以来自患者自身, 无排斥反应, 具有重要的临床应用价值, 因而有望成为肝组织工程新的种子细胞来源. 我们已经通过密度梯度离心-贴壁培养筛选-免疫磁性双阴性分选(magnetic activated cell sorting, MACS)3个步骤高效率地纯化分选出骨髓间充质干细胞(mesenchymal stem cells, MSCs)亚群MAPCs(CD45-, GlyA-), 并将之命名为ZHJ-MAPCs(Zhujiang-MAPCs)[4-5]; 本实验采用ZHJ-MAPCs与肝细胞系L02共培养的方法继续探讨ZHJ-MAPCs向肝细胞定向分化的能力. 为其在组织工程学研究和临床医学中的广泛应用奠定基础.
L02人肝细胞株, 购自上海细胞生物研究所; 羊抗人ALB, 购自Sigma公司; 鼠抗人AFP, 购自Neomarkers公司; 鼠抗人CK18, 鼠抗人CK19, 购自Chemicon公司; 抗小鼠 IgG SABC-Cy3试剂盒, 抗山羊IgG SABC-Cy3试剂盒, 武汉博士德; CFSE, 购自Molecular Probes公司; 抗羊SP免疫组化试剂盒、AEC显色试剂盒、DAB显色试剂盒、抗鼠免疫组化广谱试剂盒, 购自福州迈新生物技术开发公司. ZHJ-MAPCs培养基配方(1000 mL): 低糖DMEM 600 mL, MCDB-201 400 mL, 胰岛素5 mg, 转铁蛋白100 mg, 牛血清白蛋白1 g, 地塞米松0.03925 mg, 硒仕钠抗坏血栓2-磷酸盐25.62 mg, 亚油酸4.7 mg, 谷氨酰胺3.9 mg, 用NaHCO3调节pH值至7.4, 过滤除菌, 4 ℃保存(LIF按10 µg/L、FCS按50 mL/L浓度在使用中加入). CFSE荧光染剂: CFSE 500 µg; DMSO 90 µL(使用时取上述原液1 µL加入PBS 2 mL中).
1.2.1 人肝细胞系L02与ZHJ-MAPCs间接共培养诱导其向肝样细胞分化: (1)将分别接种于盖玻片上的传代ZHJ-MAPCs和人肝细胞系L02(密度均为1×107/L)按照各50%比例共置于直径10 cm培养皿中, 培养液共通(自制ZHJ-MAPCs培养基, 5% FCS, 不加LIF), 实现间接共培养. (2)分别于间接共培养第1, 3, 5, 7天免疫细胞化学鉴定ZHJ-MAPCs的ALB, AFP, CK18, CK19等肝细胞特征性表型表达变化情况, 并设阳性对照(单独培养的L02细胞)和阴性对照(单独培养未经诱导的ZHJ-MAPCs), 计数阳性细胞比率, 起始共培养时间计为第0天. 间接共培养的细胞达到各诱导时间点后, 行免疫细胞化学染色. 一抗为羊抗人ALB(1:400)、鼠抗人AFP(1:320)、CK18(1:400)和CK19(1:400), 设阳性、阴性、替代对照. 其中AFP, CK18和CK19用ABC法, DAB显色, 胞质内出现棕黄色颗粒反应为阳性; ALB用SP法, AEC显色, 胞质内出现棕红色颗粒反应为阳性. 我们采用半量化免疫细胞化学结果: 每个结果我们取5个有代表性的高倍镜视野(×200), 计数阳性染色细胞所占百分比, 取其平均值.
1.2.2 CFSE标记第4代ZHJ-MAPCs后与人肝细胞系L02直接共培养诱导其向肝样细胞分化: 待50 mL培养瓶内长满第4代ZHJ-MAPCs后(2×106)吸去培养液, 加入配制好的CFSE荧光染剂2 mL, 终浓度为0.3 nmol/细胞, 37 ℃孵箱内孵育20 min; 吸去CFSE荧光染剂, PBS清洗2遍; 加入自制MAPCs全培后37 ℃孵箱内继续孵育30 min. 更换全培后37 ℃孵箱内过夜. 用0.25 g/L胰酶将CFSE标记的ZHJ-MAPCs消化下来后与L02细胞(密度均为1×107/L)按照各50%比例混合后接种于激光共聚焦显微镜扫描专用培养皿内, 实现直接共培养. 直接共培养5 d用SABC-Cy3(红色荧光)间接免疫荧光进行双标免疫荧光染色. 一抗为羊抗人ALB(1:400), 鼠抗人AFP(1:320)和CK18(1:400)、设阳性、阴性、空白对照. 阳性对照为单独培养的CFSE标记L02细胞, 阴性对照为单独培养未诱导分化的CFSE标记ZHJ-MAPCs. 在激光共聚焦显微镜下观察ZHJ-MAPCs表达ALB, AFP, CK18的情况. 阳性结果为胞质出现黄色荧光.
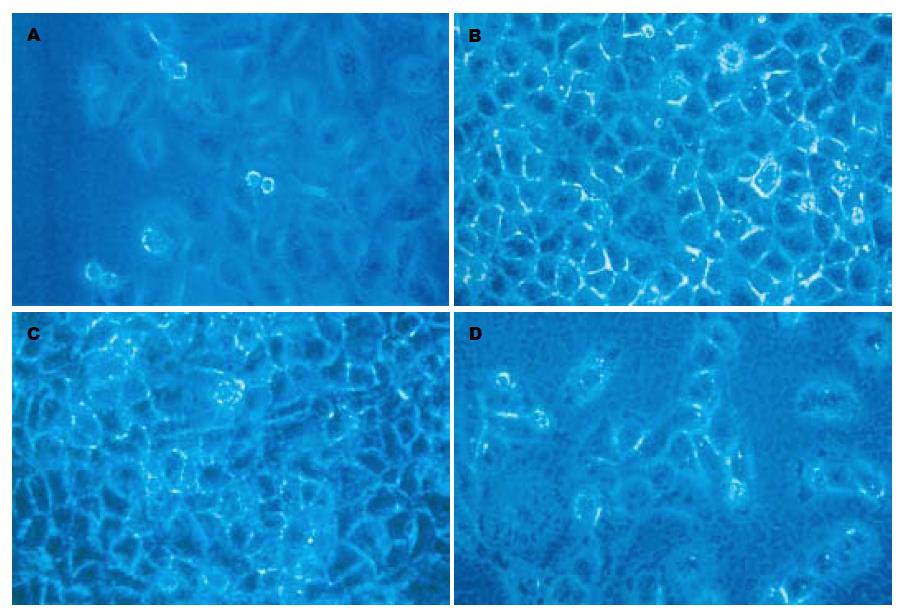
ZHJ-MAPCs单独培养时大多呈现内皮细胞样的梭型或成纤维细胞样长条形. 在两种共培养体系中, 梭形或成纤维细胞样ZHJ-MAPCs均随着诱导时间的延长, 变成纺锤、不规则圆形或多角形, 与L02肝细胞形态相似(图1D).
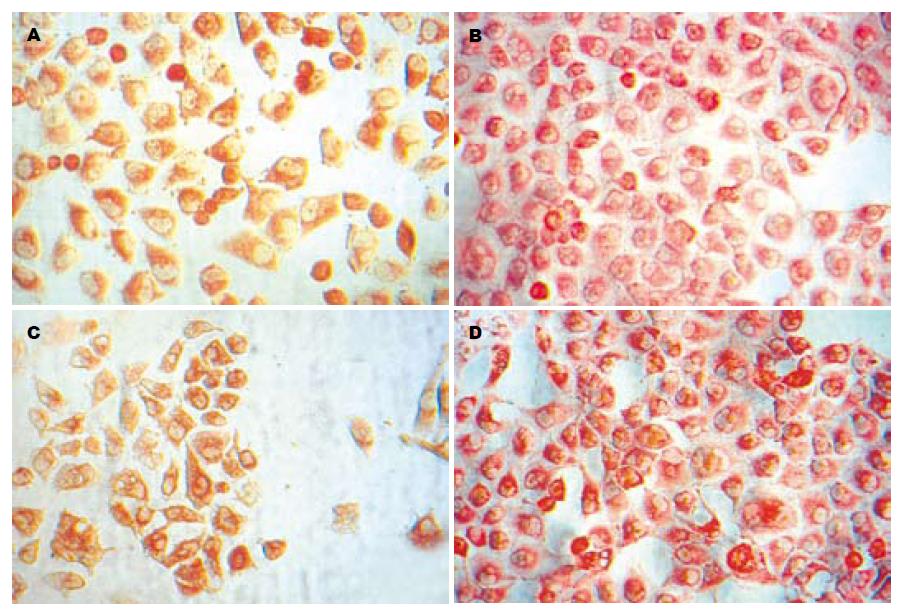
我们分别在诱导第1, 3, 5, 7天对ZHJ-MAPCs行免疫细胞化学染色, L02细胞为阳性对照, 未诱导ZHJ-MAPCs细胞为阴性对照, 结果见表1. 结果显示: AFP作为不成熟肝细胞的表型标志, 在间接共培养第1天表现为强阳性表达, ALB可疑阳性表达, CK18为阴性; 而间接共培养第3天, ALB即出现较强的阳性表达, 相反AFP的阳性表达减少; 第5天, ALB的阳性表达即达到高峰, AFP阳性表达继续减少, 而此时CK-18出现阳性表达; 间接共培养第7天, 密集生长的细胞广泛的阳性表达ALB, AFP的阳性表达已经很少, CK-18阳性表达增多; CK-19在各时间点均为阴性着色(图2A-D).
| 天数(d) | ALB | AFP | CK-18 | CK-19 |
| 1 | ± | ++++++ | - | - |
| 3 | +++++ | +++ | - | - |
| 5 | ++++++ | + | ++ | - |
| 7 | ++++++ | ± | +++ | - |
| 阳性对照 | +++++ | ± | ++++ | - |
| 阴性对照 | - | - | - | - |
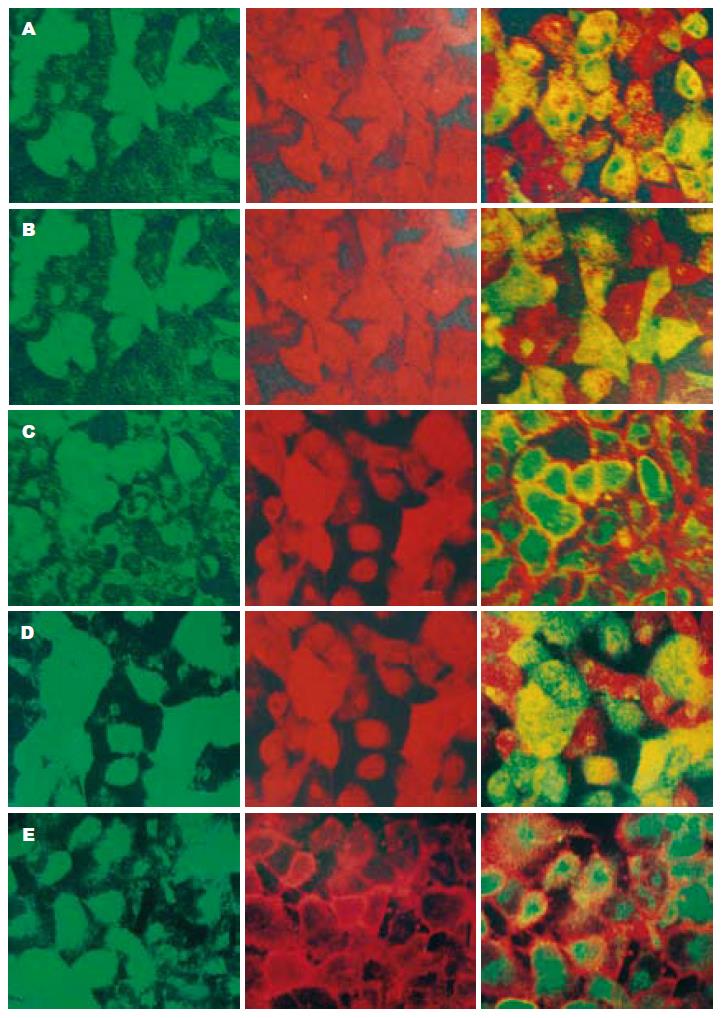
我们将CFSE(绿色)荧光标记的ZHJ-MAPCs和L02直接共培养, 在第5天行SABC-Cy3免疫细胞荧光(红色)染色后行激光共聚焦显微镜扫描分析, 观察ALB, AFP, CK18的表达情况, 镜下呈黄色荧光的细胞即是向肝细胞分化的ZHJ-MAPCs, 为阳性细胞; 单纯表达绿色荧光的细胞为未分化的ZHJ-MAPCs; 单纯表达红色荧光的细胞为L02细胞. 图像分析显示, 胞质内呈黄色荧光的ALB和CK18表达阳性细胞较多, 而AFP则仅在极个别细胞内呈阳性表达(图3A-E).
自1999年以来, 在骨髓中已经发现多种细胞亚群具有向肝细胞分化的潜能[6-9], 其中MAPCs在一定诱导、培养条件下, 不仅能分化为间充质组织细胞, 而且能分化为内皮组织[10-12]细胞如血管内皮细胞和内胚层组织细胞如具有肝功能样肝细胞[13-15]. 我们参照Reyes et al[10,16]的研究从正常成年人骨髓中通过梯度离心及免疫磁珠筛选分离纯化出MSCs一个亚群的ZHJ-MAPCs (CD45-, glycophorin-A-), 该类细胞具有易于调控、供源丰富、易于获得、有自体供源避免免疫排斥等优点. 但是ZHJ-MAPCs是否能在一定条件下向肝细胞定向分化, 是其能否成为肝组织工程种子细胞的关键. 目前诱导干细胞向肝细胞定向分化的方法以细胞因子诱导多见[10-11,17-18]. Yamazaki et al[19], Yamada et al[20], Lange et al[2,21]分别将鼠骨髓细胞与肝非实质细胞、胎肝细胞、肝细胞共培养, 检测到较强表达的肝细胞特异性基因及成熟肝细胞表型的基因, 并阐明其机制在于模拟了器官特异性的微环境. 本实验应用的人肝细胞系L02源于正常成人肝细胞, 是一种高分化的人肝细胞系, 各项生物功能较好[22]. 探讨ZHJ-MAPCs与其在间接和直接两种共培养模式下向肝样细胞分化的能力.
在间接共培养模式下, ZHJ-MAPCs与L02细胞分别培养, 培养液共通, 结果显示, AFP作为不成熟肝细胞的表型标志, 在间接共培养1 d表现为强阳性表达, 随着时间逐渐减少; ALB在第1 d可疑阳性表达, 随着时间渐增强, 间接共培养7 d, 密集生长的细胞广泛的阳性表达ALB, AFP的阳性表达已经很少; 另一种成熟肝细胞特征表型CK18在共培养5 d出现阳性表达, 在间接共培养7 d阳性表达增多; 成熟胆管细胞特征表型CK19在各时间点均为阴性着色. 说明在此模式下, 7 d可以诱导ZHJ-MAPCs分化为较为成熟的肝样细胞. 本实验结果表明ZHJ-MAPCs和肝细胞或具有肝细胞特异性功能的肝细胞系间接共培养, 可能为ZHJ-MAPCs向肝样细胞定向分化提供适宜的微环境, 从而诱导其分化为肝细胞.
在间接共培养取得阳性结果的基础上, 我们探讨了直接共培养诱导分化的方法, 即将ZHJ-MAPCs与L02细胞混合后共培养, 使之直接接触. 我们采用了绿色荧光染料羧基荧光素二醋酸盐琥珀酰亚胺酯(5, 6-carboxyfluorescein diacetate succinimidyl ester, CFSE)标记ZHJ-MAPCs, 这是一种可穿过细胞膜的荧光染料[23-24], 细胞分裂时CFSE标记荧光可平均分配到两个子代细胞中, 可定位于细胞膜、细胞质和细胞核内, 细胞核标记最明显[25], 且对细胞的正常生理活动无影响[26]; SABC-Cy3是专为免疫荧光化学设计的检测试剂盒, 用以显示组织或细胞中的抗原分布. 其中花箐素-3(Cyanine-3, Cy3)是3H-吲哚箐染料中的代表化合物, 与标记在二抗上的长臂生物素结合后, 激发呈鲜红色荧光, 较传统荧光更具有亲水性. 标记CFSE后的ZHJ-MAPCs与未标记的L02细胞直接共培养, 在第5天行SABC-Cy3免疫细胞荧光(红色)染色后行激光共聚焦显微镜扫描(laser scanning confocal microscope, LSCM), 分别观察ALB, AFP, CK18的表达情况. 镜下单纯表达绿色荧光的细胞为未分化的ZHJ-MAPCs; 表达黄色荧光的细胞既是向肝细胞分化的ZHJ-MAPCs, 为阳性细胞; 单纯表达红色荧光的细胞为L02细胞. 结果ALB和CK18胞质内出现较多黄色荧光表达, 而AFP则仅在极个别细胞内阳性表达. 初步说明直接共培养5 d, ZHJ-MAPCs被诱导分化为较为成熟的肝样细胞, 较间接共培养诱导分化的时间似乎更为提前, 提示细胞直接接触时, 细胞间直接信号交流和或细胞因子局部的高浓度也可能对诱导特异性分化产生作用. 国内外尚未见有关于人类骨髓来源干细胞的类似研究结果. 根据Mizugchi et al[27]的研究, 将骨髓来源基质细胞和肝细胞共培养, 发现肝细胞和基质细胞数均较单独培养明显增加, 且肝细胞功能较单独培养增强. Takeda et al[28]的体内实验取得了相似的结果.
目前利用共培养诱导骨髓间充质干细胞的实验研究较少, 且局限于啮齿类动物细胞, 本实验利用我们自行分离纯化、传代培养的人骨髓来源的多能成体组细胞(ZHJ-MAPCs), 建立了与人肝细胞系L02共培养诱导其向肝样细胞定向分化的方法, 在较短的时间(7 d)诱导ZHJ-MAPCs转化为具有较成熟肝细胞表型的肝样细胞, 且获得了较高的转化效率, 比较利用细胞因子[10-11,17-18]、病理血清[29-30]等诱导的方法, 在诱导时间及效率上, 共培养表现出较为明显的优势. 同时, 本实验间接共培养的研究由于干细胞不与肝组织直接接触而排出了融合的可能性, 与Jiang et al[31]的结果一致, 支持了微环境诱导ZHJ-MAPCs横向分化为功能性肝细胞的理论.
尽管向肝细胞分化的ZHJ-MAPCs的功能尚需进一步检测, 干细胞定向分化的机制仍需探索, 与不同细胞共培养诱导转化的效能尚需要更多的证据, 共培养情况下肝细胞功能的改变仍值得进一步研究, 但我们已经证实ZHJ-MAPCs具有较高的纯度, 体外培养获得了活跃而稳定的增殖特性, 并表明骨髓来源的ZHJ-MAPCs与肝细胞体外共培养可以成功诱导其向成熟肝样细胞定向分化. 通过共培养模式诱导其定向分化, 扩大培养规模有望在短时间内满足治疗数量级的需求和维持较高的肝特异性功能, 可以为HBAL和肝细胞移植等肝细胞组织工程提供更为充足的肝细胞源.
杂交型生物人工肝治疗可使终末期肝病患者桥接肝移植, 促进肝细胞再生, 但其核心生物材料的肝细胞来源问题未得到根本解决. 研究证明, 人骨髓来源多能成体祖细胞具有向肝细胞分化潜能, 由于其取材方便, 可以来自患者自身, 无排斥反应, 具有重要的临床应用价值, 因而有望成为肝组织工程新的种子细胞来源.
目前诱导干细胞向肝细胞定向分化的方法以细胞因子诱导多见[10-11,17-18], 其可能的机制在于这些生长因子和细胞因子对肝细胞的分化和再生的控制作用; 利用共培养诱导骨髓 间充质干细胞的实验研究较少, 且局限于啮齿类动物细胞[19-21].
根据Takeda et al[28]的研究, 将骨髓来源基质细胞和大 鼠肝细胞共培养, 发现肝细胞和基质细胞数均较单独培养明显增加, 且肝细胞功能较单独培养增强, 而将二处细胞用可透过可溶因子的半透膜隔开共培养, 肝细胞增殖不明显, 间接证明了 骨髓基质细胞对肝细胞的作用是通过直接接触发生作用的.
目前利用共培养诱导骨髓间充质干细胞的实验研究较少, 且局限于啮齿类动物细胞, 本文课题实 验利用自行分离纯化、传代培养的人骨髓来源的多能成体组细胞(ZHJ-MAPCs), 建立了与人肝细胞系L02共培养, 诱导其向肝样细胞定向分化的方法. 在较短的时间(7 d)诱导ZHJ-MAPCs转化为具有较成熟肝细胞表型的肝样细胞, 且获得了较高的转化效率, 比较利用细胞因子、病理血清等诱导的方法, 在诱导时间及效率上, 共培养表现出较为明显的优势.
通过共培养模式诱导其定向分化, 扩大培养规模有望在短时间内满足治疗数量级的 需求和维持较高的肝特异性功能, 可以为HBAL和肝细胞移植等肝细胞组织工程提供更为充足的肝细胞源.
人骨髓来源多能成体祖细胞(MAPCs): 是Verfaillie et al从出生后啮齿类动物和人类骨髓中筛选出的一种细胞, 该细胞表达CD45-和GlyA-, class Ⅰ HLA-, CD34-、CD45-、CD117-与造血干细胞区分. 这种细胞在体外能扩增80代以上保持未分化状态, 在一定诱导、培养条件下, 不仅能分化为间充质组织细胞, 而且能分化为内皮组织细胞如血管内皮细胞和内胚层组织细胞, 如具有肝功能样细胞.
电编: 李琪 编辑:潘伯荣
| 1. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] |
| 2. | Lange C, Bassler P, Lioznov MV, Bruns H, Kluth D, Zander AR, Fiegel HC. Liver-specific gene expression in mesenchymal stem cells is induced by liver cells. World J Gastroenterol. 2005;11:4497-4504. [PubMed] |
| 3. | Kang XQ, Zang WJ, Song TS, Xu XL, Yu XJ, Li DL, Meng KW, Wu SL, Zhao ZY. Rat bone marrow mesenchymal stem cells differentiate into hepatocytes in vitro. World J Gastroenterol. 2005;11:3479-3484. [PubMed] |
| 6. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] |
| 7. | Yamamoto N, Terai S, Ohata S, Watanabe T, Omori K, Shinoda K, Miyamoto K, Katada T, Sakaida I, Nishina H. A subpopulation of bone marrow cells depleted by a novel antibody, anti-Liv8, is useful for cell therapy to repair damaged liver. Biochem Biophys Res Commun. 2004;313:1110-1118. [PubMed] |
| 8. | Shu SN, Wei L, Wang JH, Zhan YT, Chen HS, Wang Y. Hepatic differentiation capability of rat bone marrow-derived mesenchymal stem cells and hematopoietic stem cells. World J Gastroenterol. 2004;10:2818-2822. [PubMed] |
| 9. | Lee KD, Kuo TK, Whang-Peng J, Chung YF, Lin CT, Chou SH, Chen JR, Chen YP, Lee OK. In vitro hepatic differentiation of human mesenchymal stem cells. Hepatology. 2004;40:1275-1284. [PubMed] |
| 10. | Reyes M, Lund T, Lenvik T, Aguiar D, Koodie L, Verfaillie CM. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood. 2001;98:2615-2625. [PubMed] |
| 11. | Uzan G. Therapeutic potential of circulating endothelial cells. J Soc Biol. 2005;199:107-111. [PubMed] |
| 12. | Quirici N, Soligo D, Caneva L, Servida F, Bossolasco P, Deliliers GL. Differentiation and expansion of endothelial cells from human bone marrow CD133(+) cells. Br J Haematol. 2001;115:186-194. [PubMed] |
| 13. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 14. | Tang LJ, Gao Y, Zhang Z, Li H, Shan YQ. Human bone marrow multipotent adult progenitor cells differentiate into hepatocyte-like cells with hepatocyte growth factor plus fibroblast growth factor-4 in vitro. Zhonghua Ganzangbing Zazhi. 2005;13:652-655. [PubMed] |
| 16. | Reyes M, Verfaillie CM. Characterization of multipotent adult progenitor cells, a subpopulation of mesenchymal stem cells. Ann NY Acad Sci. 2001;938:231-233; discussion 233-235. [PubMed] |
| 17. | Oh SH, Miyazaki M, Kouchi H, Inoue Y, Sakaguchi M, Tsuji T, Shima N, Higashio K, Namba M. Hepatocyte growth factor induces differentiation of adult rat bone marrow cells into a hepatocyte lineage in vitro. Biochem Biophys Res Commun. 2000;279:500-504. [PubMed] |
| 18. | Okumoto K, Saito T, Hattori E, Ito JI, Adachi T, Takeda T, Sugahara K, Watanabe H, Saito K, Togashi H. Differentiation of bone marrow cells into cells that express liver-specific genes in vitro: implication of the Notch signals in differentiation. Biochem Biophys Res Commun. 2003;304:691-695. [PubMed] |
| 19. | Yamazaki S, Miki K, Hasegawa K, Sata M, Takayama T, Makuuchi M. Sera from liver failure patients and a demethylating agent stimulate transdifferentiation of murine bone marrow cells into hepatocytes in coculture with nonparenchymal liver cells. J Hepatol. 2003;39:17-23. [PubMed] |
| 20. | Yamada Y, Nishimoto E, Mitsuya H, Yonemura Y. In vitro transdifferentiation of adult bone marrow Sca-1+ cKit- cells cocultured with fetal liver cells into hepatic-like cells without fusion. Exp Hematol. 2006;34:97-106. [PubMed] |
| 21. | Lange C, Bassler P, Lioznov MV, Bruns H, Kluth D, Zander AR, Fiegel HC. Hepatocytic gene expression in cultured rat mesenchymal stem cells. Transplant Proc. 2005;37:276-279. [PubMed] |
| 23. | Hoefel D, Grooby WL, Monis PT, Andrews S, Saint CP. A comparative study of carboxyfluorescein diacetate and carboxyfluorescein diacetate succinimidyl ester as indicators of bacterial activity. J Microbiol Methods. 2003;52:379-388. [PubMed] |
| 24. | Wang XQ, Duan XM, Liu LH, Fang YQ, Tan Y. Carboxyfluorescein diacetate succinimidyl ester fluorescent dye for cell labeling. Acta Biochim Biophys Sin (Shanghai). 2005;37:379-385. [PubMed] |
| 25. | 陈 蕾蕾, 陈 军浩, 孙 雪梅, 施 广飞. 荧光染料CFSE作为细胞标记的特性研究. 细胞与分子免疫学杂志. 2004;20:140-141. |
| 26. | Dumitriu IE, Mohr W, Kolowos W, Kern P, Kalden JR, Herrmann M. 5,6-carboxyfluorescein diacetate succinimidyl ester-labeled apoptotic and necrotic as well as detergent-treated cells can be traced in composite cell samples. Anal Biochem. 2001;299:247-252. [PubMed] |
| 27. | Mizuguchi T, Hui T, Palm K, Sugiyama N, Mitaka T, Demetriou AA, Rozga J. Enhanced proliferation and differentiation of rat hepatocytes cultured with bone marrow stromal cells. J Cell Physiol. 2001;189:106-119. [PubMed] |
| 28. | Takeda M, Yamamoto M, Isoda K, Higashiyama S, Hirose M, Ohgushi H, Kawase M, Yagi K. Availability of bone marrow stromal cells in three-dimensional coculture with hepatocytes and transplantation into liver-damaged mice. J Biosci Bioeng. 2005;100:77-81. [PubMed] |
| 29. | 方 天翎, 闵 军, 邓 小耿, 钱 世鹍, 禇 忠华, 陈 亚进, 邵 静, 魏 莆, 陈 积圣. 含淤胆血清的培养体系外诱导胚胎干细胞表达肝细胞功能的研究. 中华肝脏病杂志. 2004;12:726-729. |
| 30. | 邓 小耿, 方 天翎, 曹 铭辉, 杨 勇志, 邵 静, 魏 菁, 陈 积圣, 闵 军. 淤胆血清"病理微环境"诱导胚胎干细胞向肝细胞分化. 中国病理生理杂志. 2004;20:985-989. |
| 31. | Jang YY, Collector MI, Baylin SB, Diehl AM, Sharkis SJ. Hematopoietic stem cells convert into liver cells within days without fusion. Nat Cell Biol. 2004;6:532-539. [PubMed] |