修回日期: 2006-06-20
接受日期: 2006-06-27
在线出版日期: 2006-08-18
目的: 研究幽门螺杆菌(H. pylori)疫苗接种小鼠产生免疫后胃炎的影响因素.
方法: 将H. pylori疫苗免疫C57BL/6和BALB/c的小鼠, 观察攻击后胃黏膜H. pylori定植和炎症情况. 将H. pylori疫苗免疫C57BL/6小鼠, 然后予不同菌量的H. pylori攻击, 观察胃黏膜H. pylori定植和炎症情况. 将H. pylori疫苗经口和经腹腔免疫C57BL/6小鼠, 观察攻击后胃黏膜H. pylori定植和炎症情况. 对感染H. pylori的C57BL/6小鼠予H. pylori疫苗治疗, 观察治疗免疫后胃黏膜H. pylori定植和炎症情况.
结果: 不同品系的小鼠免疫保护程度无明显差异, 但C57BL/6小鼠免疫后胃炎重于BALB/c小鼠. 接受不同攻击菌量的小鼠保护程度无明显差异, 但大的攻击菌量可诱导更严重的免疫后炎症. 不同免疫途径诱导的免疫保护程度及攻击后不同时间点的炎症程度均无显著性差异. 治疗性免疫导致H. pylori定植明显降低, 同时也引发更为严重的胃炎.
结论: 在不同的免疫宿主、免疫途径和治疗性免疫中均存在免疫后胃炎. 免疫后胃炎的强弱程度受免疫宿主和攻击菌量的影响.
引文著录: 陈洁, 陈旻湖, 王锦辉, 朱森林. 幽门螺杆菌疫苗接种小鼠产生免疫后胃炎的影响因素. 世界华人消化杂志 2006; 14(23): 2275-2280
Revised: June 20, 2006
Accepted: June 27, 2006
Published online: August 18, 2006
AIM: To explore the influence factors of post-immunization gastritis after H. pylori vaccine immunization in mice.
METHODS: (1) C57BL/6 and BALB/c mice were orally immunized with H. pylori vaccine (H. pylori whole cell sonicate antigen plus mucosa adjuvant cholera toxin). Gastric H. pylori infection and inflammation were evaluated after H. pylori challenge. (2) C57BL/6 mice were orally immunized with H. pylori vaccine, and then challenged by different amounts of H. pylori. Gastric H. pylori infection and inflammation were evaluated after H. pylori challenge. (3) C57BL/6 mice were immunized orally or intraperitoneally with H. pylori vaccine. Gastric H. pylori infection and inflammation were evaluated after H. pylori challenge at different time points. (4) Infected C57BL/6 mice were orally immunized with H. pylori vaccine, and gastric H. pylori infection and inflammation were evaluated after immunization at different time points.
RESULTS: (1) Similar decreasing of H. pylori colonization was found in both C57BL/6 and BALB/c mice. However, C57BL/6 mice showed more severe post-immunization gastritis than BALB/c mice did. (2) Although H. pylori colonization was similar in all groups with different challenging amounts, larger amount of H. pylori challenge induced more severe post-immunization gastritis. (3) Similar post-immunization gastritis and decreasing of H. pylori colonization were found in mice with both oral and intraperitoneal immunization at different time points. (4) Therapeutic immunization led to significant decreasing of H. pylori colonization in infected mice; meanwhile more severe gastritis was also found in therapeutic group when compared with that in control group.
CONCLUSION: Post-immunization gastritis occurs in different immune hosts, the same hosts with different vaccination routes and hosts received therapeutic immunization. H. pylori challenge amounts and immune host are influential factors of post-immunization gastritis degree.
- Citation: Chen J, Chen MH, Wang JH, Zhu SL. Influence factors of post-immunization gastritis after Helicobacter pylori vaccine immunization in mice. Shijie Huaren Xiaohua Zazhi 2006; 14(23): 2275-2280
- URL: https://www.wjgnet.com/1009-3079/full/v14/i23/2275.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i23.2275
在幽门螺杆菌(H. pylori)疫苗免疫的动物实验中, 免疫后胃炎这一现象引起了越来越多的关注. 早在90年代初Eaton et al[1]即报道免疫后的悉生小猪受到H. pylori攻击时出现较感染对照更为严重的活动性胃炎. 以后一些研究者在他们的实验中均提及了这一现象[2-4], 而且发现这种胃炎的严重程度与免疫动物受保护的程度相关, 为了和单纯H. pylori感染导致的胃炎区别, 将其称为免疫后胃炎(post-immunization gastritis). 免疫后胃炎的报道引起人们对H. pylori疫苗用于人体的安全性的担忧[5]. 对免疫后胃炎的一种解释是由于免疫反应未能彻底清除攻击细菌, 残存的细菌导致了炎症的发生[2]. Eaton et al[6]用联合免疫缺陷(SCID)小鼠所做的被动免疫实验提示免疫后胃炎与细胞免疫有关; Sutton et al[7]的报道也指出免疫后胃炎是由细胞免疫导致的一过性增强的炎症反应, 而且对免疫动物用猫胃螺杆菌(H. files)攻击较H. pylori攻击可诱发更为严重的免疫后胃炎, 提示免疫后胃炎严重程度受细菌因素影响. 我们前期的研究表明, 不同抗原传递系统组成的H. pylori疫苗即以减毒鼠伤寒沙门菌(Salmonella typhimurium)为载体构建的重组H. pylori疫苗和以黏膜免疫佐剂霍乱毒素(cholera toxin, CT)加H. pylori全菌超声粉碎抗原组成的疫苗免疫小鼠后均出现免疫后胃炎, 免疫后胃炎实质上是免疫动物受到H. pylori攻击后增强的Th1反应的一种表现, 他是伴发于抗H. pylori感染免疫应答的组织病理损伤[8-11]. 我们将进一步探讨免疫后胃炎的其他影响因素, 包括宿主、免疫途径、攻击细菌量等; 了解治疗性免疫(即对已经感染H. pylori的动物进行免疫)是否也会导致免疫后胃炎以及免疫后胃炎的持续时间, 这些问题的研究将进一步加深我们对H. pylori疫苗保护性免疫机制认识, 同时对H. pylori疫苗应用于人体的安全性提供有价值的资料.
C57BL/6和BALB/c小鼠(清洁级)均为♀, 8周龄, 体质量17-20 g, 由中国医学科学院医学实验动物研究所提供. 所用H. pylori SS1菌株(Sydney Strain 1)为澳大利亚新南威尔士大学微生物学院Adrian Lee教授惠赠. 霍乱毒素购自Sigma公司. H. pylori培养和全菌超声粉碎抗原的制备均按我室建立方法进行[10].
1.2.1 免疫宿主对免疫后胃炎的影响: C57BL/6小鼠和BALB/c小鼠各30只, 随机分为免疫组(20只)和对照组(10只). 免疫组在第1周和第4周分别灌胃CT 5 µg+H. pylori超声粉碎抗原1 mg, 对照组予生理盐水(normal saline, NS) 100 µL. 第2次免疫后4 wk给予H. pylori SS1菌株攻击1次(5×107 cfu), 攻击后5 wk处死所有小鼠, 观察胃黏膜H. pylori定植和炎症情况. 按照我们既往的报道[8-11], 胃黏膜H. pylori定植通过快速尿素酶试验和组织学检查评价, 胃黏膜炎症情况通过组织学检测评分.
1.2.2 攻击菌量对免疫后胃炎的影响: C57BL/6小鼠随机分为3个免疫组(15只/组)和1个对照组(10只). 免疫组在第1周和第4周分别灌胃CT 5 µg+H. pylori超声粉碎抗原1 mg, 对照组予NS 100 µL. 第2次免疫后4 wk, 3个免疫组分别予H. pylori SS1菌株5×107 cfu×2次, 5×107 cfu×1次和5×105 cfu×1次攻击, 对照组予SS1 5×107 cfu攻击1次. 攻击后5 wk处死所有小鼠, 观察胃黏膜H. pylori定植和炎症情况.
1.2.3 免疫途径对免疫后胃炎的影响: C57BL/6小鼠随机分为经口免疫组(40只), 腹腔免疫组(40只)和对照组(25只). 免疫组在第1周和第4周分别予CT 5 µg+H. pylori超声粉碎抗原1 mg进行灌胃或ip免疫, 对照组予NS 100 µL. 第2次免疫后第4周予H. pylori SS1菌株攻击1次(5×107 cfu), 攻击后3, 6, 12, 26, 35 wk免疫组各处死8只小鼠, 对照组5只, 观察胃黏膜H. pylori定植和炎症情况.
1.2.4 治疗性免疫对免疫后胃炎的影响: C57BL/6小鼠随机分为免疫治疗组(40只)和对照组(25只). 全部小鼠先予H. pylori SS1菌株感染(5×107 cfu×2次), 感染4 wk后治疗组予CT 5 µg+H. pylori超声粉碎抗原1 mg进行灌胃免疫, 1 wk 1次, 连续4次. 对照组灌胃同体积NS. 免疫后3, 6, 12, 26, 35 wk治疗组各处死8只小鼠, 对照组5只, 观察胃黏膜H. pylori定植和炎症情况.
统计学处理 采用SPSS 10.0统计软件进行. 各组尿素酶试验结果、H. pylori定植评分和胃黏膜炎症评分均以中位数(median, Md)表示, 采用Kruskal-Wallis秩和检验和Mann-whitney秩和检验对各组变量进行比较, P<0.05认为有统计学差异.
和对照组相比C57BL/6小鼠和BALB/c小鼠免疫组在H. pylori攻击后5 wk胃黏膜H. pylori定植量均明显降低(免疫 vs 对照, P<0.001), 但两免疫组保护程度无明显差异; 和对照组相比两免疫组均出现更为严重的胃炎(免疫 vs 对照, P<0.01), 以胃体及窦体交界黏膜中底部和黏膜下层为明显, C57BL/6小鼠的炎症程度重于BALB/c小鼠(P = 0.043, 表1).
| 分组 | n | H. pylori定植 | 炎症评分 | ||
| 尿素酶试验 | 组织学评分 | 胃体 | 胃窦 | ||
| BALB/c小鼠对照组 | 10 | 2 | 3 | 1 | 0.5 |
| BALB/c小鼠免疫组 | 20 | 0 | 0.5 | 2 | 1 |
| C57BL/6小鼠对照组 | 10 | 2 | 3 | 1.2 | 0.5 |
| C57BL/6小鼠免疫组 | 20 | 0 | 0 | 3 | 1.5 |
和对照组相比3个免疫组在H. pylori攻击后5 wk胃黏膜H. pylori定植量均明显降低(P<0.001), 但3组保护程度无明显差异; 3免疫组均出现较对照组更为严重的胃炎(表2), 5×107 cfu攻击菌量诱导的炎症程度重于5×105 cfu攻击菌量(P = 0.037).
| 分组 | n | 攻击菌量(cfu) | H. pylori定植 | 炎症评分 | ||
| 尿素酶试验 | 组织学评分 | 胃体 | 胃窦 | |||
| 对照组 | 10 | 5×107×1次 | 2 | 3.0 | 1 | 0.5 |
| 免疫组 | 15 | 5×107×2次 | 0 | 0.5 | 3 | 2.0 |
| 免疫组 | 15 | 5×107×1次 | 0 | 0 | 3 | 2.0 |
| 免疫组 | 15 | 5×105×1次 | 0 | 0 | 2 | 1.5 |
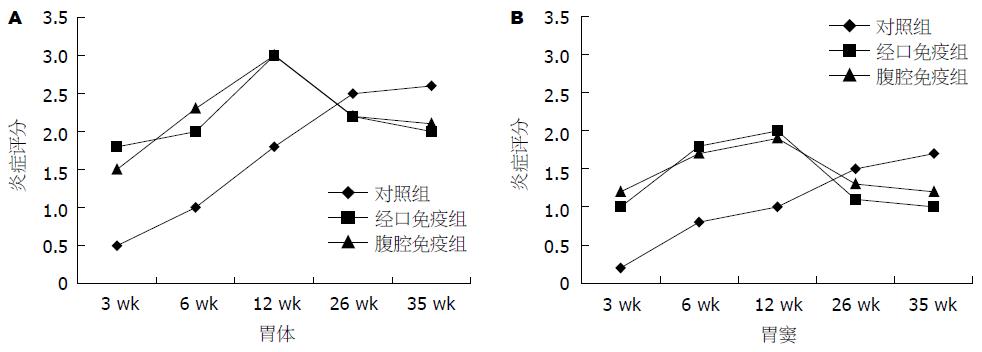
和对照组相比经口免疫组和腹腔免疫组在攻击后各时间点胃黏膜H. pylori定植量均明显降低(P<0.001), 且免疫组随时间推移H. pylori定植逐渐减少, 但两免疫组各时间点保护程度无明显差异. 和对照组相比免疫组在攻击后3, 6, 12 wk出现更为严重的胃炎(P<0.01), 以胃体及窦体交界黏膜中底部和黏膜下层为明显, 但不同免疫途径免疫组炎症程度无显著性差异; 攻击后26, 35 wk免疫组炎症程度有所减轻而对照组炎症程度逐渐加重, 免疫组和对照组炎症程度相比无显著性差异(表3). 在整个实验期间除炎症反应外, 所有小鼠胃黏膜未见萎缩、肠化生等病理改变(图1).
| 分组 | 尿素酶实验 | H. pylori定植组织学评分 | ||||||||
| 3 wk | 6 wk | 12 wk | 26 wk | 35 wk | 3 wk | 6 wk | 12 wk | 26 wk | 35 wk | |
| 对照组 | 1.5 | 2 | 2 | 2 | 2 | 2 | 2.5 | 3 | 3 | 3 |
| 经口免疫组 | 1 | 0 | 0 | 0 | 0 | 1.2 | 0.5 | 0 | 0 | 0 |
| 腹腔免疫组 | 1 | 0.5 | 0 | 0 | 0 | 1.5 | 0.8 | 0.5 | 0 | 0 |
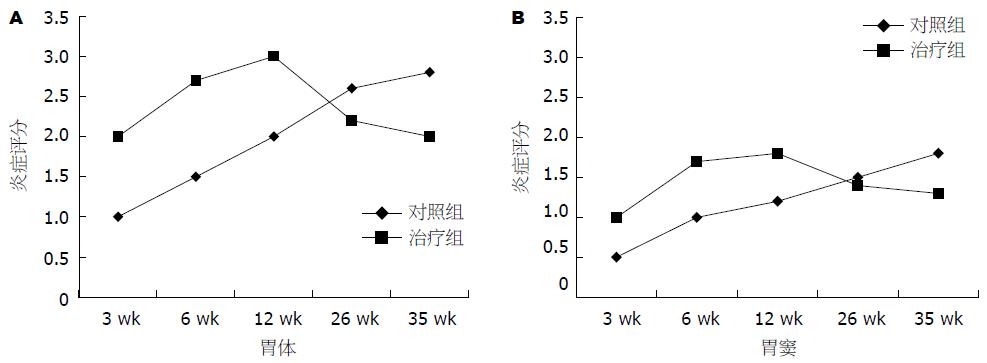
和对照组相比治疗组在免疫后各时间点H. pylori定植均明显降低(P<0.01), 且治疗组随时间推移H. pylori定植逐渐减少(表4); 治疗组在免疫后3, 6, 12 wk出现较对照组更为严重的胃炎(P<0.05), 免疫后26, 35 wk治疗组炎症程度较前有所减轻, 但和对照组相比无显著性差异(图2).
| 分组 | 尿素酶实验 | H. pylori定植组织学评分 | ||||||||
| 3 wk | 6 wk | 12 wk | 26 wk | 35 wk | 3 wk | 6 wk | 12 wk | 26 wk | 35 wk | |
| 对照组 | 2 | 2 | 2 | 2 | 2 | 2.5 | 3 | 3 | 3 | 3 |
| 治疗组 | 1 | 1 | 1 | 0 | 0 | 1.5 | 1.5 | 0.5 | 0 | 0 |
虽然有不少文献都提及了免疫后胃炎这一现象, 但对其进行系统研究的报道极少. 我们前期的研究已经证明, 免疫后胃炎的实质是免疫动物受到H. pylori攻击后早期增强的Th1反应的一种表现, 他是伴发于抗H. pylori感染免疫的组织病理损伤. 免疫后胃炎和H. pylori感染本身导致的胃炎的实质是一样的, 但在时间上H. pylori感染本身导致的胃炎较免疫后胃炎明显延迟[8-11]. Sutton et al[7]报道, 对免疫动物用H. files攻击较H. pylori攻击可诱发更为严重的免疫后胃炎, 提示免疫后胃炎严重程度受细菌因素影响. 虽然免疫后胃炎在不同的动物模型包括悉生小猪、雪貂、小鼠[1-2,7,12-13]中均有报道, 但是没有研究对不同宿主的免疫后胃炎进行比较. 本研究对C57BL/6和BALB/c 2种不同品系的小鼠予同样方案免疫, 再用H. pylori攻击, 结果发现2种小鼠免疫保护程度无明显差异, 但C57BL/6小鼠的免疫后胃炎程度重于BALB/c小鼠, 证明宿主因素也会影响免疫后胃炎的严重程度.
在H. pylori自然感染的研究中, 许多文献报道认为胃组织病理损害的严重程度与活动度均与感染菌量呈正相关[14-16]. 那么在H. pylori疫苗免疫动物模型中, 用于攻击感染的细菌量是否会对免疫后胃炎的严重程度产生一定影响呢? 我们比较了不同攻击菌量对免疫后胃炎的影响, 结果发现和单纯感染对照组相比, 3个免疫组在H. pylori攻击后5 wk胃黏膜H. pylori定植量均明显降低, 3个免疫组均出现较对照组更为严重的胃炎, 5×107 cfu攻击菌量诱导的炎症程度重于5×105 cfu攻击菌量. 这证明攻击菌量在早期可以影响免疫后胃炎的严重程度. 由于H. pylori是一种黏膜感染, 在H. pylori疫苗的研制中多数实验采用黏膜免疫进行接种, 包括经口、经鼻黏膜和直肠黏膜等途径[2,17-18]. 值得注意的是免疫后胃炎多数出现于黏膜免疫途径接种的报道中, 而在系统免疫途径中少有报道. 我们比较了经口免疫和腹腔注射免疫两种不同免疫途径对免疫后胃炎的影响, 结果发现经口免疫和腹腔免疫两种途径达到的免疫保护程度无明显差异, 两种免疫途径均导致了程度相似的免疫后胃炎, 证明免疫后胃炎的产生与不同的免疫接种途径无关. 在现有的报道中, 免疫后胃炎高峰期大多数出现于免疫动物受到攻击的早期, 时间从攻击后1 wk到3 mo不等[2-3,7,12], 随着H. pylori被清除, 免疫后胃炎逐渐减轻, 我们的研究也证明在不同疫苗[8-11]、不同免疫宿主、不同免疫途径的免疫/感染模型中免疫后胃炎的高峰期多出现于攻击后5 wk, 以后炎症程度逐渐减轻. 但是文献报道和本研究均发现, 虽然免疫后胃炎在高峰期过后逐渐减轻, 但在现有的观察期内(Goto et al[3]报道为18 wk, Ermak et al[2]报道为54 wk, Sutton et al[7]报道为18 mo, 本研究最长为35 wk), 免疫后胃炎并没有如预期的完全消退, 而且随时间的推移免疫后胃炎和感染对照组的炎症程度已没有明显差异. 对于H. pylori减少乃至清除后免疫后胃炎在一定时间内仍然持续的原因, 有研究推测与自身免疫反应有关[19]. 免疫后胃炎和H. pylori感染本身导致的胃炎的实质都是Th1反应的一种表现, 在Th1反应中产生的一些细胞因子, 例如IFN-γ可以显著增加胃黏膜上皮细胞MHCⅡ抗原的表达, 而过度表达的MHCⅡ抗原可以将自身抗原提呈给免疫细胞从而激发自身免疫反应. 自身免疫反应也可以解释H. pylori定植和免疫后胃炎产生部位的一些差异, 因为H. pylori多数定植于胃窦和窦体交界部位的胃黏膜[20], 然而免疫后胃炎产生的部位却以胃体和窦体交界部位的胃黏膜为主.
有关免疫后胃炎的报道多数见于预防性免疫实验, 在治疗性免疫实验中报道较少, 一些报道表明随着H. pylori的根除, 免疫动物的胃炎也随之减轻[21-23]. 但Whary et al[13]对感染了鼬鼠螺杆菌的雪貂进行免疫治疗, 却使雪貂的十二指肠炎和溃疡等病理损害加重; Dieterich et al[24]对感染海尔曼螺杆菌(H. heilmannii)的小鼠进行免疫治疗, 结果使免疫小鼠胃黏膜细菌显著减少的同时也加重了胃体黏膜萎缩; 近期Eaton et al[25]所做的被动免疫治疗实验证明, 将免疫C57BL/6小鼠的脾细胞转移给H. pylori感染的联合免疫缺陷(SCID)小鼠, 结果受体鼠在被动免疫后出现了较单纯H. pylori感染的C57BL/6小鼠更为严重的胃炎, 这种炎症反应由细胞免疫介导, 在免疫后9 wk达到高峰, 在免疫后45 wk随H. pylori感染的清除而减退. 本研究也证实, 治疗性免疫使免疫小鼠H. pylori感染清除的同时也导致了较对照鼠更为严重的胃炎, 这种炎症反应在免疫后3-12 wk达到高峰, 免疫后26 wk减轻, 但和预防性免疫实验类似这种炎症直到实验期结束(免疫后35 wk)也没有完全消退, 炎症持续的原因, 推测也与自身免疫反应有关. 对于治疗性免疫导致免疫后胃炎的现象我们可以做如下解释: 在治疗性免疫中, 已经存在的细菌感染对实验动物而言相当于"初次免疫", 而后来进行的免疫治疗则相当于再次免疫; 再次免疫可以导致机体产生更强的免疫反应, 在清除感染细菌的同时也加重了胃黏膜炎症反应.
总之, 我们证实了在不同的免疫宿主、免疫途径和治疗性免疫中均存在免疫后胃炎. 免疫后胃炎的强弱程度受免疫宿主和攻击菌量的影响. 虽然到目前为止免疫后胃炎还没有在人体实验中报道, 但仍然需要更多的尤其是临床实验提供H. pylori疫苗应用于人体的安全性的数据.
幽门螺杆菌(H. pylori)是慢性活动性胃炎和消化性溃疡的重要致病菌, 并与胃腺癌和胃黏膜相关淋巴组织淋巴瘤发病相关. 大量动物实验表明, 通过适当的抗原传递系统(Antigen delivery system)如佐剂或细菌、病毒载体将H. pylori抗原导入机体进行免疫接种可预防甚至治疗H. pylori感染, 说明有效的疫苗接种可诱导机体产生保护性免疫反应
近年来在利用H. pylori疫苗所做的免疫实验中, 免疫后胃炎, 即免疫动物受到H. pylori攻击后出现较单纯感染对照更为严重的胃炎这一现象引起越来越多关注, 对免疫后胃炎的实质以及其影响因素的研究将加深我们对H. pylori疫苗保护性免疫机制认识, 同时对H. pylori疫苗应用于人体的安全性提供有价值的资料.
本文研究了宿主、免疫途径、攻击细菌量等对免疫后胃炎的影响, 证明宿主因素也会影响免疫后胃炎的严重程度; 经口免疫和腹腔免疫两种途径达到的免疫保护程度无明显差异, 两种免疫途径均导致了程度相似的免疫后胃炎, 证明免疫后胃炎的产生与不同的免疫接种途径无关. 研究选题准确, 设计合理, 结果数据可信, 结论明确, 具有一定的理论意义.
电编: 张敏 编辑:潘伯荣
| 1. | Eaton KA, Krakowka S. Chronic active gastritis due to Helicobacter pylori in immunized gnotobiotic piglets. Gastroenterology. 1992;103:1580-1586. [PubMed] |
| 2. | Ermak TH, Ding R, Ekstein B, Hill J, Myers GA, Lee CK, Pappo J, Kleanthous HK, Monath TP. Gastritis in urease-immunized mice after Helicobacter felis challenge may be due to residual bacteria. Gastroenterology. 1997;113:1118-1128. [PubMed] |
| 3. | Goto T, Nishizono A, Fujioka T, Ikewaki J, Mifune K, Nasu M. Local secretory immunoglobulin A and postimmunization gastritis correlate with protection against Helicobacter pylori infection after oral vaccination of mice. Infect Immun. 1999;67:2531-2539. [PubMed] |
| 4. | Mohammadi M, Czinn S, Redline R, Nedrud J. Helicobacter-specific cell-mediated immune responses display a predominant Th1 phenotype and promote a delayed-type hypersensitivity response in the stomachs of mice. J Immunol. 1996;156:4729-4738. [PubMed] |
| 6. | Eaton KA, Ringler SR, Danon SJ. Murine splenocytes induce severe gastritis and delayed-type hypersensitivity and suppress bacterial colonization in Helicobacter pylori-infected SCID mice. Infect Immun. 1999;67:4594-4602. [PubMed] |
| 7. | Sutton P, Danon SJ, Walker M, Thompson LJ, Wilson J, Kosaka T, Lee A. Post-immunisation gastritis and Helicobacter infection in the mouse: a long term study. Gut. 2001;49:467-473. [PubMed] |
| 8. | Chen M, Chen J, Liao W, Zhu S, Yu J, Leung WK, Hu P, Sung JJ. Immunization with attenuated Salmonella typhimurium producing catalase in protection against gastric Helicobacter pylori infection in mice. Helicobacter. 2003;8:613-625. [PubMed] |
| 12. | Michetti P, Corthesy-Theulaz I, Davin C, Haas R, Vaney AC, Heitz M, Bille J, Kraehenbuhl JP, Saraga E, Blum AL. Immunization of BALB/c mice against Helicobacter felis infection with Helicobacter pylori urease. Gastroenterology. 1994;107:1002-1011. [PubMed] |
| 13. | Whary MT, Palley LS, Batchelder M, Murphy JC, Yan L, Taylor NS, Fox JG. Promotion of ulcerative duodenitis in young ferrets by oral immunization with Helicobacter mustelae and muramyl dipeptide. Helicobacter. 1997;2:65-77. [PubMed] |
| 14. | Jonkers D, Houben G, de Bruine A, Arends JW, Stobberingh E, Stockbrugger R. Prevalence of gastric metaplasia in the duodenal bulb and distribution of Helicobacter pylori in the gastric mucosa. A clinical and histopathological study in 96 consecutive patients. Ital J Gastroenterol Hepatol. 1998;30:481-483. [PubMed] |
| 15. | Satoh K, Kimura K, Yoshida Y, Kasano T, Kihira K, Taniguchi Y. A topographical relationship between Helicobacter pylori and gastritis: quantitative assessment of Helicobacter pylori in the gastric mucosa. Am J Gastroenterol. 1991;86:285-291. [PubMed] |
| 16. | Yamamura F, Yoshikawa N, Akita Y, Mitamura K, Miyasaka N. Relationship between Helicobacter pylori infection and histologic features of gastritis in biopsy specimens in gastroduodenal diseases, including evaluation of diagnosis by polymerase chain reaction assay. J Gastroenterol. 1999;34:461-466. [PubMed] |
| 17. | Corthesy-Theulaz IE, Hopkins S, Bachmann D, Saldinger PF, Porta N, Haas R, Zheng-Xin Y, Meyer T, Bouzourene H, Blum AL. Mice are protected from Helicobacter pylori infection by nasal immunization with attenuated Salmonella typhimurium phoPc expressing urease A and B subunits. Infect Immun. 1998;66:581-586. [PubMed] |
| 18. | Kleanthous H, Myers GA, Georgakopoulos KM, Tibbitts TJ, Ingrassia JW, Gray HL, Ding R, Zhang ZZ, Lei W, Nichols R. Rectal and intranasal immunizations with recombinant urease induce distinct local and serum immune responses in mice and protect against Helicobacter pylori infection. Infect Immun. 1998;66:2879-2886. [PubMed] |
| 19. | van Doorn NE, Namavar F, Sparrius M, Stoof J, van Rees EP, van Doorn LJ, Vandenbroucke-Grauls CM. Helicobacter pylori-associated gastritis in mice is host and strain specific. Infect Immun. 1999;67:3040-3046. [PubMed] |
| 20. | Lee A, O'Rourke J, De Ungria MC, Robertson B, Daskalopoulos G, Dixon MF. A standardized mouse model of Helicobacter pylori infection: introducing the Sydney strain. Gastroenterology. 1997;112:1386-1397. [PubMed] |
| 21. | Corthesy-Theulaz I, Porta N, Glauser M, Saraga E, Vaney AC, Haas R, Kraehenbuhl JP, Blum AL, Michetti P. Oral immunization with Helicobacter pylori urease B subunit as a treatment against Helicobacter infection in mice. Gastroenterology. 1995;109:115-121. [PubMed] |
| 22. | Cuenca R, Blanchard TG, Czinn SJ, Nedrud JG, Monath TP, Lee CK, Redline RW. Therapeutic immunization against Helicobacter mustelae in naturally infected ferrets. Gastroenterology. 1996;110:1770-1775. [PubMed] |
| 23. | Michetti P, Kreiss C, Kotloff KL, Porta N, Blanco JL, Bachmann D, Herranz M, Saldinger PF, Corthesy-Theulaz I, Losonsky G. Oral immunization with urease and Escherichia coli heat-labile enterotoxin is safe and immunogenic in Helicobacter pylori-infected adults. Gastroenterology. 1999;116:804-812. [PubMed] |
| 24. | Dieterich C, Bouzourene H, Blum AL, Corthesy-Theulaz IE. Urease-based mucosal immunization against Helicobacter heilmannii infection induces corpus atrophy in mice. Infect Immun. 1999;67:6206-6209. [PubMed] |
| 25. | Eaton KA, Mefford ME. Cure of Helicobacter pylori infection and resolution of gastritis by adoptive transfer of splenocytes in mice. Infect Immun. 2001;69:1025-1031. [PubMed] |