修回日期: 2006-04-20
接受日期: 2006-05-08
在线出版日期: 2006-08-18
目的: 研究重组腺病毒Ad-IkBaM对5-氟尿嘧啶(5-FU)诱导胃癌细胞凋亡的作用情况, 进而研究胃癌细胞抵抗5-FU的机制.
方法: 培养胃癌SGC-7901细胞, 感染重组腺病毒Ad-IkBaM的细胞为实验组, 感染Ad-IkBa及非感染的空白对照为对照组, 以5 mg/L 5-FU加入上述各组细胞, 采用EMSA法检测5-FU处理后各组细胞内NF-κB激活情况; 应用MTT和TUNEL法分别检测5-FU对各组细胞诱导凋亡的情况.
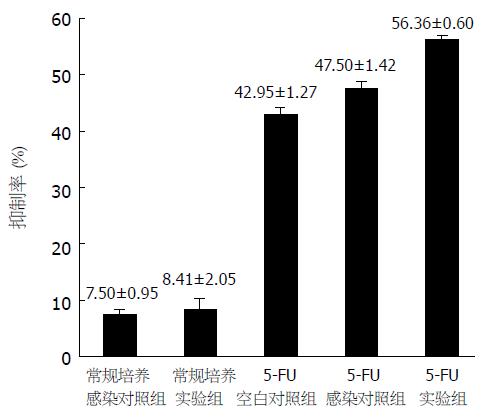
结果: 5-FU作用于胃癌细胞可使细胞内NF-κB激活, 感染Ad-IkBaM使NF-κB活性受到明显抑制. MTT法证明, 5-FU作用后, 感染Ad-IkBaM细胞的凋亡(56.36%±0.60%)较感染Ad-IkBa组(47.50%±1.42%)及未感染组(42.95%±1.27%)明显, 各组间比较有统计学差异(P<0.001); TUNEL法结果与MTT相符, 感染Ad-IkBaM组的凋亡率为29.7%±2.5%, 明显高于感染Ad-IkBa组(20.0%±2.6%)及未感染组(12.3%±1.1%)(P<0.01). 可见, 感染Ad-IkBaM可明显提高5-FU诱导的细胞凋亡.
结论: 感染Ad-IkBaM可通过抑制胃癌细胞NF-κB的活性增强5-FU的诱导凋亡作用.
引文著录: 胡丽红, 刘冰熔, 刘丹, 关景明, 吕志武, 杜雅菊. 重组腺病毒Ad-IkBaM在5-氟尿嘧啶诱导胃癌细胞凋亡中的作用. 世界华人消化杂志 2006; 14(23): 2270-2274
Revised: April 20, 2006
Accepted: May 8, 2006
Published online: August 18, 2006
AIM: To investigate the role of recombinant adenovirus IkBaM (Ad-IkBaM) on the apoptosis of gastric carcinoma SGC-7901 cells induced by 5-fluorouracil (5-FU) as well as the possible mechanism.
METHODS: The cultured SGC-7901 cells were divided into group A, B and C. The cells in group A and B were infected with Ad-IkBaM and Ad-IkBa, respectively, and those in group C served as controls. 5-FU was added to each group at the concentration of 5 mg/L, respectively. Electrophoretic mobility shift assays were used to detect the activation of nuclear facter kappa B (NF-κB) in all the groups, and the 5-FU-induced apoptosis of SGC-7901 cells was tested by MTT and TUNEL method.
RESULTS: After 5-FU treatment, NF-κB was activated in gastric carcinoma cells, but in the cells infected with Ad-IkBaM, the activity of NF-κB was inhibited. MTT assay indicated that the apoptosis rate of cells infected with Ad-IkBaM (56.36% ± 0.60%) was significantly higher than that of cells infected with Ad-IkBa (47.50% ± 1.42%), or without infection (42.95% ± 1.27%) (P < 0.001). TUNEL method showed that the apoptosis rate was 29.7% ± 2.5% in the cells infected with Ad-IkBaM, which was also significantly higher than that of cells infected with Ad-IkBa (20.0% ± 2.6%) or without infection (12.3% ± 1.1%) (P < 0.01). Therefore, infection with Ad-IkBaM markedly promoted the apoptosis induced by 5-FU.
CONCLUSION: Infection with Ad-IkBaM can effectively inhibit the activation of NF-κB in human SGC-7901 cells, and increase the apoptosis induced by 5-FU.
- Citation: Hu LH, Liu BR, Liu D, Guan JM, Lv ZW, Du YJ. Role of recombinant adenovirus IkBaM in 5-fluorouracil-induced apoptosis of gastric carcinoma SGC-7901 cells. Shijie Huaren Xiaohua Zazhi 2006; 14(23): 2270-2274
- URL: https://www.wjgnet.com/1009-3079/full/v14/i23/2270.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i23.2270
5-氟尿嘧啶(5-Fluorouracil, 5-FU)是最常用的抗肿瘤药物, 也是胃癌化疗的首选药物. 然而许多胃癌细胞对5-FU具有一定的耐药性, 从而大大影响了胃癌的治疗效果. 核转录因子B (nuclear factor κB, NF-κB)是近年来发现的一种重要的转录调节因子[1-3], 他的激活被认为是许多肿瘤细胞对化疗药物产生耐药性的关键因素[4-5]. 目前国外的一些研究表明[6-7], 在5-FU诱导胃癌细胞凋亡的同时, NF-κB也被激活, 说明NF-κB与胃癌细胞的抗凋亡作用机制有关. 因此, 是否可以通过抑制NF-κB的激活来增强5-FU治疗胃癌的效果是一个十分有意义的课题. 他不仅可以找到一条治疗胃癌的有效途径, 同时可以进一步证实NF-κB的抗凋亡机制.
正常状态下, NF-κB与其主要的调节蛋白IκBa结合以非活性状态存在于细胞质中. 肿瘤细胞在受到化疗药物、放疗等刺激后, IκBa迅速磷酸化降解, 被激活的NF-κB会进行核内转移, 与DNA启动子上特定的认知序列结合, 转录靶基因, 抑制肿瘤的凋亡[8]. 研究表明, 第32位和36位丝氨酸位点发生突变的IκBa不会被降解, 与NF-κB发生不可逆性结合而抑制其激活[9-10], 这一突变的IκBa被称为NF-κB超抑制物(IκBaM). 我们应用自行构建的重组腺病毒Ad-IκBaM[11-12]为基因治疗手段, 以胃癌SGC-7901细胞为研究对象, 研究Ad-IκBaM在5-FU诱导胃癌细胞凋亡中的作用, 进而研究胃癌细胞抵抗5-FU诱导凋亡与NF-κB活化的关系, 为探索胃癌治疗的新方法打下基础.
胃癌SGC-7901细胞系, 购自中科院上海细胞所细胞库. 重组腺病毒Ad-IκBaM为含第32和36位丝氨酸定点诱变为丙氨酸的中国人IκBa基因编码区的cDNA序列, 并表达绿色荧光蛋白(GFP)的重组腺病毒; 重组腺病毒Ad-IκBa为含未突变的中国人IκBa基因, 并表达绿色荧光蛋白的对照用重组腺病毒, 详见参考文献[11-12]. 5-FU注射液(10 mL:0.25 g), 购自天津金耀氨基酸有限公司; TUNEL细胞凋亡原位检测试剂盒购自Roche公司; 核蛋白抽提试剂盒、非放射性凝胶迁移(EMSA)试剂盒, 购自宁波唯奥基因科技发展有限公司.
实验组细胞感染重组腺病毒Ad-IκBaM; 感染对照组细胞感染重组腺病毒Ad-IκBa; 空白对照组细胞不感染任何病毒. 3组胃癌细胞用2种方法进行处理, 一种常规培养, 另一种用5 mg/L 5-FU作用一定时间, 诱导细胞的凋亡和NF-κB的表达. 细胞接种于六孔培养板, 待细胞贴壁且处于对数生长期时, 弃培养液, 加入不同感染复数(MOI)的Ad-IκBaM及Ad-IκBa, 培养2 h, 弃病毒液, 加入完全培养基继续培养. 感染Ad-IκBaM及Ad-IκBa的浓度分别为25, 50, 100, 200, 400, 48 h后在荧光显微镜下计数GFP阳性细胞百分率.
1.2.1 凝胶电泳迁移率实验: 对SGC-7901细胞用5-FU分别诱导0, 0.5, 2, 12 h后收获, 按核蛋白抽提试剂盒操作说明提取核蛋白; BCA法进行蛋白浓度测定, 将实验抽提的核蛋白调至相同的量(3 mg/孔); 进行EMSA, 其步骤为配制60 g/L聚丙烯酰胺凝胶, 然后将细胞核提取物与NF-κB寡核苷酸探针进行结合反应, 反应体系按总体积10 mL上样; 电泳后取出凝胶板, 用电泳转膜装置将凝胶上的蛋白转至结合膜, 交联、洗涤、底物结合反应、Cool Imager成像系统成像, 选择NF-κB活性较高的时间作为选定时间点. 3组细胞用5-FU诱导上述选定时间后按以上方法进行EMSA.
1.2.2 MTT比色法: 在96孔板每孔接种细胞4×103个细胞, 设调零组, 8 h后按计划实验组感染重组腺病毒Ad-IκBa, 感染对照组感染Ad-IκBa, 空白对照组不感染任何病毒, 48 h后按计划5-FU处理组加5 mg/L 5-FU, 对照不加任何药物; 继续培养48 h后, 每孔加入5 g/L MTT 20 mL, CO2培养箱37 ℃培养4 h; 弃培养液, 各孔加200 mL二甲基亚砜, 振荡10-20 min, 用自动酶标检测仪在570 nm处检测96孔的吸光度(A值), 按公式计算生长抑制率: 抑制率(%) = (1-实验组A值/对照组A值)×100, 每一处理组取3个复孔.
1.2.3 原位末端标记法: 将无菌盖玻片置于培养板中, 将培养瓶中细胞用胰酶消化制成细胞悬液, 等量(约4×106个/孔)接种于培养板内盖玻片上, 待细胞贴壁且处于对数生长期时, 上述方式分组处理后, 40 g/L多聚甲醛固定30 min, 用TdT酶将生物素标记的dUTP连接到DNA断裂端的3'OH上, 加入ABC反应试剂作用后, 用DAB/H2O2液显色, 苏木精复染, 中性树胶封片. 凋亡指数的计算: 随机计数高倍视野下细胞每100个细胞中阳性细胞数, 即为凋亡指数.
统计学处理 采用mean±SD表示数据结果, t检验, χ2检验等统计学方法进行分析.
用不同MOI的Ad-IκBaM及Ad-IκBa感染SGC-7901细胞, 48 h后用荧光显微镜观察, 结果发现, 随着MOI的增高发出绿色荧光的阳性感染细胞(图1)数量逐渐增多. 当MOI等于50时, 感染效率达到40%, 当MOI等于100时, 感染效率超过90%, 故选择100 MOI作为实验最佳MOI值.
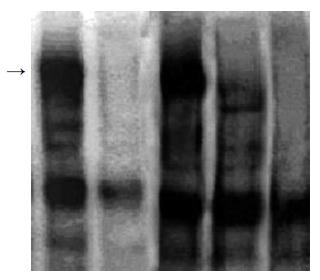
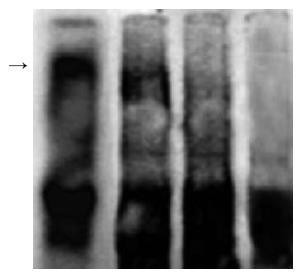
可见胃癌SGC-7901细胞受到化疗药物5-FU处理前(0 h)细胞内NF-κB基本无活性; 5-FU处理0.5 h NF-κB具有较强的活性, 2 h活性降低, 12 h则无活性(图2). 在检测感染Ad-IκBaM及Ad-IκBa对NF-κB抑制作用的实验中, 感染Ad-IκBaM及Ad-IκBa 48 h后, 5-FU诱导0.5 h收获细胞, 提取核蛋白. 感染Ad-IκBaM的细胞NF-κB无明显的活化现象(图3), NF-κB的活性完全被Ad-IκBaM抑制; 感染Ad-IκBa对照组则仍有NF-κB的活化现象, 可见感染Ad-IκBa对NF-κB活性的抑制作用较弱(→所示为NF-κB阳性条带).
常规培养的细胞感染Ad-IκBaM实验组及感染IκBa的感染对照组胃癌细胞生长均受到抑制, 但两者之间比较差别无统计学意义, 说明IκBaM及IκBa本身对肿瘤细胞的生长无影响, 两者与空白对照组之间的差别是腺病毒自身的毒性引起的. 5-FU处理后各组间生长抑制率比较: 感染Ad-IκBaM实验组>感染Ad-IκBa对照组>空白对照组, 三者之间采用LSD-t检验, 两两比较P<0.001 (56.36±0.60 vs 47. 50±1.42, t = 11.89; 47.50±1.42 vs 42.95±1.27, t = 7.81; 56.36±0.60 vs 42.95±1.27, t = 19.70), 其差别均具有统计学意义, 可见感染Ad-IκBaM可明显提高5-FU致胃癌7901细胞的生长抑制(图4).
凋亡细胞核染上棕褐色, 而正常细胞核被染成淡蓝色. 常规培养的细胞各组间比较凋亡百分率没有显著性差别; 5-FU处理的细胞各组间比较: 感染Ad-IκBaM的实验组>感染Ad-IκBa的对照组>空白对照组, 组间两两比较: 29.7±2.5 vs 20.0±2.6, χ2 = 7.51, P<0.01; 29.7±2.5 vs 12.3±1.1, χ2 = 26.91, P<0.01, 差别具有统计学意义(表1).
| 实验组 | 感染对照组 | 空白对照组 | |
| 常规培养 | 2.3±1.5 | 2.3±0.6 | 1.7±0.6 |
| 5-FU处理 | 29.7±2.5 | 20.0±2.6 | 12.3±1.1 |
胃癌的发病率和死亡率均居我国恶性肿瘤的第一位[13]. 5-FU为胃癌化疗首选药物, 诸多化疗方案都以其为基础. 但在多年的临床工作中人们却发现, 5-FU等许多化疗药物在诱导胃癌细胞凋亡的过程中会产生耐药性, 关于其机制一直未能明确. 1996年Hsu et al[14]发现, 当TNF作用于肿瘤细胞时, 肿瘤细胞通过激活NF-κB而发挥抗凋亡途径. 随后, 越来越多的研究表明, 肿瘤细胞对抗癌药物诱导的细胞凋亡的抗凋亡能力与NF-κB激活直接相关[15-16]. NF-κB抗凋亡机制的研究, 使人们对肿瘤细胞抗凋亡机制的研究有了突破性的进展. 如何有效地抑制NF-κB的活性进而将其用于肿瘤的治疗成为近年肿瘤治疗的新焦点. 抑制NF-κB活性的方法有很多[17-23], 近年来国内外学者在应用NF-κB超抑制物IκBaM为基因治疗手段治疗肿瘤, 以提高化疗药的敏感性方面作了大量的工作, 以定点诱变和N端缺失的方式构建而成的NF-κB超抑制物IκBaM, 对肿瘤细胞的抗凋亡能力有明显的抑制作用[24-29]. 重组腺病毒Ad-IκBaM, 自其构建以来, 已将其应用于肝癌细胞、血管内皮细胞等进行研究, 均证明其可明显抑制NF-κB活化.
Uetsuka et al[6]通过体外实验证明, 用5-FU分别对5-FU耐药的胃癌细胞株(NUGC3/5FU/L)和对5-FU敏感的胃癌细胞株(NUGC3)进行处理, 结果NUGC3/5FU/L细胞株可见明显的NF-κB激活, 但在NUGC3中则无NF-κB激活. Camp et al[7]通过体外实验证明, 可以通过抑制NF-κB活化的方法降低胃癌细胞对5-FU的耐药性, 国内尚无此方面的研究报道. 本实验证明, 当胃癌SGC-7901细胞受到5-FU作用后, 细胞内的核转录因子NF-κB被激活; 感染Ad-IκBaM的细胞内NF-κB的活性完全被IκBaM抑制; 感染Ad-IκBa的细胞中NF-κB活性不能完全被抑制, 可能是IκBa被部分磷酸化降解的原因. 进一步的实验表明, 感染Ad-IκBaM后, 5-FU对胃癌细胞生长抑制及诱导凋亡作用也明显增强, 而感染Ad-IκBa的细胞对5-FU的诱导凋亡作用的增强作用则较差. 由此我们可以得出, 5-FU在诱导胃癌细胞凋亡的同时激活了细胞内的NF-κB, 使胃癌细胞内的抗凋亡机制激活产生耐药性. 应用重组腺病毒Ad-IκBaM可以有效的抑制NF-κB激活, 因此可明显降低胃癌细胞对5-FU的耐药性, 增强5-FU的抗胃癌作用. 5-FU联合基因治疗的方法将为胃癌的治疗开辟一条新的途径.
核转录因子NF-κB是近年来研究的热点. 研究表明, 肿瘤细胞对化疗药物的耐药性与NF-κB的激活密切相关. 因此, 通过基因治疗手段抑制NF-κB的激活来抑制耐药性的产生, 提高肿瘤化疗药物的治疗效果是一个全新的有广泛应用前景的研究课题.
目前, 此领域的研究重点在于探讨不同的肿瘤细胞对某些化疗药物产生耐药性与NF-κB激活的关系, 并寻找更有效的抑制NF-κB激活的方法, 进一步探讨是否可通过抑制NF-κB活性的方法抑制肿瘤细胞耐药性的产生, 提高肿瘤的治疗效果.
IkBaM是由本文课题组自行克隆成功的中国人IkBaM基因进行定点诱变后构建成的NF-κB超抑制物, 在此基础上应用AdEasy腺病毒构建系统构建成重组腺病毒Ad-IkBaM. 以Ad-IkBaM为基因治疗手段, 研究其对NF-κB活性的抑制作用, 进而揭示胃癌细胞对5-FU耐药的机制, 在国内相关研究领域尚属首次.
国外学者正在对应用NF-κB超抑制物IkBaM进行广泛深入的研究, 取得了一些有意义的结果, 有些已经申请专利. 因此, 无论从拥有我国自主知识产权的药物所具有的潜在的巨大的经济效益和有效治疗恶性肿瘤所具有的巨大的社会效益来看, 该课题均具有重要的意义.
本文研究了重组腺病毒Ad-IkBaM对5-FU诱导胃癌细胞凋亡的作用情况, 实验设计合理, 方法较为先进, 结论明确, 证实了NF-κB在胃癌抗5-FU诱导凋亡中的作用.
电编: 张敏 编辑:潘伯荣
| 1. | Chen LW, Egan L, Li ZW, Greten FR, Kagnoff MF, Karin M. The two faces of IKK and NF-kappaB inhibition: prevention of systemic inflammation but increased local injury following intestinal ischemia-reperfusion. Nat Med. 2003;9:575-581. [PubMed] |
| 2. | Huang TT, Wuerzberger-Davis SM, Wu ZH, Miyamoto S. Sequential modification of NEMO/IKKgamma by SUMO-1 and ubiquitin mediates NF-kappaB activation by genotoxic stress. Cell. 2003;115:565-576. [PubMed] |
| 3. | Zhou H, Wertz I, O'Rourke K, Ultsch M, Seshagiri S, Eby M, Xiao W, Dixit VM. Bcl10 activates the NF-kappaB pathway through ubiquitination of NEMO. Nature. 2004;427:167-171. [PubMed] |
| 4. | Duan L, Aoyagi M, Tamaki M, Yoshino Y, Morimoto T, Wakimoto H, Nagasaka Y, Hirakawa K, Ohno K, Yamamoto K. Impairment of both apoptotic and cytoprotective signalings in glioma cells resistant to the combined use of cisplatin and tumor necrosis factor alpha. Clin Cancer Res. 2004;10:234-243. [PubMed] |
| 5. | Bentires-Alj M, Barbu V, Fillet M, Chariot A, Relic B, Jacobs N, Gielen J, Merville MP, Bours V. NF-kappaB transcription factor induces drug resistance through MDR1 expression in cancer cells. Oncogene. 2003;22:90-97. [PubMed] |
| 6. | Uetsuka H, Haisa M, Kimura M, Gunduz M, Kaneda Y, Ohkawa T, Takaoka M, Murata T, Nobuhisa T, Yamatsuji T. Inhibition of inducible NF-kappaB activity reduces chemoresistance to 5-fluorouracil in human stomach cancer cell line. Exp Cell Res. 2003;289:27-35. [PubMed] |
| 7. | Camp ER, Li J, Minnich DJ, Brank A, Moldawer LL, MacKay SL, Hochwald SN. Inducible nuclear factor-kappaB activation contributes to chemotherapy resistance in gastric cancer. J Am Coll Surg. 2004;199:249-258. [PubMed] |
| 8. | Davis N, Ghosh S, Simmons DL, Tempst P, Liou HC, Baltimore D, Bose HR Jr. Rel-associated pp40: an inhibitor of the rel family of transcription factors. Science. 1991;253:1268-1271. [PubMed] |
| 9. | Brown K, Gerstberger S, Carlson L, Franzoso G, Siebenlist U. Control of I kappa B-alpha proteolysis by site-specific, signal-induced phosphorylation. Science. 1995;267:1485-1488. [PubMed] |
| 10. | Brockman JA, Scherer DC, McKinsey TA, Hall SM, Qi X, Lee WY, Ballard DW. Coupling of a signal response domain in I kappa B alpha to multiple pathways for NF-kappa B activation. Mol Cell Biol. 1995;15:2809-2818. [PubMed] |
| 14. | Hsu H, Shu HB, Pan MG, Goeddel DV. TRADD-TRAF2 and TRADD-FADD interactions define two distinct TNF receptor 1 signal transduction pathways. Cell. 1996;84:299-308. [PubMed] |
| 15. | Beg AA, Baltimore D. An essential role for NF-kappaB in preventing TNF-alpha-induced cell death. Science. 1996;274:782-784. [PubMed] |
| 16. | Tergaonkar V, Pando M, Vafa O, Wahl G, Verma I. p53 stabilization is decreased upon NFkappaB activation: a role for NFkappaB in acquisition of resistance to chemotherapy. Cancer Cell. 2002;1:493-503. [PubMed] |
| 17. | Russo SM, Tepper JE, Baldwin AS Jr, Liu R, Adams J, Elliott P, Cusack JC Jr. Enhancement of radiosensitivity by proteasome inhibition: implications for a role of NF-kappaB. Int J Radiat Oncol Biol Phys. 2001;50:183-193. [PubMed] |
| 18. | Dong QG, Sclabas GM, Fujioka S, Schmidt C, Peng B, Wu T, Tsao MS, Evans DB, Abbruzzese JL, McDonnell TJ. The function of multiple IkappaB: NF-kappaB complexes in the resistance of cancer cells to Taxol-induced apoptosis. Oncogene. 2002;21:6510-6519. [PubMed] |
| 19. | Holmes-McNary M, Baldwin AS Jr. Chemopreven-tive properties of trans-resveratrol are associated with inhibition of activation of the IkappaB kinase. Cancer Res. 2000;60:3477-3483. [PubMed] |
| 20. | Gupta S, Afaq F, Mukhtar H. Involvement of nuclear factor-kappa B, Bax and Bcl-2 in induction of cell cycle arrest and apoptosis by apigenin in human prostate carcinoma cells. Oncogene. 2002;21:3727-3738. [PubMed] |
| 21. | Mouria M, Gukovskaya AS, Jung Y, Buechler P, Hines OJ, Reber HA, Pandol SJ. Food-derived polyphenols inhibit pancreatic cancer growth through mitochondrial cytochrome C release and apoptosis. Int J Cancer. 2002;98:761-769. [PubMed] |
| 22. | Nawata H, Maeda Y, Sumimoto Y, Miyatake J, Kanamaru A. A mechanism of apoptosis induced by all-trans retinoic acid on adult T-cell leukemia cells: a possible involvement of the Tax/NF-kappaB signaling pathway. Leuk Res. 2001;25:323-331. [PubMed] |
| 23. | Dhanalakshmi S, Singh RP, Agarwal C, Agarwal R. Silibinin inhibits constitutive and TNFalpha-induced activation of NF-kappaB and sensitizes human prostate carcinoma DU145 cells to TNFalpha-induced apoptosis. Oncogene. 2002;21:1759-1767. [PubMed] |
| 24. | Wang CY, Mayo MW, Baldwin AS Jr. TNF- and cancer therapy-induced apoptosis: potentiation by inhibition of NF-kappaB. Science. 1996;274:784-787. [PubMed] |
| 25. | Van Antwerp DJ, Martin SJ, Kafri T, Green DR, Verma IM. Suppression of TNF-alpha-induced apoptosis by NF-kappaB. Science. 1996;274:787-789. [PubMed] |
| 26. | Shinoura N, Yamamoto N, Yoshida Y, Asai A, Kirino T, Hamada H. Adenovirus-mediated transfer of caspase-8 in combination with superrepressor of NF-kappaB drastically induced apoptosis in gliomas. Biochem Biophys Res Commun. 2000;271:544-552. [PubMed] |
| 27. | Chen S, Fribley A, Wang CY. Potentiation of tumor necrosis factor-mediated apoptosis of oral squamous cell carcinoma cells by adenovirus-mediated gene transfer of NF-kappaB inhibitor. J Dent Res. 2002;81:98-102. [PubMed] |
| 28. | Duffey DC, Crowl-Bancroft CV, Chen Z, Ondrey FG, Nejad-Sattari M, Dong G, Van Waes C. Inhibition of transcription factor nuclear factor-kappaB by a mutant inhibitor-kappaBalpha attenuates resistance of human head and neck squamous cell carcinoma to TNF-alpha caspase-mediated cell death. Br J Cancer. 2000;83:1367-1374. [PubMed] |