修回日期: 2006-05-22
接受日期: 2006-06-05
在线出版日期: 2006-08-08
目的: 研究COX-2和BFGF在大肠癌及大肠腺瘤组织中的表达及意义.
方法: 采用免疫组化SP方法检测了手术切除的大肠癌49例, 腺瘤性息肉25例, 正常大肠黏膜组织20例中的COX-2和BFGF表达.
结果: COX-2和BFGF在大肠癌中的表达阳性率分别为59.2%和69.3%, 在腺瘤性息肉的表达率为52.0%和56.0%, COX-2和BFGF在大肠癌组织与腺瘤性息肉中表达无显著性差异(P>0.05); 正常肠黏膜中未检出COX-2和BFGF. COX-2和BFGF在大肠癌中表达与性别, 年龄, 肿瘤大小, 肿瘤位置, 分化程度无关(P>0.05). 但与肿瘤Dukes分期有关, C, D期高于A, B期(81.5% vs 54.5%, P<0.05), 淋巴结转移之间具有显著性差, 有异淋巴结转移高于无淋巴结转移(81.5% vs 54.5%, P<0.05). 肠癌组织中COX-2、BFGF表达二者间有相关性(r = 0.349, P<0.05).
结论: COX-2、BFGF在大肠癌组织及大肠腺瘤中的表达水平增高, 在大肠腺瘤恶变及大肠癌的发生发展过程中起协同作用, 共同促进肿瘤的发生.
引文著录: 林瑶光, 韦良宏. 大肠癌和大肠腺瘤COX-2和BFGF表达的意义. 世界华人消化杂志 2006; 14(22): 2199-2202
Revised: May 22, 2006
Accepted: June 5, 2006
Published online: August 8, 2006
AIM: To investigate the mechanism of cyclooxygenase-2 (COX-2), basic fibroblast growth factor (BFGF) in the carcinogenesis of colorectal carcinoma and adenoma.
METHODS: Intestinal biopsy specimens were collected from patients with colorectal carcinoma (n = 49), adenoma (n = 25), and normal mucosa (n = 20), and the expression of COX-2 and BFGF were detected by immunohistochemical staining (SP method).
RESULTS: The positive rates of COX-2, BFGF expression were 59.2%, 69.3% in colorectal carcinoma, and 52.0%, 56.0% in adenoma, respectively. COX-2 and BFGF expression were not detected in normal intestinal mucosa. The positive rates of COX-2 and BFGF expression were not significantly difference between colorectal carcinoma and adenoma (P > 0.05). The expression of COX-2 and BFGF were not significantly correlated with the gender, age, tumor size, tumor location, and cell differentiation, but had marked correlations with Dukes stages (stage C, D vs A, B: 81.5% vs 54.5%, P < 0.05) and lymph node metastasis (metastasis vs non-metastasis: 81.5% vs 54.5%, P < 0.05). Furthermore, there were significant correlations between COX-2 and BFGF expression (r = 0.349, P < 0.05).
CONCLUSION: Excessive expression of COX-2 and BFGF may play a synergic role in the carcinogenesis and development of colorectal carcinoma and adenoma.
- Citation: Lin YG, Wei LH. Expression and significance of cyclooxygenase-2 and basic fibroblast growth factor in colorectal carcinoma and adenoma. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2199-2202
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2199.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2199
大肠癌是我国发病率及死亡率最高的恶性肿瘤之一, 其发病机制尚未完全清楚. 目前认为大肠癌的发生及发展是一个涉及多阶段、多基因、多因素异常积累的复杂过程. 细胞生长因子、癌基因与肿瘤的关系已日益受到重视. 我们采用免疫组化方法检测大肠良恶性肿瘤组织中的COX-2及BFGF蛋白表达, 以探讨COX-2和BFGF蛋白在大肠癌发生和发展中的作用.
2003-11/2004-04手术治疗病理确诊为结直肠癌的广西籍患者49例, 术前未行放化疗. 男32例, 女17例; 年龄24-85(中位57.4)岁, 年龄<50岁15例, 年龄≥50岁34例; 直肠癌32例, 结肠癌17例; 肿瘤大小<5 cm 20例, 肿瘤大小≥5cm 29例; 高中分化腺癌41例, 低未分化腺癌8例; 有区域淋巴结转移27例, 无区域淋巴结转移22 例; 远处转移9例; Dukes A期12例, B期10例, C期18例, D期9例. 大肠腺瘤性息肉25例(为3/4病理确诊内镜下电凝电切息肉)及正常大肠黏膜标本20例(均为IBS病例且患者有病理检查要求, HE染色均为为正常肠黏膜). 全部标本均用甲醛固定, 石蜡包埋, 5 μm厚连续切片.
免疫组化染色采用SP法进行. COX-2, BFGF均为即用型抗体, 由福建迈新生物技术开发公司提供, 按说明书进行操作. 结果判断使用德国Leica公司QMR+Q550型计算机图像分析仪进行分析. COX-2, BFGF免疫阳性物质定位于胞质或胞膜. 先按染色强度打分: 0分为无色, 1 分为浅黄色, 2分为棕黄色, 3分为棕褐色; 再按阳性细胞百分比打分: 阳性细胞数≤5%为0分, 6%-25%为1分, >26%-50%为2分, >51%-75%为3分, >75%为4分; 最后按染色强度分数与阳性细胞百分比分数之和判断结果≥2分为+, <2 分为-.
统计学处理 采用SPSS 10.0统计软件包, 2个样本率的比较用卡方检验; 相关分析为计数资料的相关分析. P<0.05具有显著差异.
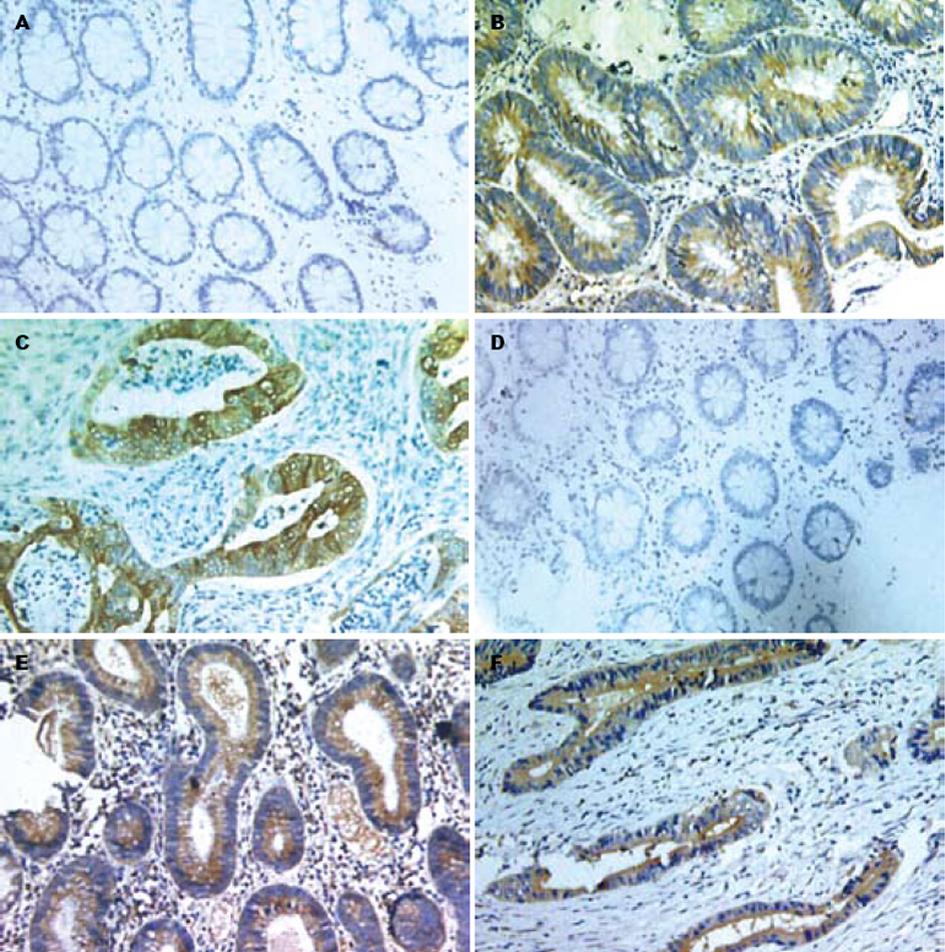
COX-2和BFGF蛋白在正常肠黏膜胞质及核内未出现阳性黄色信号, COX-2和BFGF蛋白在腺瘤性息肉胞质内出现µ黄色阳性信号, COX-2和BFGF蛋白在大肠癌细胞质出现棕黄色阳性信号(图1). 大肠癌和腺瘤性息肉中COX-2和BFGF蛋白的表达明显高于正常肠黏膜(P<0.05), 大肠癌和腺瘤性息肉中COX-2和BFGF蛋白的表达无显著性差异(P>0.05, 表1).
COX-2在大肠癌中表达与性别、年龄、肿瘤大小、肿瘤位置、分化程度无关, 但与肿瘤Dukes分期、淋巴结转移有关(表2,3).
| 性别 | n | COX-2 | BFGF |
| 男 | 32 | 18(56.2) | 21(65.6) |
| 女 | 17 | 11(64.7) | 13(76.5) |
| 年龄 | |||
| <50岁 | 15 | 9(60.0) | 8(53.3) |
| ≥50岁 | 34 | 20(58.8) | 26(76.5) |
| 肿瘤大小 | |||
| <5 cm | 20 | 13(65.0) | 15(75.0) |
| ≥5 cm | 29 | 16(55.2) | 19(65.5) |
| 肿瘤位置 | |||
| 结肠 | 17 | 8(47.0) | 11(64.7) |
| 直肠 | 32 | 21(65.6) | 23(71.9) |
| 分化程度 | |||
| 高、中分化 | 41 | 26(63.4) | 28(68.3) |
| 低分化 | 8 | 3(37.5) | 6(75.0) |
| Dukes分期 | |||
| A, B | 22 | 9(40.9)a | 12(54.5)a |
| C, D | 27 | 20( 74.1) | 22(81.5) |
| 淋巴结移 | |||
| 无 | 22 | 9(40.9)a | 12(54.5)a |
| 有 | 27 | 20(74.1) | 22(81.5) |
| COX-2 | BFGF | 合计 | |
| + | - | ||
| + | 24 | 5 | 29 |
| - | 10 | 10 | 20 |
| 合计 | 34 | 15 | 49 |
近年来研究表明, 在肿瘤形成和演化的多步骤过程中, 细胞生长因子, 癌基因扮演着一个相当重要的角色. COX-2在多种肿瘤(如肝癌, 肺癌等)的发生、发展过程中起重要作用[1-2], 并与肿瘤转移、血管浸润等恶性生物学行为有关. COX-2可通过刺激肿瘤血管形成, 抑制肿瘤细胞凋亡, 增加细胞侵袭和转移能力等途径, 促进肿瘤的发生和发展, 其在大肠癌发生和发展中的作用已得到充分的证实[3-6]. COX-2是"早期即时"基因, 他可被迅速诱导, 严格的调控, 在基础条件下, COX-2表达是高度受限的, 而在炎症过程中却能奇迹般地升高. Eberhart et al研究发现, COX-2蛋白在大约80%的大肠癌和40%的大肠腺瘤中高表达. 国内外大量实验现已证实, COX-2的过表达与大肠癌发生、发展有密切联系. 我们用免疫组织化学染色法检测49例大肠癌组织标本中的COX-2表达, COX-2的表达为61.22%, 在大肠癌中表达与性别, 年龄, 肿瘤大小, 肿瘤位置, 分化程度无关. 但与肿瘤Dukes分期, 淋巴结转移有关. 与国内外报道相比: COX-2蛋白与大肠癌临床病理特征的关系与大多数学者研究的结果基本一致, 但表达率偏低, 这种差别可能与样本量不够大及区域性致癌因素不同有关. 我们检测到大肠癌组织与腺瘤的COX-2蛋白表达无显著差异, 与国内外报道结果相符[7-9]. 腺瘤中COX-2蛋白表达增多, 可能是腺瘤向腺癌发生的早期事件, 数据支持多数学者认为的腺瘤具有高癌率的结论.
BFGF在体内分布广泛, 存在于中胚层、神3/4外胚层的细胞及多种肿瘤细胞中, 对这些细胞有促增殖分化功能, 参与胚胎发育、血管生成、损伤修复、神3/4再生、肿瘤生长等多项生理及病理过程. 许多研究表明, BFGF能够促进细胞恶性转化及肿瘤形成. BFGF可能通过以下两种主要机制参与肿瘤的形成和发展: 一方面通过表达BFGF而以自分泌或旁分泌方式促进细胞过度增殖和肿瘤生长, 另一方面通过促进新生血管形成, 为肿瘤细胞生长提供丰富营养. 现代分子生物学研究表明, BFGF过度表达与肿瘤发生、发展及预后有密切关系[10]. 我们用免疫组织化学染色法检测49例大肠癌组织标本中的BFGF表达阳性率为67.3%, 在大肠癌中表达与性别、年龄、肿瘤大小、肿瘤位置、分化程度无关, 但与肿瘤Dukes分期、淋巴结转移之间具有显著差异, 与国内检测结果基本一致. BFGF蛋白在恶性肿瘤组织中强表达, 可能因为: (1)BFGF基因在4号染色体上与癌基因Hat, int-2相邻, 并且有相当程度的同源性, 因而推断BFGF基因与Hat, int-2等癌基因为连锁基因. 因此, 当外界因素使肿瘤Hat, int-2等癌基因表达时, 通过某种机制, 促使BFGF mRNA的表达, 导致BFGF蛋白的过表达; (2)因BFGF为细胞分裂原, 当肿瘤细胞恶性生长时, 为了适应本身生长需要, 通过某种反馈, 促使BFGF mRNA的表达, 因而BFGF合成增多. 在良性肿瘤中, 肿瘤生长较慢, 细胞几乎无坏死, 以及各种酶释放减少, 不能启动BFGF mRNA表达的机制, 因此, BFGF无法合成. 但本研究检测到大肠癌与腺瘤BFGF蛋白表达无显著差异(P>0.05). 腺瘤BFGF蛋白表达达56.0%. 为什么腺瘤中BFGF蛋白表达这么高, 目前国内外未见相关文献报道, 我们认为可能的原因为腺瘤是一种癌前病变, 其演变过程为正常肠上皮→增生改变/微小腺瘤→早期腺瘤→中期腺瘤→后期腺瘤→癌→癌转移. 在这一过程中伴随着一系列癌基因和抑癌基因的变化, BFGF为其中的一种. 但是BFGF在腺瘤中的作用机制仍需进一步研究. 我们发现, COX-2蛋白、BFGF蛋白与大肠癌Dukes分期、淋巴结转移有关, 提示COX-2蛋白、BFGF蛋白高表达可以影响大肠癌的生物学行为, 可使其更易发生转移等, 可能是预后不良的指征. 因此, 我们认为, 作为Dukes分期的补充, 大肠癌组织中COX-2蛋白、BFGF蛋白的检测可作为大肠癌患者判断预后有价值的指标. 虽然COX-2, BFGF均参与肿瘤细胞增生、肿瘤血管形成、调节细胞凋亡等, 但目前国内外尚无有关BFGF与COX-2直接联系的研究报道. 我们的研究表明大肠癌组织中的COX-2, BFGF蛋白表达水平增高, 参与了大肠癌的发生发展过程, 大肠癌组织中的COX-2, BFGF蛋白表达具有相关性, 提示他们在大肠癌的发生发展中起到Ð同作用, 共同促进肿瘤的发生, 但他们二者之间如何相互作用, 仍需进一步研究.
近年来, 细胞生长因子与肿瘤的关系已日益受到重视. 多种生长因子在不同的肿瘤组织或体液中可被检测; 某些生长因子的编码基因与癌基因有同源性, 与肿瘤血管生成关系密切. 碱性成纤维细胞生长因子(BFGF)是成纤维生长因子家族中的一员, 研究证明与肿瘤发生关系密切. 近年研究证明, 动物实验、细胞学研究、临床试验和流行病学研究证明环氧合酶-2(COX-2)抑制剂可以在早期阶段阻止结直肠癌的发生.
BFGF或COX-2在大多数结直肠肿瘤明显升高并与肿瘤的发生密切相关, 但他们是Ð同或各自发挥作用,目前未见有相关报道. 本研究初步阐明BFGF, COX-2与结直肠癌及大肠腺瘤的关系, 及结直肠癌中BFGF与COX-2的关系.
将BFGF和COX-2作为靶向治疗的目标, 将为防治结直肠癌提供理论依据.
本文研究大肠癌和大肠腺瘤COX-2和BFGF的表达及意义, 选题意义热门、学术价值较高、文字质量良、有一定的学术价值和新颖性.
电编: 李琪 编辑:潘伯荣
| 1. | Wolff H, Saukkonen K, Anttila S, Karjalainen A, Vainio H, Ristimaki A. Expression of cyclooxygenase-2 in human lung carcinoma. Cancer Res. 1998;58:4997-5001. [PubMed] |
| 2. | Shiota G, Okubo M, Noumi T, Noguchi N, Oyama K, Takano Y, Yashima K, Kishimoto Y, Kawasaki H. Cyclooxygenase-2 expression in hepatocellular carcinoma. Hepatogastroenterology. 1999;46:407-412. [PubMed] |
| 3. | Zhang JZ, Huang YW, Liu DM. Tissue microarray technology and its preliminary application in large intestinal carcinoma. Shijie Huaren Xiaohua Zazhi. 2002;10:157-160. |
| 4. | Chen WS, Wei SJ, Liu JM, Hsiao M, Kou-Lin J, Yang WK. Tumor invasiveness and liver metastasis of colon cancer cells correlated with cyclooxygenase-2 (COX-2) expression and inhibited by a COX-2-selective inhibitor, etodolac. Int J Cancer. 2001;91:894-899. [PubMed] [DOI] |
| 5. | Liu XH, Kirschenbaum A, Yao S, Stearns ME, Holland JF, Claffey K, Levine AC. Upregulation of vascular endothelial growth factor by cobalt chloride-simulated hypoxia is mediated by persistent induction of cyclooxygenase-2 in a metastatic human prostate cancer cell line. Clin Exp Metastasis. 1999;17:687-694. [PubMed] [DOI] |
| 6. | Cianchi F, Cortesini C, Bechi P, Fantappie O, Messerini L, Vannacci A, Sardi I, Baroni G, Boddi V, Mazzanti R. Up-regulation of cyclooxygenase 2 gene expression correlates with tumor angiogenesis in human colorectal cancer. Gastroenterology. 2001;121:1339-1347. [PubMed] [DOI] |
| 8. | 田 慧军, 邓 涛, 沈 志祥, 唐 明武, 胡 志芳, 陈 会敏. 大肠癌和大肠腺瘤COX-2和Bcl-2的基因表达及意义. 胃肠病学和肝病学杂志. 2003;12:544-546. |
| 9. | Hao X, Bishop AE, Wallace M, Wang H, Willcocks TC, Maclouf J, Polak JM, Knight S, Talbot IC. Early expression of cyclo-oxygenase-2 during sporadic colorectal carcinogenesis. J Pathol. 1999;187:295-301. [PubMed] [DOI] |
| 10. | Oppenheim J, Fujiwara H. The role of cytokines in cancer. Cytokine Growth Factor Rev. 1996;7:279-288. [PubMed] [DOI] |