修回日期: 2006-05-10
接受日期: 2006-05-11
在线出版日期: 2006-08-08
目的: 采用基因工程技术大量表达、提纯幽门螺杆菌(H. pylori)细胞空泡毒素毒性片段, 和黏附素片段的融合蛋白, 以此为抗原, 制备高效价的抗VacA-HpaA蛋黄抗体(IgY).
方法: 大量培养重组菌pQE30-VacA-HpaA-DH5a, 诱导表达获得融合蛋白VacA-HpaA, Ni2+-NTA树脂纯化. 将纯化的重组蛋白免疫鸡, 水稀释法提取IgY, 硫酸铵沉淀法纯化浓缩VacA-HpaA IgY. ELISA法测定抗体产生的时间-效价变化, SDS-PAGE分析纯度, Bradford法测定蛋白含量, Western blot检测其分别对VacA和HpaA抗原的特异性, ELISA法检测效价.
结果: 重组蛋白主要以包涵体形式表达, 免疫鸡后提取的IgY可与该蛋白发生免疫反应, IgY效价总体上随免疫时间增加而升高. 经纯化、浓缩后, 获得纯度为60%左右, 效价为1∶12 800的VacA-HpaA IgY, 蛋白浓度为22 g/L, Western blot显示在Mr27 000和Mr30 000处分别有相应条带, ELISA检测与VacA和HpaA反应的效价分别为1∶3200和1∶6400(P<0.01).
结论: 成功制备了高浓度、高效价的抗重组VacA-HpaA的特异性IgY.
引文著录: 叶翠莲, 杨致邦, 黄伟, 毛小琴, 张绍兰, 黄进. 幽门螺杆菌重组VacA-HpaA IgY的制备. 世界华人消化杂志 2006; 14(22): 2186-2191
Revised: May 10, 2006
Accepted: May 11, 2006
Published online: August 8, 2006
AIM: To prepare a highly specific and efficient egg yolk immunoglubin (IgY) against recombinant vacuolating cytotoxin A-Helicobacter pylori adhesin A (VacA-HpaA) from the yolk of hen's eggs.
METHODS: Recombinant bacteria of pQE30-VacA-HpaA-DH5α was cultured in large numbers to get VacA-HpaA fusion protein. The recombinant protein was purified by Ni2+-NTA column chromatography and used to immunize the hens. The VacA-HpaA IgY was extracted from the yolk of hen's eggs by water-dilution methods. In order to evaluate the relationship between IgY titer and immune time, the titer of IgY was detected by enzyme-linked immunosorbent assay (ELISA). IgY was purified and concentrated by deposition technique with ammonium sulfate. The purity of IgY was analyzed by SDS-PAGE, and protein content of IgY was checked by Bradford method. The specificities of VacA-HpaA IgY to the antigens of VacA and HpaA were identified by Western blotting.
RESULTS: The recombinant protein was mainly expressed as inclusion body. The content of fusion protein was 0.72 g/L. VacA-HpaA IgY from eggs' yolk of hens immunized with the fusion protein could react with the fusion protein. The titer of VacA-HpaA IgY was increased with the immune time. After purification and concentration, the purity of VacA-HpaA IgY was about 60%; the titer was 1∶128 000; And the concentration of IgY was 22 g/L. Western blot exhibited the protein bands with molecular weight of 27 000 and 30 `000. The titer of VacA-HpaA IgY to VacA and HpaA were 1∶3200 and 1∶6400 (P < 0.01).
CONCLUSION: VacA-HpaA-IgY with high concentration, purity, and specificity is successfully prepared.
- Citation: Ye CL, Yang ZB, Huang W, Mao XQ, Zhang SL, Huang J. Preparation of egg yolk immunoglubin against recombinant vacuolating cytotoxin A-Helicobacter pylori adhesin A in Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2186-2191
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2186.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2186
现有的资料表明, 幽门螺杆菌(Helicobacter pylori, H. pylori)是胃炎、胃十二指肠溃疡、胃癌等消化道疾病的重要病原菌[1-8], 1994年国际癌症研究机构将其列为1类致癌原, 清除H. pylori感染已具有现实的临床意义. 虽然多种抗生素和铋剂的联合应用是清除H. pylori的有效方法, 但10%-15%的病例由于细菌产生耐药性而治疗失败. 而且随着抗生素的应用, 耐药菌株正在不断增加, 寻找防治H. pylori感染的有效措施是临床急需解决的问题. 目前, 发现该菌有多种毒力因子, 如尿素酶、细胞空泡毒素抗原(vacuolating cytotoxin antigen, VacA)、黏附素(H. pylori adhesin A , HpaA)、细胞毒素相关抗原[9-11]等. 在众多的致病物质中, HpaA是主要定植因子, 是致病的先决条件, 为H. pylori所特有, 能与多种胃上皮细胞表面受体结合, 使H. pylori紧密黏附于胃上皮细胞, 进而发挥对胃黏膜的损伤作用, 其免疫原性已被证实. 针对HpaA的被动免疫具有预防H. pylori感染的作用. VacA是引起细胞病变的主要毒力因素, 也是研究得最清楚的一种致病物质. VacA可通过受体介导的内吞作用进入细胞内, 引起内吞作用障碍, 最终导致细胞内空泡样变性; 同时能在胞膜上形成通道, 增强极化上皮单层细胞的渗透性, 最终导致细胞死亡. 针对VacA的被动免疫具有治疗H. pylori感染所致的细胞损伤作用. Telford et al的实验指出, 全菌疫苗不但不能起到清除H. pylori的作用, 而且会増加人体全身和局部黏膜的不良反应. 单一抗原的保护率低于80%, 二种或二种以上抗原组合的疫苗具有更好的保护效果. 因此针对VacA-HpaA融合蛋白的防治措施具有重要价值.
蛋黄抗体(egg yolk immunoglubilin, IgY)是母鸡接受免疫后血液中的免疫球蛋白IgG选择性转移到卵黄中形成的抗体[12-13]. 因其具有优越的生物学活性和较高的稳定性, 且采集方便, 产量高, 具有产业化生产价值, 许多学者将其制成各种针对特异性病原的口服制剂, 用于防治肠道感染性疾病, 已取得满意效果[14-19]. 本文旨在制备抗H. pylori重组VacA-HpaA的IgY[20-25], 为制备集预防和治疗为一体的, 抗H. pylori感染的特异性口服制剂奠定基础.
DH5α菌株和pQE30质粒, 源于重庆医科大学病毒性肝炎研究所, 本室保存. 重组菌pQE30-v/h-DH5α由本室构建并保存[2]. VacA和HpaA[3]重组蛋白由本室制备. 114日龄立克体产蛋母鸡, 西南大学荣昌校区生物中心提供. HRP标记羊抗鸡IgY为Promega公司产品. 蛋白质marker为深圳晶美公司产品. Ni2+-NTA亲合层析柱为Qiagen公司产品. 琼脂粉为日本公司产品. IPTG、SDS、DTT、EDTA、丙烯酰胺、N, N'-亚甲丙烯酰胺、考马斯亮蓝R250、考马斯亮蓝G250均为Sigma公司产品. 胰蛋白胨、酵母抽提物均为Difco公司产品.
1.2.1 重组VacA-HpaA蛋白的大量表达: 挑取一个含有重组质粒pQE30-v/h的阳性克隆DH5α菌落接种于LA培养基5 mL中, 同时以含空pQE30质粒的DH5α和空DH5α为对照, 37℃ 150 r/min振摇过夜培养. 按1∶20比例, 吸取菌液转种于盛有100 mL LA培养基的培养瓶中, 于37℃培养至A570 = 0.6时, 加入终浓度为0.5 mmol/L的IPTG, 诱导表达4 h. 收集菌液, 4℃ 6000 r/min离心10 min, 弃上清, 沉淀物按3 mL/g湿菌的比例加入超声破碎缓冲液(50 mmol/L NaH2PO4, 300 mmol/L NaCl)碎菌. 然后4℃ 8000 r/min离心40 min, 分别收集沉淀与上清. 120 g/L SDS-PAGE分析重组蛋白的表达形式. 在细菌破碎物的沉淀中加入包涵体裂解液(50 mmol/L NaH2PO4, 300 mmol/L NaCl, 8 mol/L尿素), 4℃裂解4 h, 然后4℃, 12 000 r/min离心15 min, 收集上清, 用Ni2+-NTA树脂亲和层析进行纯化. 120 g/L SDS-PAGE分析纯度, Bradford法测定蛋白含量.
1.2.2 母鸡免疫和IgY的分离: 用纯化的重组VacA-HpaA和等量完全弗氏佐剂混合, 并充分研磨乳化作为抗原, 胸部肌肉多点注射免疫114日龄立克体母鸡, 第1次免疫剂量为100 μg/只; 15 d后进行第2次免疫, 剂量为200 μg/只; 之后每隔1 mo进行第3次免疫和加强免疫, 剂量均为300 μg /只. 第2次免疫后1 wk开始收集鸡蛋4℃保存备用. 采用水稀释结合氯仿有机沉淀法. 具体步骤为: 用一次性注射器取出蛋黄液; 加入与蛋黄液等体积的生理盐水稀释并用力摇匀; 加入2倍体积的氯仿, 摇匀后静置过夜; 离心留上清, 即含有IgY, 4℃保存备用.
1.2.3 建立检测VacA-HpaA: IgY的间接ELISA法 以融合蛋白为抗原, 用包被液倍半稀释为40.0-2.0 mg/L, 每孔100 μL包被聚苯乙烯反应板, 酶标羊抗鸡IgY用酶稀释液作1∶10 000-1∶100 000稀释, 方阵滴定法确定最佳抗原包被浓度和酶标二抗工作浓度. 测定20份免疫前的鸡蛋的A570值, 取其平均值作为阴性对照. 测定免疫后提取的IgY, 以免疫后与免疫前IgY的A570值之比大于2.1判为阳性. 将未免疫和第1次免疫后不同时间提取的IgY用样品稀释液稀释成一定浓度, 用所建立的ELISA法测定其效价. 将免疫后110-120 d提取的IgY混合, 用常规饱和硫酸铵法纯化. 用已建立的ELISA法测定IgY效价. 120 g/L SDS-PAGE检测IgY的纯度; Bradford法测定蛋白含量. 分别以重组蛋白的VacA和HpaA为包被抗原, 建立检测VacA和HpaA IgY的ELISA法.
1.2.4 IgY的特异性检测: 采用western blot分析, 分别将纯化的融合蛋白VacA, HpaA抗原120 g/L SDS-PAGE. 将凝胶靠近阴性一侧, NC膜靠近阳性一侧, 在150 V条件下转移2 h, 取出NC膜, 用PBS洗涤4次, 每次5 min, 然后加封闭液, 室温封闭非特异性位点, 用PBS同上洗膜. 然后, 加上融合蛋白 IgY(37℃作用2 h, 用PBS同上洗膜)和HRP标记的羊抗鸡IgY二抗(37℃作用2 h, 用PBS同上洗膜). 最后, 将NC膜浸泡在DAB显色剂中10-15 min, 用双蒸水冲洗, 以终止染色.
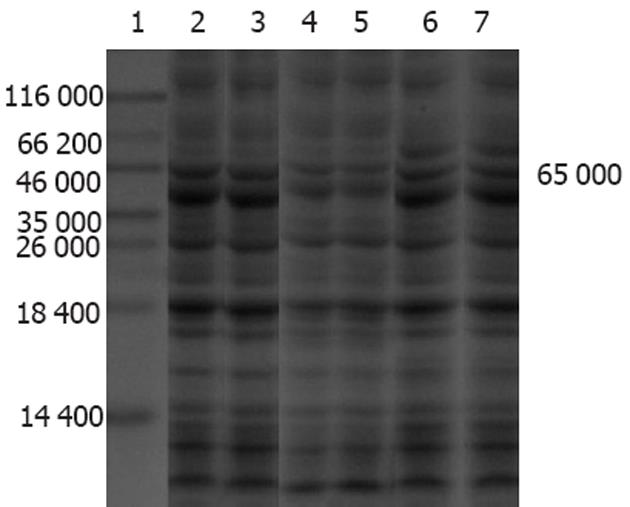
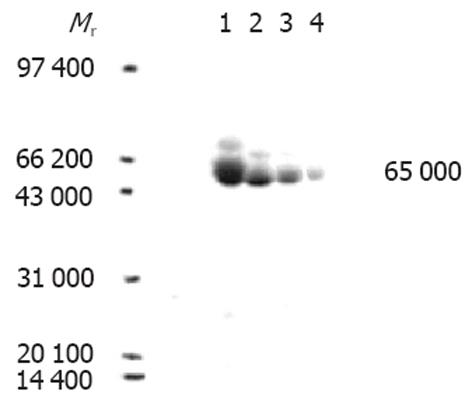
SDS-PAGE分析表明, 破碎菌的沉淀物可见明显特异蛋白表达带, 薄层扫描分析表明, 目的蛋白表达量为86%, 上清液中无明显表达带, 表明融合蛋白主要以包涵体形式表达(图1). 将收集的破碎菌的沉淀洗涤后变性溶解, 以NI2+-NTA柱纯化, 经SDS-PAGE和图像分析表明, 纯化产物主要存在于前3管洗脱液中, 纯度为90%(图2). Bradford法测定蛋白含量为0.72 g/L.
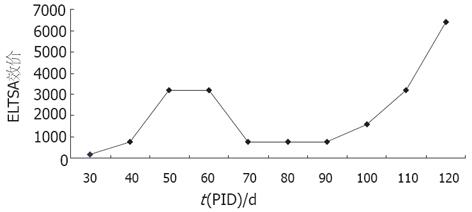
方阵滴定法确定抗原包被浓度为10 g/L, 酶标二抗的稀释度为1∶40 000, 20份免疫前IgY标本检测结果, A570平均值为0.134, 按P>2.1N判为阳性, 即A570>0.281时, 判为阳性, A570≤0.281判为阴性. 在上述实验条件下, VacA-HpaA IgY效价可达1∶6400. ELISA法检测结果发现, 免疫时间和抗体效价的变化总体上呈上升趋势: 在第1次免疫后30 d(PID30)左右抗体效价达到1∶200, 在50 d时可达1∶3200, 并保持了1 mo. 但随后至70 d时A570值下降到1∶800, 直至100 d方开始回升, 至120 d时可达1∶6400, 免疫时间与抗体效价变化(图3).
纯化浓缩后IgY效价为1∶12 800, 蛋白浓度为22 g/L. 在样品缓冲液中含100 mmol/L DTT时, IgY的二硫键被拆开, 经120 g/L SDS-PAGE电泳见2条带(图4). IgY纯度约为60%左右, 重链的分子质量为65 kDa左右, 轻链为24 kDa左右. 两条重链与两条轻链之和与总分子质量180 kDa相符合.
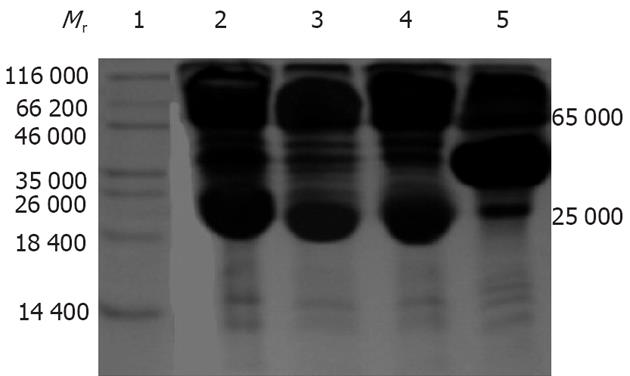
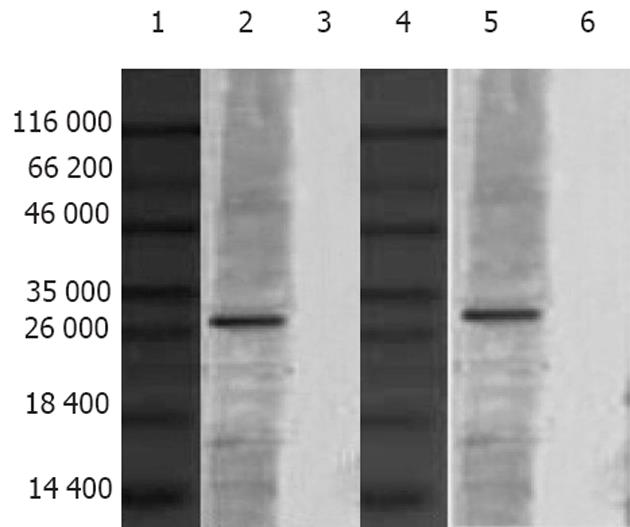
NC膜显色后分别在相对分子质量约27 000和30 000处出现相应的条带, 与预期值一致, 表明该融合蛋白同时能与VacA, HpaA两种蛋白发生反应(图5).
方阵滴定法确定工作浓度是: VacA和HpaA抗原包被浓度分别为7.5 mg/L和10 mg/L, 样品稀释度为1∶100时, 酶标羊抗鸡IgY的稀释度为1∶40 000, 阴性IgY平均值为0.142. 在上述实验条件下, 按P>2.1N判为阳性, A570>0.298时, 判为阳性, A570≤0.298判为阴性. 测得浓缩后IgY分别与VacA和HpaA反应的效价可达1∶3200和1∶6400(表1).
口服特异性IgY替代抗生素可以成功地治疗许多胃肠道疾病, 近年来报道较多[26-31], 如抗轮状病毒的IgY. 在抗H. pylori感染中, 以研究抗尿素酶IgY较多[32-34]. Nomura et al[22]用抗尿素酶IgY治疗感染H. pylori的沙鼠模型, 结果显示规律服用IgY不仅能预防H. pylori对沙鼠的感染, 而且能抑制所感染的H. pylori生长. Sasazuki et al[6]用抗尿素酶IgY对志愿者进行实验, 结果17名13C-尿素呼气实验阳性的志愿者, 在按规定口服该IgY 4 wk后其检测值明显降低. 这些结果为抗H. pylori IgY的应用提供了实验依据. Lehours et al报道, 如果一种蛋白能够包括H. pylori的两种或多种有效抗原成分, 刺激机体将会产生多重免疫保护性反应, 有利于防治H. pylori的感染.
大量研究表明, VacA和黏附素是H. pylori引发疾病的主要致病因子, 影响H. pylori在胃内定植的因素有很多, 如鞭毛、尿素酶、热休克蛋白、黏附因子、过氧化物歧化酶等, 其中的关键环节是黏附, 宿主细胞的特异性黏附由黏附素受体系统介导, 依赖于黏附分子上某些特定的氨基酸位点与受体的结合. HpaA基因为H. pylori所特有, 编码保守的HpaA能与多种胃上皮细胞表面受体结合, 使H. pylori紧密黏附于胃上皮细胞, 进而发挥对胃黏膜的损伤作用. 而VacA是H. pylori引起细胞损伤的重要的致病物质. 如能制备二者融合蛋白的IgY, 将既能阻止H. pylori黏附又能中和H. pylori细胞毒性, 应有更好的抗H. pylori感染效果. 为此我们制备了融合蛋白VacA-HpaA IgY, 国内外尚未见报道. 通过Western blot法表明, 该IgY可分别与VacA和HpaA反应, 即同时具有VacA和HpaA的抗体活性, 这表示他既可阻止H. pylori在胃内定植, 又可中和VacA的细胞毒性作用, 为进一步制备防治H. pylori的IgY抗体制剂打下了良好的基础. 经ELISA检测VacA-HpaA IgY对VacA和HpaA的效价分别为1∶3200和1∶6400, 该效价略低于与融合蛋白抗原反应时的效价, 可能是因为在VacA-HpaA融合基因构建过程中VacA和HpaA的部分有效基因被覆盖, 导致所表达的融合蛋白所产生的IgY分别对VacA和HpaA反应的效价降低.
抗原免疫后IgY效价通常是与免疫时间成正比的, 而我室制备的VacA-HpaA IgY的时间效价变化曲线未完全随时间递增, 首次免疫60-70 d时, 效价从60 d的1∶3200降到1∶800, 且持续了20 d, 第100 d后又迅速递增, 120 d时达到1∶6400. 分析其原因可能是在60至100 d时的鸡蛋收回后未能及时提取IgY, 以至提取时其效价已降低. 如果采蛋后立刻提取IgY, 4℃冷藏保存其效价则可保存效长时间.
在制备IgY的过程中, 纯化的方法很多[35], 其中以水稀释最为常用, 且效率高、纯度高, 简便实用, 适合大规模制备. 进一步纯化IgY的最好的方法是亲和层析, 得到的IgY纯度可达90%以上, 但在洗脱过程中可能会造成IgY变性, 产率也低. 因此本实验用水稀释结合氯仿有机沉淀法提取IgY后, 再用浓度为25%-40%的硫酸铵沉淀IgY, 纯化并浓缩IgY, 纯度可达60%左右, 蛋白含量为22 g/L, 抗体效价达1∶12 800, 并有效保证了其抗体活性, 可满足本实验的要求. 本实验进一步为制备集预防和治疗性为一体的抗H. pylori感染的IgY口服制剂奠定了基础
幽门螺杆菌是慢性胃炎和大部分消化性溃疡的重要病因, 并明确为胃癌的危险因素. 世界上超过了一半的人群受到H. pylori感染, 在发展中国家80%以上的成年人感染本菌, 且婴幼儿和儿童的感染也很普遍. 在中国, 据报道成人感染率在60%以上. 根除H. pylori感染的的方案很多, 如药物的二联、三联以及四联疗法, 取得了一定的疗效, 但近年来由于广泛、长期应用抗生素, 耐药菌株不断增加, 同时出现了一些药物副作用, 而且患者耐受性、依从性以及经济承受力都是需要面对的问题. 因此研究者们寻找更多的替代药物来预防和治疗H. pylori感染, 最有效的方法是研制免疫制剂.
大量文献显示, lgY技术正成为医药领域的新热点, 他适于生产特异性抗体, 其被动免疫功能可以用于抗病毒和细菌性疾病, 具有开发功能性食品和新药的潜能, 用特异性IgY治疗腹泻等胃肠道疾病已经在兽医学中广泛应用. Lee et al(2002)在体外实验中发现特异性IgY能有效防治人沙门氏菌性肠炎. Sarker et al(2001)报道口服特异性IgY可以治疗儿童轮状病毒腹泻. 王忠泽 et al(2002)报道了抗大肠杆菌O157∶H7鸡蛋黄抗体的制备及被动保护作用, 通过动物实验表明IgY是治疗肠道感染的一种有潜力的口服药物. Mine et al(2002)总结了IgY的治疗作用后表明口服IgY是抗人胃肠道病原的有效防治制剂.
VacA和HpaA作为H. pylori的重要毒力因子, 也是制备疫苗的重要候选抗原, 两者均具有良好的免疫原性, 用VacA-HpaA融合蛋白所制备的IgY将既能阻止H. pylori黏附又能中和H. pylori细胞毒性, 现今尚无报道.
自从1893年Klemperer发现鸡蛋中存在抗体以来, IgY技术正成为医药领域的新热点. 与产生于哺乳动物的IgG相比, IgY具有许多独特的优点. 本实验中的IgY尚需做进一步的体内外实验证实其实用性, 为确定其集预防与治疗为一体的口服疫苗打下良好的基础.
本研究成功制备了融合蛋白VacA-HpaA IgY. 文章选题准确, 实验设计合理, 目的明确, 具有科学性、创新性和可读性, 较好地反映了我国目前在胃肠病学基础和临床对H. pylori的研究水平.
电编: 李琪 编辑:潘伯荣
| 1. | Sasazuki S, Inoue M, Iwasaki M, Otani T, Yamamoto S, Ikeda S, Hanaoka T, Tsugane S. Effect of Helicobacter pylori infection combined with CagA and pepsinogen status on gastric cancer development among Japanese men and women: a nested case-control study. Cancer Epidemiol Biomarkers Prev. 2006;15:1341-1347. [PubMed] [DOI] |
| 2. | Akbulut M, Demirkan N, Duzcan E. PCNA expression in chronic gastritis due to. Helicobacter pylori . Turk J Gastroenterol. 2006;17:84-89. [PubMed] |
| 3. | The frequency and resistance of cytotoxin-associated (CAG-A) Helicobacter pylori strains to antibacterial agents in chronic gastritis and duodenal ulcer. Klin Med (Mosk). 2006;84:51-54. [PubMed] |
| 4. | Rai SK, Shah RD, Bhattachan CL, Rai CK, Ishiyama S, Kurokawa M, Ono K, Uga S. Helicobacter pylori associated gastroduodenal problem among the Nepalese. Nepal Med Coll J. 2006;8:9-13. [PubMed] |
| 5. | Harder J, Opitz OG. Gastric cancer--risk factors and medical therapy. Schweiz Rundsch Med Prax. 2006;95:1021-1028. [PubMed] |
| 6. | Sasazuki S, Inoue M, Iwasaki M, Otani T, Yamamoto S, Ikeda S, Hanaoka T, Tsugane S. Effect of Helicobacter pylori infection combined with CagA and pepsinogen status on gastric cancer development among Japanese men and women: a nested case-control study. Cancer Epidemiol Biomarkers Prev. 2006;15:1341-1347. [PubMed] [DOI] |
| 7. | Ignasi Elizalde J, Pique JM. Risk assessment in relatives of gastric cancer patients: hyperproliferation, genetics, and Helicobacter pylori infection. Eur J Gastroenterol Hepatol. 2006;18:877-879. [PubMed] [DOI] |
| 8. | Frieling T. The clinical impact of capsule endoscopy: to believe or not to believe. Eur J Gastroenterol Hepatol. 2006;18:873-874. [PubMed] [DOI] |
| 9. | Boonjakuakul JK, Canfield DR, Solnick JV. Comparison of Helicobacter pylori virulence gene expression in vitro and in the Rhesus macaque. Infect Immun. 2005;73:4895-4904. [PubMed] [DOI] |
| 10. | Yan J, Mao YF, Shao ZX. Frequencies of the expression of main protein antigens from Helicobacter pylori isolates and production of specific serum antibodies in infected patients. World J Gastroenterol. 2005;11:421-425. [PubMed] [DOI] |
| 11. | Muller I, Medina-Selby A, Palacios JL, Martinez P, Opazo P, Bruce E, Mancilla M, Valenzuela P, Yudelevich A, Venegas A. Cloning and comparison of ten gene sequences of a Chilean H. pylori strain with other H. pylori strains revealed higher variability for VacA and CagA virulence factors. Biol Res. 2002;35:67-84. [PubMed] [DOI] |
| 12. | Schade R, Calzado EG, Sarmiento R, Chacana PA, Porankiewicz-Asplund J, Terzolo HR. Chicken egg yolk antibodies (IgY-technology): a review of progress in production and use in research and human and veterinary medicine. Altern Lab Anim. 2005;33:129-154. [PubMed] |
| 13. | Gasparyan VK. Hen egg immunoglobulin Y in colloidal gold agglutination assay: comparison with rabbit immunoglobulin G. J Clin Lab Anal. 2005;19:124-127. [PubMed] [DOI] |
| 14. | Motoi Y, Inoue S, Hatta H, Sato K, Morimoto K, Yamada A. Detection of rabies-specific antigens by egg yolk antibody (IgY) to the recombinant rabies virus proteins produced in Escherichia coli. Jpn J Infect Dis. 2005;58:115-118. [PubMed] |
| 15. | Sunwoo HH, Wang WW, Sim JS. Detection of Escherichia coli O157:H7 using chicken immunoglobulin Y. Immunol Lett. 2006;. [PubMed] [DOI] |
| 16. | Miyamoto K, Shimamoto T, Aosasa M, Kimura S, Nakamura N, Okubo Y, Yokoyama T, Horiuchi H, Furusawa S, Matsuda H. Development of recombinant chicken IgY from single chain fragment of variable region for diagnosis of BSE. Biologicals. 2006;. [PubMed] |
| 17. | Girard F, Batisson I, Martinez G, Breton C, Harel J, Fairbrother JM. Use of virulence factor-specific egg yolk-derived immunoglobulins as a promising alternative to antibiotics for prevention of attaching and effacing Escherichia coli infections. FEMS Immunol Med Microbiol. 2006;46:340-350. [PubMed] [DOI] |
| 18. | Van Nguyen S, Umeda K, Yokoyama H, Tohya Y, Kodama Y. Passive protection of dogs against clinical disease due to Canine parvovirus-2 by specific antibody from chicken egg yolk. Can J Vet Res. 2006;70:62-64. [PubMed] |
| 19. | Malik MW, Ayub N, Qureshi IZ. Passive immunization using purified IgYs against infectious bursal disease of chickens in Pakistan. J Vet Sci. 2006;7:43-46. [PubMed] [DOI] |
| 20. | Fu CY, Huang H, Wang XM, Liu YG, Wang ZG, Cui SJ, Gao HL, Li Z, Li JP, Kong XG. Preparation and evaluation of anti-SARS coronavirus IgY from yolks of immunized SPF chickens. J Virol Methods. 2006;133:112-115. [PubMed] [DOI] |
| 21. | Schade R, Calzado EG, Sarmiento R, Chacana PA, Porankiewicz-Asplund J, Terzolo HR. Chicken egg yolk antibodies (IgY-technology): a review of progress in production and use in research and human and veterinary medicine. Altern Lab Anim. 2005;33:129-154. [PubMed] |
| 22. | Nomura S, Suzuki H, Masaoka T, Kurabayashi K, Ishii H, Kitajima M, Nomoto K, Hibi T. Effect of dietary anti-urease immunoglobulin Y on Helicobacter pylori infection in Mongolian gerbils. Helicobacter. 2005;10:43-52. [PubMed] [DOI] |
| 23. | Suzuki H, Nomura S, Masaoka T, Goshima H, Kamata N, Kodama Y, Ishii H, Kitajima M, Nomoto K, Hibi T. Effect of dietary anti-Helicobacter pylori-urease immunoglobulin Y on Helicobacter pylori infection. Aliment Pharmacol Ther. 2004;20 Suppl 1:185-192. [PubMed] [DOI] |
| 24. | Shin JH, Roe IH, Kim HG. Production of anti-Helicobacter pylori urease-specific immunoglobulin in egg yolk using an antigenic epitope of H. pylori urease. J Med Microbiol. 2004;53:31-34. [PubMed] [DOI] |
| 25. | Shin JH, Yang M, Nam SW, Kim JT, Myung NH, Bang WG, Roe IH. Use of egg yolk-derived immunoglobulin as an alternative to antibiotic treatment for control of Helicobacter pylori infection. Clin Diagn Lab Immunol. 2002;9:1061-1066. [PubMed] [DOI] |
| 26. | Wang WH, Wang WJ, Zhang BX. Effect of IgY solution on dental plaque. Zhonghua KouQiang YiXue ZaZhi. 2003;38:417-419. [PubMed] |
| 27. | Fan M, Jiang Q, Bian Z. The study on specific anti-Streptococcus mutans IgY against dental caries in rats. HuaXi KouQiang YiXue ZaZhi. 2003;21:339-341. [PubMed] |
| 28. | Larsson A, Carlander D. Oral immunotherapy with yolk antibodies to prevent infections in humans and animals. Ups J Med Sci. 2003;108:129-140. [PubMed] |
| 29. | Wu C, Yang R, Zhou J, Bao S, Zou L, Zhang P, Mao Y, Wu J, He Q. Production and characterisation of a novel chicken IgY antibody raised against C-terminal peptide from human thymidine kinase 1. J Immunol Methods. 2003;277:157-169. [PubMed] [DOI] |
| 30. | Kollberg H, Carlander D, Olesen H, Wejaker PE, Johannesson M, Larsson A. Oral administration of specific yolk antibodies (IgY) may prevent Pseudomonas aeruginosa infections in patients with cystic fibrosis: a phase I feasibility study. Pediatr Pulmonol. 2003;35:433-440. [PubMed] [DOI] |
| 31. | Zhang WW. The use of gene-specific IgY antibodies for drug target discovery. Drug Discov Today. 2003;8:364-371. [PubMed] [DOI] |
| 32. | Kazimierczuk K, Cova L, Ndeboko B, Szczyrk U, Targosz A, Brzozowski T, Sirko A. Genetic immunization of ducks for production of antibodies specific to Helicobacter pylori UreB in egg yolks. Acta Biochim Pol. 2005;52:261-266. [PubMed] |
| 33. | Suzuki H, Nomura S, Masaoka T, Goshima H, Kamata N, Kodama Y, Ishii H, Kitajima M, Nomoto K, Hibi T. Effect of dietary anti-Helicobacter pylori-urease immunoglobulin Y on Helicobacter pylori infection. Aliment Pharmacol Ther. 2004;20 Suppl 1:185-192. [PubMed] [DOI] |
| 34. | Shin JH, Roe IH, Kim HG. Production of anti-Helicobacter pylori urease-specific immunoglobulin in egg yolk using an antigenic epitope of H. pylori urease. J Med Microbiol. 2004;53:31-34. [PubMed] [DOI] |
| 35. | Cook CL, Pao W, Firca JR, Anderson BE, Fryer JP. Simple purification methods for an alphagalactose-specific antibody from chicken eggs. J Biosci Bioeng. 2001;91:305-310. [PubMed] [DOI] |