修回日期: 2006-05-10
接受日期: 2006-06-14
在线出版日期: 2006-08-08
目的: 利用pEGFP6-1和pGenesil-1质粒构建针对Fas的2个短发夹RNA(short hairpin RNA, shRNA) 串联表达的载体.
方法: 设计表达2个shRNA结构的互补DNA序列, 经退火成双链, 分别克隆至带有U6启动子的质粒载体pEGFP6-1和pGenesil-1中, 构建重组质粒, 转化大肠杆菌DH5α菌株, 扩增, 提取质粒, 酶切鉴定后测序分析. 分别用SacI+ SalI双酶切重组质粒, 胶回收酶切pEGFP6-1-siFas1大片段和酶切pGenesil-1-siFas2小片段, T4 DNA Ligase连接酶切大、小片段, 得到pEGFP6-1-siFas1+siFas2重组质粒. 转化感受态细胞DH5α, 扩增, 提取串联重组质粒进行酶切鉴定.
结果: 成功构建靶向Fas的2个shRNA串联重组质粒载体pEGFP6-1-siFas1+siFas2. 酶切鉴定和测序分析重组质粒, shRNA编码序列与设计的片段完全一致, 经酶切凝胶电泳证实载体构建成功.
结论: 表达2个靶向Fas的shRNA表达框成功构建在一个重组质粒载体上.
引文著录: 刘明社, 王兰, 赵中夫, 张国英, 张芸, 封江南. 干扰Fas受体表达的串联shRNA表达载体的构建. 世界华人消化杂志 2006; 14(22): 2174-2179
Revised: May 10, 2006
Accepted: June 14, 2006
Published online: August 8, 2006
AIM: To construct the recombinant plasmid expressing two Fas-targeted short hairpin RNA (shRNA) by pEGFP6-1 and pGenesil-1 plasmids vector.
METHODS: Two pairs of DNA sequences were designed, and then synthesized into complementary chains by annealing, respectively. Then the obtained products containing short hairpin structure were inserted into plasmid vector pEGFP6-1/pGenesil-1 with U6 promoter. The recombinant plasmids were transformed into Escherichia coli strain DH5a for screening and amplifying. The sequence analysis of the plasmids identified by restriction enzyme were carried out. The two plasmids were first digested with SacⅠ, and then with SalⅠ. A long segment from pEGFP6-1-siFas1 and a short segment from pGenesil-1-siFas2 were reclaimed, and connected with T4 DNA Ligase. The recombinant plasmid series was identified by restriction endonuclease digestion.
RESULTS: The two Fas-targeted shRNAs were successfully inserted into the plasmid vector pEGFP6-1, and the coding sequences of the obtained shRNAs were consistent with the designed fragments.
CONCLUSION: The recombinant plasmid series of two Fas-targeted shRNAs is successfully constructed in one pEGFP6-1 plasmid.
- Citation: Liu MS, Wang L, Zhao ZF, Zhang GY, Zhang Y, Feng JN. Construction of recombinant plasmid series with two Fas-targeted short hairpin RNAs. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2174-2179
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2174.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2174
RNAi技术是通过导入细胞19-23 nt的小分子干扰RNA(small interference RNA, siRNA), 降解同源mRNA, 高效、特异性阻断目的基因表达[1-5]. 但是, 裸siRNA导入机体和细胞, 转染效率低, 抑制时间短. 针对靶基因不同位点设计的siRNA, 抑制效果也各有差异. 因此需要筛选、设计和构建高效导入和稳定、持久并有效抑制基因表达的siRNA载体. 短发夹RNA(short hairpin RNA, shRNA)是设计导入细胞的RNA单链上, 在编码siRNA正、反义链序列之间添加一段不相互补的碱基序列, 这样使RNA自身折叠成发卡状双链后形成一个loop环. 在细胞内, shRNA的loop环被酶切而成为siRNA双链. 有研究表明, shRNA对靶基因的抑制效果优于siRNA[6-7], 因此, 我们针对小鼠Fas基因设计了2个位点的shRNA表达序列, 用小鼠U6启动子和RNA polymeraseⅢ(PolⅢ)终止信号, 构建针对Fas的特异性shRNA真核表达载体, 在一个载体上串联两个shRNA表达框架.
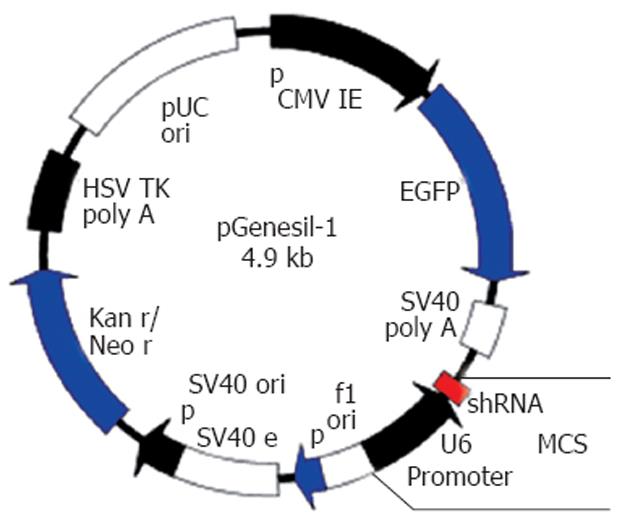
质粒载体pEGFP6-1/pGensil-1(含有EGFP, Kanar, Neor表达框架和U6启动子), Escherichia coli感受态菌株DH5α均由武汉晶赛生物公司提供; 质粒抽提试剂盒由中鼎公司提供; DNA连接酶和核酸内切酶: T4 DNA Ligase, SalⅠ, SacⅠ, BamHⅠ、HindⅢ以及DL2000 Marker均由美国NEB公司提供.
1.2.1 靶向Fas RNAi位点筛选及表达shRNA序列的设计: 根据GeneBank中小鼠Fas的核苷酸序列, 参考siRNA的设计策略, 使用BLAST排除和其他编码序列/EST同源的序列, 结合文献[8], 最后筛选2个作用位点(1个位于Fas胞外的受体域, 另1个位于Fas胞内的死亡域), 分别设计表达shRNA(65 bp)的寡核苷酸序列, siFas1, siFas2和通用阴性对照HK. 表达shRNA的寡核苷酸结构:BamHⅠ-Sense-Loop-Antisense-终止信号EcoRI/SacI-HindⅢ. siFas1的靶序列1: 5'-GTGCAAGTGCAAACCA GAC-3'. siFas1-A(Sense)和siFas1-B(Antisense): 5'-GATCCGTGCAAGTGCAAACCAGACTTCAAGACGGTCTGGTTTGCACTTGCACTTTTTTGAATTCA-3'; 3'-GCACGTTCACGTTTGGTCTGAAGTTCTGCCAGACCAAACGTGAACGTGAAAAAACTTAAGTTCGA-5'. siFas2的靶序列2: 5'-AAGCCGAATGTCGCA GAAC-3'. siFas2-A(Sense)和siFas2-B(Antisense): 5'-GATCCAAGCCGAATGTCGCAGAACTTCAAGACGGTTCTGCGACATTCGGCTTTTTTTTGAGCTCA-3'; 3'-GTTCGGCTTACAGCGTCTTGAAGTTCTGCCAAGACGCTGTAAGCCGAAAAAAAACTCGAGTTCGA-5'. 通用对照靶序列HK: 5'-GACTTCATAAGGCGCATGC-3'. HK-1(Sense)和HK-2(Antisense):5'-GATCCGACTTCATAAGGCGCATGCTTCAAGACGGCATGCGCCTTATGAAGTCTTTTTTGTCGACA-3'; 3'GCTGAAGTATTCCGCGTACGAAGTTCTGCCGTACGCGGAATACTTCAGAAAAAACAGCTGTTCGA-5'以上序列送武汉伯杰生物技术公司合成.
1.2.2 表达质粒的线性化: pEGFP6-1和pGenesil-1两种质粒(图1)均用BamHⅠ和HindⅢ双酶切, 37℃酶切8 h, 10 g/L Agarose凝胶电泳分别回收大片段, 即为线性化表达质粒.
1.2.3 质粒pEGFP6-1/pGenesil-1与siFas1/siFas2的连接: 分别用annealing buffer 50 μL溶解上述单链寡核苷酸(2OD)片段. 各取2 μL(即siFas1-A 2 μL+siFas1-B 2 μL或siFas2-A 2 μL+siFas2-B 2 μL)+annealing buffer 16 μL混匀. 94℃退火 5 min, 自然冷却至室温, 得到退火产物siFas1和siFas2双链. 各取退火产物1 μL加H2O 99 μL稀释100倍. 稀释的退火产物siFas1和siFas2分别与线性化质粒pEGFP6-1和pGenesil-1载体用T4 DNA Ligase, 10×Ligase Buffer进行连接, 22℃水浴反应过夜. 连接产物分别命名为pEGFP6-1-siFas1和pGenesil-1-siFas2. 各取过夜连接产物(pEGFP6-1-siFas1和pGenesil-1-siFas2)5 μL转化感受态DH5α, 分别涂布于含Kanar抗性(终浓度为30 mg/L)的LB平板上, 37℃恒温箱培养过夜. 从每个培养皿上随机挑取3个单菌落接种于3 mL含Kanar抗性(终浓度为30 mg/L)的LB培养液中, 37℃恒温摇床(250 r/min)培养过夜. 用质粒提取试剂盒小量提取质粒, 并分别做酶切鉴定: pEGFP6-1-siFas1 8.5 μL用EcoRⅠ 0.5 μL, 10×H Buffer 1 μL做酶切, 37℃水浴反应3 h; pGenesil-1-siFas2 8.5 μL用SalⅠ 0.5 μL, 10×L Buffer 1 μL做酶切, 37℃水浴反应3 h. 挑取经酶切鉴定克隆正确的pEGFP6-1-siFas1和pGenesil-1-siFas2质粒转化菌液去测序. 通用阴性对照HK与pEGFP6-1的连接亦如上述.
1.2.4 pEGFP6-1-siFas1与pGenesil-1-siFas2的串联: 用SacⅠ+SalⅠ双酶切pEGFP6-1-siFas1回收大片段, 用SacⅠ+ SalⅠ双酶切pGenesil-1-siFas2回收小片段(403 bp). 先用SacⅠ酶切, 质粒DNA 5 μL, 10×L Buffer 2 μL, SacⅠ 1 μL和H2O 12 μL, 37℃水浴反应3 h. 加入5 mol/L NaCl 2 μL, 混匀, 再加入乙醇 51 μL, 混匀. -70℃冰箱放置15 min, 15 000 r/min离心15 min. 用700 mL/L乙醇洗涤2遍, 然后各用H2O 17 μL溶解. 再用SalⅠ酶切, 上步SalⅠ酶切产物17 μL 10×H Buffer 2 μL和SalⅠ1 μL, 37℃水浴反应过夜. 10 g/L Agarose凝胶电泳, 胶回收试剂盒分别回收大片段和小片段(403 bp), 各用30 μL H2O洗脱. 用T4 DNA Ligase 1 μL和10×Ligase Buffer 1 μL连接回收大片段4 μL与回收小片段4 μL, 22℃水浴反应过夜. 连接产物命名为pEGFP6-1-siFas1+siFas2. 取过夜连接产物5 μL转化感受态细胞DH5α, 涂布于含Kana r抗性(终浓度为30 mg/L)的LB平板上, 37℃恒温箱培养过夜. 从培养皿上挑取3个单菌落接种于3 mL含Kanar抗性(终浓度为30 mg/L)的LB培养液中, 37℃恒温摇床(250 r/min)培养过夜. 用质粒提取试剂盒小量提取质粒, 并分别用BamHⅠ做酶切鉴定, 37℃水浴反应3 h, 10 g/L Agarose凝胶电泳.
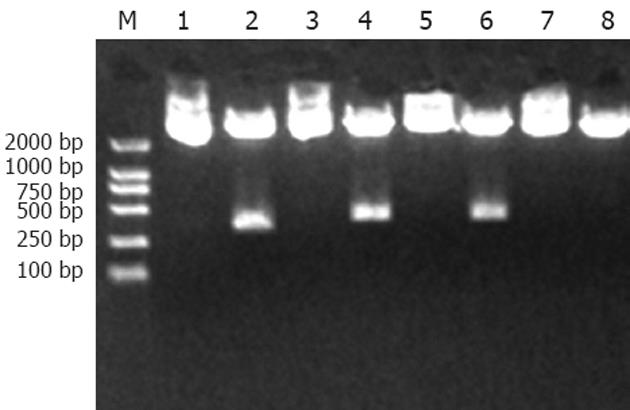
pEGFP6-1-siFas1经酶切分析: 因为pEGFP6-1质粒载体本来只含有一个EcoRⅠ的酶切位点, 而pEGFP6-1-siFas1质粒能够被EcoRⅠ酶切出一条393 bp的DNA带, 说明目的序列siFas1已经插入到pEGFP6-1质粒载体(图2, 条带3, 4和5, 6). pGenesil-1-siFas2经酶切分析: 因为pGenesil-1质粒载体本来不含SacⅠ的酶切位点的, 而pGenesil-1-siFas2质粒能够被SacⅠ酶切, 表明目的序列siFas2已经插入到pGenesil-1质粒载体(图2, 条带7, 8). pEGFP6-1-HK质粒能够被SalⅠ酶切出一条415 bp的DNA带, 说明目的序列HK已经插入到pEGFP6-1质粒载体(图2, 条带1, 2).
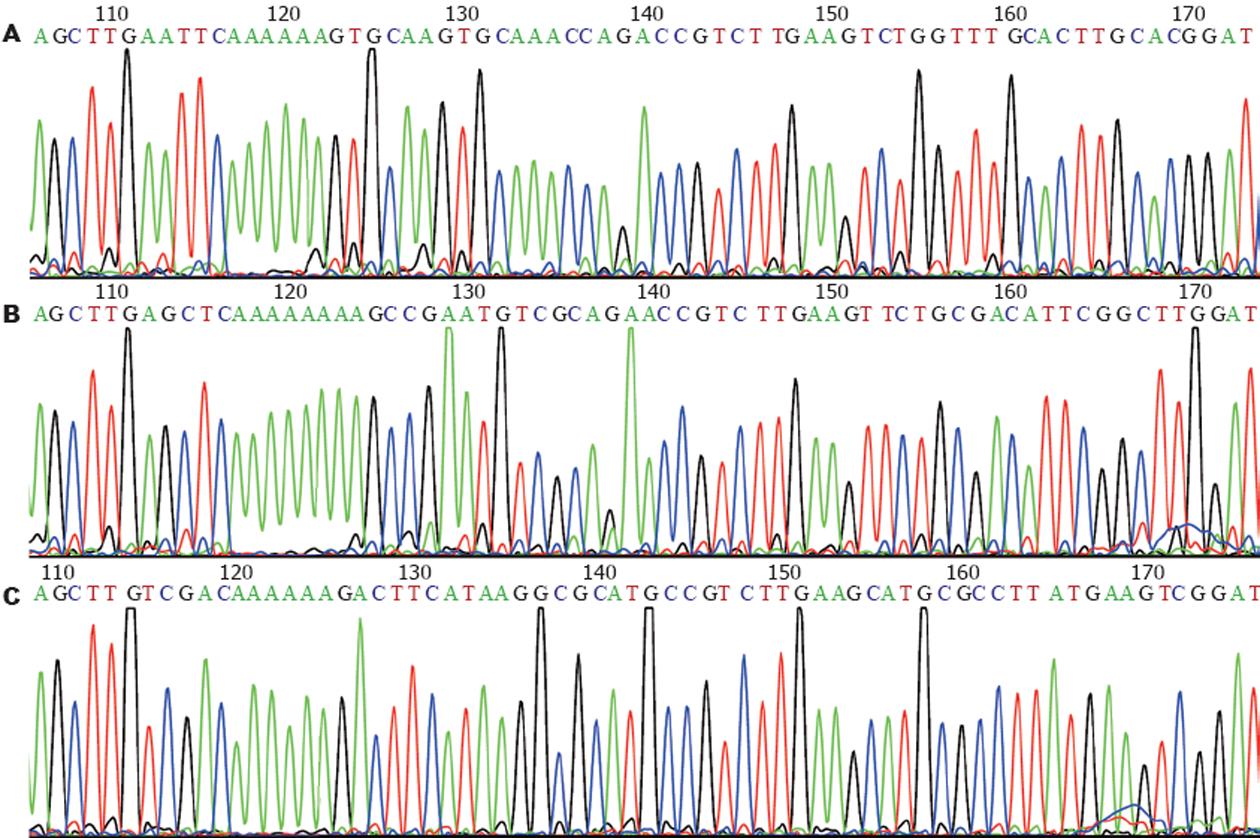
经测序结果分析pEGFP6-1-siFas1, pGenesil-1-siFas2和pEGFP6-1-HK均为插入正确的克隆质粒, 而且分子质量均符合设计标准(图3).
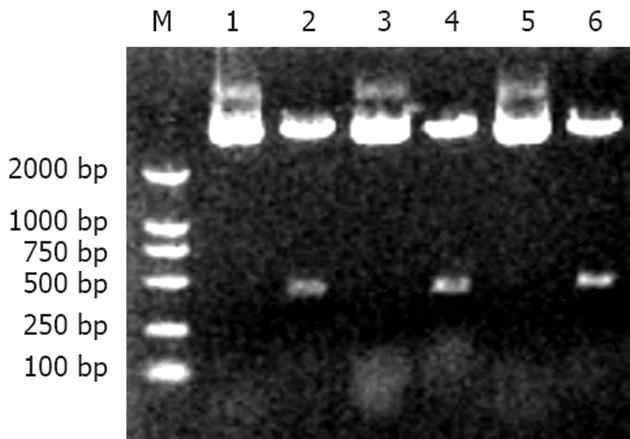
经酶切分析, 目的序列siFas1和siFas2与质粒连接成功后的串联重组质粒MCS应该为: -HindⅢ-siFas1-BamHⅠ-U6_Promotor-EcoRⅠ-siFas2-BamHⅠ-U6_Promotor-EcoRⅠ-SalⅠ-BssHⅡ-XbaⅠ-NotⅠ-PstⅠ-DraⅢ-. 3个单菌落质粒经BamHⅠ酶切, 10 g/L Agarose凝胶电泳(图4), 可见407 bp的DNA条带, 符合设计要求, 故为插入正确的重组质粒.
在生物体发育过程中和在许多疾病的发病机制中, 细胞凋亡起着重要的作用[9-12]. 参与调节细胞凋亡的许多信号途径中, Fas/FasL是最重要的介导细胞凋亡系统[13-16]. 细胞表面的死亡受体中, Fas是最重要的诱导凋亡的受体[17]. Fas 与FasL或抗Fas抗体结合导致一个凋亡信号启动, 通过细胞内的Fas相关死亡域蛋白(Fas-associated with death domain, FADD)[18-19], 活化蛋白酶caspase-8[20-22], 激活caspases的级联反应, 最后由caspase-3活化caspase依赖的核酸内切酶(caspase-activated DNase, CAD)[23], 切割细胞骨架和核骨架蛋白, 完成细胞凋亡全过程[24]. 肝脏的许多细胞表达Fas/FasL, 当Fas这一重要的细胞凋亡受体过度表达时, 则可以引起疾病. 如, 受HBV感染的人肝细胞表面有高度表达的Fas, 可以诱发感染细胞过度凋亡, 成为严重肝功能衰竭的主要原因[25-27]. 越来越多的证据表明, Fas/FasL在许多肝脏疾病中起着重要作用. 抑制疾病状态下Fas蛋白的过度表达, 对于治疗疾病和控制疾病的发展, 具有重要意义. 近年来发展的RNAi技术是一种快速、简洁、经济的抑制基因表达技术[28], 尤其给病毒性疾病的基因治疗带来新的希望[29-30].
RNAi技术运用于沉默哺乳动物基因, 可以通过体外转录或化学合成siRNA经脂质体、质粒或病毒载体等转染细胞后发挥作用, 也可用shRNA表达载体转染细胞, 在细胞内shRNA经酶切去loop环形成siRNAs双链而起作用. 体外化学合成的siRNAs因成本高、不能持续抑制基因表达, 且易于污染RNA酶而降解, 限制了其应用. 而shRNAs表达载体转染细胞后在细胞内可持续稳定表达, 构建成本相对较低, 作用效果也优于转染体外合成的siRNA[6-7]. 串联多个shRNA于同一质粒载体上, 增强RNAi沉默基因的作用, 或同时发挥RNAi抑制多个基因的作用研究并不多见[31]. 有文献报道, 针对Fas基因的siRNA可以有效的沉默基因表达, 并保护由ConA诱导的小鼠肝损伤[8]. 也有学者构建了质粒载体并成功抑制Fas基因的表达[32]. 尚无人在同一载体构建多个针对Fas的shRNA表达载体. 为提高对Fas基因表达的持续有效抑制, 我们筛选针对小鼠Fas基因2个位点的shRNA, 通过GeneBank数据库BLAST分析, 选用的siRNA编码序列没有与人和动物其他基因明显同源的靶位点, 保证RNAi的特异性, 把2条shRNA成功串联在同一个载体质粒上, 在不同位点同时发挥RNAi作用, 可以增强抑制基因的效果. 另外, 我们所构建的载体含有EGFP基因, 在细胞内, EGFP基因的表达产物-绿色荧光蛋白可以方便地通过荧光显微镜或流式细胞仪检测, 确定载体转染效率. 构建的Fas shRNA真核表达载体使用了U6启动子指导shRNA编码序列的转录、Pol Ⅲ识别的转录终止信号, 经过酶切和测序分析无碱基突变, 证实质粒载体构建成功. 通过Fas shRNA载体质粒转染细胞, 检测其对Fas mRNA的抑制效率, 为进一步研究Fas基因在多种疾病中的作用以及探索肝病的基因治疗奠定基础.
Fas是重要的凋亡诱导受体, 当Fas这一重要的细胞凋亡受体过度表达时, 则可以引起疾病. RNA干扰(RNAi)技术的发展为抑制疾病状态下Fas基因的过渡表达带来新希望. 构建shRNA真核表达载体可以在细胞内有效表达shRNA, 发挥RNAi作用, 有效沉默基因表达.
Song et al2003年首先运用化学方法合成针对Fas基因的siRNA并成功导入小鼠体内, 有效抑制了ConA诱导的肝细胞Fas过表达; 刘苏虎 et al 2005年根据Song的一个siRNA序列构建 Fas靶向的干扰质粒载体并进行了生物活性; 雷印胜 et al 2005年构建串联表达shRNA载体, 观察RNAi对大鼠心肌细胞Kir2.1的体外效应.
本研究采用骨架质粒pEGFP6-1和pGenesil-1, 将靶向Fas基因2个位点的shRNA表达框架串联构建在1个质粒上, 以提高RNAi沉默基因的效率.
在同1个质粒上串联2个shRNA表达框架的方法, 不仅可以提高沉默基因的效率, 也减少了质粒构建费用. 靶向Fas shRNA的串联表达质粒的构建, 为进一步体外和体内实验, 探索抑制Fas表达在疾病治疗中的作用奠定了基础.
本研究设计合成串联表达针对Fas的2个shRNA, 以提高对靶序列的抑制效率, 具有较重要的意义. 建议课题组通过进一步质粒转染细胞实验, 检测RNAi对Fas mRNA的沉默作用. 明确串联表达载体对Fas过度表达的有效抑制.
电编: 李琪 编辑:潘伯荣
| 2. | Donze O, Picard D. RNA interference in mammalian cells using siRNAs synthesized with T7 RNA polymerase. Nucleic Acids Res. 2002;30:e46. [PubMed] [DOI] |
| 3. | Yu JY, DeRuiter SL, Turner DL. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc Natl Acad Sci USA. 2002;99:6047-6052. [PubMed] [DOI] |
| 4. | Miyagishi M, Taira K. U6 promoter-driven siRNAs with four uridine 3' overhangs efficiently suppress targeted gene expression in mammalian cells. Nat Biotechnol. 2002;20:497-500. [PubMed] [DOI] |
| 6. | Paul CP, Good PD, Winer I, Engelke DR. Effective expression of small interfering RNA in human cells. Nat Biotechnol. 2002;20:505-508. [PubMed] [DOI] |
| 7. | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science. 2002;296:550-553. [PubMed] [DOI] |
| 8. | Song E, Lee SK, Wang J, Ince N, Ouyang N, Min J, Chen J, Shankar P, Lieberman J. RNA interference targeting Fas protects mice from fulminant hepatitis. Nat Med. 2003;9:347-351. [PubMed] [DOI] |
| 9. | Cardin R, D'Errico A, Fiorentino M, Cecchetto A, Naccarato R, Farinati F. Hepatocyte proliferation and apoptosis in relation to oxidative damage in alcohol-related liver disease. Alcohol Alcohol. 2002;37:43-48. [PubMed] [DOI] |
| 10. | Sanford AN, Suriano AR, Herche D, Dietzmann K, Sullivan KE. Abnormal apoptosis in chronic granulomatous disease and autoantibody production characteristic of lupus. Rheumatology (Oxford). 2006;45:178-181. [PubMed] [DOI] |
| 11. | Andrikoula M, Tsatsoulis A. The role of Fas-mediated apoptosis in thyroid disease. Eur J Endocrinol. 2001;144:561-568. [PubMed] [DOI] |
| 12. | Fischer U, Schulze-Osthoff K. New approaches and therapeutics targeting apoptosis in disease. Pharmacol Rev. 2005;57:187-215. [PubMed] [DOI] |
| 13. | Nagata S. Apoptosis mediated by the Fas system. Prog Mol Subcell Biol. 1996;16:87-103. [PubMed] [DOI] |
| 14. | Lambert JC, Zhou Z, Kang YJ. Suppression of Fas-mediated signaling pathway is involved in zinc inhibition of ethanol-induced liver apoptosis. Exp Biol Med (Maywood). 2003;228:406-412. [PubMed] |
| 15. | Zhou Z, Sun X, Kang YJ. Ethanol-induced apoptosis in mouse liver: Fas- and cytochrome c-mediated caspase-3 activation pathway. Am J Pathol. 2001;159:329-338. [PubMed] [DOI] |
| 16. | Ishigami A, Fujita T, Handa S, Shirasawa T, Koseki H, Kitamura T, Enomoto N, Sato N, Shimosawa T, Maruyama N. Senescence marker protein-30 knockout mouse liver is highly susceptible to tumor necrosis factor-alpha- and Fas-mediated apoptosis. Am J Pathol. 2002;161:1273-1281. [PubMed] [DOI] |
| 17. | Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science. 1998;281:1305-1308. [PubMed] [DOI] |
| 18. | Juo P, Woo MS, Kuo CJ, Signorelli P, Biemann HP, Hannun YA, Blenis J. FADD is required for multiple signaling events downstream of the receptor Fas. Cell Growth Differ. 1999;10:797-804. [PubMed] |
| 19. | Bang S, Jeong EJ, Kim IK, Jung YK, Kim KS. Fas- and tumor necrosis factor-mediated apoptosis uses the same binding surface of FADD to trigger signal transduction. A typical model for convergent signal transduction. J Biol Chem. 2000;275:36217-36222. [PubMed] [DOI] |
| 20. | Kischkel FC, Hellbardt S, Behrmann I, Germer M, Pawlita M, Krammer PH, Peter ME. Cytotoxicity-dependent APO-1 (Fas/CD95)-associated proteins form a death-inducing signaling complex (DISC) with the receptor. EMBO J. 1995;14:5579-5588. [PubMed] |
| 21. | Boldin MP, Goncharov TM, Goltsev YV, Wallach D. Involvement of MACH, a novel MORT1/FADD-interacting protease, in Fas/APO-1- and TNF receptor-induced cell death. Cell. 1996;85:803-815. [PubMed] [DOI] |
| 22. | Muzio M, Chinnaiyan AM, Kischkel FC, O'Rourke K, Shevchenko A, Ni J, Scaffidi C, Bretz JD, Zhang M, Gentz R. FLICE, a novel FADD-homologous ICE/CED-3-like protease, is recruited to the CD95 (Fas/APO-1) death--inducing signaling complex. Cell. 1996;85:817-827. [PubMed] [DOI] |
| 23. | Sakahira H, Enari M, Nagata S. Cleavage of CAD inhibitor in CAD activation and DNA degradation during apoptosis. Nature. 1998;391:96-99. [PubMed] [DOI] |
| 24. | Liu X, Li P, Widlak P, Zou H, Luo X, Garrard WT, Wang X. The 40-kDa subunit of DNA fragmentation factor induces DNA fragmentation and chromatin condensation during apoptosis. Proc Natl Acad Sci USA. 1998;95:8461-8466. [PubMed] [DOI] |
| 25. | Galle PR, Hofmann WJ, Walczak H, Schaller H, Otto G, Stremmel W, Krammer PH, Runkel L. Involvement of the CD95 (APO-1/Fas) receptor and ligand in liver damage. J Exp Med. 1995;182:1223-1230. [PubMed] [DOI] |
| 26. | Pan J, Duan LX, Sun BS, Feitelson MA. Hepatitis B virus X protein protects against anti-Fas-mediated apoptosis in human liver cells by inducing NF-kappa B. J Gen Virol. 2001;82:171-182. [PubMed] [DOI] |
| 27. | Liu ZX, Govindarajan S, Okamoto S, Dennert G. Fas-mediated apoptosis causes elimination of virus-specific cytotoxic T cells in the virus-infected liver. J Immunol. 2001;166:3035-3041. [PubMed] [DOI] |
| 30. | Uprichard SL, Boyd B, Althage A, Chisari FV. Clearance of hepatitis B virus from the liver of transgenic mice by short hairpin RNAs. Proc Natl Acad Sci USA. 2005;102:773-778. [PubMed] [DOI] |
| 31. | 雷 印胜, 张 海洲, 王 来城, 郭 兰敏, 范 全心, 邹 承伟, 李 红昕, 王 安彪. 串联表达大鼠心肌细胞Kir2·1shRNA载体的构建及其体外效应. 中华医学杂志. 2005;85:2910-2915. |
| 32. | 刘 苏虎, 张 王刚, 张 镁, 朱 青, 田 玮, 孙 静昕. Fas靶向RNA干扰质粒载体的构建及生物活性鉴定. 西安交通大学学报(医学版). 2005;26:115-118, 123. |