修回日期: 2006-05-10
接受日期: 2006-05-11
在线出版日期: 2006-08-08
目的: 观察重症急性胰腺炎(SAP)大鼠血浆中TNF-α, 血小板活化因子(PAF), IL-10, IL-12, sTNFR的水平变化及其银杏苦内酯B(BN52021)的影响.
方法: 实验选用Wistar♂大鼠45只, 随机分成SAP模型组(SAP, n = 15), BN52021治疗组(BN, n = 15)和阴性对照组(NC, n = 15). 前两组以50 g/L牛磺胆酸钠逆行注入主胰管制成SAP模型, NC组开腹后仅翻动十二指肠并触摸胰腺数次关腹. 制模15 min后, SAP组经股静脉以5 mL/mg注射生理盐水; BN组以BN52021(5 mg/kg)代替生理盐水静注. 制模后分别于1, 6, 12 h采血, 应用ELISA技术测定血浆TNF-α, PAF, IL-10, IL-12和sTNFR水平.
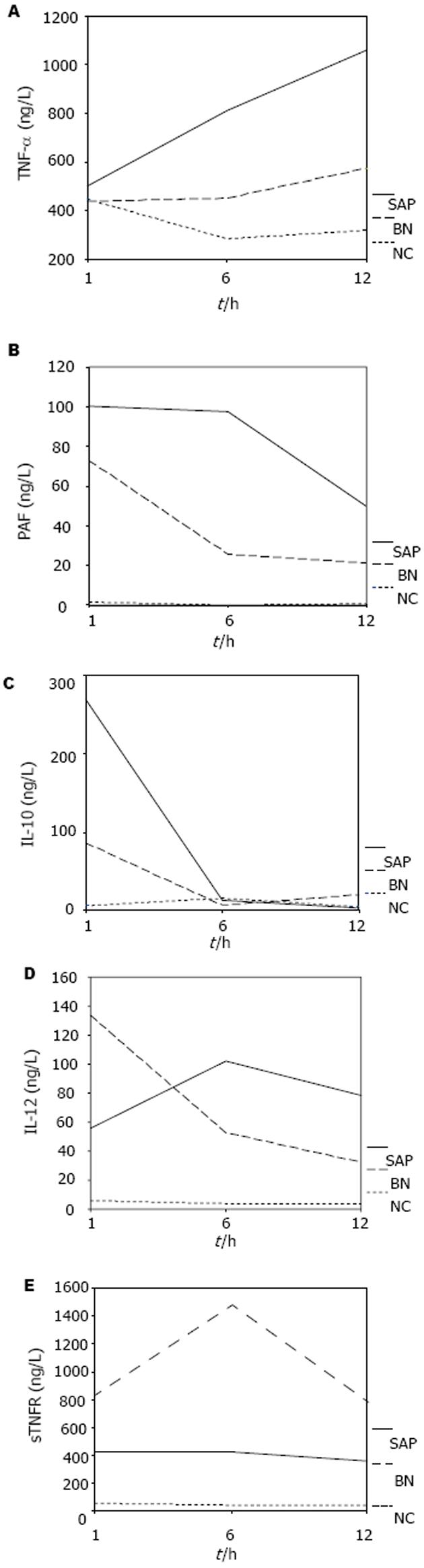
结果: SAP组, NC组和BN组大鼠血浆TNF-α和PAF水平相比, 具有显著性差异, SAP组(746.2±374.1, 82.5±35.4 ng/L)显著高于NC组(385.1±86.3, 1.1±1.9 ng/L), BN组(503.7±177.9, 39.9±29.9 ng/L)显著低于SAP组(P<0.05). 血浆sTNFR水平三组相比存在明显差异, SAP组(488.7±363.8 ng/L)显著高于NC组(50.0±21.0 ng/L), BN组(883.4±552.5 ng/L)显著高于SAP组(488.7±363.8 ng/L)(P<0.05). 血浆IL-12三组相比存在明显差异, SAP组(97.1±55.9 ng/L)显著高于NC组(20.4±19.4 ng/L), BN组在1 h时相点(133.5±33.4 ng/L)显著高于SAP组(55.9±14.7 ng/L)(P<0.05). 血浆IL-10三组相比不存在明显差异(P>0.05).
结论: SAP大鼠促炎细胞因子和抗炎细胞因子均显著升高. BN52021能降低血浆促炎因子含量, 提高IL-12和细胞因子拮抗剂sTNFR含量.
引文著录: 邸瑶, 夏时海, 佟长青. 银杏苦内酯B对重症急性胰腺炎大鼠血浆细胞因子的影响. 世界华人消化杂志 2006; 14(22): 2169-2173
Revised: May 10, 2006
Accepted: May 11, 2006
Published online: August 8, 2006
AIM: To observe the level changes of tumor necrosis factor-alpha (TNF-α), platelet activating factor (PAF), interleukin-10 (IL-10), interleukin-12 (IL-12) and soluble TNF receptors (sTNFR) in rats with severe acute pancreatitis (SAP) and the influences of Ginkgolide B (BN52021) on the changes.
METHODS: Male Wistar rats were randomly divided into 3 groups: SAP model group (SAP, n = 15), BN52021 treatment group (BN, n = 15) and negative control group (NC, n = 15). SAP was induced by retrograde infusion of 50 g/L sodium taurocholate into the pancreatic duct of rats. Sham operation was performed in the rats of NC group, while the rats in SAP and NC groups received the femoral vein injection of normal saline (5 mL/kg) 15 min after induction of SAP. Moreover, the rats in BN group received BN52021 injection instead of normal saline. After operation, the animals were sacrificed at 1st, 6th and 12th h for plasma cytokines detection with enzyme-linked immunosorbent assay (ELISA).
RESULTS: The levels of plasma TNF-α and PAF were significantly higher in SAP group than those in NC group (746.2 ± 374.1 ng/L vs 385.1 ± 86.3 ng/L, P<0.05; 82.5 ± 35.4 ng/L vs 1.1 ± 1.9 ng/L, P<0.05), but they were significantly decreased in BN group (503.7 ± 177.9, 39.9 ± 29.9 ng/L)(both P<0.05). The levels of plasma sTNFR were 50.0 ± 21.0, 488.7 ± 363.8, and 883.4 ± 552.5 ng/L in NC, SAP and BN group, respectively, and there were significant differences among them (P<0.05). Plasma IL-12 level was markedly increased in SAP group as compared with that in NC group (97.1 ± 55.9 ng/L vs 20.4 ± 19.4 ng/L, P<0.05), while it was further increased at the 1st h in BN group as compared with that in SAP group (133.5 ± 33.4 ng/L vs 55.9 ± 14.7 ng/L, P<0.05). The level of IL-10 was not significant different among the three groups (P > 0.05).
CONCLUSION: The plasma levels of pro- and anti-cytokines are increased in SAP rats, and BN52021 can inhibit the production of pro-cytokines and promote the secretion of anti-cytokines such as IL-12 and sTNFR to some extent.
- Citation: Di Y, Xia SH, Tong CQ. Effect of Ginkgolide B on plasma levels of cytokines in severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2169-2173
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2169.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2169
急性胰腺炎(acute pancreatitis, AP)为胰酶消化自身胰腺及其周围组织所引起的化学性炎症. 重症急性胰腺炎(severe acute pancreatitis, SAP)占AP病例的10%-15%, 病因复杂, 病情危重, 并发症多, 预后不良. 大量实验证明, 细胞因子是SAP局部和全身炎症反应中的关键因素, 是导致胰腺持续性坏死的一大重要机制. 细胞因子与炎性介质, 血管活性物质形成恶性循环, 产生一系列连锁反应和放大效应, 加剧对全身细胞的损伤, 导致全身炎症反应综合症(systemic inflammatory response syndrome, SIRS), 进一步发展成多器官功能障碍综合症(multiple organ dysfunction syndrome, MODS), 多器官衰竭(multiple organ failure, MOF), 甚至死亡. 银杏苦内酯B(Ginkgolide B, 代号BN52021)为银杏叶提取物中重要的有效成分之一, 具有抗炎、抗休克、抗血栓形成等多种药理作用. BN52021在治疗AP的实验中也表现出显著疗效, 但其作用机制尚缺乏深入研究. 本实验旨在通过制备SAP大鼠模型, 以BN52021进行治疗, 观察大鼠血浆中肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α), 血小板活化因子(platelet activating factor, PAF), 白介素-10(interleukin-10, IL-10), 白介素12(interleukin-12, IL-12), 可溶性肿瘤坏死因子受体(soluble TNF receptors, sTNFR)的表达水平变化, 从炎症介质水平探讨BN52021对SAP的治疗作用.
♂Wistar大鼠45只, 质量200±10 g, 购自解放军军事医学科学院实验动物中心. 随机分为SAP模型组(SAP, n = 15), BN52021治疗组(BN, n = 15)和阴性对照组(NC, n = 15)共三组. 动物模型的制作参照Aho et al[1]方法制作, Wistar大鼠称质量, 标记, 术前24 h禁食, 自由饮水. 4 g/L戊巴比妥钠(40 mg/kg)腹腔注射麻醉, 仰卧位固定后, 备皮, 消毒, 铺无菌巾, 于上腹正中做2 cm切口进入腹腔, 找到大鼠的十二指肠和胆胰管后, 用无创血管夹夹住胆胰管肝端, 用钝头针头经十二指肠浆肌层行胆胰管逆行穿刺术, 穿刺成功后, 微量注射器逆行胰胆管内注射50 g/L牛磺胆酸钠(0.1 mL/100 g), 推注速度0.20 mL/min. 推药后用无创血管夹夹住胰胆管入十二指肠处, 观察10 min, 去除血管夹, 确认腹腔内无活动性出血后, 两层关腹并用无菌纱布覆盖伤口, NC组开腹后仅翻动十二指肠并触摸胰腺数次关腹. 术后15 min NC组和SAP组股静脉注射生理盐水(5 mL/g); BN组股静脉注射BN52021(5 mg/kg).
SAP, BN, NC三组每组内分别随机分为1 h, 6 h, 12 h各小组, 每小组5只大鼠, 并分别于实验结束后1 h, 6 h, 12 h经右心房直接穿刺取血, 收集血浆, 并贮存于-20℃冰箱内待测. 全自动生化仪检测血浆淀粉酶(试剂盒购自北京科美东雅生物技术有限公司). 用ELISA方法对大鼠进行血浆TNF-α, PAF, IL-10, IL-12, sTNFR测定(操作按试剂盒说明进行, 试剂盒产自美国Rapid Bio Lab公司). 采用双抗体夹心法测定, A值450 nm, 通过测定标准品绘制标准曲线, 以样品A值在标准曲线上查到样品对应浓度. 采血后处死大鼠, 取部分胰腺组织, 40 g/L中性缓冲甲醛固定, 石蜡包埋切片后HE染色制片, 观察胰腺组织病理学变化.
统计学处理 实验数据用mean±SD表示, 应用SPSS 11.5进行统计学分析, 采用Kolmogorov-Smirnov进行正态性检验, 采用单因素方差分析, 方差齐性检验, 用LSD检验进行组间两两比较, 以P<0.05作为显著性检验的界值.
SAP组大鼠胰腺腺泡片状出血, 坏死, 正常胰腺小叶消失, 结构破坏, 可见散在的空泡变性的腺泡细胞, 部分泡核溶解消失, 间质血管扩张充盈, 坏死胰腺组织周围可见大量中性白细胞浸润; 而BN组较SAP组的组织结构破坏明显减轻, NC组胰腺腺泡结构大致正常(表1, 2).
大鼠血浆TNF-α和PAF水平在三组之间存在显著性差异, SAP组显著高于NC组, BN组显著低于SAP组(P<0.05). 血浆sTNFR水平三组相比存在明显差异, SAP组显著高于NC组, BN组显著高于SAP组(P<0.05). 血浆IL-12三组相比存在明显差异, SAP组显著高于NC组, BN组在1 h时相点显著高于SAP组(P<0.05). 血浆IL-10三组相比不存在明显差异(P>0.05)(图1, 表3).
TNF-α是炎症反应的启动介质, 介导胰腺局部和全身炎症反应. 其作用机制主要有[1-5]: 参与IL-1β, IL-6的生成, 促进TNF-α自身生成; 增加毛细血管通透性, 导致局部缺血, 形成血栓, 损伤微循环; 激活炎症细胞, 上调黏附分子表达, 增强NO及氧自由基生成; 使白细胞趋化, 黏附, 脱颗粒, 释放溶酶体; 诱使腺泡细胞凋亡, 胰腺组织坏死等. Liu et al[6]通过PCR实验, 认为SAP动物胰腺组织中的TNF-α水平在1 h已有显著升高, 7 h达到顶峰. 本实验数据表明, SAP组各时相血浆TNF-α水平较NC组均明显升高, 说明在SAP发病早期TNF-α水平已有明显增加; BN 组与SAP组比较, 显著降低, 说明BN52021对SAP大鼠具有治疗作用, 这与Valone et al[7]研究结果较为一致; 而BN组与NC组比较, 不具有显著性差异, 说明BN52021对SAP大鼠具有明显的治疗效果, 使其血浆TNF-α水平明显下降, 接近NC组水平. PAF在AP的局部和全身的炎症反应中被称为关键性炎症介质[8], 其参与AP炎症反应的作用可能在于[9]: (1)通过胆碱能作用影响胰腺外分泌, 参与胰酶自身消化; (2)上调内皮细胞黏附分子表达, 促进中性粒细胞聚集及炎性介质释放; (3)增加肠上皮细胞通透性, 破坏肠道屏障功能, 造成多器官功能障碍; (4)引起心输出量降低, 胰腺血流减少, 胰腺组织破坏. 在胰腺炎早期(24 h内), 胰腺组织内检测不出PAF, 在7-14 d时, 胰腺组织内PAF含量则是正常对照组的12倍之高[10]. 本实验发现, NC组难检测到PAF的存在, 含量接近于0, 而在SAP早
期(1 h), 即可见到PAF的显著升高, SAP组PAF含量显著高于N C组, 说明S A P的发病确实导致机体释放PAF的量显著增加; BN组显著低于 SAP组, BN52021对PAF的拮抗作用在6, 12 h时 相点表现的尤为显著, 不仅使BN组血浆PAF含量快速下降, 同时也使BN组血浆PAF含量接近 NC组水平.
IL-10是抗炎细胞因子中很重要的一员, 他是主要由Th2细胞产生一种单键糖蛋白, 主要作用在于[11-12]: (1)能抑制单核细胞合成和表达TNF-α, IL1-β, IL-6, IL-8等, 减轻炎症; (2)抑制 Th1细胞产生干扰素, 抑制免疫反应; (3)作为旁分泌或自分泌介质发挥作用; (4)减轻动物模型AP严重程度. Shi et al[13]对早期SAP大鼠的 IL-10水平进行了检测, 发现IL-10在3 h和6 h时 相点均显著升高. 夏时海 et al[14]研究结果提示,急性胰腺炎患者发病后1 d, IL-10升高, 随后呈进行性下降. 本实验在1 h时相点, SAP组血浆 IL-10水平显著高于NC组, 这与Machado et al[15]的实验结果十分相似; BN组血浆IL-10水平显著低于SAP组, 提示BN52021在SAP发病早期可促使机体减少抗炎因子IL-10过度释放. 随时间变化, 存在于3组间的差异逐渐消失, P>0.05.
IL-12又名NK细胞刺激因子, 主要作用有[16-17]: (1)诱导T细胞增殖, 增加CD56+NK细胞活性, 诱导NK细胞增殖; (2)直接促进骨髓干细胞增殖和形成集落; (3)抗细胞生成作用, 阻止肿瘤和其他恶性病变中的血管形成. 2003年, Uehara et al[18]对AP患者血浆进行ELISA测定, 发现AP早期IL-12明显上升, SAP患者血浆IL-12水平比MAP患者上升得更为明显. Pezzilli et al[19] 发现AP患者发病1-6 d内, 血清IL-12等细胞因子显著高于正常组. 在本实验中, SAP组患者 血浆I L-12水平较对照组明显上升, P<0.005, 这与Uehara et al的实验结果一致. IL-12是一种具有抗炎作用的细胞因子, 其水平的升高对于SAP的预后可能具有积极意义. 我们发现SAP组IL-12水平在6, 12 h时相点显著高于NC组, 峰值出现在6 h; 1 h时相点BN组血浆IL-12水平显著高于SAP组, 说明在SAP发病早期应用BN52021进行治疗, 可以有效提高抗炎因子IL-12的含量, 有助于阻止SAP病程的进展. sTNFR是TNF的拮抗剂. 其作用是双方面的: (1) 对局部产生的TNF起到结合和灭活作用, 减少发挥作用的TNF的数量; (2)作为TNF的储库, 维持低水平TNF的生物学活性, 延长其效应[20]. 目前sTNFR在胰腺炎中的作用逐渐成为研究的焦点. Kaufmann et al[21]的实验证实sTNFR与MOF的发生率、死亡率正相关(r = 0.81), sTNFR与胰腺坏死的关系提示sTNFR能反映炎症组织损坏导致严重全身合并症的发生. 长期以来, TNF都作为AP的有力的生化指标, 但在发病早期TNF的值很难测到, sTNFR容易检测, 是反应TNF-α的良好指标[22]. de Beaux et al[22]发现, MAP患者在发病的1-2 d血清sTNFR水平明显升高, 本实验发现1 h时相点SAP组大鼠血浆sTNFR水平显著高于NC组. 说明血浆sTNFR水平确实能替代TNF-α, 作为SAP发病的一项生化指标. 在SAP, BN, NC各组之间, 血浆sTNFR水平存在明显差异, BN52021对大鼠血浆sTNFR含量具有明显的提升作用, 利于抗炎作用的发挥.
现代医学认为, 解决SAP的关键是调节炎症反应平衡. 在适当时效内抑制炎性细胞因子的过度释放; 同时保存细胞免疫力, 不至引起免疫抑制. 使用特异性细胞因子拮抗剂, 血液净化清除过多细胞因子都是基于该指导思想的研究和探索. 细胞因子的可溶性受体, 受体拮抗剂能有效降低某种细胞因子的水平, 减轻胰腺损伤, 但只能针对某一种细胞因子起作用, 疗效并不确切. 全身炎症反应过程复杂, 是数量巨大种类繁多的细胞因子共同作用的结果. 抗炎治疗亦应联合应用多种细胞因子拮抗剂和调节剂进行综合调节, 我们发现BN52021既能有效降低促炎因子TNF-α, PAF的含量, 又能提高具有抗炎作用的IL-10, IL-12, sTNFR的含量, 从而抑制炎症反应的过度发生, 可望对SAP有较好的治疗效果, 为从阻止全身炎症反应方面治疗SAP带来了希望.
银杏苦内酯B对急性胰腺炎具有显著疗效, 但其作用机制尚缺乏深入研究. 细胞因子是SAP局部和全身炎症反应中的关键因素, 是导致胰腺持续性坏死的重要机制. 对于SAP发病机制的研究是目前胰腺研究的热点.
本文为中药单体BN52021治疗SAP提供了重要的实验依据, 为我国国宝中药的开发做出了一定工作.
本文主要通过ELISA技术检测SAP大鼠血浆细胞因子TNF-α, PAF, IL-10, IL-12, sTNFR含量的动态变化, 并分析了BN52021对SAP的影响作用, 结果显示BN52021能降低血浆促炎因子含量, 在SAP早期降低抗炎因子IL-10含量, 提高IL-12和细胞因子拮抗剂sTNFR含量. 文章选题合适, 结果明确, 有一定的科学性、新颖性.
电编: 李琪 编辑:潘伯荣
| 1. | AhoHJ , KoskensaloSM , NevalainenTJ . Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] [DOI] |
| 3. | Masamune A, Shimosegawa T. Anti-cytokine therapy for severe acute pancreatitis. Nippon Rinsho. 2004;62:2116-2121. [PubMed] |
| 4. | Gomez-Cambronero LG, Sabater L, Pereda J, Cassinello N, Camps B, Vina J, Sastre J. Role of cytokines and oxidative stress in the pathophysiology of acute pancreatitis: therapeutical implications. Curr Drug Targets Inflamm Allergy. 2002;1:393-403. [PubMed] [DOI] |
| 5. | Bhatia M. Inflammatory response on the pancreatic acinar cell injury. Scand J Surg. 2005;94:97-102. [PubMed] |
| 6. | Liu XM, Xu J, Wang ZF. Pathogenesis of acute lung injury in rats with severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2005;4:614-617. [PubMed] |
| 7. | Valone FH, Ruis NM. Stimulation of tumour necrosis factor release by cytotoxic analogues of platelet-activating factor. Immunology. 1992;76:24-29. [PubMed] |
| 9. | 姚 新生, 孙 万邦. 血小板活化因子的生理、病理作用及机制. 国外医学•生理、病理科学与临床分册. 2002;22:374-376. |
| 10. | Zhou WG, Chao W, Levine BA, Olson MS. Evidence for platelet-activating factor as a late-phase mediator of chronic pancreatitis in the rat. Am J Pathol. 1990;137:1501-1508. [PubMed] |
| 11. | Zhou X, Schmidtke P, Zepp F, Meyer CU. Boosting interleukin-10 production: therapeutic effects and mechanisms. Curr Drug Targets Immune Endocr Metabol Disord. 2005;5:465-475. [PubMed] [DOI] |
| 12. | Grutz G. New insights into the molecular mechanism of interleukin-10-mediated immunosuppression. J Leukoc Biol. 2005;77:3-15. [PubMed] |
| 13. | Shi C, Andersson R, Zhao X, Wang X. Potential role of reactive oxygen species in pancreatitis-associated multiple organ dysfunction. Pancreatology. 2005;5:492-500. [PubMed] [DOI] |
| 15. | Machado MC, Coelho AM, Pontieri V, Sampietre SN, Molan NA, Soriano F, Matheus AS, Patzina RA, Cunha JE, Velasco IT. Local and systemic effects of hypertonic solution (NaCl 7.5%) in experimental acute pancreatitis. Pancreas. 2006;32:80-86. [PubMed] [DOI] |
| 16. | Ma X, Trinchieri G. Regulation of interleukin-12 production in antigen-presenting cells. Adv Immunol. 2001;79:55-92. [PubMed] [DOI] |
| 18. | Uehara S, Gothoh K, Handa H, Tomita H, Tomita Y. Immune function in patients with acute pancreatitis. J Gastroenterol Hepatol. 2003;18:363-370. [DOI] |
| 19. | Pezzilli R, Miniero R, Cappelletti O, Barakat B. Behavior of serum interleukin 12 in human acute pancreatitis. Pancreas. 1999;18:247-251. [PubMed] [DOI] |
| 20. | Aggarwal BB, Eessalu TE, Hass PE. Characterization of receptors for human tumour necrosis factor and their regulation by gamma-interferon. Nature. 1985;318:665-667. [PubMed] [DOI] |
| 21. | Kaufmann P, Tilz GP, Lueger A, Demel U. Elevated plasma levels of soluble tumor necrosis factor receptor (sTNFRp60) reflect severity of acute pancreatitis. Intensive Care Med. 1997;23:841-848. [PubMed] [DOI] |