修回日期: 2006-06-20
接受日期: 2006-06-27
在线出版日期: 2006-07-28
目的: 探讨DNA错配修复基因hMLH1在胃癌和癌前病变中的表达及临床意义.
方法: 应用免疫组织化学技术PV-6000二步法检测20例慢性浅表性胃炎、20例慢性萎缩性胃炎伴肠化生、8例胃腺瘤性息肉、58例胃癌患者癌组织及其癌旁组织的hMLH1基因蛋白表达.
结果: hMLH1基因蛋白主要表达于黏膜上皮的细胞质内, 少量表达于细胞核. 在慢性浅表性胃炎上皮细胞和慢性萎缩性胃炎伴肠化生的阳性表达率(均为90%)明显高于胃腺瘤性息肉及胃癌旁组织上皮细胞的阳性表达率(分别为62.5%和62.1%), 差别有统计学意义(χ2 = 9.741, P = 0.02). hMLH1基因蛋白在胃癌细胞的表达率为72.41%, 与前四者之间差别无统计学意义. 在58例癌旁组织中, 21例(36.2%)为慢性浅表性胃炎, 37例(63.8%)为慢性萎缩性胃炎伴肠化生, 二者hMLH1蛋白阳性表达率相近, 但明显低于非胃癌患者慢性浅表性胃炎和慢性萎缩性胃炎伴肠化生的阳性表达率, 差别具有统计学意义(χ2 = 9.885, P = 0.02).
结论: hMLH1表达缺失可能是胃癌的早期分子事件, 对hMLH1蛋白表达缺失的慢性胃炎患者进行随访、监测, 可能有利于胃癌的早期诊断.
引文著录: 肖桂珍, 刘希双. 胃癌和癌前病变中错配修复基因hMLH1的表达及意义. 世界华人消化杂志 2006; 14(21): 2093-2097
Revised: June 20, 2006
Accepted: June 27, 2006
Published online: July 28, 2006
AIM: To investigate the expression of DNA mismatch repair gene hMLH1 and its clinical significances in gastric cancer and premalignant lesions.
METHODS: Immunohistochemical technique was used to detect the expression of hMLH1 protein in 20 cases of chronic superficial gastritis, 20 cases of chronic atrophic gastritis complicated with intestinal metaplasia, 8 cases of adenomatous polyp, 58 cases of gastric cancer and the corresponding cancer-adjacent mucosa.
RESULTS: The hMLH1 protein was expressed mostly in epithelial cytoplasm and a little in cell nucleus. The positive rate of hMLH1 expression in chronic superficial gastritis and chronic atrophic gastritis with intestinal metaplasia were all 90%, which were significantly higher (χ2 = 9.741, P = 0.02) than those in adenomatous polyp (62.5%) and the corresponding cancer-adjacent mucosa (62.1%). The positive rate of hMLH1 expression was not significantly different between gastric cancer (72.4%) and the others (P > 0.05). Of 58 cases of cancer-adjacent mucosa, 21 (36.2%) were with chronic superficial gastritis, and 37 (63.8%) with chronic atrophic gastritis and intestinal metaplasia. The positive rates of hMLH1 expression were similar between the 21 and 37 cases, but they were both markedly lower than those in the nonneoplastic mucosa (χ2 = 9.885, P = 0.02).
CONCLUSION: Absence of hMLH1 expression may be one of the early molecular events in the carcinogenesis of gastric cancer. Timely visiting and monitoring chronic gastric patients with absence of hMLH1 protein expression may help to achieve early diagnosis of gastric cancer.
- Citation: Xiao GZ, Liu XS. Expression of DNA mismatch repair gene hMLH1 and its significance in gastric cancer and premalignant lesions. Shijie Huaren Xiaohua Zazhi 2006; 14(21): 2093-2097
- URL: https://www.wjgnet.com/1009-3079/full/v14/i21/2093.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i21.2093
胃癌是消化道最常见的恶性肿瘤之一, 其发病率及死亡率居消化道恶性肿瘤之首, 他的发生、发展涉及多基因和多步骤的过程. 错配修复(MMR)基因是由一系列错配修复碱基的酶分子(包括hMLH1)组成, 他的缺陷导致基因组不稳定性、出现微卫星不稳定(microsatellite instable, MSI)、对肿瘤易感. 我们应用免疫组织化学技术, 检测错配修复基因hMLH1蛋白在慢性浅表性胃炎、慢性萎缩性胃炎伴肠化生、腺瘤性息肉、癌旁组织以及癌组织的表达情况, 以探讨其表达与胃癌的关系和意义.
2005-01/2005-08外科手术切除的胃癌58例, 男35例, 女23例, 年龄35-80(中位62)岁, 术前未经放化疗. 另胃镜活检慢性浅表性胃炎20例, 男9例, 女11例, 年龄14-65(中位40)岁; 慢性萎缩性胃炎伴肠化生20例, 男7例, 女13例, 年龄34-75(中位50)岁; 胃腺瘤性息肉8例, 男5例, 女3例, 年龄46-79(中位60)岁. 全部病例均经病理证实, 无癌症病史, 无肿瘤家族史. 标本经40 g/L中性甲醛固定, 常规石蜡包埋. hMLH1多克隆兔抗体购自Santa Cruz公司, PV-6000试剂盒购自北京中杉金桥生物技术有限公司, 为Zymed公司推出的二步法免疫组化检测试剂.
采用免疫组化PV-6000两步法. 对石蜡包埋的标本连续切为3-4 µm厚的薄片, 展平黏于挂胶的载玻片上, 置烤片箱内60℃烤6 h; 二甲苯脱蜡, 梯度乙醇水化; 30 mL/L的过氧化氢孵育10 min; 微波抗原修复(修复液为pH 6.0 的EDTA) 10 min; 滴加一抗hMLH1(工作浓度为1∶50), 37℃温箱孵育60 min, PBS冲洗; 加入二抗, 温箱孵育20 min; DAB显色, 苏木素复染, 中性树胶封片. 取已知阳性组织作阳性对照, PBS取代一抗作阴性对照. 所有切片均由两位资深病理学专家阅片. 每张切片计数5个高倍视野, 每个视野取100个细胞, 阳性表达以黏膜上皮细胞质或核出现棕黄色颗粒为准. 根据Friedrichs et al[1]判定结果: 不着色为0分, 浅黄色为1分, 棕黄色为2分, 棕褐色为3分; 着色细胞占计数细胞百分率≤5%为0分, 6%-20%为1分, 21%-50%为2分, ≥51%为3分; 染色程度与染色细胞百分率得分乘积为最后得分: 0-1分为阴性病例, 2分以上为阳性病例.
统计学处理 采用χ2检验, 应用统计软件SPSS l1.5进行统计学分析.
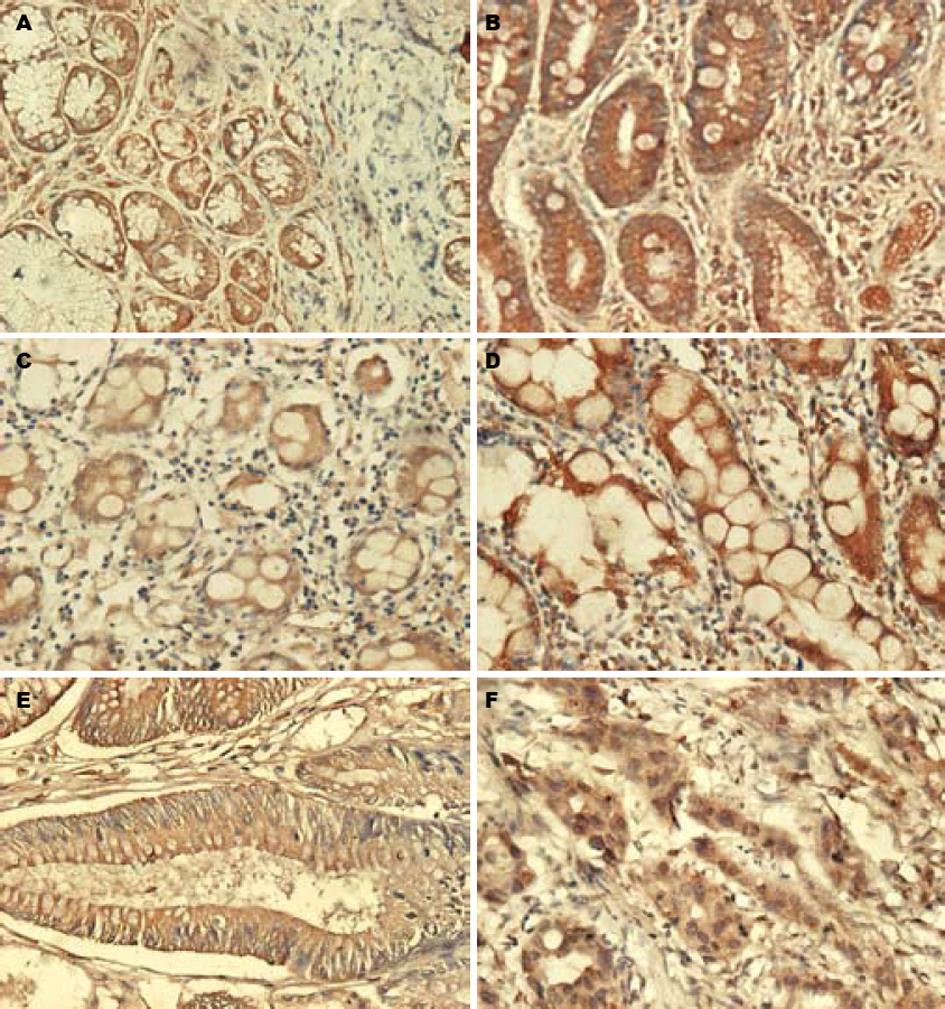
hMLH1蛋白的阳性表达表现为黏膜上皮细胞质出现棕黄色颗粒, 少量细胞核出现棕黄色颗粒(图1). hMLH1蛋白在慢性浅表性胃炎和慢性萎缩性胃炎伴肠化生黏膜上皮细胞阳性表达率明显高于腺瘤性息肉和癌旁黏膜上皮细胞, 差异有显著性(χ2 = 9.741, P = 0.02<0.05, 表1); hMLH1蛋白在癌细胞阳性表达率低于慢性浅表性胃炎和慢性萎缩性胃炎伴肠化生, 而高于腺瘤性息肉和癌旁黏膜上皮细胞, 但两两比较差异无显著性; 腺瘤性息肉和癌旁黏膜上皮细胞比较差异亦无显著性.
在58例癌旁组织中, 21例(36.2%)为慢性浅表性胃炎, 37例(63.8%)为慢性萎缩性胃炎伴肠化生, 二者hMLH1蛋白阳性表达率相近, 但明显低于非肿瘤患者慢性浅表性胃炎和慢性萎缩性胃炎伴肠化生的阳性表达率, 差别具有统计学意义(χ2 = 9.885, P = 0.02<0.05, 表1). 而癌旁组织的慢性浅表性胃炎阳性表达率和慢性萎缩性胃炎伴肠化生的hMLH1蛋白阳性表达率相近, 差异无显著性.
MMR是生物进化过程中的保守基因, 具有修复DNA碱基错配、增强DNA复制忠实性、维持基因组稳定性和降低自发性突变的功能[2-3]. 目前已发现人类9个MMR, 其中hMSH2, hMSH6, hMSH5, hMSH4和hMSH3为细菌MutS同源物; hMLH1, hPMS1, hPMS2和hMLH3为细菌MutL同源物. hMLH1是1994年克隆到的第2个与HNPCC发病有关的MMR, 大约30%的遗传性非息肉病性结肠癌(HNPCC)与hMLH1发病有关. hMLH1位于3p21.3-23, 其基因组DNA全长约58 kb(不包括启动子), 含19个外显子, cDNA有2268 bp的开放阅读框架, 编码蛋白质756个氨基酸, 其编码的蛋白产物与PMS2/PMS1结合形成异源二聚体, 识别错配位点, 参与错配修复[4]. 研究显示, hMLH1基因功能丧失与基因突变及启动子甲基化有关[5-6]. 基因突变多位于基因的后半部分, 其中15和16号外显子为突变发生的热点, 约占突变的半数. 突变形式多为移码突变以及错义突变, 产生截短性蛋白或启动子甲基化导致基因转录与翻译的沉默使蛋白表达缺失, 不能与PMS2/PMS1形成复合物, 也就无法帮助MutS识别错配位点, 从而不能启动修复. 错配的DNA不能修复, 突变基因进一步积累, 引起基因组的不稳定, 导致肿瘤的发生[7]. 目前研究认为, hMLH1基因蛋白表达缺失不仅与遗传性肿瘤的发生有关, 也参与散发性肿瘤的发生[8]. 研究表明, hMLH1表达缺失使错配修复的功能丧失导致肿瘤的发生的机制可能为: (1)不能修复DNA复制中的错误[9]; (2)增加癌基因或抑癌基因(如Bax, crbB-2, p53和TGF-β等)的突变频率[10]; (3)引起基因组不稳定, 即出现DNA MSI现象[11]. MMR缺陷胃癌组织中MSI的发生率为13%-59%[12], 有的甚至报道发生率高达64%, 一般为26.7%; 胃肠化生组织为9.3%, 说明从肠化生到癌的演进是基因不稳定的积累过程, 且MSI发生的频率在由癌前病变向癌转化的过程中逐渐增高, 提示错配修复和MSI参与胃癌的多步骤发生过程[13].
胃癌的发生是一个漫长过程, 一般认为胃癌的发生过程是从正常胃黏膜上皮细胞经内外环境因素作用发生慢性胃炎到胃癌前病变, 包括腺瘤、肠化生和不典型增生, 经过一系列基因突变的积累最终导致胃癌的发生[14]. 癌旁黏膜上皮与癌细胞处于同一机体, 有着同样的遗传背景, 受到同样的环境刺激, 有着同样基因突变的积累, 可被看作肿瘤易发组织. 本研究显示, 21例(36.2%)癌旁组织为慢性浅表性胃炎, 其hMLH1的阳性表达率(57.1%)明显低于非胃癌患者的慢性浅表性胃炎; 37例(63.8%)癌旁组织为慢性萎缩性胃炎伴肠化生, 其hMLH1的阳性表达率(64.9%)明显低于非胃癌患者的萎缩性胃炎伴肠化生, 差别具有统计学意义; 而癌旁组织的慢性浅表性胃炎阳性表达率和慢性萎缩性胃炎伴肠化生的hMLH1蛋白阳性表达率相近, 差异无显著性. 说明慢性萎缩性胃炎伴肠化生比慢性浅表性胃炎易发生癌变. 因而, 已将慢性萎缩性胃炎列为癌前疾病, 将肠化生列为癌前病变[15]. 但癌旁黏膜上皮无论是浅表性胃炎还是萎缩性胃炎伴肠化生, hMLH1的表达明显降低, 这可能是其易发生癌变的基础; 也提示慢性胃炎上皮细胞hMLH1表达缺失的非胃癌患者的胃癌发生率可能高于hMLH1表达正常者, 但这一结论尚需进一步的前瞻性研究.
hMLH1蛋白表达缺失促使多种肿瘤的发生[16-17]. Chaves et al[18]发现, 76例散发性结直肠癌和癌旁组织hMLH1阴性表达率分别是11.8% 和13.2%, 两者间hMLH1蛋白表达缺失无差异. Berends et al[19]研究子宫内膜增生和子宫内膜癌hMLH1表达, 9/38子宫内膜癌hMLH1蛋白缺失, 3/11子宫内膜增生hMLH1蛋白缺失, 8例正常子宫内膜hMLH1蛋白表达正常. 本研究结果显示, hMLH1蛋白在胃腺瘤性息肉及癌旁组织的表达相近, 明显低于慢性浅表性胃炎及慢性萎缩性胃炎伴肠化生的上皮细胞, 其结果与Semba et al[20]研究相吻合, 也与Kim et al[21]发现合并腺瘤的胃癌比单纯胃癌MSI的发生率高、由腺瘤发生胃癌常与MMR的缺陷有关的观点一致. hMLH1在癌细胞中的表达虽与慢性浅表性胃炎、慢性萎缩性胃炎伴肠化生、腺瘤性息肉及癌旁组织无明显差异, 但低于慢性胃炎而与腺瘤性息肉及癌旁组织接近, 提示hMLH1缺失可能是部分胃癌发生的早期分子事件. 本研究显示, 胃腺瘤性息肉或癌旁组织中hMLH1蛋白表达阳性率明显低于慢性胃炎, 提示hMLH1蛋白表达缺失发生在胃癌前病变, 可能是胃癌发生的早期分子事件, 与胃癌发生、发展密切相关. 对hMLH1蛋白表达缺失的慢性胃炎患者应进行随访、监测, 有利于胃癌的早期诊断和治疗, 以提高胃癌患者的生存率和生存质量.
hMLH1是一种错配修复基因, 其表达缺失与多种肿瘤的发生有关. 我们对hMLH1在胃黏膜相关疾病中表达进行研究, 初步探讨hMLH1表达与胃癌演进的关系, 为深入研究打下基础.
hMLH1有望成为胃癌检测的早期指标, hMLH1蛋白表达缺失的机制有待于进一步研究, 以便用于胃癌的预防.
胃慢性炎症、癌前病变与癌的演进过程中hMLH1的表达存在差异, hMLH1的表达缺失与胃癌的发生密切相关.
微卫星DNA: 是广泛分布于原核和真核生物基因组中简单的重复核苷酸序列, 长约1-6bp.
微卫星DNA不稳定性(MSI): 是指肿瘤组织与其相对应的正常组织相比其DNA等位基因结构发生简单重复序列的改变. 这种改变表现: 肿瘤组织与其相对应的组织的PCR产物, 经电泳后电泳条带出现增加、减少、条带位置发生改变以及条带密度改变.
本文选取慢性浅表性胃炎, 慢性萎缩性胃炎, 胃腺瘤性息肉, 癌旁组织及胃癌原发灶组织标本, 采用免疫组化方法检测hMLH1蛋白在上述组织中的表达, 结果有一定新意, 对理解胃癌与其癌前病变关系的分子机制有一定科学意义.
电编: 张敏 编辑:潘伯荣
| 1. | Friedrichs K, Gluba S, Eidtmann H, Jonat W. Overexpression of p53 and prognosis in breast cancer. Cancer. 1993;72:3641-3647. [PubMed] [DOI] |
| 2. | Jacob S, Praz F. DNA mismatch repair defects: role in colorectal carcinogenesis. Biochimie. 2002;84:27-47. [PubMed] [DOI] |
| 3. | Kulke MH, Thakore KS, Thomas G, Wang H, Loda M, Eng C, Odze RD. Microsatellite instability and hMLH1/hMSH2 expression in Barrett esophagus-associated adenocarcinoma. Cancer. 2001;91:1451-1457. [PubMed] [DOI] |
| 5. | Wijnen J, Khan PM, Vasen H, Menko F, van der Klift H, van den Broek M, van Leeuwen-Cornelisse I, Nagengast F, Meijers-Heijboer EJ, Lindhout D. Majority of hMLH1 mutations responsible for hereditary nonpolyposis colorectal cancer cluster at the exonic region 15-16. Am J Hum Genet. 1996;58:300-307. [PubMed] |
| 6. | Yao Y, Tao H, Kim JJ, Burkhead B, Carloni E, Gasbarrini A, Sepulveda AR. Alterations of DNA mismatch repair proteins and microsatellite instability levels in gastric cancer cell lines. Lab Invest. 2004;84:915-922. [PubMed] [DOI] |
| 7. | Yashiro M, Carethers JM, Laghi L, Saito K, Slezak P, Jaramillo E, Rubio C, Koizumi K, Hirakawa K, Boland CR. Genetic pathways in the evolution of morphologically distinct colorectal neoplasms. Cancer Res. 2001;61:2676-2683. [PubMed] |
| 8. | Deng G, Peng E, Gum J, Terdiman J, Sleisenger M, Kim YS. Methylation of hMLH1 promoter correlates with the gene silencing with a region-specific manner in colorectal cancer. Br J Cancer. 2002;86:574-579. [PubMed] [DOI] |
| 9. | Duval A, Hamelin R. Genetic instability in human mismatch repair deficient cancers. Ann Genet. 2002;45:71-75. [PubMed] [DOI] |
| 10. | Lu SL, Akiyama Y, Nagasaki H, Saitoh K, Yuasa Y. Mutations of the transforming growth factor-beta type II receptor gene and genomic instability in hereditary nonpolyposis colorectal cancer. Biochem Biophys Res Commun. 1995;216:452-457. [PubMed] [DOI] |
| 11. | Modrich P. Mismatch repair, genetic stability, and cancer. Science. 1994;266:1959-1960. [PubMed] [DOI] |
| 12. | Moskaluk CA, Rumpel CA. Allelic deletion in 11p15 is a common occurrence in esophageal and gastric adenocarcinoma. Cancer. 1998;83:232-239. [PubMed] [DOI] |
| 13. | Leung WK, Kim JJ, Kim JG, Graham DY, Sepulveda AR. Microsatellite instability in gastric intestinal metaplasia in patients with and without gastric cancer. Am J Pathol. 2000;156:537-543. [PubMed] [DOI] |
| 14. | Yokozaki H, Yasui W, Tahara E. Genetic and epigenetic changes in stomach cancer. Int Rev Cytol. 2001;204:49-95. [PubMed] [DOI] |
| 15. | Correa P. Chronic gastritis as a cancer precursor. Scand J Gastroenterol Suppl. 1984;104:131-136. [PubMed] |
| 16. | Ball CG, Dupre MP, Falck V, Hui S, Kirkpatrick AW, Gao ZH. Sessile serrated polyp mimicry in patients with solitary rectal ulcer syndrome: is there evidence of preneoplastic change? Arch Pathol Lab Med. 2005;129:1037-1040. [PubMed] |
| 17. | Handra-Luca A, Couvelard A, Degott C, Flejou JF. Correlation between patterns of DNA mismatch repair hmlh1 and hmsh2 protein expression and progression of dysplasia in intraductal papillary mucinous neoplasms of the pancreas. Virchows Arch. 2004;444:235-238. [PubMed] [DOI] |
| 18. | Chaves P, Cruz C, Lage P, Claro I, Cravo M, Leitao CN, Soares J. Immunohistochemical detection of mismatch repair gene proteins as a useful tool for the identification of colorectal carcinoma with the mutator phenotype. J Pathol. 2000;191:355-360. [PubMed] [DOI] |
| 19. | Berends MJ, Hollema H, Wu Y, van Der Sluis T, Mensink RG, ten Hoor KA, Sijmons RH, de Vries EG, Pras E, Mourits MJ. MLH1 and MSH2 protein expression as a pre-screening marker in hereditary and non-hereditary endometrial hyperplasia and cancer. Int J Cancer. 2001;92:398-403. [PubMed] [DOI] |
| 20. | Semba S, Yokozaki H, Yamamoto S, Yasui W, Tahara E. Microsatellite instability in precancerous lesions and adenocarcinomas of the stomach. Cancer. 1996;77:1620-1627. [PubMed] [DOI] |
| 21. | Kim HS, Woo DK, Bae SI, Kim YI, Kim WH. Microsatellite instability in the adenoma-carcinoma sequence of the stomach. Lab Invest. 2000;80:57-64. [PubMed] [DOI] |