修回日期: 2006-05-20
接受日期: 2006-05-22
在线出版日期: 2006-07-28
目的: 以2, 4-二硝基氯苯(DNCB)致大鼠结肠炎, 探索免疫因素的作用以及结肠炎与肠神经系统的关系.
方法: 给♂SD大鼠以DNCB涂腹致敏, 然后以DNCB灌肠或脊髓珠网膜下腔注射(ith)激发过敏. DNCB灌肠或ith注射后, 根据每日记录的动物体质量和大便性状做疾病活动指数(DAI)评分; d 10-15处死动物后, 做结肠大体评分、结肠HE染色的镜下评分以及肠壁组织白细胞移动抑制因子(LMIF)的免疫荧光测定.
结果: 4 g/L和8 g/L DNCB灌肠组大鼠的结肠大体和镜下评分明显高于600 mL/L乙醇灌肠组(大体评分: 2.200±0.416, 3.857±0.143 vs 0.143±0.143, P<0.05; 镜下评分: 2.000±0.471, 3.714±0.184 vs 0.429±0.297, P<0.05), 其肠壁组织中LMIF的荧光染色也明显强于乙醇组. ith DNCB 8和16 g/L组大鼠的DAI评分明显高于ith 600 mL/L乙醇组(P<0.05和0.01), ith 4, 8和16 g/L DNCB大鼠的结肠组织镜下表现为黏膜层水肿、大量炎性细胞浸润、黏膜糜烂坏死和溃疡形成.
结论: DNCB灌肠或ith注射可使致敏大鼠出现结肠炎, 肠神经系统和神经免疫介导物LMIF在DNCB所致实验性结肠炎中起重要作用.
引文著录: 吴星宇, 潘慧, 黄鹏, 吴彬, 蒋惠君, 梅林. 二硝基氯苯引起大鼠结肠炎与神经源性肠炎的关系. 世界华人消化杂志 2006; 14(21): 2067-2072
Revised: May 20, 2006
Accepted: May 22, 2006
Published online: July 28, 2006
AIM: To explore the immune mechanism of ulcerative colitis as well as the relationship between ulcerative colitis and enteric nervous system.
METHODS: Male Sprague Dawley rats were divided into 2, 4-dinitrochlorobenzene (DNCB) groups and ethanol (control) group. After sensitized by DNCB smeared on the abdominal skin, the rats were challenged with DNCB by enema or intrathecal injection. The weight, stool viscosity and hematochezia were observed and accumulated as the disease active index (DAI) score; the colon pathological score was achieved by macropathology and HE staining of section prepared for microscopy; and the activity of leukocyte migration inhibitory factor (LMIF) was determined by immunofluorescence staining in colon tissues.
RESULTS: In the rats treated with 4 and 8 g/L DNCB enema, the macropathological and microscopic scores were significantly higher than those in the controls (macropathological: 2.200 ± 0.416, 3.857 ± 0.143 vs 0.143 ± 0.143, P < 0.05; microscopic: 2.000 ± 0.471, 3.714 ± 0.184 vs 0.429 ± 0.297, P < 0.05). The colon tissue showed higher fluorescence intensity of LMIF in the rats treated with DNCB enema than that in the controls. In the rats intrathecally injected with 8 and 16 g/L DNCB, the DAI scores were significantly higher than those in the control rats (P < 0.05 and P <0.01). Colon HE staining showed mucosal edema in the rats intrathecally injected 4 g/L DNCB, infiltration of numerous inflammatory cells in those with 8 g/L DNCB, and mucosal erosion, necrosis, and ulceration in those with 16 g/L DNCB.
CONCLUSION: Colitis can be induced by DNCB enema or intrathecal injection in sensitized rat, which reflects a delayed type of hypersensitivity (DTH). The enteric nervous system and neuroimmune mediator LMIF play important roles in the DNCB-induced colitis.
- Citation: Wu XY, Pan H, Huang P, Wu B, Jiang HJ, Mei L. Dinitrochlorobenzene-induced colitis and its correlations with neurogenic inflammation of gut in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(21): 2067-2072
- URL: https://www.wjgnet.com/1009-3079/full/v14/i21/2067.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i21.2067
溃疡性结肠炎(ulcerative colitis, UC)使用多种治疗手段都不能取得根治效果[1-3]. 1999年Barbara et al[4]提出, UC很可能是神经源性炎症的表现形式之一, 即肠的神经源性炎症, 其根据主要来自Kemler et al[5]的临床报道以及此临床报道之前的一些实验室资料[6-8]. Barbara的观点很快得到Peck et al[9]的又一项临床观察的支持. 这种观点的出现给人们认识UC的病因提供了新的思路. 利用动物研究UC时, 由致敏原2, 4-二硝基氯苯(DNCB)建立的具有DTH (delayed-type hypersensitivity)反应特征[10]的实验性结肠炎模型, 在其发病机制和病理学改变上被认为与人的UC有许多相似之处[11], 并且较早在豚鼠和家兔[10-11], 后来又在大鼠和小鼠[12-14]被研究和报道. 我们在DNCB致小鼠结肠炎[13-14]的基础上, 用DNCB灌肠大鼠模型探讨作为神经免疫介导物和DTH反应特异指标[15-16]的白细胞移动抑制因子(LMIF)是否在炎性结肠的组织中活性增加; 然后用DNCB中枢注射的大鼠模型, 探讨脊髓神经元直接受到免疫炎症刺激后, 其末梢支配的靶器官(胃肠道)是否发生炎症改变. 进一步探索免疫因素在UC中的作用及其与肠神经系统的关系, 从而为Barbara和Peck关于"神经源性肠炎"的观点提供直接证据.
健康♂SD大鼠由北京大学医学部实验动物科学部提供, 体质量180-210 g. DNCB购于北京化学试剂公司, 兔抗大鼠LMIF多克隆抗体购于Santa Cruz公司, 荧光素TRITC(罗丹明)标记的山羊抗兔IgG、山羊血清工作液和EDTA均购于北京中杉金桥生物技术有限公司. DNCB涂腹液以丙酮∶橄榄油(1∶1)混合液配制, 浓度为33 g/L; DNCN灌肠液和脊髓珠网膜下腔注射(ith)液均以600 mL/L乙醇配制, 灌肠用DNCB浓度分别为2 g/L, 4 g/L和8 g/L, ith用DNCB浓度分别为4 g/L, 8 g/L和16 g/L. 兔抗大鼠LMIF抗体和荧光素标记的二抗均以PBS缓冲液(pH 7.4)稀释, PBS-H2O2以30 mL/L H2O2和PBS配制(比例1∶9).
1.2.1 DNCB造模及结肠炎评价: 实验第1天, 在大鼠的腹部剪毛区滴涂200 μL DNCB涂腹液致敏, 每天1次, 连续4 d. 第5天, 以DNCB灌肠液或ith激发过敏. 灌肠方法: 将直径1 mm的硅胶管从肛门插入经12 h禁食后的大鼠结肠, 插管尖端距肛门约6.5-7.0 cm, 分别灌入2 g/L, 4 g/L和8 g/L的DNCB灌肠液, 每天1次, 每次2 mL/kg体质量. ith注射方法: 给大鼠进行ith插管后, 取4 g/L, 8 g/L和16 g/L的DNCB, 分别注入大鼠脊髓珠网膜下腔, 每天1次, 每次10 μL, 于2 min内缓慢注入. 对照组以同体积溶剂(600 mL/L乙醇)灌肠或ith. DNCB灌肠或ith后, 每日记录动物的体质量和大便性状, 进行DAI (disease activation index)综合评分[13]和结肠大体、镜下评分[14].
1.2.2 脊髓珠网膜下腔(ith)插管: 参照Wu et al[17]的方法并加以改动: 以100 mL/L水合氯醛麻醉大鼠(ip, 0.3 g/kg体质量)后, 腰背部剪毛、消毒. 在髂棘(约L4)水平正中线沿脊柱纵向分别上下划开皮肤0.5 cm, 用一长约15 cm的不锈钢套管(外径0.9 mm, 内径可容PE-10管通过, 前端打磨成斜面), 在L4和L5间隙垂直刺入椎管, 以动物的尾巴或后肢出现轻微抽动确认钢管在脊髓内. 改变钢套管方向指向动物头端, 将PE-10管通过钢套管沿蛛网膜下腔向头端送入约2.8 cm, 达L1-L5水平. 拔除钢套管, 缝合固定PE-10管. 颈背部皮肤剪小口, 使PE-10管经皮下由此穿出, 缝合固定, 外露约1 cm, 管内注入3 g/L肝素生理盐水, 封口, 缝合皮肤. 术后ip青霉素10 kU以预防感染, 3 d后即可进行实验.
1.2.3 LMIF免疫荧光染色: 取经过石蜡包埋的大鼠肠组织切片(5 μm), 按参考文献[18]方法进行LMIF免疫荧光染色. 大致步骤: 标本做脱蜡和水化处理, 并经过抗原修复和封闭非特异结合等处理后, 滴加兔抗大鼠LMIF一抗(1∶300), 置于湿盒4℃过夜. 待标本恢复至室温并经PBS洗后, 滴加荧光素(TRITC)标记的二抗(1∶300), 避光室温下孵育1 h. 在Nikon-Eclpse TE2000-μ(日本)荧光显微镜下观察LMIF的荧光强度并照相.
统计学处理 采用PRISM 4.0统计软件包进行统计学分析, 计量资料采用mean±SE表示, 多组间比较采用方差分析(ANOVA)进行, P<0.05为有统计学意义.
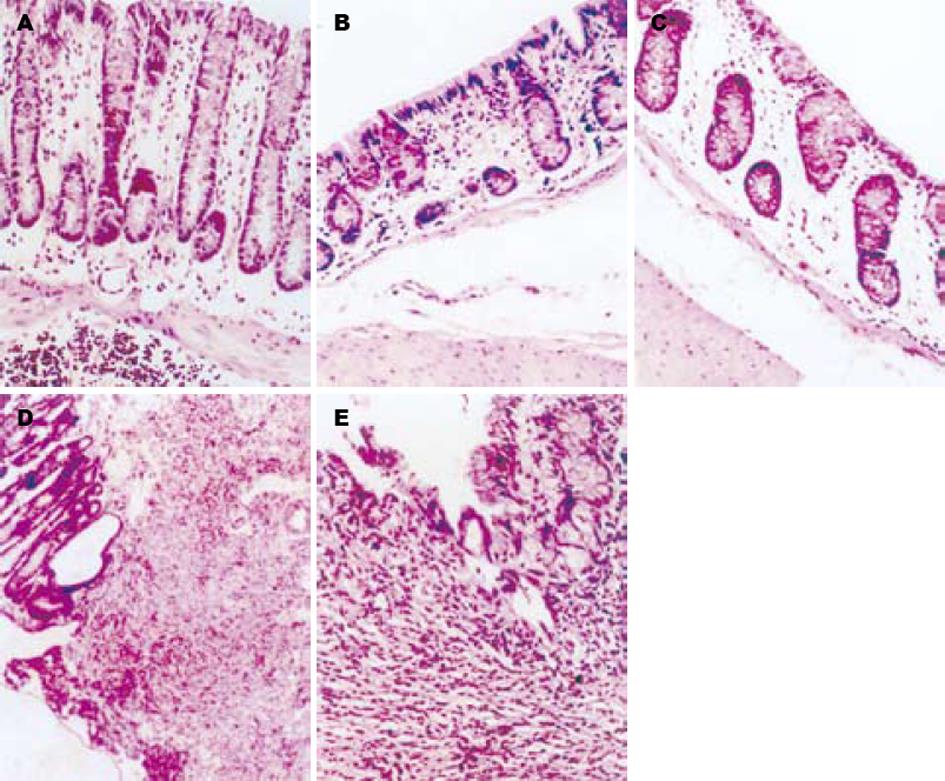
4 g/L和8 g/L DNCB灌肠后24 h, 个别动物开始出现稀便, 2-3 d后出现不同程度的血便, 7-8 d后可见脓血便. 尤其是8 g/L DNCB组的大鼠, 脓血便出现最早、脓血最明显, 其中个别动物因严重脓血便而从第10天相继死亡. DNCB引起的大鼠结肠病理学改变与以前小鼠的结果[13-14]基本相同. 2 g/L DNCB组近端肠腔扩张及少量白色渗出物, 结肠黏膜充血; 4 g/L DNCB组结肠黏连较明显, 但比较局限, 可见一处或多处溃疡形成; 8 g/L DNCB组结肠广泛黏连, 多处坏死, 个别部位有肠壁穿孔. 镜下特点: 4 g/L DNCB组的结肠黏膜层有炎性细胞浸润, 黏膜下层高度水肿; 8 g/L DNCB组黏膜坏死, 肠壁有大量炎性细胞浸润. 对照组(600 mL/L乙醇)显示正常结构, 仅见黏膜固有层有少量嗜酸性粒细胞(表1).
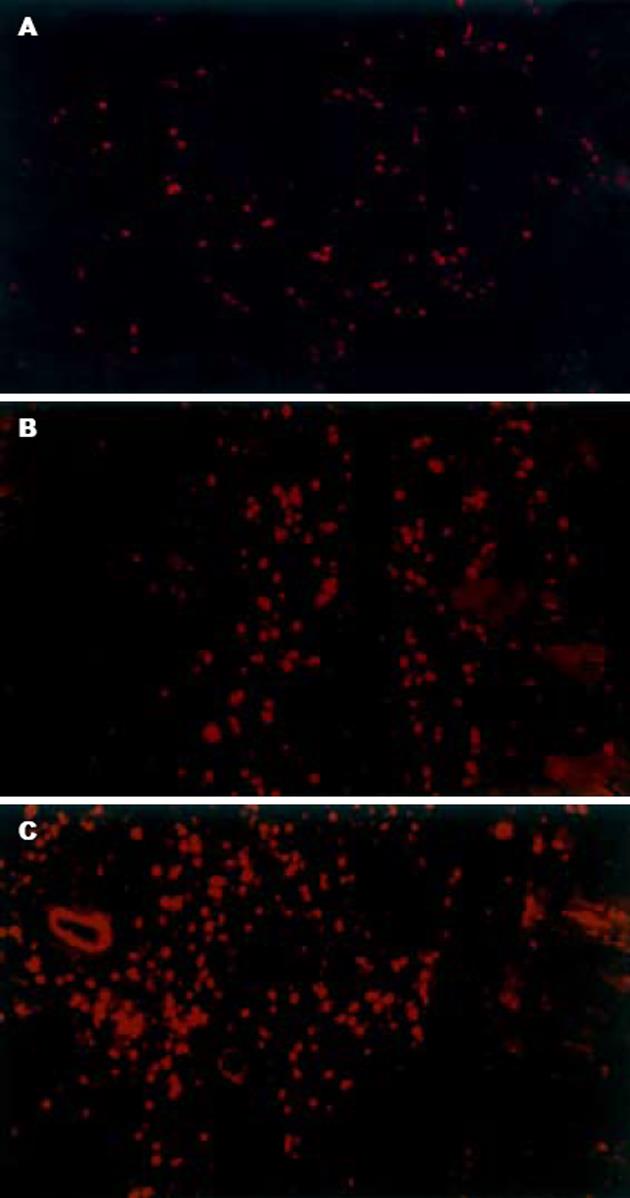
以免疫荧光方法检测结肠组织中LMIF蛋白在荧光显微镜下显示红色(图1). DNCB灌肠组的LMIF荧光明显强于乙醇灌肠(对照)组, 尤其以8 g/L DNCB组的荧光强度最大.
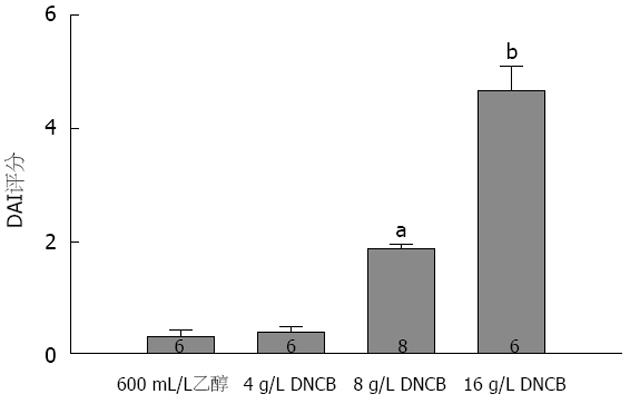
致敏大鼠每天1次ith DNCB, 经过13-15 d, 动物出现不同程度的体质量下降和稀便, 其DAI评分明显高于ith乙醇组(图2). 3 wk后取结肠组织, 发现ith DNCB组的结肠有黏连和表面伪膜; 镜下见结肠组织有大量淋巴细胞浸润, 并有溃疡形成(图3). 同时取脊髓组织切片观察, 除在16 g/L DNCB组有轴突根部增粗和白质疏松水肿的表现之外, 大多数神经元结构清楚、排列整齐(结果未显示).
我们首先用DNCB给大鼠灌肠, 出现了与我们以往在小鼠结肠所见到的相似的病理学变化(表1). 并且, 结肠炎的肠壁组织可见LMIF荧光强度随DNCB灌肠液浓度的增大而增加(图1), 与病理学评分的改变是一致的. 结合我们曾经在DNCB结肠炎小鼠的肠系膜淋巴细胞发现LMIF功能增强的结果[13], 使我们更加确信LMIF在此DNCB结肠炎模型中起重要作用. LMIF是由致敏的T淋巴细胞当再次受同种抗原刺激时释放的一种致炎因子[19-20], 是衡量DTH反应的主要指标之一[16]. 在某些其他类细胞如胃肠上皮[21]和中枢神经元[18]等, 也发现有LMIF的表达. 从本实验看到, 对照组大鼠的结肠有一定程度的LMIF表达, 主要分布于黏膜层的腺体之间(图1A); DNCB结肠炎时LMIF表达明显增多, 并且在肠壁的各层组织都可见到较强的LMIF荧光, 其中很可能包括肠壁神经元(图1B-C). 结合已有的报道, 即: LMIF可作为DTH反应如DNCB结肠炎[10,14]、接触性皮炎[16,19]的特异性免疫指标, 且在人的UC中明显升高[22-23], 我们有理由认为, 从DNCB诱导的实验性结肠炎模型中取得的资料在一定程度上可以说明人类的UC. 根据已有的发现, LMIF是神经免疫的重要介导物[15-16], 我们更倾向于"UC是与神经和免疫因素都有密切关系的炎症[24]"这一观点.
正是为了以DNCB肠炎模型验证UC与神经系统的关系, 我们将DNCB直接注射到脊髓中枢, 从插管的位置看, 更可能是影响了支配大肠的(交感)中枢[17,25]. 我们观察到, 如果肠神经系统首先受免疫原(半抗原DNCB与体内蛋白质结合即构成免疫原)刺激, 不仅神经组织本身出现病理变化, 而且继发性地影响到其末梢支配的靶器官-大肠. 在我们使用的DNCB剂量范围内, 神经组织的变化仅见于ith DNCB最大浓度(16 g/L)组, 只有个别神经元出现嗜碱性变、轴突根部增粗和白质疏松水肿, 而大多数神经元结构完整(且在ith用药全过程中, 动物的运动功能和感觉功能始终正常); 但结肠的变化却可见于ith DNCB 3个浓度组, 其病理改变非常显著, 以大量淋巴细胞浸润为其特点(图3). 我们还注意到, 与DNCB灌肠不同的是: ith DNCB引起的结肠病理变化需要在13-15 d后才明显易见; 动物虽然有稀便但很少出现血便或脓血便. 同时取动物的小肠、胃、肝脾以及肾和膀胱等组织, 都未检测到病理学变化. 这说明, 支配结肠的脊髓节段受到免疫或炎性刺激, 能够比较特异地导致其末梢支配的肠组织发炎, 这似乎吻合了Barbara和Peck关于"神经源性肠炎"的反应模式.
所谓神经源性炎症(neurogenic inflamma-tion)的报道较多见于皮肤[26]、呼吸道[27]以及某些病原体不明的疾病, 如慢性盆腔痛、偏头痛和类风湿性关节炎等[28], 多认为是由于神经末梢释放的炎症介质作用于靶组织, 影响其血管壁的通透性和平滑肌运动[29]等. 将人类UC与"神经源性炎症"联系起来的第1篇报道是Kemler et al[5]在1999年的一个奇异发现: 他给一位慢痛综合征患者施行脊髓刺激疗法以缓解骨折后疼痛的过程中, 见到这位患者原有的UC呈现反复发作, 但是如果停止脊髓刺激则UC得到缓解. 当Barbara根据这一报道以及在此之前的一些动物实验资料, 如P物质在UC模型的动物体内活性增强[6-7]、麻醉药利多卡因能减轻动物结肠炎的炎症[8]等, 提出UC是"肠神经源性炎症"的假说[4]后不久, Peck et al[9]也报道了另一位UC多年的患者因外伤累及第五颈椎而瘫痪后, 以前曾经多次复发的UC却不再复发. 但是, 上述无论动物实验, 还是临床报道, 都缺乏最直接的证据, 也未见到他们在这方面继续深入的工作. 我们第一次直接证实, 支配肠的脊髓中枢如果受到免疫原(或其他诱因)刺激而导致神经元结构(或功能)异常时, 神经元末梢支配的肠组织就会出现炎症. 当然, 如果能同时测定此过程中脊髓和肠壁神经元是否释放了致炎因子, 特别是有无LMIF的活性变化, 将会使肠神经-肠炎(或肠炎-肠神经)之间的因果关系更加明确, 这也是我们将要继续探讨的课题.
本文组织病理、荧光免疫技术分别得到宫恩聪教授和杨敏博士的指导和帮助.
自100多年前发现溃疡性结肠炎(UC)至今, 对其病因仍然没有彻底阐明. 从神经源角度分析UC的发病机制, 是近10a国际学术界出现的一种倾向. 相关的国内文献尚未检索到, 国外文献最经典的是1999年Kemleretal和2000年Pecketal的临床病例报道. 迄今停留在推测阶段, 缺乏直接证据, 而且再未见他们后续报道. 本研究采用了方法学上颇具难度的ith插管慢性动物实验, 第一次直接探讨肠神经与结肠炎的因果关系.
UC研究的热点是其病因和发病机制. 本研究从神经免疫特别是神经源性炎症的观点出发, 必将为UC病因和发病机制的认识提供新思路.
关于DNCB灌肠致大鼠结肠炎-PubMed检索自1992年以来仅不到10篇. 他们造模的方法与本文大同小异, 但是都没有同时检测LMIF活性, 而是偏重治疗研究(如针刺、中药等), 与本文研究目的不同.
给致敏大鼠ithDNCB导致结肠炎的动物模型是本文创新点. 测定DNCB结肠炎时肠壁组织LMIF的表达也未见报道.
如果阐明了肠神经系统与结肠炎的因果关系, 则有可能在治疗或预防UC时, 用神经干预的理念, 采取有效手段.
DTH反应: 迟发型过(超)敏反应. 致敏T细胞当再次接受相同抗原后, 被进一步激活并大量增殖, 并释放包括LMIF在内的多种淋巴因子, 直接和间接杀伤靶细胞, 引起局部炎症反应.
LMIF: 致敏T淋巴细胞再遇相同抗原而释放出的一种生物活性物质.
神经源性炎症: 神经(多指外周感觉神经)受刺激, 其局部的血管通透性增加、组织血流量增加, 表现为血液渗出、局部组织温度升高、红肿等. 这种炎症多见于皮肤(如特应性皮炎和风疹)、呼吸道(如支气管哮喘)以及某些病原体不明的疾病如慢性盆腔痛、偏头痛和类风湿性关节炎等.
本实验方法先进, 数据可靠, 观点明确, 题目新颖, 为溃疡性结肠炎的神经免疫发病学说提供了依据, 对溃疡性结肠炎的发病机制研究有重要参考价值.
电编: 张敏 编辑:潘伯荣
| 1. | Haskey N, Dahl WJ. Synbiotic therapy: a promising new adjunctive therapy for ulcerative colitis. Nutr Rev. 2006;64:132-138. [PubMed] [DOI] |
| 2. | Hibi T, Inoue N, Ogata H, Naganuma M. Introduction and overview: recent advances in the immunotherapy of inflammatory bowel disease. J Gastroenterol. 2003;38 Suppl 15:36-42. [PubMed] |
| 3. | Xu CT, Meng SY, Pan BR. Drug therapy for ulcerative colitis. World J Gastroenterol. 2004;10:2311-2317. [PubMed] [DOI] |
| 4. | Barbara G, De Giorgio R, Stanghellini V, Gionchetti P, Campieri M, Corinaldesi R. Relapsing ulcerative colitis after spinal cord stimulation: a case of intestinal neurogenic inflammation? Gastroenterology. 1999;117:1256-1257. [PubMed] [DOI] |
| 5. | Kemler MA, Barendse GA, Van Kleef M. Relapsing ulcerative colitis associated with spinal cord stimu-lation. Gastroenterology. 1999;117:215-217. [PubMed] [DOI] |
| 6. | Evangelista S, Maggi M, Renzetti AR. Down-regulation of substance P receptors during colitis induced by trinitrobenzene sulfonic acid in rats. Neuropeptides. 1996;30:425-428. [PubMed] [DOI] |
| 7. | Watanabe T, Kubota Y, Muto T. Substance P containing nerve fibers in ulcerative colitis. Int J Colorectal Dis. 1998;13:61-67. [PubMed] [DOI] |
| 8. | McCafferty DM, Sharkey KA, Wallace JL. Beneficial effects of local or systemic lidocaine in experimental colitis. Am J Physiol. 1994;266:G560-567. [PubMed] |
| 9. | Peck OC, Wood JD. Brain-gut interactions in ulcerative colitis. Gastroenterology. 2000;118:807-808. [PubMed] [DOI] |
| 10. | Glick ME, Falchuk ZM. Dinitrochlorobenzene-induced colitis in the guinea-pig: studies of colonic lamina propria lymphocytes. Gut. 1981;22:120-125. [PubMed] [DOI] |
| 11. | Rabin BS, Rogers SJ. A cell-mediated immune model of inflammatory bowel disease in the rabbit. Gastroenterology. 1978;75:29-33. [PubMed] |
| 12. | Guo SM, Tong HB, Bai LS, Yang W. Effect of traditional Chinese medicinal enemas on ulcerative colitis of rats. World J Gastroenterol. 2004;10:1914-1917. [PubMed] [DOI] |
| 14. | Yu WG, Lin P, Pan H, Xiao L, Gong EC, Mei L. Pathophysiological significance of a reaction in mouse gastrointestinal tract associated with delayed-type hypersensitivity. World J Gastroenterol. 2004;10:2254-2258. [PubMed] |
| 15. | Bucala R. Neuroimmunomodulation by macrophage migration inhibitory factor (MIF). Ann N Y Acad Sci. 1998;840:74-82. [PubMed] [DOI] |
| 16. | Mei L, Li L, Li Y, Deng Y, Sun C, Ding G, Fan S. Conditioned immunosuppressive effect of cyclophosphamide on delayed-type hypersen-sitivity response and a preliminary analysis of its mechanism. Neuroimmunomodulation. 2000;8:45-50. [PubMed] [DOI] |
| 17. | Wu WP, Xu XJ, Hao JX. Chronic lumbar catheteri-zation of the spinal subarachnoid space in mice. J Neurosci Methods. 2004;133:65-69. [PubMed] [DOI] |
| 18. | Vera PL, Meyer-Siegler KL. Anatomical location of macrophage migration inhibitory factor in urogenital tissues, peripheral ganglia and lumbosacral spinal cord of the rat. BMC Neurosci. 2003;4:17. [PubMed] [DOI] |
| 19. | Goebeler M, Gutwald J, Roth J, Sorg C. The severity of irritant contact dermatitis in various strains of mice correlates with endothelial expression of migration inhibitory factor (MIF). Arch Dermatol Res. 1991;283:246-250. [PubMed] [DOI] |
| 20. | Baugh JA, Donnelly SC. Macrophage migration inhibitory factor: a neuroendocrine modulator of chronic inflammation. J Endocrinol. 2003;179:15-23. [PubMed] [DOI] |
| 21. | Maaser C, Eckmann L, Paesold G, Kim HS, Kagnoff MF. Ubiquitous production of macrophage migration inhibitory factor by human gastric and intestinal epithelium. Gastroenterology. 2002;122:667-680. [PubMed] [DOI] |
| 22. | Murakami H, Akbar SM, Matsui H, Onji M. Macrophage migration inhibitory factor in the sera and at the colonic mucosa in patients with ulcerative colitis: clinical implications and pathogenic significance. Eur J Clin Invest. 2001;31:337-343. [PubMed] [DOI] |
| 23. | Murakami H, Akbar SM, Matsui H, Horiike N, Onji M. Macrophage migration inhibitory factor activates antigen-presenting dendritic cells and induces inflammatory cytokines in ulcerative colitis. Clin Exp Immunol. 2002;128:504-510. [PubMed] [DOI] |
| 24. | di Mola FF, Friess H, Zhu ZW, Koliopanos A, Bley T, Di Sebastiano P, Innocenti P, Zimmermann A, Buchler MW. Nerve growth factor and Trk high affinity receptor (TrkA) gene expression in inflammatory bowel disease. Gut. 2000;46:670-679. [PubMed] [DOI] |
| 25. | Guyton AC, Hall JE. Text book of medical physiology. tenth ed. Singapore: Health Science Asia, Elsevier Science 2000; 698-702. |
| 26. | Zegarska B, Lelinska A, Tyrakowski T. Clinical and experimental aspects of cutaneous neurogenic inflammation. Pharmacol Rep. 2006;58:13-21. [PubMed] |
| 27. | Liu CL, Lai KF, Chen RC, Luo W, Zeng YX, Yao WM, Zhong NS. The role of airway neurogenic inflammation in gastro-esophageal reflux induced cough. Zhonghua Jiehe He Huxi Zazhi. 2005;28:520-524. [PubMed] |
| 28. | Wesselmann U. Neurogenic inflammation and chronic pelvic pain. World J Urol. 2001;19:180-185. [PubMed] [DOI] |
| 29. | Wiedermann CJ, Dunzendorfer S, Kahler CM, Reinisch N, Schratzberger P. Secretoneurin and neurogenic inflammation. Zhongguo Yaolixuebao. 1999;20:789-794. [PubMed] |