修回日期: 2006-06-01
接受日期: 2006-06-27
在线出版日期: 2006-07-28
目的: 探讨蛋白激酶B丝氨酸磷酸化在高脂诱导大鼠非乙醇性脂肪肝发病机制中的作用.
方法: 选Wistar大鼠60只, 随机分为正常对照组(n = 20), 高脂组(n = 20)和高脂+罗格列酮组(n = 20). 分别用正常、高脂和高脂+罗格列酮饲料喂养16 wk, 处死, 观察血脂、胰岛素、肝功, 肝脏组织学及超微结构的变化, 免疫组化法检测丝氨酸磷酸化的蛋白激酶B在肝脏中的表达.
结果: 高脂组16 wk后, 肝细胞中出现大量的脂肪滴, 小叶内及汇管区炎性细胞浸润并伴有点片状坏死. 超微结构示: 细胞器结构消失, 线粒体嵴断裂或空泡变. 肝指数、甘油三酯、胰岛素抵抗指数、肝脏谷丙转氨酶(ALT)、γ-氨基酰胺转肽酶(GGT)(分别为3.96%±0.32%, 2.87±0.3 mmol/L, 15.59±1.7, 136.7±0.26 nkat/L和1700.3±0.92 nkat/L)较正常对照组(2.31%±0.21%, 0.56±0.20 mmol/L, 1.79±1.7, 125.0±0.14 nkat/L和158.4±0.63 nkat/L)相比明显增加(P<0.01或P<0.05). 高脂组肝脏蛋白激酶B蛋白表达量为34.2%, 与正常对照组的89.06%相比明显减弱(P<0.01).
结论: 高脂可能通过抑制蛋白激酶B的活性的表达影响胰岛素信号传导而产生胰岛素抵抗进而参与了非乙醇性脂肪肝的形成.
引文著录: 韩继武, 詹晓蓉, 阴惠清, 梁桂敏, 何强, 王月影. 蛋白激酶B丝氨酸磷酸化在非乙醇性脂肪肝发病机制中的作用. 世界华人消化杂志 2006; 14(21): 2055-2059
Revised: June 1, 2006
Accepted: June 27, 2006
Published online: July 28, 2006
AIM: To clarify whether protein kinase B (PKB) serine phosphorylation pathway is involved in the pathogenesis of nonalcoholic fatty liver disease (NAFLD) induced by high-fat diets.
METHODS: Sixty male Wistar rats were randomly divided into group A, B and C. The rats in group A served as controls, and those in group B and C were fed with high-fat diets for 16 wk. Meanwhile, the rats in group C were also treated with rosiglitazone 4 mg per day. At the end of 16th wk, all the animals were sacrificed. Liver index (liver/body weight ratio), serum activities of liver-associated enzymes, blood lipids, liver index, fasting blood glucose, fasting plasma insulin, liver histology and liver ultrastructure were assayed in all the groups. The expression of serine phosphorylated PKB was detected by immunohistochemistry. The liver histological and ultrastructural changes were observed by light and electron microscopy.
RESULTS: The liver index, plasma triglycerides (TG), homeostasis model assessment of insulin resistance (HOMA-IR), serum activities of alanine aminotansferase (ALT), gamma glutamyl transferase (GGT) were significantly increased in group B than those in the normal controls (3.96% ± 0.32% vs 2.31% ± 0.21%, P < 0.01; 2.87 ± 0.3 mmol/L vs 0.56 ± 0.20 mmol/L, P < 0.05; 15.59 ± 1.7 vs 1.79 ± 1.7, P < 0.05; 1108.5 ± 0.61 nkat/L vs 231.7 ± 0.23 nkat/L, P < 0.05; 1700.3 ± 0.92 nkat/L vs 158.4 ± 0.63 nkat/L, P < 0.05), while the expression of serine phosphorylated PKB was markedly lower (34.2% vs 89.06%, P < 0.01). Macroscopic and microscopic findings demonstrated that lipid accumulation in the liver was observed as early as 2 wk after high-fat diets used used; a fatty liver phenotype developed at 12 wk; and severe steatosis, mainly as microvesical steatosis, lobular inflammatory, cell infiltration and necrosis, occurred at 16 wk. Electron microscopy showed that the structures of cell organelle disappeared, and the ruptured mitochondrial crista or vacuole-like mitochondria was observed. However, the histopathological and ultrastructural changes were notably alleviated in group C.
CONCLUSION: PKB signaling pathway may be involved in the pathogenesis of NAFLD induced by high-fat diets.
- Citation: Han JW, Zhan XR, Yin HQ, Liang GM, He Q, Wang YY. Role of protein kinase B serine phosphorylation in pathogenesis of nonalcoholic fatty liver disease induced by high-fat diets. Shijie Huaren Xiaohua Zazhi 2006; 14(21): 2055-2059
- URL: https://www.wjgnet.com/1009-3079/full/v14/i21/2055.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i21.2055
非乙醇性脂肪性肝病(NAFLD)是一种多病因引起的肝细胞内脂质蓄积过多的临床病理综合征. NAFLD常与中心性肥胖、高血压、高TG血症及2型糖尿病相伴行. 近年来, NAFLD已被认为是代谢综合征的肝脏表现[1]. 最近的几个临床研究[2-4]亦发现, 几乎所有的NAFLD患者都既存在外周胰岛素抵抗, 又存在肝脏胰岛素抵抗, 并认为胰岛素抵抗(insulin resistance, IR)所导致的脂质在肝脏中蓄积是NAFLD发病的基础.
有关IR所导致的脂质在肝脏中蓄积的发病机制并不完全清楚, 众所周知, 在肝脏中, 胰岛素通过肝细胞表面受体及细胞内的调节, 如PI3/PKB(磷酸肌醇激酶3激酶/蛋白激酶B)即控制脂代谢又控制糖代谢, 胰岛素信号传导通路PI3/PKB途径发生障碍是导致IR的主要机制[5], 基于此, 我们试图通过分析胰岛素传导通路中的关键酶-蛋白激酶B (PKB)的表达情况与肝脏组织学和超微结构的变化的关系探讨脂质在肝脏中的蓄积的机制.
用♂Wistar大鼠60只, 体质量160-180 g, 购自哈医大学第一临床医学院实验动物中心, 合格证号: 黑动字第P00102008号. 正常普通饲料由本实验中心提供, 其组成中小麦面占10%, 麸子占30%, 玉米面占30%, 豆饼占20%, 鱼粉占5%, 骨粉占2%, 酵母占2%, 氯化钠占1%. 高脂饲料为在普通饲料中添加10%猪油, 2%胆固醇, 0.2%甲基硫氧嘧啶, 0.5%胆盐. 人胰岛素试剂盒批号(Tarrytown, NY 10591-5079 USA), 购自拜耳公司, PKBSer473兔抗鼠PKB多克隆抗体和羊抗兔IgG/HRP (SA1022, 二抗)均购自SentaCruzBiotechInc. (Calif. USA). 胆固醇购自Sigma公司.
所有大鼠适应性喂养3 d后, 随机分为2组, 正常对照组(Con, n = 20)给予普通饮食喂养; 高脂组和高脂组+罗格列酮(n = 20)分别给予含20%脂肪的高脂食料和高脂组每日加用罗格列酮4 mg/(kg·d)喂养16 wk, 高脂组病理证实造模成功. 肝指数: 肝湿质量/体质量×100%. 生化指标检测: 大鼠0 wk左眼底静脉丛采血1 mL; 第16周时禁食12 h后戊巴比妥钠(60 mg/kg, ip)麻醉, 开胸心脏采血4 mL, 开腹取肝脏. 测肝功、三酯酰甘油(TG), 胆固醇(TC)和胰岛素(FINS). 所取肝脏置于40 g/L的多聚甲醛溶液中. 胰岛素的测定和胰岛素抵抗指数的计算: 胰岛素的测定采用化学发光法: 胰岛素抵抗指数(HOMA-IR)和胰岛素敏感指数(ISI)的判定: HOMA-IR = (FBG×FINS)/22.5, ISI = 1/FBS×FINS, 取大鼠肝脏后, 去除包膜, 长轴方向对切, 用10 g/L的中性甲醛固定后, 石蜡包埋切片, 切片厚度1 μm, 作常规HE染色. 使用日本电子公司生产的JEM-1220型透射电镜. 肝脏石蜡切片免疫组化染色程序: 石蜡切片常规脱蜡至水, 行30 mL/L H2O2去除内源性过氧化物酶, 进行热修复和BSA封闭. 滴加一抗(1∶800)和二抗[生物素化山羊抗兔(鼠)血清], 再滴加试剂SABC. 用苏木素复染1 min, 自来水冲洗返蓝5 min. 切片经过梯度酒精脱水干燥, 二甲苯透明5 min, 中性树胶封片. 免疫组化染色判定结果: 胞膜/胞质内呈明显棕黄色颗粒的细胞为阳性细胞.
统计学处理 计量资料用mean±SD表示, 采用SPSS 12分析软件, 组间差异用单因素方差分析.
正常对照组和高脂组分别为2.31%±0.21%和3.96%±0.32%, 差异显著(P<0.01). 罗格列酮组为2.98%±0.26%与高脂组相比差异显著(P<0.05)(表1). 高脂组: ALT和GGT分别为1108.5±0.61 nkat/L和1700.3±0.92 nkat/L与正常组的231.7±0.23 nkat/L和158.4±0.63 nkat/L相比差异显著(P<0.05), 其中ALT增加5倍, GGT增加10倍, 而AST两组值分别为136.7±0.26 nkat/L和125.0±0.14 nkat/L, 两组无显著差异(P>0.05, 表1). 高脂组: TG和TC分别为2.87±0.3 mmol/L和2.68±0.26 mmol/L与正常对照组的0.56±0.20 mmol/L和1.42±0.15 mmol/L相比显著差异(P<0.05), 且其中TG增加5-6倍, TC增加1倍. 罗格列酮组TG明显降低(P<0.05), 胰岛素抵抗指数(HOMA IR): 高脂组15.59±1.7与正常对照组的1.79±1.7明显升高(P<0.05), 罗格列酮组4.55±1.9与高脂组相比明显降低(P<0.05, 表2).
正常对照组大鼠肝色鲜红, 边缘锐利, 质韧; 高脂组大鼠肝外观呈奶油黄或红黄相间, 体积明显增大, 边缘变钝, 质地变软, 切面略带油腻感. 正常对照组大鼠肝小叶清晰, 肝细胞索排列整齐, 偶见小泡性脂肪滴空泡; 高脂组: 肝小叶中心带肝细胞中出现大小不等的脂肪滴, 以大泡性脂肪滴为主, 部分肝细胞核则被脂肪滴挤压而明显偏位, 小叶内及汇管区局灶性炎性细胞浸润, 并伴有一定程度的点片状坏死. 罗格列酮组: 病理改变较高脂组明显减轻.
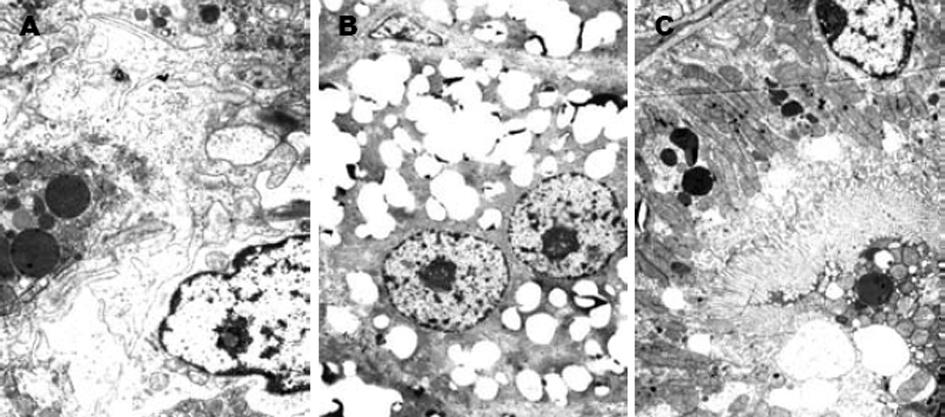
正常对照组肝细胞胞质内细胞器结构完好, 线粒体、粗面内质网和游离核蛋白体丰富发达, 未见脂肪颗粒, 狄氏间隙内肝细胞的微绒毛完整(图1A); 高脂组肝细胞胞质内充满大量的脂肪颗粒, 细胞器结构消失, 被大量的脂滴所充填(图1B); 罗格列酮组: 胞质内脂肪颗粒减少, 线粒体和粗面内质网细胞器结构完整(图1C).
IR是导致脂质在肝脏中蓄积的基础[6], 但其确切的机制尚不清楚. 我们通过建立高脂血症胰岛素抵抗Wistar大鼠脂肪肝模型, 旨在探讨胰岛素信号传导通路在非酒精性脂肪肝发病机制中的作用, 进一步确定胰岛素抵抗在NAFLD发病机制的意义和地位. 持续高脂喂养Wistar大鼠16 wk, 大鼠肝脏从大体解剖、组织学至肝脏的超微结构均有明显改变, 同时胰岛素抵抗指数与肝脏脂肪含量及肝脏组织损害程度呈一致性, 我们研究发现随着大鼠食物脂肪含量的增加, 肝脏GGT, ALT, IRI数值也随之增高, 与正常对照组相比差异显著P<0.05, 且IRI与肝脏脂肪的含量呈正比, 而罗格列酮组随着胰岛素敏感性的改善, 肝细胞脂肪堆积量也明显减轻, 肝脏的酶学和组织结构也趋于正常, 此结果表明体内胰岛素抵抗程度和肝脏中脂肪沉积量与肝细胞的损伤相一致, 进一步证实IR是引起脂质在肝细胞中沉积的原因, 还发现高脂组肝脏酶学升高以GGT, ALT为主, 且以GGT表现更为显著, 故推测以GGT升高为主的肝脏酶学改变为非酒精性脂肪肝酶学升高的一大特点.
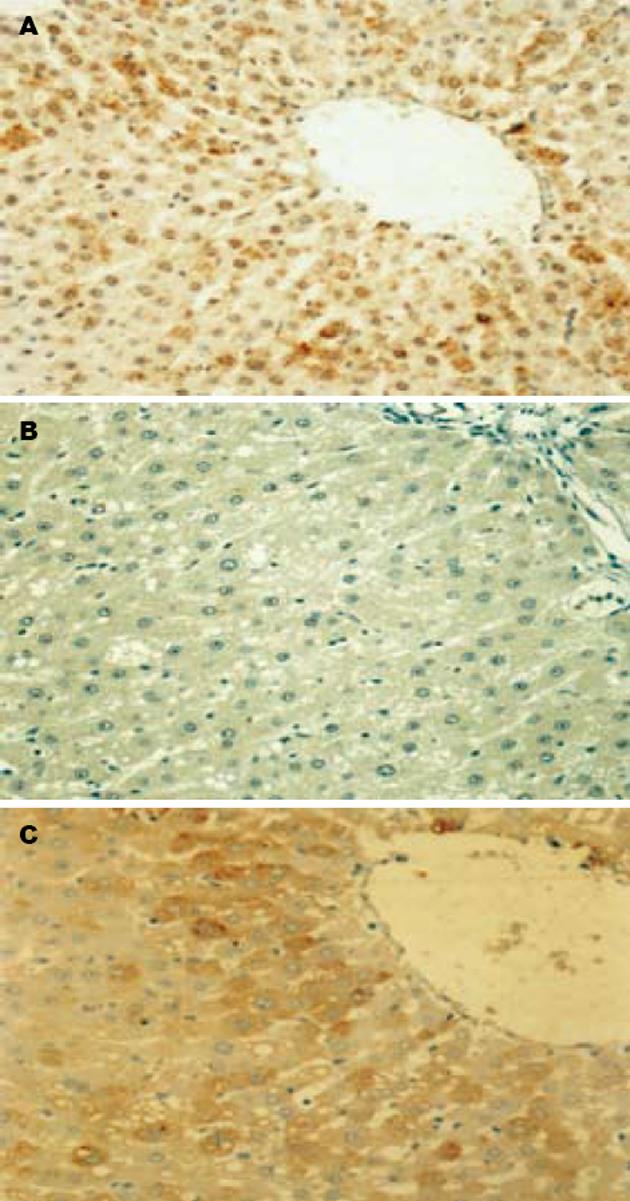
磷脂酰肌醇3-激酶(phophatidylinositol 3-kinase, PI3-K)途径是胰岛素作用的主要信号转导途径之一, 而作为PI3-K下游激酶的PKB/AKT是这一途径中重要的丝氨酸/苏氨酸激酶, PKB表达量的改变是导致IR的主要机制之一[7]. 目前有关高脂诱导IR的分子机制尚不清楚. 本研究免疫组化结果发现磷酸化的PKB在正常肝脏的表达近乎达95%以上, 个别片子全表达, 而高脂组表达量只有34%较正常对照组减弱50%以上, 同时高脂组血脂的变化以TG升高为主, 同时肝脏内有大量的脂肪沉积, 于是我们推测血中大量的甘油三脂可能在脂肪、肌肉和肝脏细胞中的沉积使PKB丝氨酸磷酸化受抑制, 从而削弱了细胞内胰岛素信号蛋白PKB丝氨酸磷酸化进一步使胰岛素传递受损, 从而抑制糖的转运活动而诱导IR. 反之, 具有IR的个体, 体内增高的胰岛素水平作用于脂肪细胞促进其对脂肪的分解, 形成的大量游离脂肪酸(free fatty acids, FFA)通过门脉系统送至肝细胞中并合成脂肪酸, 又加重了FFA在肝脏的沉积. 升高FFA除直接的细胞毒性外, 可抑制胰岛素受体底物和磷脂酰肌醇-3激酶信号途径-P13. 严重IR的大鼠表现出胰岛素介导的IRS-1和PI3-K激酶活性下降[8]. 同时我们尚推论IR时高胰岛素水平也促使肝脏的生脂作用进一步加重, 而导致脂肪在肝细胞中的沉积, 我们的研究与Wilkinson et al[9]有关"高浓度FFA 可影响胰岛素信号转导途径中的重要物质包括胰岛素受体底物1 (IRS-1)和蛋白激酶C等, 从而诱导发生IR的研究"有一致之处.
我们尚发现高脂喂养后的大鼠在加用罗格列酮治疗16 wk后, 磷酸化的PKB在肝脏中阳性细胞的表达数由高脂组的34%增加至66%, 同时肝脏的酶学、肝脏细胞内脂沉积的量和细胞的超微结构均明显改善, 进一步证实胰岛素抵抗可能作为原发病因参与NAFLD的发生和发展. 且实验中尚发现高脂组与正常对照组及高脂组与罗格列酮组大鼠血糖增加的均数差与ALT、GGT的均数差相一致, 推测NAFLD可能是IR发展为糖尿病的中间阶段.
至今NAFL的发病机制尚未明确, 我们研究的PKB丝氨酸磷酸化受抑而致胰岛素传导信号障碍而引发的胰岛素抵抗是NAFLD的发病的基础, 提高胰岛素的活性, 可能是改善NAFLD的有效手段.
非酒精性脂性肝脏疾病(NAFLD)是最常见的弥漫性肝脏病变之一, 15%的患者可以从单纯的脂肪肝转变为肝纤维化、肝硬化, 甚至3%的患者可能进展为肝功能衰竭. 流行病学显示:在不同的国家中NAFLD的发病率约占20%-34%, 肥胖人的发病率高达57%-74%. 无症状性转氨酶升高的患者中, 在排除了其他肝病后约42%-90%是由NAFLD引起的. 在肥胖人群中发NAFLD病率增加4-6倍, 在我国有1/3的糖尿患者患有NAFLD. 在我国肥胖人群中2/3以上患有肝脂肪变性, 在发达国家NAFLD与2型糖尿病一样可发生于任何年龄, NAFLD并有不断增加的趋势, 严重地威胁着人们的健康, 有效地控制NAFLD的发生已成为全球关注的热点.
目前研究显示NAFLD的发生与胰岛素抵抗有关, 基于此, 本研究试图以胰岛素传导通路的关键酶-磷酸肌醇激酶3激酶/蛋白激酶B(PKB)为线索, 观察使用胰岛素增敏剂前后PKB活性和在肝脏中的表达情况与肝脏组织学和超微结构的变化关系, 探讨脂质在肝脏中的蓄积的机制并寻找出治疗NAFLD的有效方法.
目前研究尚发现胰岛素抵抗患者的脂肪、肝脏和肌肉组织对胰岛素的反应减退, 从而降低了脂肪和肌肉对葡萄糖的摄取, 增加肝脏的葡萄糖释放并且增加脂肪组织游离脂肪酸的释放. 游离脂肪酸水平的升高会进一步加重肝脏和肌肉的胰岛素抵抗. Sanyaletal在研究胰岛素抵抗时观察到血清游离脂肪酸(FFA)上升伴有胰岛素抵抗和NAFLD出现, 另组研究发现胰岛素抵抗的严重程度与脂肪沉积部位有关, 即以躯干内脏性肥胖最为重要.
非乙醇性脂肪肝发病机制仍不清楚, 有报道胰岛素抵抗在NAFLD形成过程中起了重要的作用. 但目前国内外尚未有人系统地观察以胰岛素传导通路为线索, 从肝脏的病理组织学, 超微结构对其发病机制进行探讨. 国内外尚未有人系统地观察应用胰岛素的增敏剂干预后大鼠肝脏的形态学、超微结构和胰岛素传导通路关键酶活性和蛋白水平表达量的变化, 确定治疗脂肪肝的有效方法.
目前对于NAFLD仍无有效地治疗手段. 对糖尿病、高脂血症患者, 主要目标是治疗原发病, 但效果不理想. 寻找对脂肪肝具有潜在治疗作用的药物, 依然是亟待研究的重要课题. 此研究的实现是为脂肪肝的治疗开辟一条新思路.
本文对PKB在NAFLD发病机制中的作用进行研究, 设计合理, 研究结果有一定意义.
电编: 张敏 编辑:潘伯荣
| 1. | Ibdah JA, Perlegas P, Zhao Y, Angdisen J, Borgerink H, Shadoan MK, Wagner JD, Matern D, Rinaldo P, Cline JM. Mice heterozygous for a defect in mitochondrial trifunctional protein develop hepatic steatosis and insulin resistance. Gastroenterology. 2005;128:1381-1390. [PubMed] [DOI] |
| 2. | Bugianesi E, Gentilcore E, Manini R, Natale S, Vanni E, Villanova N, David E, Rizzetto M, Marchesini G. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol. 2005;100:1082-1090. [PubMed] [DOI] |
| 3. | Qi NR, Wang J, Zidek V, Landa V, Mlejnek P, Kazdova L, Pravenec M, Kurtz TW. A new transge-nic rat model of hepatic steatosis and the metabolic syndrome. Hypertension. 2005;45:1004-1011. [PubMed] [DOI] |
| 4. | Nishino M, Ikegami H, Fujisawa T, Kawaguchi Y, Kawabata Y, Shintani M, Ono M, Ogihara T. Functional polymorphism in Z-DNA-forming motif of promoter of SLC11A1 gene and type 1 diabetes in Japanese subjects: association study and meta-analysis. Metabolism. 2005;54:628-633. [PubMed] [DOI] |
| 5. | Schattenberg JM, Wang Y, Singh R, Rigoli RM, Czaja MJ. Hepatocyte CYP2E1 overexpression and steatohepatitis lead to impaired hepatic insulin signaling. J Biol Chem. 2005;280:9887-9894. [PubMed] [DOI] |
| 6. | Angulo P, Alba LM, Petrovic LM, Adams LA, Lindor KD, Jensen MD. Leptin, insulin resistance, and liver fibrosis in human nonalcoholic fatty liver disease. J Hepatol. 2004;41:943-949. [PubMed] [DOI] |
| 7. | Stratford S, Hoehn KL, Liu F, Summers SA. Regulation of insulin action by ceramide: dual mechanisms linking ceramide accumulation to the inhibition of Akt/protein kinase B. J Biol Chem. 2004;279:36608-36615. [PubMed] [DOI] |
| 8. | Yang SQ, Lin HZ, Mandal AK, Huang J, Diehl AM. Disrupted signaling and inhibited regeneration in obese mice with fatty livers: implications for nonalcoholic fatty liver disease pathophysiology. Hepatology. 2001;34:694-706. [PubMed] [DOI] |
| 9. | Wilkinson P, Leach C, Ah-Sing EE, Hussain N, Miller GJ, Millward DJ, Griffin BA. Influence of alpha-linolenic acid and fish-oil on markers of cardiovascular risk in subjects with an atherogenic lipoprotein phenotype. Atherosclerosis. 2005;181:115-124. [PubMed] [DOI] |