修回日期: 2006-05-12
接受日期: 2006-05-25
在线出版日期: 2006-07-18
目的: 研究聚腺苷二磷酸核糖聚合酶(poly adenosine diphosphate (ADP) -ribose polymerase-1, PARP-1)在肝癌及癌周肝组织中的表达, 以及其表达水平与肝癌生物学特征的关系.
方法: 采用免疫组织化学技术及Western blot技术, 检测40例手术切除的人肝癌组织及癌旁组织中PARP-1的表达, 结合肝癌的临床生物学特征分析PARP-1表达与肝癌分化、转移及复发的关系.
结果: PARP-1主要表达于细胞核, 肝癌组织中PARP-1的表达明显高于癌旁肝组织, 分别为61.44%和40.20%, 差异有显著性(t = 6.49, P<0.01); 低分化肝癌组织中PARP-1的表达明显高于中高分化肝癌组织, 分别为70.8%和45.6%, 差异有显著性(t = 4.57,P<0.01); 伴有转移或复发的肝癌组织中PARP-1的表达明显高于不伴有转移或复发的肝癌组织, 分别为73.0%和43.4%, 差异有显著性(t = 3.33, P<0.01).
结论: PARP-1基因在肝癌组织中表达显著上调, 且PARP-1表达上调与肝癌的恶性分化及转移复发有密切关系.
引文著录: 王志强, 黄志勇, 陈孝平, 张志发. 人肝癌组织中PARP-1的表达与生物学特征的关系. 世界华人消化杂志 2006; 14(20): 1995-1998
Revised: May 12, 2006
Accepted: May 25, 2006
Published online: July 18, 2006
AIM: To investigate the expression of poly adenosine diphosphate-ribose polymerase-1 (PARP-1) in human hepatocellular carcinoma (HCC) and its adjacent liver tissues as well as the correlation between the expression of PARP-1 and the biological characteristics.
METHODS: Immunohistochemical staining and Western blotting were employed to examine the expression of PARP-1 in HCC and its adjacent liver tissues obtained from the surgical specimens of 40 HCC patients who underwent liver resections in our hospital, and the correlation between the expression level of PARP-1 and the differentiation, recurrence and metastasis of HCC were analyzed.
RESULTS: The expression of PARP-1 was mainly located in the nucleus, and the rate of PARP-1 expression in HCC was significantly higher than that in its adjacent liver tissues (t = 6.49, P < 0.01). The rates of PARP-1 expression in the poorly differentiated HCC were significantly greater than those in the well and moderately differentiated HCC (t = 4.57, P < 0.01). Furthermore, the expression rates in the HCC with recurrence and metastasis were significantly higher than those in the ones without recurrence and metastasis (t = 3.33, P < 0.01).
CONCLUSION: PARP-1 expression is up-regulated in HCC, and the up-regulation of PARP-1 is closely correlated with the differentiation and metastasis. This study indicates that the PARP-1 gene may be involved in the carcinogenesis and development of human HCC.
- Citation: Wang ZQ, Huang ZY, Chen XP, Zhang ZF. Relationship between expression of poly adenosine diphosphate-ribose polymerase-1 and its biological characteristics in human hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(20): 1995-1998
- URL: https://www.wjgnet.com/1009-3079/full/v14/i20/1995.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i20.1995
肝癌是我国常见的恶性肿瘤之一, 且对放、化疗均不敏感, 除了少数患者有机会获得手术切除外, 多数患者常因缺乏有效治疗而于短期内死亡. 即使获得手术切除, 多数患者也将难免死于肝癌复发和转移, 5年生存率仅为30%-40%. 因此, 深入研究肝癌的发生、发展机制, 探索新的药物治疗靶点, 对肝癌治疗具有重要意义. 聚腺苷二磷酸核糖聚合酶[poly adenosine diphosphate (ADP)-ribose polymerase-1, PARP-1]是存在于真核细胞中催化聚ADP核糖化的细胞核酶, 他参与的聚ADP核糖化是真核细胞中蛋白质翻译后的重要修饰方法之一. PARP-1在DNA修复、细胞凋亡和肿瘤发生过程中发挥着至关重要的作用[1-3]. 体外和体内研究表明, 抑制PARP-1则可降低DNA修复功能, 增强放疗和化疗对多种肿瘤的治疗效果[4-6]. 但目前对肝癌中PARP-1的表达状况及PARP-1表达与肝癌恶性生物学特征的关系尚缺乏深入研究. 深入研究人肝癌组织中PARP-1的表达及PARP-1与肝癌恶性生物学特征的关系, 将为对肝癌开展PARP-1抑制剂治疗研究奠定基础.
2003-08/2006-01我中心切除的原发性肝细胞癌组织及远离癌灶边缘2 cm无肿瘤浸润的癌旁肝组织标本40例, 其中低分化20例, 中高分化20例. 门静脉或肝静脉分支癌栓形成16例, 术后半年内肿瘤复发; 无癌栓形成24例, 半年内无肿瘤复发. 所取标本均置于-70 ℃超低温冰箱中保存备用. 抗PARP-1一抗为CALBIOCHEM公司产品.
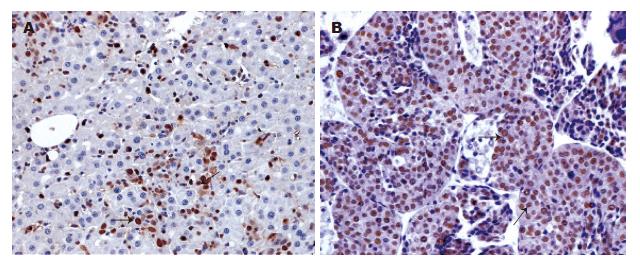
1.2.1 免疫组织化学: 石蜡包埋组织标本行4 mm厚连续切片, 组织切片常规脱蜡、水化, 余后步骤按上海基因公司代理Dako公司二步法抗兔/鼠通用型免疫组化检测试剂盒操作指南进行. 磷酸盐缓冲液(PBS)代替一抗作为阴性对照. 结果判断根据肿瘤细胞染色程度以及阳性细胞所占百分比进行综合评分, PARP-1阳性细胞为细胞核被染成棕黄色, 阳性细胞数≤50%为低表达, 阳性细胞数>50%为高表达. 100倍镜头下随意选取10个视野, 400倍镜头下在每一视野中连续计数100个癌细胞, 记录其中阳性细胞数, 计算阳性细胞百分数, 取平均数.
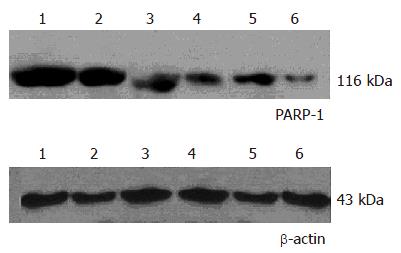
1.2.2 蛋白免疫印迹分析: 肝癌组织和对应癌旁组织以三去污裂解液法(按"分子克隆"配制)提取组织及细胞中蛋白, 每孔加样80 mg蛋白, 以80 g/L SDS-PAGE凝胶电泳分离, 电转印将蛋白质转移到硝酸纤维膜(NC膜), 用含50 g/L脱脂奶粉的TBST缓冲液37 ℃下封闭1 h, 将兔抗人PARP-1一抗和b-actin以含50 g/L脱脂奶粉的TBST缓冲液稀释(1:200), 分别置杂交袋中37 ℃孵育1 h, TBST漂洗数次后, 在1:2000稀释的HRP标记羊抗兔IgG中于37 ℃孵育1 h, TBST漂洗数次, 采用ECL化学发光试剂(美国Pierce生物技术公司)于暗室中进行放射自显影.
统计学处理 采用配对t检验方法检测各组间PARP-1的表达差异. 应用SPSS 12.0统计软件对实验结果进行统计学处理.
PARP-1表达位于细胞核(图1), 在肝癌组织中PARP-1阳性表达细胞的比例明显高于在癌旁组织中PARP-1阳性表达细胞的比例, 分别为61.4%和40.2%, 二者间有显著性差异(t = 6.49, P<0.01); Western blot进一步证实肝癌组织中PARP-1的蛋白表达显著高于其癌旁肝组织(图2).
PARP-1在低分化肝癌中的阳性表达的细胞比例明显高于中高分化肝癌, 分别为70.75%和45.60%, 有显著性差异(t = 4.57, P<0.01). 16例合并有血管内癌栓并在术后半年内复发或转移肝癌中PARP-1阳性表达率为73.0%, 而24例无癌栓且术后半年内无转移复发的肝癌中PARP-1的阳性表达率为43.4%, 差异有显著性(t = 3.33, P<0.01).
肝癌是我国常见的恶性程度极高的肿瘤之一, 手术切除率不足20%. 肝癌对放疗、化疗均不敏感, 对手术切除后复发和转移的病例及不能手术切除的肝癌, 目前尚无有效的药物治疗手段. 深入研究肝癌的发生、转移的分子机制, 探索新的药物治疗靶点对肝癌治疗具有重要意义. 聚腺苷酸二磷酸核糖聚合酶-1[poly(ADP-ribose) polymerase-1, PARP-1]是存在于真核细胞中催化聚ADP核糖化的细胞核酶, 他参与的聚ADP核糖化是真核细胞中蛋白质翻译后的重要修饰方式之一. 最近的研究表明: PARP-1是一种催化以NAD为底物, 将聚ADP核糖多聚体共价连接到受体蛋白上的翻译后修饰酶, 他参与体内DNA修复、染色质结构与功能的调节、细胞程序化死亡等多种重要的生命活动[7-9]. PAPR-1的缺失使细胞对DNA损伤因子易感, 可能参与肿瘤的发生. 体外和体内研究表明抑制PARP-1则可降低DNA修复功能, 增强放疗和化疗对肿瘤的治疗效果[4-6]. 目前PARP-1抑制剂已进入抗肿瘤药物Ⅰ期临床研究. 然而, 对PARP-1的表达与人肝癌恶性生物学特征的关系及PARP-1抑制剂对肝癌的治疗学意义目前尚缺乏深入研究.
Nozaki et al[10]通过破坏PARP外显子1产生PARP-1-/-小鼠, 给予AOM(氧化偶氮甲烷)后PARP-1-/-小鼠结肠腺瘤和腺癌、肝脏结节发生率均明显高于PARP+/+组, 而Nomura et al[11]利用P32标记NAD后多聚ADP核糖基化的蛋白凝胶电泳发现, 肝癌组织中116 kDa蛋白条带明显高于邻近非肿瘤组织, 提示PARP-1在肝癌组织中可能高表达. 对PARP-1在人肝癌中的表达及功能意义目前并不清楚. 我们的研究结果表明, PARP-1在人肝癌中的表达显著高于其在癌旁肝组织中的表达, 表明PARP-1可能参与了肝癌的恶性转化, 与Tsujiuchi et al[12]的研究结论一致. 我们发现, PARP-1在低分化肝癌中的表达显著高于其在中高分化肝癌中的表达, 在有转移及复发肝癌中的表达高于其在无转移及复发肝癌中的表达, 表明肝癌中PARP-1的表达水平与肝癌的恶性生物学特征有密切相关性, PARP-1表达增高可能同时参与肝癌的恶性转化及促进肝癌的恶性生物学表型. 对肝癌中PARP-1表达水平增高的分子机制, 目前尚不清楚. 推测可能与乙肝病毒感染和化学致癌剂产生的DNA损伤诱导机体启动DNA损伤修复机制有关. 如果这一推测得到证实, 那么, 抑制PARP-1, 则可能阻断肝癌中PARP-1介导的DNA损伤修复机制, 可使已损伤的DNA得不到修复, 从而提高放、化疗对肝癌的治疗肝癌效果. 该研究为进一步开展PARP-1抑制剂对肝癌的治疗研究奠定了基础. 本研究的意义在于, 揭示肝癌中PARP-1的表达显著增高, 且其表达水平增高与肝癌的恶性分化及转移复发等生物学特征相关. PARP-1在DNA修复、细胞死亡、增殖分化等机制中发挥着重要作用, 因此通过抑制PARP-1活性对肝癌可能具有潜在治疗价值, 并可能成为肝癌治疗的新方法.
PARP-1是存在于真核细胞中催化聚ADP核糖化的细胞核酶, 自发现40年来, PARP-1在DNA修复、细胞凋亡、增殖分化等方面的作用机制引起广大学者的关注, 并逐渐得到阐明. 他参与的聚ADP核糖化是真核细胞中蛋白质翻译后的重要修饰方法之一, 在DNA修复、细胞凋亡和肿瘤发生过程中发挥着至关重要的作用. 体外和体内研究表明, 抑制PARP-1则可降低DNA修复功能, 增强放疗和化疗对多种肿瘤的治疗效果.
利用调节PARP-1来提高肿瘤治疗效果的研究取得了令人鼓舞的成绩, 目前PARP-1抑制剂已进入抗肿瘤药物Ⅰ期临床研究. 将为对肝癌开展PARP-1抑制剂治疗研究奠定基础.
本研究揭示肝癌中PARP-1的表达显著增高, 且其表达水平增高与肝癌的恶性分化及转移复发等生物学特征相关. 通过抑制PARP-1活性对肝癌可能具有潜在治疗价值, 并可能成为肝癌治疗的新方法. 下一步我们可以通过PARP-1抑制剂对肝癌进行体外研究.
本文通过研究PARP-1在肝癌及癌周肝组织中的表达, 以及其表达水平与肝癌生物学特征的关系, 发现PARP-1基因在肝癌组织中表达显著上调, 且PARP-1表达上调与肝癌的恶性分化及转移复发有密切关系, 提示PARP-1的表达可能与肝癌发生、转移及复发密切相关. 论文研究目的明确, 方法可靠, 实验设计合理, 研究结果有临床指导意义.
电编: 张敏 编辑:潘伯荣
| 1. | Rouleau M, Aubin RA, Poirier GG. Poly(ADP-ribosyl)ated chromatin domains: access granted. J Cell Sci. 2004;117:815-825. [PubMed] [DOI] |
| 2. | Koh DW, Dawson TM, Dawson VL. Mediation of cell death by poly(ADP-ribose) polymerase-1. Pharmacol Res. 2005;52:5-14. [PubMed] [DOI] |
| 3. | Tong WM, Cortes U, Hande MP, Ohgaki H, Cavalli LR, Lansdorp PM, Haddad BR, Wang ZQ. Synergistic role of Ku80 and poly(ADP-ribose) polymerase in suppressing chromosomal aberrations and liver cancer formation. Cancer Res. 2002;62:6990-6996. [PubMed] |
| 4. | Calabrese CR, Almassy R, Barton S, Batey MA, Calvert AH, Canan-Koch S, Durkacz BW, Hostomsky Z, Kumpf RA, Kyle S. Anticancer chemosensitization and radiosensitization by the novel poly(ADP-ribose) polymerase-1 inhibitor AG14361. J Natl Cancer Inst. 2004;96:56-67. [PubMed] [DOI] |
| 5. | Miknyoczki SJ, Jones-Bolin S, Pritchard S, Hunter K, Zhao H, Wan W, Ator M, Bihovsky R, Hudkins R, Chatterjee S. Chemopotentiation of temozolomide, irinotecan, and cisplatin activity by CEP-6800, a poly(ADP-ribose) polymerase inhibitor. Mol Cancer Ther. 2003;2:371-382. [PubMed] |
| 6. | Brock WA, Milas L, Bergh S, Lo R, Szabo C, Mason KA. Radiosensitization of human and rodent cell lines by INO-1001, a novel inhibitor of poly(ADP-ribose) polymerase. Cancer Lett. 2004;205:155-160. [PubMed] [DOI] |
| 7. | Alkhatib HM, Chen DF, Cherney B, Bhatia K, Notario V, Giri C, Stein G, Slattery E, Roeder RG, Smulson ME. Cloning and expression of cDNA for human poly(ADP-ribose) polymerase. Proc Natl Acad Sci USA. 1987;84:1224-1228. [PubMed] [DOI] |
| 8. | Schreiber V, Hunting D, Trucco C, Gowans B, Grunwald D, De Murcia G, De Murcia JM. A dominant-negative mutant of human poly(ADP-ribose) polymerase affects cell recovery, apoptosis, and sister chromatid exchange following DNA damage. Proc Natl Acad Sci USA. 1995;92:4753-4757. [PubMed] [DOI] |
| 9. | Cleaver JE, Morgan WF. Poly(ADP-ribose) poly-merase: a perplexing participant in cellular responses to DNA breakage. Mutat Res. 1991;257:1-18. [PubMed] [DOI] |
| 10. | Nozaki T, Fujihara H, Watanabe M, Tsutsumi M, Nakamoto K, Kusuoka O, Kamada N, Suzuki H, Nakagama H, Sugimura T. Parp-1 deficiency implicated in colon and liver tumorigenesis induced by azoxymethane. Cancer Sci. 2003;94:497-500. [PubMed] [DOI] |
| 11. | Nomura F, Yaguchi M, Togawa A, Miyazaki M, Isobe K, Miyake M, Noda M, Nakai T. Enhancement of poly-adenosine diphosphate-ribosylation in human hepatocellular carcinoma. J Gastroenterol Hepatol. 2000;15:529-535. [PubMed] [DOI] |
| 12. | Tsujiuchi T, Tsutsumi M, Denda A, Kondoh S, Nakae D, Maruyama H, Konishi Y. Possible involvement of poly ADP-ribosylation in phenobarbital promotion of rat hepatocarcinogenesis. Carcinogenesis. 1990;11:1783-1787. [PubMed] [DOI] |