修回日期: 2006-05-22
接受日期: 2006-06-08
在线出版日期: 2006-07-18
目的: 探讨磷脂酰肌醇3激酶/蛋白激酶B (PI3K/PKB)信号转导通路在重症急性胰腺炎中性粒细胞活化中的作用.
方法: 健康成年♂SD大鼠30只, 随机分为对照组、SAP组和SAP+wortmannin组, 每组10只. 胆胰管内逆行注射法制作SAP模型, 模型制成6 h后采用密度梯度离心方法分离出中性粒细胞, 用ELISA法检测血中TNF-α和IL-1β的含量, RT-PCR技术检测中性粒细胞内TNF-α和IL-1β mRNA的变化, Western blot法检测细胞中PKB的活性变化.
结果: 胰腺炎大鼠血中TNF-α和IL-1β的含量较对照组明显升高(150.8±31.7 ng/L vs 22.4±5.2 ng/L, P<0.01; 217.5±38.4 ng/Lvs 43.7±9.6 ng/L, P<0.01), 同时中性粒细胞内TNF-α和IL-1β mRNA及p-PKB的水平也明显升高(0.72±0.06 vs 0.19±0.03,P<0.01; 0.84±0.11 vs 0.14±0.04, P<0.01; 0.63±0.08 vs 0.34±0.03, P<0.01), wortmannin能显著抑制血中TNF-α(70.9±11.3 vs 150.8±31.7 ng/L)和IL-1β (93.0±11.5 vs 217.5±38.4 ng/L)含量, 中性粒细胞中TNF-α和IL-1β mRNA (0.32±0.04 vs 0.72±0.06及0.22±0.04 vs 0.84±0.11, P<0.01)的表达及PKB活性(0.38±0.06 vs 0.63±0.08, P<0.01)也显著下降.
结论: PI3K/PKB信号转导通路介导了重症急性胰腺炎大鼠中性粒细胞的活化及促炎性细胞因子TNF-α和IL-1β的产生.
引文著录: 张成, 栾正刚, 葛春林, 郭仁宣. 磷脂酰肌醇3激酶/蛋白激酶B信号转导通路在重症急性胰腺炎中性粒细胞活化中的作用. 世界华人消化杂志 2006; 14(20): 1987-1991
Revised: May 22, 2006
Accepted: June 8, 2006
Published online: July 18, 2006
AIM: To investigate the role of phosphatidy-linositol 3-kinase/protein kinase B (PI3K/PKB) signal transduction pathway in the activation of neutrophils during severe acute pancreatitis (SAP).
METHODS: Thirty male health adult Sprague Dawley rats were averagely randomized into group A, B and C. SAP model was established in group B and C by retrograde injection of 50 g/L sodium taurocholate into the pancreatic and biliary duct. The rats in group C were treated with wortmannin 4 h before modeling, and those in group A served as the controls. All the rats were killed 6 h after modeling, and the neutrophils were isolated by density gradient centrifugation. The serum levels of tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) were analyzed by enzyme-linked immunosorbent assay (ELISA). The expression of TNF-α and IL-1β mRNA were detected by RT-PCR and the activity of phosphorylated PKB (p-PKB) was examined by Western blot.
RESULTS: The serum levels of TNF-α and IL-1β were significantly higher in group B than those in group A (150.8 ± 31.7 ng/L vs22.4 ± 5.2 ng/L, P < 0.01; 217.5 ± 38.4 ng/L vs 43.7 ± 9.6 ng/L, P < 0.01), and mRNA levels of TNF-α and IL-1β were also markedly increased (0.72 ± 0.06 vs 0.19 ± 0.03, P < 0.01; 0.84 ± 0.11 vs 0.14 ± 0.04, P < 0.01). However, the serum and mRNA levels of TNF-α and IL-1β were all significantly decreased in group C in comparison with those in group B (TNF-α: 70.9 ± 11.3 ng/L, 0.32 ± 0.04; IL-1β: 93.0 ± 11.5 ng/L, 0.22 ± 0.04; all P < 0.01). Western blot showed that the activity of p-PKB was increased in group B as compared with that in group A (0.63 ± 0.08 vs 0.34 ± 0.03, P < 0.01), but it was markedly down-regulated in group C (0.38 ± 0.06, P < 0.01).
CONCLUSION: PI3K/PKB signal transduction pathway is activated in the neutrophils during severe acute pancreatitis, which mediates the production of pro-inflammatory cytokines TNF-α and IL-1β.
- Citation: Zhang C, Luan ZG, Ge CL, Guo RX. Role of phosphatidylinositol 3-kinase/protein kinase B signal transduction pathway in activation of neutrophils during severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2006; 14(20): 1987-1991
- URL: https://www.wjgnet.com/1009-3079/full/v14/i20/1987.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i20.1987
中性粒细胞在重症急性胰腺炎(severe acute pancreatitis, SAP)时被过度激活并产生大量炎性介质, 在机体全身炎症反应过程中发挥了重要作用[1-4], 但中性粒细胞如何被激活并产生炎性介质目前仍不清楚. 大量研究表明磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase, PI3K)信号转导通路在脓毒败血症、过度机械通气等原因造成的中性粒细胞活化过程中发挥了重要的调节作用, 抑制PI3K信号转导通路的激活可以明显减轻这些病理状态的炎症反应[5-6]; 同时也有研究表明, 阻断PI3K转导通路可以减轻SAP时的胰腺炎症及中性粒细胞浸润[7-8]. 因此我们探讨PI3K信号转导通路在SAP中性粒细胞活化中的作用, 以了解PI3K信号转导通路对SAP全身炎症反应的调控机制.
Wortmannin (PI3K抑制剂)和牛磺胆酸钠, Sigma公司; 戊巴比妥钠, 东北制药厂; 淋巴细胞分离液(Ficoll-Paque Plus), Amersham Biosciences公司; 葡聚糖T-500, Pharmacia公司; TNF-α和IL-1β的ELISA试剂盒, 深圳晶美公司; AKT及p-AKT抗体, Cell Signaling Technology公司; RNA提取及PCR扩增试剂盒, TaKaRa公司; PCR仪及电泳仪; 凝胶扫描分析系统, 美国Kodak; 大鼠TNF-α引物序列: 上游5'-GGCCACCACGCTCTTCTG-3', 下游5'-GCCATTGGCCAGGAGGGC-3', 扩增片段229 bp; IL-1β引物序列: 上游5'-AGAAGCTGTGGCAGCTACCT-3'; 下游5'-TTGGGATCCACACTCTCCAG-3', 扩增片段400 bp; b-actin引物序列: 上游5'-GCCAACCGTGAAAAGATG-3', 下游5'-CCAGGATAGAGCCACCAAT-3', 扩增片段700 bp. 健康的成年♂SD大鼠30只, 体质量250-300 g, 购自中国医科大学动物部.
大鼠随机分为对照组、SAP组和SAP+ wortmannin组, 每组10只. 采用胆胰管内逆行注射法制作SAP模型. 大鼠试验前12 h禁食, 自由饮水. 用20 g/L戊巴比妥钠(1 mL/kg)ip麻醉后, 取上腹正中切口, 切开4 cm, 进入腹腔后提起十二指肠显露胰腺, 从乳头处的十二指肠壁进针, 逆行穿刺胆胰管并固定, 同时用动脉夹阻断胆胰管的肝门端, 以0.2 mL/min的速度向胆胰管内匀速注入50 g/L牛磺胆酸钠(1 mL/kg), 注射后用动脉夹夹闭穿刺处5 min, 以防药液溢出并保持胰管内压力, 然后关腹, 对照组给与等量盐水注射. SAP+wortmannin组于制模前4 h给与wortmannin 1.4 mg/kg ip[9], 对照组和SAP组给与等量对应溶剂. 各组大鼠在模型制成6 h后处死, 心脏穿刺取血分离中性粒细胞及血清. 密度梯度离心法分离中性粒细胞[10-11]. 大鼠血肝素抗凝(25 kU肝素/L)后加入50 g/L葡聚糖至终质量浓度为10 g/L. 混匀后室温下静置40 min, 吸取上层清液并轻轻置于淋巴细胞分离液上, 2000 r/min离心40 min后, 弃除血浆层、单个核细胞层、分离液层, 留下的即为中性粒细胞和残留红细胞, 加入相当于细胞团块9倍体积的0 ℃氯化铵溶液(NH4Cl 155 mmol/L, KHCO3 10 mmo/L, EDTA 0.1 mmol/L), 混匀后在0 ℃静置7 min, 溶解残存的红细胞, 1500 r/min离心10 min后弃上清, 留下的即为中性粒细胞. 这种方法分离的中性粒细胞经台盼蓝染色证实存活率大于95%, 瑞氏染色证明纯度大于98%. 以PBS洗2次后收集细胞, 提取总RNA和胞质蛋白, 行RT-PCR和Western blot检测. 用ELISA法检测血中TNF-α和IL-1β的含量, 严格按照说明书操作.
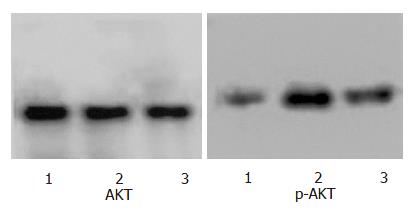
1.2.1 Western blot检测中性粒细胞AKT及p-AKT的活性: 中性粒细胞团块加入细胞裂解液, 2000 g离心20 min, 收集上清液, 考马斯亮蓝法进行蛋白定量. SDS-PAGE分离样品(40 mg)后电转移至硝酸纤维膜上, 封闭后, 加入一抗(AKT或p-AKT)(1:1000)室温下免疫沉淀1 h, 摇洗后加入标记二抗(1:2000), 室温下作用2 h. ECL浸膜, 显影. 照片在图像分析仪上进行分析定量, 记录相应蛋白条带的平均光强度值, 并计算p-AKT和AKT吸光度值的比值.
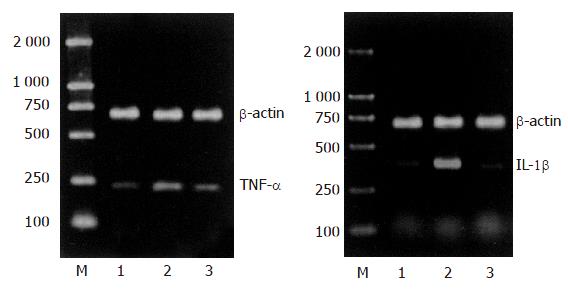
1.2.2 RT-PCR检测中性粒细胞TNF-α mRNA和IL-1β mRNA: 采用TaKaRa公司RNA提取试剂盒提取细胞中的总RNA, 紫外分光光度计测定A260:A280比值, 该值稳定于1.8-2.0. 按试剂盒说明合成cDNA后取反转录产物, 加入PCR反应体系, 扩增目的基因, PCR反应按下列条件循环: 94 ℃ 预变性2 min, 然后94 ℃ 30 s, 58 ℃ 30 s, 72 ℃40 s, 进行30个循环后, 72 ℃延伸10 min. 反应完成后将PCR扩增产物(TNF-α, IL-1β, b-actin的cDNA)用15 g/L琼脂糖凝胶电泳检测, 凝胶用凝胶扫描分析系统扫描, 计算目的基因与相对b-actin表达量的比值.
统计学处理 所有数据均以mean±SD表示, 采用单因素方差分析, 经SPSS 11.0统计分析软件处理完成.
与正常对照组相比SAP模型制成6 h后血中TNF-α和IL-1β含量明显升高(P<0.01), SAP+wortmannin组大鼠血中的TNF-α和IL-1β含量显著低于SAP组(P<0.01, 表1).
中性粒细胞在基础状态下PKB总蛋白表达丰富, 但磷酸化水平较低(图1, 表1). SAP模型制成6 h后中性粒细胞内PKB磷酸化迅速升高, 较对照组增加明显(P<0.01), 在SAP模型制成前给与wortmannin阻断后, 中性粒细胞内PKB的磷酸化被明显抑制, 与SAP组相比差异显著(P<0.01, 表1).
中性粒细胞是白细胞家族众多成员中最大的组成部分, 占白细胞总数的50%-70%, 同时也是机体清除侵入细菌、异物的重要载体, 具有重要的防御屏障作用. 但大量研究表明, 中性粒细胞也是机体炎性介质如ROS、蛋白酶、脂类介质和TNF-α, IL-1β等细胞因子的主要来源, 是感染、创伤、烧伤等全身炎症反应的中心环节[12-14], 具有重要的病理意义. 1988年Rinderknecht提出急性胰腺炎的白细胞过度激活学说[15]以后, 人们逐渐认识到重症急性胰腺炎(severe acute pancreatitis, SAP)死亡率和并发症发生率高的根本原因是由于过度放大的全身炎症反应没有得到有效的控制, 而中性粒细胞在其中发挥了核心的作用[16]. 因此如果能够控制SAP时中性粒细胞的过度激活, 就可能通过减少炎性介质的产生进而减弱SAP的炎症反应, 进而成为治疗SAP的新切入点.
细胞受到外界因素刺激后是通过蛋白质磷酸化(细胞内信号转导)来快速向细胞内传递信息. 阻断中性粒细胞活化后的细胞内信号转导, 就可以通过控制其活化而减轻炎症反应. 目前SAP时中性粒细胞活化后的细胞内信号转导途径仍不清楚, 但大量研究发现严重感染、创伤及大面积烧伤等全身炎症反应综合征状态下, 活化的中性粒细胞主要通过PI3K及其下游的蛋白激酶B (protein kinase B, PKB)信号转导通路调节自身的活化、趋化和凋亡[5-6,17-19]. 近期也有研究发现使用PI3K基因敲除鼠制成的胰腺炎模型, 其炎症反应明显减轻[7]. 因此我们探讨了PI3K信号转导通路在SAP中性粒细胞活化中的作用.
正常中性粒细胞中PKB总蛋白表达较为丰富, 但是磷酸化PKB的水平较低; SAP形成后PKB磷酸化明显升高, 显著高于正常对照组, 同时中性粒细胞内的TNF-α和IL-1β mRNA水平及血中TNF-α和IL-1β含量也明显增加, 这表明SAP大鼠的中性粒细胞中PI3K信号转导通路显著活化并介导了炎性介质的产生. 使用PI3K信号转导通路抑制剂wortmannin后中性粒细胞内PKB的活化被明显抑制, 同时也显著降低了细胞TNF-α和IL-1β mRNA的表达及血中TNF-α和IL-1β的含量. 这进一步表明PI3K信号转导通路调控了SAP中性粒细胞的活化及TNF-α、IL-1β的产生, 在SAP的全身炎症反应中发挥了核心作用. PI3K是普遍存在于各种细胞的异二聚体酯类激酶复合物, 研究显示中性粒细胞内PI3K活化后, 活化的PKB可以导致IkBa磷酸化, 致使IkBa与核因子NF-κB解离[20-21], NF-κB被活化并入核, 结合到特定的启动子或促进子上进而提高炎性介质基因的转录活性, 最终导致细胞产生大量细胞因子[22-23]. SAP时PI3K信号转导通路是否也是按照这一模式传递信息还需要进一步的实验来证实, 同时还需要明确是否存在其他的转导通路与之并行或交叉.
本试验结果表明, SAP可以导致中性粒细胞PI3K信号转导通路的活化, 但其机制目前仍不清楚. 异位释放入血的胰蛋白酶[24]、肠道细菌内毒素移位入血[5]、氧自由基[25-26]产生增多都可能直接活化PI3K. 目前尚不清楚是一种还是多种刺激因素联合导致了中性粒细胞的活化, 这也需要进一步的研究. 本实验首次证实了PI3K信号转导通路在SAP中性粒细胞活化过程中发挥了重要调控作用,这将有助于我们从新的角度认识和了解SAP的发病本质, 并为采取积极的干预措施提供了理论依据.
白细胞被过度激活在重症急性胰腺炎的发生、发展过程中发挥了重要的作用, 是造成炎症反应过度放大的根本原因. 因此阐明激活中性粒细胞的致病因子及中性粒细胞活化后的细胞内信号转导通路必将有助于深入理解重症急性胰腺炎全身炎症反应综合征的发病机制, 同时也为寻找有效的炎症反应控制方法提供了新的思路. 本研究就PI3K/PKB信号转导通路在重症急性胰腺炎中的作用进行了研究.
大量研究表明在多种急性炎症反应状态下中性粒细胞主要是通过PI3K/PKB信号转导通路调节细胞的迁移、凋亡及炎性介质的产生. 重症急性胰腺炎时中性粒细胞是否也通过PI3K/PKB信号转导通路调节细胞炎症反应至今未见报道.
现已研究发现革兰氏阴性杆菌感染、机械通气造成的创伤、烧伤等炎症反应状态下中性粒细胞内的PI3K/PKB信号转导通路被激活, 并发挥了重要的调节作用.
本文的创新之处在于首次探讨了重症急性胰腺炎时中性粒细胞的活化机制问题, 并且阐明了PI3K/PKB信号转导通路在中性粒细胞活化及释放炎性介质TNF-α和IL-1β过程中的作用.
本研究初步探讨了重症急性胰腺炎中性粒细胞的活化机制, 为进一步研究通路的上、下游及可能存在的并行通路提供了前期基础, 同时研究也为控制炎症反应提供了一种新的思路, 并为临床开发新药控制炎症反应提供了理论依据.
磷脂酰肌醇3激酶(PI3K)家族: 是一类特异性地催化磷脂酰肌醇3位羟基磷酸化, 产生具有第二信使作用的激醇脂物质的激酶. 研究表明, PI3K家族与细胞增殖、抗凋亡、细胞迁移、膜泡转运、细胞癌性转化等过程相关. 近期研究发现在急性胰腺炎中也发挥了重要作用.
本文用急性重症胰腺炎的动物模型观察了PI3K/PKB信号传导通路在介导中性粒细胞的活化及促炎因子产生的作用, 立题较新颖, 对临床治疗急性重症胰腺炎具有一定的指导意义.
电编: 张敏 编辑:潘伯荣
| 1. | Chiu DF, Chen JC, Chen HM, Ng CJ, Shyr MH, Chen MF. Results of treating severe acute pancrea-titis with gabexate is associated with neutrophil apoptosis activity. Hepatogastroenterology. 2003;50:553-558. [PubMed] |
| 2. | Zhao H, Chen JW, Zhou YK, Zhou XF, Li PY. Influence of platelet activating factor on expression of adhesion molecules in experimental pancreatitis. World J Gastroenterol. 2003;9:338-341. [PubMed] [DOI] |
| 3. | Brady M, Bhatia M, Christmas S, Boyd MT, Neopto-lemos JP, Slavin J. Expression of the chemokines MCP-1/JE and cytokine-induced neutrophil chemoattractant in early acute pancreatitis. Pancreas. 2002;25:260-269. [PubMed] [DOI] |
| 4. | Frossard JL, Saluja AK, Mach N, Lee HS, Bhagat L, Hadenque A, Rubbia-Brandt L, Dranoff G, Steer ML. In vivo evidence for the role of GM-CSF as a mediator in acute pancreatitis-associated lung injury. Am J Physiol Lung Cell Mol Physiol. 2002;283:L541-L548. [PubMed] [DOI] |
| 5. | Yum HK, Arcaroli J, Kupfner J, Shenkar R, Penninger JM, Sasaki T, Yang KY, Park JS, Abraham E. Involvement of phosphoinositide 3-kinases in neutrophil activation and the development of acute lung injury. J Immunol. 2001;167:6601-6608. [PubMed] [DOI] |
| 6. | Uhlig U, Fehrenbach H, Lachmann RA, Goldmann T, Lachmann B, Vollmer E, Uhlig S. Phosphoino-sitide 3-OH kinase inhibition prevents ventilation-induced lung cell activation. Am J Respir Crit Care Med. 2004;169:201-208. [PubMed] [DOI] |
| 7. | Lupia E, Goffi A, De Giuli P, Azzolino O, Bosco O, Patrucco E, Vivaldo MC, Ricca M, Wymann MP, Hirsch E. Ablation of phosphoinositide 3-kinase-gamma reduces the severity of acute pancreatitis. Am J Pathol. 2004;165:2003-2011. [PubMed] [DOI] |
| 8. | Gukovsky I, Cheng JH, Nam KJ, Lee OT, Lugea A, Fischer L, Penninger JM, Pandol SJ, Gukovskaya AS. Phosphatidylinositide 3-kinase gamma regulates key pathologic responses to cholecystokinin in pancreatic acinar cells. Gastroenterology. 2004;126:554-566. [PubMed] [DOI] |
| 9. | Singh VP, Saluja AK, Bhagat L, van Acker GJ, Song AM, Soltoff SP, Cantley LC, Steer ML. Phosphatidy-linositol 3-kinase-dependent activation of trypsino-gen modulates the severity of acute pancreatitis. J Clin Invest. 2001;108:1387-1395. [PubMed] [DOI] |
| 10. | Tudan C, Jackson JK, Blanis L, Pelech SL, Burt HM. Inhibition of TNF-αlpha-induced neutrophil apoptosis by crystals of calcium pyrophosphate dihydrate is mediated by the extracellular signal-regulated kinase and phosphatidylinositol 3-kinase/Akt pathways up-stream of caspase 3. J Immunol. 2000;165:5798-5806. [PubMed] [DOI] |
| 11. | Kilpatrick LE, Lee JY, Haines KM, Campbell DE, Sullivan KE, Korchak HM. A role for PKC-delta and PI 3-kinase in TNF-αlpha-mediated antiapoptotic signaling in the human neutrophil. Am J Physiol Cell Physiol. 2002;283:C48-C57. [PubMed] [DOI] |
| 12. | Meliton AY, Munoz NM, Lambertino A, Boetticher E, Learoyd J, Zhu X, Leff AR. PDE4-inhibition on {beta}2-integrin Adhesion Caused by LTB4 and TNF{alpha} in Human Neutrophils. Eur Respir J. 2006;. [PubMed] [DOI] |
| 13. | Card JW, Carey MA, Bradbury JA, Degraff LM, Morgan DL, Moorman MP, Flake GP, Zeldin DC. Gender differences in murine airway responsive-ness and lipopolysaccharide-induced inflammation. J Immunol. 2006;177:621-630. [PubMed] [DOI] |
| 14. | Agren J, Thiemermann C, Foster SJ, Wang JE, Aasen AO. Cytokine responses to CpG DNA in human leukocytes. Scand J Immunol. 2006;64:61-68. [PubMed] [DOI] |
| 15. | Rinderknecht H. Fatal pancreatitis, a consequence of excessive leukocyte stimulation? Int J Pancreatol. 1988;3:105-112. [PubMed] |
| 16. | Kyriakides C, Jasleen J, Wang Y, Moore FD Jr, Ashley SW, Hechtman HB. Neutrophils, not complement, mediate the mortality of experimental hemorrhagic pancreatitis. Pancreas. 2001;22:40-46. [PubMed] [DOI] |
| 17. | Adib-Conquy M, Moine P, Asehnoune K, Edouard A, Espevik T, Miyake K, Werts C, Cavaillon JM. Toll-like receptor-mediated tumor necrosis factor and interleukin-10 production differ during systemic inflammation. Am J Respir Crit Care Med. 2003;168:158-164. [PubMed] [DOI] |
| 18. | Pawlik TM, Lohmann R, Souba WW, Bode BP. Hepatic glutamine transporter activation in burn injury: role of amino acids and phosphatidylinositol-3-kinase. Am J Physiol Gastrointest Liver Physiol. 2000;278:G532-G541. [PubMed] |
| 19. | Strommer L, Permert J, Arnelo U, Koehler C, Isaksson B, Larsson J, Lundkvist I, Bjornholm M, Kawano Y, Wallberg-Henriksson H. Skeletal muscle insulin resistance after trauma: insulin signaling and glucose transport. Am J Physiol. 1998;275:E351-E358. [PubMed] |
| 20. | Li Z, Jiang H, Xie W, Zhang Z, Smrcka AV, Wu D. Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction. Science. 2000;287:1046-1049. [PubMed] [DOI] |
| 21. | Hirsch E, Katanaev VL, Garlanda C, Azzolino O, Pirola L, Silengo L, Sozzani S, Mantovani A, Altruda F, Wymann MP. Central role for G protein-coupled phosphoinositide 3-kinase gamma in inflammation. Science. 2000;287:1049-1053. [PubMed] [DOI] |
| 22. | Strassheim D, Kim JY, Park JS, Mitra S, Abraham E. Involvement of SHIP in TLR2-induced neutrophil activation and acute lung injury. J Immunol. 2005;174:8064-8071. [PubMed] [DOI] |
| 23. | Arndt PG, Suzuki N, Avdi NJ, Malcolm KC, Worthen GS. Lipopolysaccharide-induced c-Jun NH2-terminal kinase activation in human neutrophils: role of phosphatidylinositol 3-Kinase and Syk-mediated pathways. J Biol Chem. 2004;279:10883-10891. [PubMed] [DOI] |
| 24. | Namkung W, Han W, Luo X, Muallem S, Cho KH, Kim KH, Lee MG. Protease-activated receptor 2 exerts local protection and mediates some systemic complications in acute pancreatitis. Gastroenterology. 2004;126:1844-1859. [PubMed] [DOI] |
| 25. | Reistad T, Mariussen E. A commercial mixture of the brominated flame retardant pentabrominated diphenyl ether (DE-71) induces respiratory burst in human neutrophil granulocytes in vitro. Toxicol Sci. 2005;87:57-65. [PubMed] [DOI] |