修回日期: 2006-05-02
接受日期: 2006-05-08
在线出版日期: 2006-07-18
目的: 观测双氢青蒿素(dihydroartemisinin, DHA)对体外培养的蓝氏贾第鞭毛虫滋养体细胞骨架的损伤作用.
方法: 将用含双氢青蒿素的改良TYI-S-33培养基培养后的蓝氏贾第鞭毛虫滋养体, 用专一性结合f-肌动蛋白(f-actin)的荧光染料罗丹明-鬼笔环肽(rhodanmine phalloidin, RDP)标记微丝, 结合微管的紫杉醇(Paclitaxel, Oregen Green 488, P22310)标记微管, 用流式细胞术(flow cytometry, FCM)检测、分析, 用激光共聚焦显微镜(confocal microscopy, CFM)观察滋养体微丝和微管的变化.
结果: 经双氢青蒿素0.002 mg/L (LC50)作用12 h, RDP标记后, 流式细胞仪检测结果显示, 滋养体的微丝结构有明显的损伤, 其FCM激发光荧光强度值(16.18±11.02)明显低于对照组(81.7±6.43), 二者有显著性差异(P<0.01); 激光共聚焦显微镜观察显示, 虫体形态及轮廓不完整. 经P22310标记后, 共聚焦显微镜下显示, 虫体的吸盘和鞭毛轮廓不清, 荧光强度降低或消失, 实验组吸盘面积的荧光强度值与对照组比较有显著性差异(χ2 = 3.154, P<0.01).
结论: 双氢青蒿素对体外蓝氏贾第鞭毛虫滋养体的细胞骨架有明显的损伤作用.
引文著录: 田喜凤, 卢思奇, 尚红伟, 王凤云. 双氢青蒿素对体外蓝氏贾第鞭毛虫滋养体细胞骨架的损伤作用. 世界华人消化杂志 2006; 14(20): 1977-1981
Revised: May 2, 2006
Accepted: May 8, 2006
Published online: July 18, 2006
AIM: To detect and observe the effect of dihydroartemisinin on the cytoskeleton of Giardia lamblia in vitro.
METHODS: The trophozoites of G. lamblia were cultivated axenically with modified TYI-S-33 medium contained dihydroartemisinin (0.002 mg/L) for 12 h and then stained by rhodanmine phalloidin (RDP) and paclitaxel (P22310). The cytoskeletons of the organisms were detected and analyzed by flow cytometry, and then observed by confocal microscopy.
RESULTS: The cytoskeleton of trophozoites was markedly damaged after treatment with 0.002 mg/L dihydroartemisinin for 12 h. The fluorescence intensity value of excitation light of the parasites (16.18 ± 11.02) was less than that of the controls (81.7 ± 6.43) after stained by RDP, and the difference was significant (P < 0.01). The confocal microscopic observation showed that the outlines of the organisms were unintact. After stained by P22310, the adhesive discs and flagella were obscured and the fluorescence intensity was weak. The intensity value of the adhesive disc area was significantly different between experiment group and control group (χ2 = 3.154, P < 0.01).
CONCLUSION: The cytoskeleton of G. lamblia can be effectively injured by dihydroartemisinin.
- Citation: Tian XF, Lu SQ, Shang HW, Wang FY. Effect of dihydroartemisinin on the cytoskeleton of Giardia lamblia trophozoites in vitro. Shijie Huaren Xiaohua Zazhi 2006; 14(20): 1977-1981
- URL: https://www.wjgnet.com/1009-3079/full/v14/i20/1977.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i20.1977
蓝氏贾第鞭毛虫(Giardia lamblia, 亦称G. intestinalis或G. duodenalis, 简称贾第虫)寄生于人体小肠, 引起以腹泻和消化不良为主要症状的蓝氏贾第鞭毛虫病(giardiasis, 简称贾第虫病). 呈慢性感染的儿童, 可因吸收不良而造成发育障碍. 本虫也可偶尔侵犯胆道系统造成炎性病变[1]. 贾第虫感染不仅在发展中国家流行广泛, 即使在美国他也是水传腹泻爆发流行的最常见原因. 在特定区域, 被贾第虫包囊污染的水源常引起旅游者腹泻[2]. 自1681年荷兰学者Van Leewenhoek发现本虫以来, 贾第虫作为腹泻病原体的历史已长达300多年之久, 但虫体导致宿主腹泻的机制尚未完全明了, 一般认为本虫滋养体借助其腹吸盘和鞭毛的协助, 吸附于小肠上皮细胞表面, 覆盖小肠黏膜并直接损伤肠黏膜细胞, 致使肠微绒毛变短、变粗, 甚至萎缩, 从而导致营养物质吸收障碍及腹泻[3]. 研究表明, 贾第虫虽然是一种较低等的真核生物, 但确有与其他生物相似的高度发达而复杂的细胞骨架系统. 吸盘和鞭毛主要由大量微丝和微管等细胞骨架成分构成[4]. 新近的研究表明, 在分类学上同属于鞭毛虫的阴道毛滴虫和利什曼原虫对双氢青蒿素的作用十分敏感, 其对阴道毛滴虫的杀灭作用机制是通过破坏虫体的微丝结构, 进而造成虫体细胞骨架严重受损, 导致细胞破裂死亡[5]. 这些结果启示我们以贾第虫的细胞骨架成分作为研究抗贾第虫药物的作用靶点.
双氢青蒿素粉剂(原药批号010904)由北京丰台科技园生物技术公司藤海宁女士惠赠. 蓝氏贾第鞭毛虫虫株(C2)系从四川省一名腹泻患者体内分离建立的纯培养虫株[3]. 罗丹明鬼笔环肽(rhodanmine phalloidin, RDP)和紫杉醇(Paclitaxel, Oregen Green 488, P22310)购自Invitrogen公司. 将液氮内冻存的C2株贾第虫复苏. 置含改良TYI-S-33培养基的10 mL硼酸硅培养瓶内[6], 于37 ℃培养. 48-72 h后(虫体呈对数生长), 选取虫体贴满瓶壁的培养管, 置4 ℃冰浴15 min, 在双手掌间滚搓培养管数次, 使贴壁生长的虫体完全自管壁脱落, 用血球计数板计数虫数, 再用培养基将虫液密度调至6×109-10×109个滋养体/L.
将双氢青蒿素原粉用Tuwee80研磨成乳液后(在显微镜下观察确认无药物结晶颗粒), 再用改良TYI-S-33培养基配制成浓度为0.2 g/L药液. 实验分4组: 双氢青蒿素组(DHA 0.002 mg/L作用后, 用RDP标记)、阳性对照组(正常贾第虫滋养体用RDP标记)、阴性对照组(正常贾第虫滋养体不用RDP标记)、甲硝唑(metronidazole, MTZ)组(MTZ 0.005 mg/L作用后, 用RDP标记). 将上述各组培养物置37 ℃培养12 h, 用倒置显微镜观察, 待虫体已全部脱壁, 离心(1000 r/min, 5 min), 弃上清, PBS (pH 7.4)洗涤2次, 离心5 min, 弃上清, 收集虫体, 将虫液密度调至2×109/L, 移入1.5 mL Eppendorf管备用.
1.2.1 流式细胞术样本制备及检测: 将DHA组、阳性对照组和MTZ组的虫体, 分别用PBS 200 mL悬浮, 各加入10 mL罗丹明(rhodanmine)-鬼笔环肽(phalloidin), 室温静置20 min, 使其染色标记, 阴性对照组不做上述标记. PBS洗涤1次, 加入40 g/L多聚甲醛固定, 用前以PBS洗1次, 调细胞密度至1×109/L. 用COUNTER-EPIC®XL流式细胞仪检测分析(上述实验均各重复3次).
1.2.2 激光共聚焦显微镜样本制备及观察:
1.2.2.1 罗丹明-鬼笔环肽标记: 取上述虫体标本, PBS (0.01 mol/L, pH 7.4)漂洗2次, 离心(1000 r/min, 5 min), 750 mL/L乙醇固定, 4 ℃过夜, PBS (0.01 mol/L, pH 7.4)漂洗2次, 离心(同上). 加入10 g/L TritonX-100 (PBS配制)200 mL, 室温静置5 min, PBS漂洗2次, 弃上清将虫体悬浮于10 g/L BSA (PBS配制)200 mL, 室温放置30 min, PBS漂洗2次, 加入PBS 200 mL重悬细胞, 加罗丹明标记的鬼笔环肽(200 000 U/L, 溶于甲醇)10 mL混匀, 室温避光静置20 min, PBS漂洗1次, 离心5 min. 用PBS 50 mL悬浮虫体, 取虫液滴在载玻片上, 加盖玻片, 用Bio_Rad. Radiance 2100TM激光共聚焦显微镜观察(吸收波长540 nm, 发射波长566 nm)和Lasersharp 2000软件分析, 摄像.
1.2.2.2 紫杉醇标记: 取上述双氢青蒿素组(DHA组)和正常对照组虫液1 mL (1×109/L), 加入1 mL紫杉醇(1 mol/L), 37 ℃温箱孵育1 h后, 再用PBS(含20 g/L BSA)冲洗2次, 4 ℃避光, 静置, 滴片, Leica, TCS, SP5激光共聚焦显微镜观察摄片. LAS, AF软件分析.
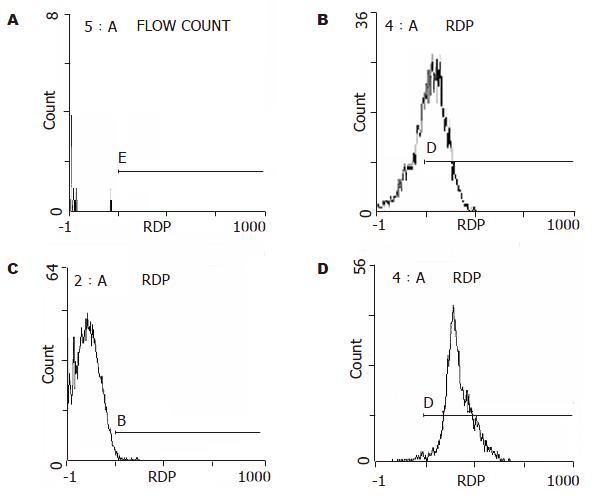
流式细胞仪检测分析结果显示, 经双氢青蒿素作用后罗丹明-鬼笔环肽标记的DHA组虫体的胞质内被标记的微丝荧光强度值(16.18±11.02)明显低于阳性对照组(88.10±6.43), 二者结果有显著性差异(bP<0.01). 甲硝唑组(91.46±6.05)的结果与阳性对照组(88.10±6.43)的相同. 阴性对照组几乎无阳性峰(1.16±0.52).
FCM直方图(图1)显示: A无阳性峰; B显示非常高的阳性峰; C只有阴性峰; D显示非常高的阳性峰与阳性对照组峰值基本相同.
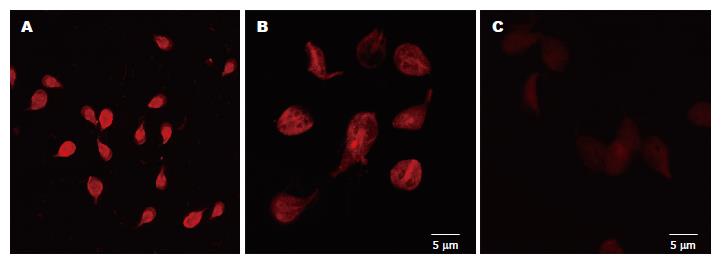
2.2.1 DHA对微丝的作用结果: 在固定激光共聚焦显微镜系统参数不变的条件下, 经RDP标记后, 对照组虫体形态完整, 轮廓清晰,虫体内可见非常明亮的、呈均匀密集的弥散状红色荧光亮点, 边缘环绕有明显带状强荧光(图2A, B); 而经DHA作用后, 实验组滋养体梨形形态轮廓不清, 体内可见相对较弱的红色荧光, 虫体荧光强度低(图2C), 表明虫体的微丝受到破坏.
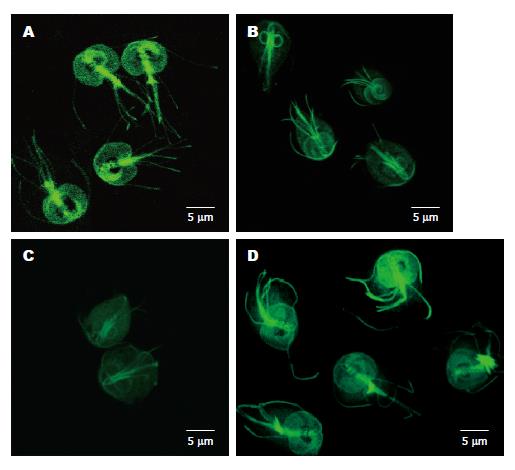
2.2.2 DHA对微管的作用结果: 经紫杉醇标记后, 共聚焦显微镜观察结果显示, 对照组虫体吸盘和鞭毛形态完整, 轮廓清晰, 呈均匀密集、明亮的弥散状绿色荧光亮点, 虫体其余部分未见荧光, 显示构成贾第虫细胞骨架的微管主要分布在吸盘和鞭毛处(图3A).而经DHA作用(4 h, 8 h)时, 滋养体吸盘和鞭毛的形态轮廓处绿色荧光强度逐渐变弱(图3B, C), 甚至完全消失(12 h时荧光强度值为零, 无可见图像). 将对照组和试验组滋养体吸盘(面积)与荧光强度值进行比较, 经SPSS统计软件分析, 结果显示有显著性差异(P<0.01, 表1), 表明虫体的微管受到损伤. 而阳性对照组经甲硝唑作用后(8 h), 用紫杉醇标记染色, 共聚焦显微镜观察结果显示, 吸盘和鞭毛轮廓清晰, 几乎同正常对照组(图3D).
| 面积 | 荧光强度 | |
| 实验组 | 36.52±14.39 | 33.41±7.95 |
| 对照组 | 38.71±5.12 | 86.69±15.96 |
| t | 0.452 | 9.45 |
| P | >0.05 | <0.01 |
广义的细胞骨架包括胞膜骨架、核骨架和胞质骨架, 是真核细胞中的蛋白纤维网格结构, 细胞骨架主要由微丝、微管和中间纤维构成. 细胞骨架参与细胞形态的维持、承受外力, 以此保持细胞内部结构的有序性. 研究表明, 蓝氏贾第鞭毛虫虽然是一种较低级的真核生物, 但细胞骨架结构高度发达, 有大量呈网状分布的微丝和复杂的吸盘微管, 这些结构起支架作用, 对维持虫体的正常形态, 完成虫体运动(其运动形式为复杂的瓢形"翻滚")和其他生理功能起重要作用[7-9]. 贾第虫滋养体寄生于人体小肠, 借助其前端的吸盘吸附于肠上皮细胞表面, 造成微绒毛损伤和机械性阻隔, 由此导致肠黏膜吸收功能的障碍. 我们最近的电镜观察显示, 经双氢青蒿素作用后, 质膜下空泡增大, 吸盘隆起形成一个大的空腔, 此系因胞膜和吸盘的细胞骨架经药物作用后遭到破坏, 致使细胞变形所致. 由此表明双氢青蒿素确实对贾第虫滋养体内构成细胞骨架的微丝、微管有明显的损伤作用[10].
本文中罗丹明-鬼笔环肽(RDP)染色标记可特异性地显示细胞骨架中的微丝(F-actin)结构, 而紫杉醇(P22310)染色标记可特异性地显示细胞骨架中的微管结构. 经双氢青蒿素作用后, 将待测细胞分别用上述两种方法标记制成单细胞悬液. 流式细胞仪检测结果显示, 用RDP染色标记的对照组虫体荧光强度值高(峰值达88.10±6.43), 呈现非常高的阳性峰(图1B); 未经标记的阴性对照组则无阳性峰, 只出现较高的阴性峰(图1C); 而实验组流式细胞术荧光强度值明显低于正常对照组, 无可见的阳性峰(图1A). 上述样本经激光共聚焦显微镜观测结果显示, 未经双氢青蒿素作用的虫体, 罗丹明-鬼笔环肽标记后, 虫体呈鲜艳的橘红色, "梨形"形态完好, 其轮廓清晰, 微丝遍布于整个虫体, 但不显示吸盘和鞭毛结构(图2A), 经双氢青蒿素作用的虫体, 虫体"梨形"轮廓不清或消失; 紫杉醇(P22310)染色标记后, 虫体吸盘和鞭毛的轮廓清晰, 未显示出虫体的"梨形"轮廓(图3A), 表明微管主要分布于吸盘和鞭毛处. 因此, 可以解释虫体"梨形"轮廓不清或消失是微丝受损而不能维持正常的形态(F-actin是一种细胞中重要的细胞骨架成分, 其含量减少或排列改变, 可以导致细胞紧密连接结构不能维持, 从而使细胞通透性增加); 而经紫杉醇(P22310)染色标记后, 虫体仅显示吸盘和鞭毛轮廓(图3A), 并不显示虫体的"梨形"轮廓, 表明虫体的微丝主要分布在胞质内, 而微管主要分布在吸盘和鞭毛处, 此结果同Meyer(1999)的免疫电镜观察结果[1]. 资料表明贾第虫的细胞骨架含有大量肌动蛋白(actin)和膜联蛋白(annexins), 一类被钙离子活化后可与膜磷脂结合的蛋白, 参与膜转运及膜表面其他一系列依赖于钙调蛋白活动的通讯连接作用[11]. 本实验证实双氢青蒿素的药理作用不同于甲硝唑的是DHA产生自由基和有极强氧化性和细胞毒性的超氧阴离子烷自由基, 这些自由基对细胞的毒性表现为: (1)引发链式脂质过氧化反应损伤细胞膜系, 导致膜的损伤或直接氧化细胞骨架蛋白[12]引起细胞死亡[13]; 自由基可通过诱导过氧化而影响脂质, 从而产生短链脂酰衍化物和副产物丙二醛而介导各种交联反应, 催化氨基酸氧化、蛋白质-蛋白质交联和蛋白质链的断裂; (2)胞质、膜蛋白及某些酶可交联成二聚体或更大的聚合物, 这种交联既可借助于蛋白质之间的二硫键形成, 也可由于自由基损伤的氨基酸残基间的反应形成, 蛋白质的交联将使其失去活性, 结构改变, 虫体解体而死亡; (3)染色体畸变, 核酸碱基改变或DNA断裂[14-15].
甲硝唑作用后, 虽然虫体死亡了, 但微丝结构无破坏, 因此, 仍然被罗丹明-鬼笔环肽标记, 表现出很强的荧光强度值和出现非常高的阳性峰(图1D), 多次重复实验, 结果完全相同, 说明甲硝唑不损伤虫体的微丝结构; 经紫杉醇标记结果显示, 吸盘和鞭毛轮廓清晰, 几乎同正常对照组(图3D), 说明甲硝唑不损伤虫体的微管结构, 而是作用于DNA(PI标记DNA预实验初步证实)或代谢的其他过程. 本研究结果提示将贾第虫的细胞骨架成分作为新药物开发的靶点是值得探讨的新途径.
蓝氏贾第鞭毛虫的细胞骨架结构高度发达, 起支架作用, 维持虫体的正常形态, 完成虫体运动、增殖和其他生理功能, 而且与虫体的致病密切相关. 因此, 探讨双氢青蒿素作用后, 虫体的细胞骨架变化, 了解该药物的作用机制, 为进一步开发其用途和新药物的开发寻找作用靶点.
目前贾第虫的研究较多的是有关其在生物进化中的地位和作用的研究, 但其致病机制, 药物开发较少.
本文首次应用双氢青蒿素作用于本虫, 用多种技术从不同的层面(光镜、电镜、荧光分子探针标记后共聚焦显微镜、流式细胞仪、蛋白2D-电泳等)系统研究、观察细胞骨架结构及其药物的损伤作用.
在基础理论中填补空白, 在新药物开发中提供实验依据.
本文研究发现双氢青蒿素对蓝氏贾第鞭毛虫细胞骨架有损伤作用, 结果具有一定科学和实际应用价值.
电编: 张敏 编辑:潘伯荣
| 1. | Meyer EA. Human Parasitic Diseases. New York: Elsevviser Amsterdan pub 1999; 1-11. |
| 3. | Kucik CJ, Martin GL, Sortor BV. Common intestinal parasites. Am Fam Physician. 2004;69:1161-1168. [PubMed] |
| 4. | Elmendorf HG, Dawson SC, McCaffery JM. The cytoskeleton of Giardia lamblia. Int J Parasitol. 2003;33:3-28. [PubMed] [DOI] |
| 5. | 许 静波, 高 兴政. 双氢青蒿素对阴道毛滴虫微丝作用的观察. 中国寄生虫病防治杂志. 2004;17:12-14. |
| 7. | Correa G, Morgado-Diaz JA, Benchimol M. Centrin in Giardia lamblia - ultrastructural localization. FEMS Microbiol Lett. 2004;233:91-96. [PubMed] [DOI] |
| 8. | Benchimol M, Piva B, Campanati L, de Souza W. Visualization of the funis of Giardia lamblia by high-resolution field emission scanning electron microscopy-new insights. J Struct Biol. 2004;147:102-115. [PubMed] [DOI] |
| 9. | Campanati L, Troester H, Monteiro-Leal LH, Spring H, Trendelenburg MF, de Souza W. Tubulin diversity in trophozoites of Giardia lamblia. Histochem Cell Biol. 2003;119:323-331. [PubMed] |
| 10. | Tian XF, Lu SQ, Liu YM, Wang FY, Huang S. Effect of dihydroartemisinin on ultrastructure of Giardia lamblia in vitro. Zhongguo Jishengchongxue Yu Jishengchongbing Zazhi. 2005;23:292-295. [PubMed] |
| 11. | Knepler JL Jr, Taher LN, Gupta MP, Patterson C, Pavalko F, Ober MD, Hart CM. Peroxynitrite causes endothelial cell monolayer barrier dysfunction. Am J Physiol Cell Physiol. 2001;281:C1064-C1075. [PubMed] |
| 12. | Weiland ME, McArthur AG, Morrison HG, Sogin ML, Svard SG. Annexin-like alpha giardins: a new cytoskeletal gene family in Giardia lamblia. Int J Parasitol. 2005;35:617-626. [PubMed] [DOI] |
| 13. | Jambou R, Legrand E, Niang M, Khim N, Lim P, Volney B, Ekala MT, Bouchier C, Esterre P, Fandeur T. Resistance of Plasmodium falciparum field isolates to in-vitro artemether and point mutations of the SERCA-type PfATPase6. Lancet. 2005;366:1960-1963. [PubMed] [DOI] |
| 14. | Sarciron ME, Saccharin C, Petavy AF, Peyron F. Effects of artesunate, dihydroartemisinin, and an artesunate-dihydroartemisinin combination against Toxoplasma gondii. Am J Trop Med Hyg. 2000;62:73-76. [PubMed] |
| 15. | Ittarat W, Sreepian A, Srisarin A, Pathepchotivong K. Effect of dihydroartemisinin on the antioxidant capacity of P. falciparum-infected erythrocytes. Southeast Asian J Trop Med Public Health. 2003;34:744-750. [PubMed] |