修回日期: 2006-06-02
接受日期: 2006-06-09
在线出版日期: 2006-07-18
目的: 通过构建单一质粒四环素调控载体pCEP4-tetR-IL-24, 将其转染胃癌细胞系后, 探讨IL-24对胃癌细胞的初步作用以及此系统能否发挥四环素的调控作用.
方法: 将hIL-24基因片段从pORF9-hIL-24定向克隆至pcDNA4-TO-Xpress中, 再亚克隆到pCEP4-tetR中构建pCEP4-tetR-IL-24; 利用脂质体转染法转染细胞; Western blotting检测蛋白表达; MTT法与台盘蓝拒染法检测细胞增殖; annexinⅤ法检测细胞的凋亡.
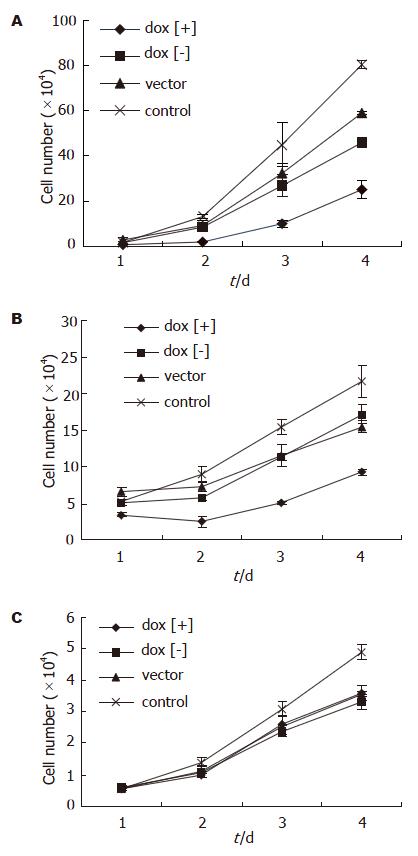
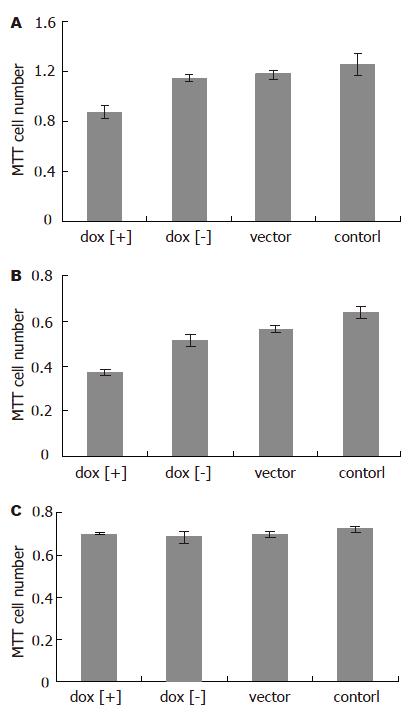
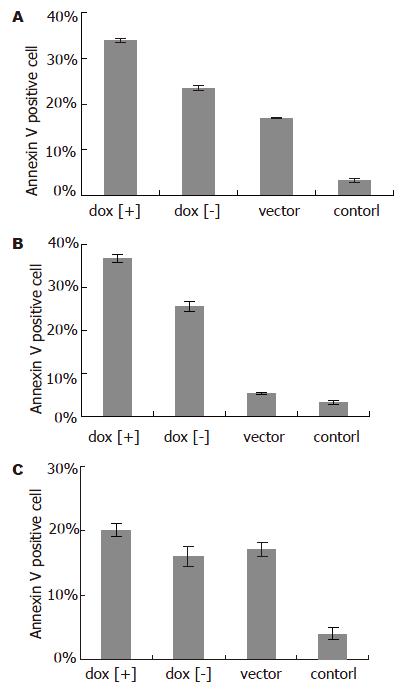
结果: pCEP4-tetR-IL-24转染胃癌细胞系MGC803, BGC823与正常胃黏膜细胞系GES-1后, 在强力霉素诱导下均可表达IL-24蛋白; MGC803, BGC823细胞中, 强力霉素诱导组的增殖较未诱导组、空载体组与对照组明显受抑制(P<0.01, 0.001-0.006); 强力霉素诱导组与未诱导组相比, 凋亡细胞比例明显增多(23.5%/25.6%→33.8%/36.7%, P<0.01); GES-1中, 诱导组与未诱导组、空载体组及对照组的差异无统计学意义(P>0.05).
结论: IL-24可以抑制胃癌细胞增殖, 诱导胃癌细胞凋亡, 对正常胃黏膜上皮细胞无明显毒性; 构建的单一质粒四环素调控系统pCEP4-tetR-IL-24可以发挥四环素的调控作用.
引文著录: 林宁晶, 朱军. 单一质粒四环素系统调控IL-24表达对胃癌细胞系的作用. 世界华人消化杂志 2006; 14(20): 1956-1962
Revised: June 2, 2006
Accepted: June 9, 2006
Published online: July 18, 2006
AIM: To estimate the tumor-suppressive activity of interleukin-24 (IL-24) in gastric cancer cells in vitro and the regulation of tetracycline in a single plasmid pCEP4-tetR-IL-24.
METHODS: A single plasmid pCEP4-tetR-IL-24 was constructed which contained the TetR and TetO. The cells were transfected with pCEP4-tetR-IL-24 using lipofectamine 2000. The expression of IL-24 was detected by Western blotting. The suppression of cellular growth was determined by MTT assay and trypan blue rejection. The induction of apoptosis was analyzed by Annexin Ⅴ staining.
RESULTS: IL-24 protein was induced to express in gastric cancer cells (MGC803 and BGC823) and normal cells (GES-1) after transfection with pCEP4-tetR-IL-24. In the MGC803 and BGC823 cells, cellular growth was inhibited more efficiently (P < 0.01, 0.001-0.006), and the percentage of apoptosis cells was higher after doxycline induction (23.5%/25.6%→33.8%/36.7%, P < 0.01). However, there were no differences observed in GES-1 cells among the groups (P > 0.05).
CONCLUSION: The plasmid-mediated tranfection of IL-24 selectively induces the suppression of cell growth and apoptosis in gastric cancer cells. Tetracycline can regulate the expression of IL-24 in gastric cancer cells and normal epithelial cells.
- Citation: Lin NJ, Zhu J. Interleukin-24 selectively induces growth suppression and apoptosis in human gastric cancer cells transfected with a single tetracycline-regulatable plasmid. Shijie Huaren Xiaohua Zazhi 2006; 14(20): 1956-1962
- URL: https://www.wjgnet.com/1009-3079/full/v14/i20/1956.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i20.1956
黑色素瘤分化相关蛋白7(melanoma differentiation-associated protein 7, mda-7)基因编码的蛋白质由206个氨基酸残基组成, 理论编码蛋白质分子质量为23.8 kDa[1-2]. 由于mda-7在基因结构和序列上与IL-10家族中的其他成员(IL10, IL19, IL20, IL22)有同源性[1,3-4], 并具有其他的一些共同特征, 包括mda-7在染色体上的位置, 存在分泌信号, 内源性表达与免疫系统有关, 其免疫调节因子的特点[5-7], 又被命名为白细胞介素24(Interleukin 24, IL24). IL-24是一种多功能的细胞因子, 他不仅参与免疫调节, 还能抑制肿瘤细胞生长, 诱导肿瘤细胞凋亡. 利用复制缺陷型腺病毒载体携带IL-24基因感染多种肿瘤细胞后, 可抑制肿瘤细胞增殖, 诱导凋亡; 而对相应的正常细胞影响甚微, 提示IL-24具有肿瘤特异性作用[8-15]. IL-24治疗肿瘤已进入临床Ⅰ期试验[16-17].
对外源基因进行调控, 使之安全有效地表达, 是基因治疗的核心问题之一. 对目的基因在空间和时间上进行有效调控, 不仅能提高基因治疗的安全性, 而且能使基因表达控制在有效作用浓度范围内, 从而避免较大的全身毒性[18]. 如果能对IL-24的作用进行调控, 则无疑会增加肿瘤基因治疗的安全性. 四环素调控系统是目前最常用的基因表达调控系统之一, T-REx系统[19-20]直接模拟大肠杆菌四环素调控系统, TetR与TetO结合, 抑制下游基因表达. 在有四环素或强力霉素时, 其与TetR结合, TetR对下游基因的抑制作用解除, 下游基因表达. 目前IL-24尚无对胃癌的研究报道. 我们利用已建立的单一质粒四环素调控基因表达的载体体系[21], 构建表达IL-24基因的单质粒四环素调控载体(pCEP4-tetR-IL-24), 将其转染胃癌细胞系后, 研究IL-24对胃癌细胞系的作用, 以及此单质粒四环素调控载体能否发挥四环素的调控作用.
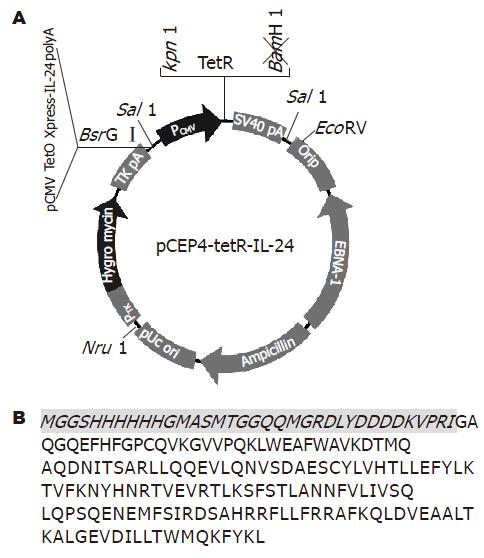
pORF9-hIL-24, Invivogen公司; pcDNA4-TO-Xpress, 从pcDNA3.1-HisA用Hind Ⅲ和XholⅠ酶切, 克隆到pcDNA4/TO, 北京市肿瘤防治研究所遗传室柯杨教授惠赠; pCEP4-tetR, 由哈佛医学院Dr. Yao惠赠[19], TetR插入在pCEP4质粒(Invitrogen公司)的KpnⅠ/BamHⅠ位点; pEGFP-N1, Clontech公司. 人胃癌细胞系BGC823, MGC803和SV40转化胎儿胃黏膜上皮细胞系GES-1均为国内所建, 由北京市肿瘤防治研究所遗传室柯杨教授惠赠. 内切酶及Buffer, T4 DNA连接酶, Biolabs公司; DMEM培养基, 强力霉素, Invitrogen公司; 台盼蓝(Trypan blue)及MTT, Sigma公司. 鼠抗Xpress抗体, Invitrogen公司; 羊抗b-actin抗体, 羊抗鼠HRP, 兔抗羊HRP, Santa Cruz公司; Qiagen Endofree® Plasmid Maxi Kit, Qiagen公司; Annexin-Ⅴ FITC细胞凋亡检测试剂盒, 南京凯基.
引物: IL-24-1: GAT AGG ATC CCA GGG GCC CAG GGC CAA G(斜体: BamHⅠ)
IL-24-2: GAC TCT CGA GCC TGG TCT AGA CAT TCA GAG(斜体: XhoⅠ)
CMV-271: F: GAC TTG TAC AAC ATC TAC GTA TTA GTC ATC(斜体: BsrGⅠ)
CMV-PA: R: GAC TTG TAC ACA GAA GCC ATA GAG CCC AC(斜体: BsrGⅠ)
PCR反应条件: 94 ℃预变性2 min, 94 ℃变性45 s, 58 ℃复性45 s, 72 ℃延伸45 s, 共30个循环, 然后72 ℃再延伸10 min. PCR产物酶切后克隆到pcDNA4-TO-Xpress中, 经酶切鉴定正确后, 亚克隆到pCEP4-tetR中, 酶切鉴定后, 阳性克隆送北京三博远志生物技术有限公司测序鉴定. 采用Qiagen Endofree® Plasmid Maxi Kit大量提取及纯化符合转染要求的质粒. BGC823, MGC803和GES-1细胞维持在含100 mL/L胎牛血清的DMEM培养基中. 采用Invitrogen公司的Lipofectamine 2000试剂盒进行基因转染. 实验设4组, 分别为强力霉素诱导组(dox[+]组): 将pCEP4-tetR-IL-24与pEGFP-N1以10:1比例共转染, 转染24 h后加入强力霉素(1 mg/L)诱导. 强力霉素未诱导组(dox[-]组): 将pCEP4-tetR-IL-24与pEGFP-N1以10:1比例共转染, 转染24 h后不加入强力霉素诱导. 空载体组(vector组): 即转染空载体pCEP4-tetR. 阴性对照组(control组): 未转染组.
1.2.1 Western blotting检测蛋白质表达: 转染前1 d, 在6孔板内接种2×105细胞; 转染相应质粒2 mg/孔; 24 h后用强力霉素(1 mg/L)诱导蛋白表达; 诱导48 h后收集细胞行Western blotting检测.
1.2.2 MTT法检测细胞增殖: 每组设5个复孔; 转染前1 d, 在96孔板内接种1.5×103细胞; 转染相应质粒0.1 mg/孔; 诱导96 h后弃上清, 各孔加入0.5 g/L噻唑蓝溶液(MTT) 200 mL, 37 ℃孵育4 h; 弃上清, 各孔中加入DMSO 150 mL, 微震荡, 37 ℃放置30 min, 使紫蓝色沉淀溶解; 用酶标仪测定492 nm波长吸光度值.
1.2.3 细胞活性检测(台盼蓝拒染法): 每组设3复孔. 转染前1 d, 在24孔板内接种2×104细胞; 转染相应质粒0.4 mg/孔; 诱导24, 48, 72, 96 h后用2 g/L胰酶消化, 并收集全部细胞; 各孔细胞按一定比例稀释后, 稀释液中加入等体积4 g/L台盼蓝计数, 并绘制生长曲线.
1.2.4 细胞凋亡检测: 转染前1 d, 在6孔板内接种1×105细胞; 转染相应质粒2 mg/孔; 诱导72 h后用2 g/L胰酶消化, 收集细胞; 按Annexin-Ⅴ FITC细胞凋亡检测试剂盒(南京凯基)要求进行检测.
统计学处理 用SPSS 11.5软件包进行统计学处理, 数据采用各组的平均值±标准误表示; 各组间比较采用Student t检验, P<0.05差异有统计学意义.
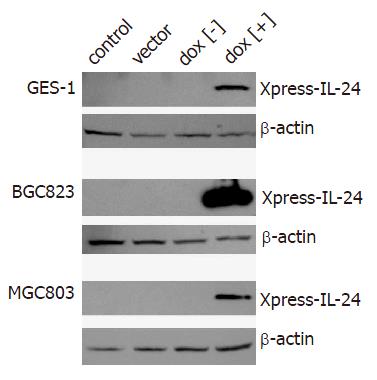
以带有hIL-24 cDNA全长的质粒(pORF9-hIL-24)为模板, 用引物IL-24-1和IL-24-2进行PCR扩增, 扩增产物包括hIL-24全长, 但去除IL-24的信号肽序列. 扩增产物定向克隆至pcDNA4-TO-Xpress中, 克隆后的载体命名为pTO-Xpress-IL-24. pTO-Xpress-IL-24是受四环素调控的hIL-24质粒, hIL-24前有含TetO的CMV启动子. 将含有TetO的hIL-24片段从pTO-Xpress-IL-24中亚克隆到pCEP4-tetR中, 构建单质粒四环素调控IL-24基因表达的载体体系. 以pTO-Xpress-IL-24为模板, CMV-271和CMV-PA为引物, 构建的质粒命名为pCEP4-tetR-IL-24, 经酶切鉴定后, 测序表明hIL-24已插入到载体中(图1). 将pCEP4-tetR-IL-24分别转染BGC823, MGC803和GES-1细胞, 24 h后用强力霉素(四环素家族成员, 较四环素半衰期长)诱导蛋白表达. 为摸索最佳的转染效率, 转染时将pCEP4-tetR-IL-24与pEGFP-N1以10:1比例共转染, 转染48 h后在荧光显微镜下观察荧光细胞所占的比例. 3种细胞系在细胞密度50%-60%时, 质粒用量2 mg(6孔板)时, 转染效率最高, BGC823和MGC803细胞可达70%-80%, GES-1细胞可达50%-60%. BGC823, MGC803和GES-1细胞在dox[+]组可见IL-24表达, 融合蛋白分子质量在20-30 kDa, 而dox[-]组, 空载体组和对照组均未见IL-24表达(图2).
诱导后1 d即可见MGC803和BGC823在dox[+]组增殖受抑制, 4 d抑制效应最明显;而GES-1细胞的增殖未见明显影响(图3). 诱导后4 d, 用MTT法检测细胞的增殖, 可以发现MGC803和BGC823在dox[+]组增殖受抑制,与dox[-]组、vector组和control组差别明显(P<0.01, 0.001-0.006), 而GES-1细胞的增殖未见明显影响(P>0.05, 图4)
实验分组同前, 每组设3复孔. 在MGC803与BGC823细胞中dox[+]组凋亡幅度最大, 高达35%左右, 强力霉素诱导前后凋亡细胞比例明显升高(23.5%/25.6%→33.8%/36.7%, P<0.01); dox[+]组与dox[-]组、vector组、control组差别明显(P<0.01, 0.001-0.002); 而GES-1细胞dox[+]组、dox[-]组、vector组差别不明显(P>0.05, 图5).
目前研究IL-24的抗肿瘤机制多采用复制缺陷型腺病毒载体, 他具有较高的转染效率, 但也存在如重组后产生有复制能力的病毒, 具有较强的免疫反应及过敏反应以及可能的插入突变等安全性问题. 而质粒等非病毒类载体不存在病毒复制, 因不含蛋白, 故免疫原性低[22]. 我们采用以pCEP4为骨架的质粒, 其能随宿主细胞复制而复制, 故可作为体内体外研究基因治疗很好的载体系统. 四环素调控系统是目前最常用的基因表达调控系统之一, 可随四环素浓度的变化调控目的基因的表达. 我们设想利用前期工作已建立的单质粒四环素调控基因表达的载体体系[21], 构建表达IL-24基因的单质粒四环素调控载体(pCEP4-tetR-IL-24), 将其分别转染胃癌细胞系与胃黏膜上皮细胞后, 研究IL-24对胃癌细胞系的作用, 了解此单质粒四环素调控载体能否发挥四环素的调控作用. 本实验需构建受四环素调控的IL-24质粒, 利用pcDNA4/TO-Xpress中含有的在CMV启动子控制下的TetO元件, 将pORF9-hIL-24中的IL-24片段插入到TetO元件的下游, 合成的新质粒pTO-Xpress-IL-24的插入片段前有TetO元件、Xpress序列, 插入片段后有BGH polyA, 能够在真核细胞中四环素调控下表达Xpress-IL-24融合蛋白. 将pTO-Xpress-IL-24中含有pCMV、TetO的IL-24片段亚克隆到pCEP4-tetR载体中. 新载体pCEP4-tetR-IL-24含有四环素调控系统的两大元件, TetR和TetO, 在缺乏四环素的条件下, TetR和TetO结合, 抑制了下游IL-24基因的表达; 加入四环素后, 四环素和TetR结合, 对下游基因的抑制作用解除, 下游基因表达. 此单质粒调控系统有如下特点[21]: (1)当EBNA和OriP存在时, 保证质粒能随细胞染色体复制而复制; (2)TetR和TetO在同一载体中, 使操作过程大大简化; (3)应用T-REx系统, 而不是VP16融合蛋白作为转录激活因子, 使载体的细胞毒性较前明显降低. 为了便于实验中检测, 我们构建的pCEP4-tetR-IL-24表达Xpress-IL-24融合蛋白, 通过检测Xpress的存在, 即可代表Xpress-IL-24融合蛋白被诱导表达. 既往文献报道GST-IL-24融合蛋白对肿瘤细胞有抑制作用, IL-24可以胞内形式或分泌蛋白形式发挥作用[11-12,23-25], 因此我们推测转染后细胞内合成的融合蛋白Xpress-IL-24对肿瘤细胞也有作用.
胃癌细胞(MGC803, BGC823)和胃黏膜上皮细胞(GES-1)在强力霉素诱导组均能表达Xpress-IL-24融合蛋白, 在未诱导组、空载体组及对照组无蛋白表达, 证实强力霉素的诱导作用. 强力霉素诱导后, 我们发现MGC803, BGC823的增殖与未诱导组、空载体组及对照组相比明显受抑制(P<0.01, 0.001-0.006), 未诱导组、空载体组的增殖与对照组相比亦受抑制, 这与质粒本身EBNA[26]的毒性, 该四环素调控系统的背景表达或转染试剂对细胞的毒性有关. MGC803和BGC823中, 强力霉素诱导组的凋亡细胞的比例远高于对照组及未诱导组(P<0.01, 0.001-0.002), IL-24可以诱导胃癌细胞的凋亡. 未诱导组亦可见凋亡细胞比例增加, 这与此质粒系统的背景表达有关. 正常胃黏膜细胞GES-1的增殖, 在诱导组、未诱导组、空载体组及阴性对照组间无明显差异(P>0.05); 用AnnexinⅤ法检测凋亡的发生, 诱导组、未诱导组及空载体组之间无明显差别(P>0.05), 上述3组与阴性对照组之间的差别有统计学意义(P<0.01), 考虑这与IL-24的作用无关, 可能是载体本身或转染试剂的毒性作用. Western blotting证实, GES-1细胞能表达IL-24融合蛋白, 且GES-1的转染效率能达50%-60%, 因此可以排除IL-24对3种细胞系的效应不同与转染效率、蛋白表达与否无关, IL-24可以抑制BGC823、MGC803胃癌细胞的增殖, 但对正常胃黏膜上皮细胞GES-1无明显影响, IL-24的作用具有肿瘤细胞特异性.
我们构建的单一质粒四环素调控系统pCEP4-tetR-IL-24, 转染BGC823, MGC803胃癌细胞后, 用强力霉素诱导前后, 细胞的增殖及凋亡存在明显差异, 此系统在细胞内能被诱导表达IL-24, 从而发挥强力霉素调控IL-24的作用. 异位表达的IL-24可以抑制胃癌细胞增殖, 诱导其凋亡, 当然这是体外实验的结果, 尚待体内实验进一步证实. 本文构建的表达IL-24的单一质粒四环素调控系统为今后研究IL-24在时间、空间上的有效调控, 探索最佳药物作用浓度及药物浓度的个性化奠定了基础.
北京市肿瘤防治研究所遗传室宁涛, 潘雅琪老师, 郑丽, 丁慧荣博士在实验中给予的指导及帮助.
IL-24的发现仅10年, 已经明确其是一种多功能的细胞因子. 目前的研究多利用复制缺陷型腺病毒载体携带IL-24基因转染多种肿瘤细胞, 发现其具有广谱的肿瘤细胞抑制活性. IL-24已成为肿瘤基因治疗中的热点基因之一, 但其在生理状态下仅微量表达, 发挥免疫调节作用, 对于基因治疗中外源导入后的大量表达是否会对机体产生严重的毒副作用尚不清楚. 如果能对IL-24导入细胞后实施有效调控, 无疑将会增加基因治疗的安全性.
四环素调控系统是目前研究中最常用的基因调控系统, 分为Tet-off/Tet-on和T-REx两种. 现在使用的四环素调控系统还存在需要完善的地方, 如常规的双质粒系统操作费时, 效率低; 对细胞毒性大等. pCEP4质粒是一能随细胞染色体的复制而复制, 并在染色体外游离存在的载体系统.
目前IL-24的研究主要集中于其抗肿瘤作用机制的研究, 改善载体系统以提高转染的效率和靶向性, 与放化疗、单克隆抗体的增敏作用等.
本文首次利用单质粒四环素调控系统研究IL-24在胃癌细胞中的可调控表达, 证实诱导表达的IL-24可以抑制胃癌细胞的增殖, 诱导胃癌细胞的凋亡.
利用四环素调控系统对IL-24的表达进行调控, 将有可能提高基因治疗的安全性, 为今后IL-24在时间上的有效调控, 探索最佳药物作用浓度及药物浓度的个性化奠定了基础.
本文设计合理, 研究内容新颖, 科学性强, 数据真实, 结果可信.
电编: 张敏 编辑:潘伯荣
| 1. | Jiang H, Lin JJ, Su ZZ, Goldstein NI, Fisher PB. Subtraction hybridization identifies a novel melanoma differentiation associated gene, mda-7, modulated during human melanoma differentiation, growth and progression. Oncogene. 1995;11:2477-2486. [PubMed] |
| 2. | Wang M, Tan Z, Thomas EK, Liang P. Conservation of the genomic structure and receptor-mediated signaling between human and rat IL-24. Genes Immun. 2004;5:363-370. [PubMed] [DOI] |
| 3. | Caudell EG, Mumm JB, Poindexter N, Ekmekcioglu S, Mhashilkar AM, Yang XH, Retter MW, Hill P, Chada S, Grimm EA. The protein product of the tumor suppressor gene, melanoma differentiation-associated gene 7, exhibits immunostimulatory activity and is designated IL-24. J Immunol. 2002;168:6041-6046. [PubMed] [DOI] |
| 4. | Ellerhorst JA, Prieto VG, Ekmekcioglu S, Broemel-ing L, Yekell S, Chada S, Grimm EA. Loss of MDA-7 expression with progression of melanoma. J Clin Oncol. 2002;20:1069-1074. [PubMed] [DOI] |
| 5. | Fisher PB, Gopalkrishnan RV, Chada S, Ramesh R, Grimm EA, Rosenfeld MR, Curiel DT, Dent P. mda-7/IL-24, a novel cancer selective apoptosis inducing cytokine gene: from the laboratory into the clinic. Cancer Biol Ther. 2003;2:S23-S37. [PubMed] [DOI] |
| 6. | Lebedeva IV, Sauane M, Gopalkrishnan RV, Sarkar D, Su ZZ, Gupta P, Nemunaitis J, Cunningham C, Yacoub A, Dent P. mda-7/IL-24: exploiting cancer's Achilles' heel. Mol Ther. 2005;11:4-18. [PubMed] [DOI] |
| 7. | Pestka S, Krause CD, Sarkar D, Walter MR, Shi Y, Fisher PB. Interleukin-10 and related cytokines and receptors. Annu Rev Immunol. 2004;22:929-979. [PubMed] [DOI] |
| 8. | Wang CJ, Xue XB, Yi JL, Chen K, Zheng JW, Wang J, Zeng JP, Xu RH. Melanoma differentiation-associated gene-7, MDA-7/IL-24, selectively induces growth suppression, apoptosis in human hepatocellular carcinoma cell line HepG2 by replication-incompetent adenovirus vector. World J Gastroenterol. 2006;12:1774-1779. [PubMed] [DOI] |
| 9. | Gopalan B, Litvak A, Sharma S, Mhashilkar AM, Chada S, Ramesh R. Activation of the Fas-FasL signaling pathway by MDA-7/IL-24 kills human ovarian cancer cells. Cancer Res. 2005;65:3017-3024. [PubMed] |
| 10. | Lebedeva IV, Sarkar D, Su ZZ, Kitada S, Dent P, Stein CA, Reed JC, Fisher PB. Bcl-2 and Bcl-x(L) differentially protect human prostate cancer cells from induction of apoptosis by melanoma differentiation associated gene-7, mda-7/IL-24. Oncogene. 2003;22:8758-8773. [PubMed] [DOI] |
| 11. | Saito Y, Miyahara R, Gopalan B, Litvak A, Inoue S, Shanker M, Branch CD, Mhashilkar AM, Roth JA, Chada S. Selective induction of cell cycle arrest and apoptosis in human prostate cancer cells through adenoviral transfer of the melanoma differentiation-associated -7 (mda-7)/interleukin-24 (IL-24) gene. Cancer Gene Ther. 2005;12:238-247. [PubMed] [DOI] |
| 12. | Su ZZ, Lebedeva IV, Sarkar D, Gopalkrishnan RV, Sauane M, Sigmon C, Yacoub A, Valerie K, Dent P, Fisher PB. Melanoma differentiation associated gene-7, mda-7/IL-24, selectively induces growth suppression, apoptosis and radiosensitization in malignant gliomas in a p53-independent manner. Oncogene. 2003;22:1164-1180. [PubMed] [DOI] |
| 13. | Zhao L, Gu J, Dong A, Zhang Y, Zhong L, He L, Wang Y, Zhang J, Zhang Z, Huiwang J. Potent antitumor activity of oncolytic adenovirus expressing mda-7/IL-24 for colorectal cancer. Hum Gene Ther. 2005;16:845-858. [PubMed] [DOI] |
| 14. | Nishikawa T, Ramesh R, Munshi A, Chada S, Meyn RE. Adenovirus-mediated mda-7 (IL24) gene therapy suppresses angiogenesis and sensitizes NSCLC xenograft tumors to radiation. Mol Ther. 2004;9:818-828. [PubMed] [DOI] |
| 15. | McKenzie T, Liu Y, Fanale M, Swisher SG, Chada S, Hunt KK. Combination therapy of Ad-mda7 and trastuzumab increases cell death in Her-2/neu-overexpressing breast cancer cells. Surgery. 2004;136:437-442. [PubMed] [DOI] |
| 16. | Cunningham CC, Chada S, Merritt JA, Tong A, Senzer N, Zhang Y, Mhashilkar A, Parker K, Vukelja S, Richards D. Clinical and local biological effects of an intratumoral injection of mda-7 (IL24; INGN 241) in patients with advanced carcinoma: a phase I study. Mol Ther. 2005;11:149-159. [PubMed] [DOI] |
| 17. | Tong AW, Nemunaitis J, Su D, Zhang Y, Cunningham C, Senzer N, Netto G, Rich D, Mhashilkar A, Parker K. Intratumoral injection of INGN 241, a nonreplicating adenovector expressing the melanoma-differentiation associated gene-7 (mda-7/IL24): biologic outcome in advanced cancer patients. Mol Ther. 2005;11:160-172. [PubMed] [DOI] |
| 18. | Huang Q, Hu JK, Lohr F, Zhang L, Braun R, Lanzen J, Little JB, Dewhirst MW, Li CY. Heat-induced gene expression as a novel targeted cancer gene therapy strategy. Cancer Res. 2000;60:3435-3439. [PubMed] |
| 19. | Yao F, Svensjo T, Winkler T, Lu M, Eriksson C, Eriksson E. Tetracycline repressor, tetR, rather than the tetR-mammalian cell transcription factor fusion derivatives, regulates inducible gene expression in mammalian cells. Hum Gene Ther. 1998;9:1939-1950. [PubMed] [DOI] |
| 20. | Xu ZL, Mizuguchi H, Mayumi T, Hayakawa T. Regulated gene expression from adenovirus vectors: a systematic comparison of various inducible systems. Gene. 2003;309:145-151. [PubMed] [DOI] |
| 21. | Lu Z, Lin N, Zhu J, Eriksson E, Yao F. Regulation of gene expression by T-REx in a single episomal-replicating expression vector in cultured mamma-lian cells. . |
| 22. | Papapetrou EP, Zoumbos NC, Athanassiadou A. Genetic modification of hematopoietic stem cells with nonviral systems: past progress and future prospects. Gene Ther. 2005;12 Suppl 1:S118-130. [PubMed] [DOI] |
| 23. | Sarkar D, Su ZZ, Lebedeva IV, Sauane M, Gopalkrishnan RV, Valerie K, Dent P, Fisher PB. mda-7 (IL-24) Mediates selective apoptosis in human melanoma cells by inducing the coordinated overexpression of the GADD family of genes by means of p38 MAPK. Proc Natl Acad Sci USA. 2002;99:10054-10059. [PubMed] [DOI] |
| 24. | Sauane M, Lebedeva IV, Su ZZ, Choo HT, Randolph A, Valerie K, Dent P, Gopalkrishnan RV, Fisher PB. Melanoma differentiation associated gene-7/interleukin-24 promotes tumor cell-specific apoptosis through both secretory and nonsecretory pathways. Cancer Res. 2004;64:2988-2993. [PubMed] [DOI] |
| 25. | Sauane M, Gopalkrishnan RV, Choo HT, Gupta P, Lebedeva IV, Yacoub A, Dent P, Fisher PB. Mechanistic aspects of mda-7/IL-24 cancer cell selectivity analysed via a bacterial fusion protein. Oncogene. 2004;23:7679-7690. [PubMed] [DOI] |
| 26. | Ascenzioni F, Donini P, Lipps HJ. Mammalian artificial chromosomes-vectors for somatic gene therapy. Cancer Lett. 1997;118:135-142. [PubMed] [DOI] |