修回日期: 2005-12-01
接受日期: 2005-12-02
在线出版日期: 2006-01-18
目的: 通过检测慢性乙型肝炎患者外周血单个核细胞 (PBMCs) 高迁移率族蛋白1 (HMGB1) mRNA的表达情况, 研究HMGB1在乙型肝炎中的临床意义.
方法: 应用逆转录聚合酶链反应 (RT-PCR)对54例慢性乙型肝炎患者和10例健康对照者PBMCs HMGB1 mRNA的表达进行检测, 同时应用ELISA法检测外周血浆肿瘤坏死因子a(TNF-α)和内毒素(LPS)水平, 比较各组HMGB1 mRNA表达水平的差异及其与TNF-α、LPS、总胆红素 (TBIL)、凝血酶原活动度 (PTA) 的关系.
结果: PBMCs HMGB1 mRNA的表达水平在慢性重型肝炎组分别高于慢性肝炎组 (0.89±0.06 vs 0.70 ± 0.10, P<0.01) 和正常对照组(0.89±0.06 vs 0.58±0.08, P<0.01), 慢性肝炎组高于正常对照组 (0.70±0.10 vs 0.58±0.08, P<0.01). 在23例慢性重型肝炎患者中, 11例未恢复患者PBMCs HMGB1 mRNA表达水平明显高于12例恢复的患者(0.93±0.04 vs 0.85±0.05, P<0.01). 其中12例已恢复的慢性重型肝炎患者, 患者恢复期PBMCs HMGB1 mRNA的表达水平较发病期明显下降 (0.72±0.07 vs 0.85±0.05, P<0.01). HMGB1 mRNA表达水平与外周血浆LPS、TNF-α及TBIL均呈显著正相关 (r = 0.74, 0.64, 0.71, 均P<0.01), 与PTA呈负相关 (r = -0.82, P<0.01).
结论: HMGB1在乙型肝炎发病过程中可能起重要作用, HMGB1 mRNA的表达水平高低与病情轻重密切相关.
引文著录: 彭建平, 范学工, 刘洪波. 慢性乙型肝炎患者高迁移率族蛋白1 mRNA的表达及其临床意义. 世界华人消化杂志 2006; 14(2): 167-172
Revised: December 1, 2005
Accepted: December 2, 2005
Published online: January 18, 2006
AIM: To investigate the expression and clinical significance of high mobility group box-1 protein (HMGB1) mRNA in chronic hepatitis B.
METHODS: The expression of HMGB1 mRNA was detected in peripheral blood mononuclear cells (PBMCs) of 54 patients with chronic hepatitis B and 10 normal controls by reverse transcription-polymerase chain reaction (RT-PCR). The levels of plasma tumor necrosis factor-α (TNF-α) and lipopolysaccharide (LPS) were measured by enzyme linked immunosorbent assay (ELISA) simultaneously. The levels of total bilirubin (TBIL) prothrombin time activity percentage (PTA) were examined by biochemical methods.
RESULTS: HMGB1 mRNA expression was significantly increased in severe hepatitis patients in comparison with that in chronic hepatitis B patients and normal controls (0.89 ± 0.06 vs 0.70 ± 0.10, 0.58 ± 0.08, P < 0.01). Marked difference also existed between the latter two (0.70±0.10 vs 0.58±0.08, P <0.01). Of the 23 patients with chronic severe hepatitis, the HMGB1 mRNA levels in 11 unrecovered patients were notably higher than those in 12 recovered patients (0.93±0.04 vs 0.85±0.05, P <0.01). Of the 12 recovered patients, the levels of HMGB1 mRNA were significantly decreased in the stage of recovery as compared with those in the stage of onset (0.72±0.07 vs 0.85±0.05, P <0.01). There was positive correlation among HMGB1 mRNA expression and plasma LPS, TNF-α and TBIL (r = 0.74, 0.64, 0.71 respectively, P<0.01) and negative correlation between HMGB1 mRNA expression and PTA (r = -0.82, P <0.01).
CONCLUSION: HMGB1 plays an important role in the pathogenesis of chronic hepatitis B, and HMGB1 mRNA level is closely associated with the condition the disease.
- Citation: Peng JP, Fan XG, Liu HB. Expression of high mobility group box-1 protein mRNA in patients with chronic hepatitis B and its clinical significance. Shijie Huaren Xiaohua Zazhi 2006; 14(2): 167-172
- URL: https://www.wjgnet.com/1009-3079/full/v14/i2/167.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i2.167
1999年, Wang et al[1]首次报道高迁移率族蛋白 1(high mobility group box 1 protein, HMGB1)作为新的潜在的晚期炎症介质, 参与了脓毒症的发病过程, 是内毒素致死效应的晚期重要炎症介质. 此后, HMGB1成为研究的热点, 大量的文献报道HMGB1在脓毒症的发病过程中起着非常重要的作用[2-5]. 目前对于HMGB1在慢性乙型肝炎中的作用情况尚未见有报道, 我们通过检测慢性乙肝患者外周血单个核细胞(PBMCs) HMGB1 mRNA的表达情况, 对此进行了初步探讨.
收集慢性乙型肝炎患者54例, 为我科2005-04/09住院患者. 其中重型肝炎23例, 慢性肝炎31例 (包括慢性重度10例, 慢性中度11例, 慢性轻度10例). 男性44例, 女性10例, 年龄18-71岁, 平均37岁. 诊断符合2000-09中华传染病与寄生虫病学分会、肝病学分会西安会议标准[6]. 另收集健康志愿者10例, 作为正常对照.
1.2.1 标本收集: 抽取清晨空腹静脉血5 mL, 肝素抗凝, 立即离心 (1 500 r/min)20 min. 吸取上层血浆100 mL用于测肿瘤坏死因子α(TNF-α), 10 mL用于测内毒素 (LPS), 余下的用于分离PBMCs.
1.2.2 PBMCs的分离: 取上述肝素抗凝血, 用Hank's液对倍稀释, 沿管壁缓缓加入含淋巴细胞分离液的试管上层, 保持界面分层清晰, 室温下2 000 r/min离心25 min, 吸取PBMCs层. 加入8 mL Hank's液洗涤细胞, 室温下1 500 r/min离心5 min, 弃上清, 得单个核细胞, 重复洗涤二次.
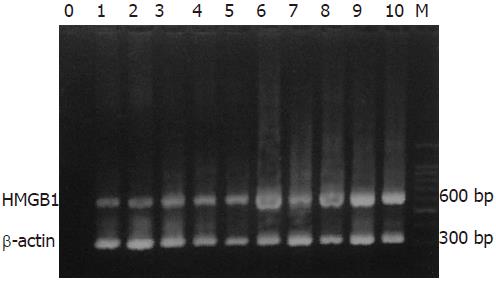
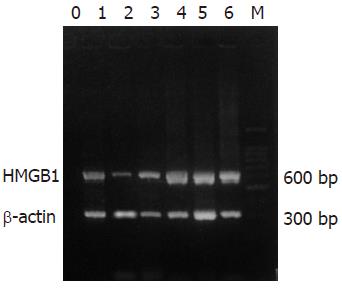
1.2.3 HMGB1: (1) RNA抽提: 于上述PBMCs中加入Trizol 1 mL裂解细胞5 min, 加入氯仿200 mL, 混匀, 室温3 min, 4 ℃ 12 000 g离心15 min, 吸取上清, 加入等体积异丙醇, 混匀, 室温置10 min, 4℃ 12 000 g 离心10 min, 弃上清, 加入750 mL/L DEPC乙醇1 mL, 7 500 g 离心5 min, 弃去乙醇, 干燥RNA沉淀, 加入20 mL DEPC处理水融解. (2) 逆转录聚合酶链反应 (RT-PCR): 于0.5 mL EP管中加入模板RNA和引物, 70 ℃ 5 min后冰上急冷, 依次加入dNTPs, MMLV, MMLV逆转录缓冲液, RNA酶抑制剂, 用DEPC处理水补充总体积至20 mL. 将上述反应液置于37 ℃ 2 h后, 95 ℃热变性5 min, 冰上冷却. 上述反应液用于PCR反应. 上游引物为5'-GTAGAATTCATGGGCAAAGGAGATCCTA-3'; 下游引物为5'-AGGCTCGAGTTCATCATCATCATCTTCT-3', 产物长度为 659 bp. 反应条件: 94 ℃ 5 min; 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 1 min 20 s, 35个循环; 72 ℃ 10 min. 根据PCR产物电泳条带与内参对照β-actin(316 bp) 相对强度的比例, 以确定HMGB1 mRNA表达水平.
1.2.4 LPS的检测: 采用ELISA法, 试剂盒由美国TPI公司提供.
1.2.5 TNF-α的检测: 采用ELISA法, 试剂盒由上海雄森科技实业有限公司提供, 进口分装.
1.2.6 肝功能及凝血酶原活动度: (PTA) 的检测 与TNF-α等测定同时留取血液标本送医院检验科用全自动生化仪测定.
统计学处理 所有数据均在SPSS 10.0软件包上进行, 实验数据用mean±SD表示, 各组间比较用多个样本均数间的多重比较, 假设检验采用LSD-t检验, 两组数据间的相关关系用直线相关分析方法, P<0.05为有显著性差异.
慢性重型肝炎组、慢性肝炎组 (包括慢性重度、慢性中度、慢性轻度肝炎)和正常人组, HMGB1 mRNA表达水平有显著性差异(P<0.01, 表1, 图1), 慢性重型肝炎组分别高于慢性肝炎组和正常对照组, 慢性肝炎组高于正常对照组. HMGB1 mRNA表达水平在31例慢性肝炎患者中, 慢性重度肝炎组分别高于慢性中度和慢性轻度肝炎组(P<0.01), 但慢性中度和慢性轻度肝炎组之间无差异(P>0.05, 表2, 图1). 在23例慢性重型肝炎患者中, 11例未恢复患者与12例恢复的患者在发病期PBMCs HMGB1 mRNA的表达水平有显著性差异(P<0.01, 表3, 图2), 未恢复患者明显高于恢复的患者. 追踪观察12例已恢复的慢性重型肝炎患者, 患者恢复期PBMCs HMGB1 mRNA的表达水平较发病期明显下降, 差异有显著性(P<0.01, 表4, 图2).
慢性重型肝炎、慢性肝炎组和正常对照血浆LPS水平(mg/L)分别为: 38.41±17.82, 8.69±6.67, 2.45±1.66. 其中, 慢性重型肝炎组高于慢性肝炎组和正常对照组(P<0.01), 但慢性肝炎组与正常对照组无差异(P>0.05, 表1). 在31例慢性肝炎中, 慢性重度分别高于慢性中度和慢性轻度肝炎组 (P<0.01), 但慢性中度与慢性轻度肝炎组之间无差异(P>0.05, 表2). 血浆TNF-α水平(ng/L) 分别为: 96.63±24.16, 68.87±37.84, 16.36±5.00. 其中, 慢性重型肝炎组分别高于慢性肝炎组和正常对照组, 慢性肝炎组高于正常对照组(P<0.01,表1). 在31例慢性肝炎中, 慢性重度高于慢性中度和慢性轻度肝炎组(P<0.01), 但慢性中度与慢性轻度肝炎组之间无差异(P>0.05, 表2). 在23例慢性重型肝炎患者中, 11例未恢复患者与12例恢复的患者在发病期血浆LPS水平差异显著(P<0.05), 但血浆TNF-α水平却无差异(P>0.05,表3). 追踪观察12例已恢复的重型肝炎患者, 患者恢复期血浆LPS及TNF-α水平较发病期明显下降, 差异有显著性(P<0.05, 表4).
HMGB1是在1970年代发现[7], 因其在聚丙烯酰胺凝胶电泳中有很高的迁移率而得名, 是普遍存在于各种细胞核及细胞质中的高度保守的蛋白. HMGB1分布十分广泛, 多种器官 (如淋巴组织、脑、肝、肺、心、脾、肾等) 的细胞中均有表达, 正常时位于大多数细胞的胞核和胞浆内, 他可参与DNA的复制、细胞分化及基因表达等多种细胞生命活动[8-9]. 新近研究发现, 当受LPS及细胞因子等刺激时, HMGB1即能释放到胞外[10-11], 具有细胞因子活性, 介导炎症反应. 与TNF-α等早期炎症介质不同, HMGB1于炎症反应晚期出现, 持续时间长, 被视为晚期炎症介质[12], 参与了脓毒症、内毒素血症的病理生理过程. 1999年, Wang et al [1]首先运用免疫印迹法测定血清HMGB1水平, 发现脓毒症患者血清HMGB1明显升高, 且未存活者明显高于存活者, 而正常人血清中却测不到. 近来又有学者动态观察了42例脓毒性休克患者, 运用实时RT PCR的方法测定其外周血HMGB1 mRNA表达水平, 并与18例健康人比较, 发现脓毒性休克患者外周血HMGB1 mRNA水平明显高于健康人[13]. 此外, HMGB1还与急性肺损伤 [14-16]、肝脏缺血再灌注损伤[17-18]、关节炎 [19-20]、滑膜炎、心率失常、动脉粥样硬化[21]、胃肠道肿瘤[22-23]及中枢神经系统病变[25-26]等有关.
乙型肝炎是我国常见病、多发病, 其治疗难度大, 费用高, 尤其是重型肝炎, 因其易并发严重感染、肝性脑病、肝肾综合征、出血等, 病死率极高. 乙型肝炎的发病机制中, 除了病毒的直接作用外, 还有肝损伤后继发引起的肠源性内毒素血症, 以及由内毒素介导产生的细胞因子和炎症介质对肝脏的毒性作用和造成的微循环障碍, 而重症肝炎在急性炎症反应的过程中与脓毒血症一样, 都存在全身炎症综合反应, 进而发展为多器官功能衰竭甚至死亡. 目前对于HMGB1在乙型肝炎中的作用情况尚未见有报道, 我们通过检测乙肝患者PBMCs HMGB1 mRNA的表达情况对此进行了初步探讨.
本组资料显示, HMGB1 mRNA表达水平在慢性重型肝炎组高于慢性肝炎组和正常对照组, 慢性肝炎组高于正常对照组. 且在31例慢性肝炎患者中, 慢性重度高于慢性中度和慢性轻度肝炎组. HMGB1 mRNA表达水平与外周血浆内毒素、TNF-α及TBIL均呈显著正相关, 与PTA呈负相关. 说明HMGB1与内毒素、TNF-α等一样, 在乙型肝炎发病过程中起着非常重要的作用, 并与病情的严重程度密切相关.
比较23例慢性重型肝炎患者, 发现未恢复的患者发病期PBMCs HMGB1 mRNA表达水平明显高于恢复的患者. 追踪观察这12例已恢复的患者, 发现恢复期HMGB1 mRNA表达水平较发病期有明显的下降, 该变化与TNF-α、LPS、TBIL、PTA的改变一致, 说明HMGB1与 TNF-α、LPS、TBIL、PTA等一样, 能反应乙型肝炎病情的严重程度、预后及其转归.
同时发现, 血浆LPS水平在慢性肝炎组和正常人组之间比较无显著性差异, 而HMGB1 mRNA在这2组之间却有差异. 其原因可能是慢性肝炎患者肝脏损伤并不严重, 肝脏的屏障保护功能未被破坏, 使得从肠道来的细菌及内毒素得以清除, 故内毒素血症并不明显, 所以血浆LPS在这2组患者之间无明显差异. 而HMGB1作为晚期炎症介质, 除受到LPS刺激产生外, TNF-α、IL-1等细胞因子亦能刺激免疫细胞产生HMGB1, 而HMGB1反过来又能刺激TNF-α、IL-1等细胞因子的产生[27-30], 他们之间相互诱生, 相互促进, 从而使炎症反应不断得以放大、加重, 导致HMGB1水平升高, 使得慢性肝炎组HMGB1 mRNA高于正常人.
我们还发现, 在23例慢性重型肝炎患者中, TNF-α在未恢复患者与恢复的患者在发病期水平无差异, 而HMGB1 mRNA在这两组组之间表达有差异. 其原因可能是未恢复的重型肝炎患者虽然病情很重, 且免疫反应亦十分强烈, 但TNF-α为炎症反应早期的细胞因子, 持续时间短, 到了疾病后期, 血清TNF-α水平已很低, 从而导致以上的结果. 有资料证实, 以致死量的内毒素攻击小鼠, 部分动物5 d后才死亡, 而此时TNF-α水平早已恢复至正常范围[16]. 所以过去采取TNF-α拮抗剂治疗重型肝炎并未取得满意效果, 其原因就可能与疾病初期致炎细胞因子迅速合成与释放, 临床治疗难以做到早期或预防性干预有关. 而HMGB1则不同, 他是晚期炎症介质, 在炎症反应中持续时间长, 即使在疾病后期, 血液HMGB1仍然维持较高的水平, 基于这一特点, HMGB1有可能成为评价重型肝炎严重程度更为方便、实用的指标, 亦可能成为临床干预治疗措施新的、更为实用的靶点. 我们仅从基因水平研究了慢性乙肝患者中HMGB1的变化, 今后的工作将进一步从蛋白水平证实HMGB1在慢性乙型肝炎中的作用.
高迁移率族蛋白-1(HMGB1)于1970年代在小牛胸腺中被现, 是一种含量丰富的核蛋白, 分子量约30ku. 近年研究现, 当受内毒素(LPS)及细胞因子等刺激时, HMGB1即能释放到胞外, 具有细胞因子活性, 介导炎症反应目前对于MGB1在乙型肝炎患者中的作用情况尚未见有报道, 本实验通过检测慢性乙肝患者PBMCsHMGB1-mRNA的表达情况对此进行了初步探讨.
目前HMGB1的研究主要集中在脓毒血症.
1 Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L, Manogue KR, Faist E, Abraham E, Andersson J, Andersson U, Molina PE, Abumrad NN, Sama A, Tracey KJ.HMG-1 as a late mediator of endotoxin lethality in mice. Science 1999; 285: 248-251
2 Achot A, Monneret G, Voirin N, Leissner P, Venet F, Bohe J, Payen D, Bienvenu J, Mougin B, Lepape A. Longitudinal study of cytokine and immune transcription factor mRNA expression in septic shock. Clin Immunol 2005; 114: 61-69
HMGB1是晚期炎症介质, 在炎症反应中持续时间长, 即使在疾病后期, 血液HMGB1仍然维持较高的水平, 基于这一特点, HMGB1有可能成为评价重型肝炎严重程度更为方便、实用的指标, 亦可能成为临床干预治疗措施新的、更为实用的靶点.
本文研究了HMGB1 mRNA在乙型肝炎中的表达情况及其与病情严重程度及转归的关系, 发现HMGB1与慢性乙肝病情严重程度正相关, 能反应乙型肝炎病情的严重程度、预后及其转归.
本文具有较高的科学性, 创新性和可读性, 临床实用性亦较强. 不足之处是未同时检测患者血浆中的HMGB1水平, 无HMGB1蛋白水平结果.
编辑: 菅鑫妍 审读: 张海宁 电编: 张勇
| 1. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] |
| 2. | Yang H, Ochani M, Li J, Qiang X, Tanovic M, Harris HE, Susarla SM, Ulloa L, Wang H, DiRaimo R. Reversing established sepsis with antagonists of endogenous high-mobility group box 1. Proc Natl Acad Sci USA. 2004;101:296-301. [PubMed] |
| 3. | Sunden-Cullberg J, Norrby-Teglund A, Rouhiainen A, Rauvala H, Herman G, Tracey KJ, Lee ML, Andersson J, Tokics L, Treutiger CJ. Persistent elevation of high mobility group box-1 protein (HMGB1) in patients with severe sepsis and septic shock. Crit Care Med. 2005;33:564-573. [PubMed] |
| 4. | Chen G, Li J, Qiang X, Czura CJ, Ochani M, Ochani K, Ulloa L, Yang H, Tracey KJ, Wang P. Suppression of HMGB1 release by stearoyl lysophosphatidylcholine:an additional mechanism for its therapeutic effects in experimental sepsis. J Lipid Res. 2005;46:623-627. [PubMed] |
| 5. | Yin K, Gribbin E, Wang H. Interferon-gamma inhibition attenuates lethality after cecal ligation and puncture in rats: implication of high mobility group box-1. Shock. 2005;24:396-401. [PubMed] |
| 7. | Goodwin GH, Sanders C, Johns EW. A new group of chromatin-associated proteins with a high content of acidic and basic amino acids. Eur J Biochem. 1973;38:14-19. [PubMed] |
| 8. | Landsman D, Bustin M. A signature for the HMG-1 box DNA-binding proteins. Bioessays. 1993;15:539-546. [PubMed] |
| 9. | Melvin VS, Edwards DP. Coregulatory proteins in steroid hormone receptor action: the role of chromatin high mobility group proteins HMG-1 and -2. Steroids. 1999;64:576-586. [PubMed] |
| 10. | Wang H, Vishnubhakat JM, Bloom O, Zhang M, Ombrellino M, Sama A, Tracey KJ. Proinflammatory cytokines (tumor necrosis factor and interleukin 1) stimulate release of high mobility group protein-1 by pituicytes. Surgery. 1999;126:389-392. [PubMed] |
| 11. | Andersson U, Wang H, Palmblad K, Aveberger AC, Bloom O, Erlandsson-Harris H, Janson A, Kokkola R, Zhang M, Yang H. High mobility group 1 protein (HMG-1) stimulates proinflammatory cytokine synthesis in human monocytes. J Exp Med. 2000;192:565-570. [PubMed] |
| 12. | Wang H, Yang H, Czura C J, Sama AE, Tracey KJ. HMGB1 as a late mediator of lethal systemic inflammation. Am J Respir Crit Care Med. 2001;164:1768-1773. [PubMed] |
| 13. | Pachot A, Monneret G, Voirin N, Leissner P, Venet F, Bohe J, Payen D, Bienvenu J, Mougin B, Lepape A. Longitudinal study of cytokine and immune transcription factor mRNA expression in septic shock. Clin Immunol 2005; 114: 61-69. [PubMed] |
| 14. | Lutz W, Stetkiewicz J. High mobility group box 1 protein as a late-acting mediator of acute lung inflammation. Int J Occup Med Environ Health. 2004;17:245-254. [PubMed] |
| 15. | Kim JY, Park JS, Strassheim D, Douglas I, Diaz del Valle F, Asehnoune K, Mitra S, Kwak SH, Yamada S, Maruyama I. HMGB1 contributes to the development of acute lung injury after hemorrhage. Am J Physiol Lung Cell Mol Physiol. 2005;288:L958-L965. [PubMed] |
| 16. | Abraham E, Arcaroli J, Carmody A, Wang H, Tracey KJ. HMG-1 as a mediator of acute lung inflammation. J Immunol. 2000;165:2950-2954. [PubMed] |
| 17. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med 2005; 201: 1135-1143. [PubMed] |
| 18. | Watanabe T, Kubota S, Nagaya M, Ozaki S, Nagafuchi H, Akashi K, Taira Y, Tsukikawa S, Oowada S, Nakano S. The role of HMGB-1 on the development of necrosis during hepatic ischemia and hepatic ischemia/reperfusion injury in mice. J Surg Res. 2005;124:59-66. [PubMed] |
| 19. | Pullerits R, Jonsson IM, Verdrengh M, Bokarewa M, Andersson U, Erlandsson-Harris H, Tarkowski A. High mobility group box chromosomal protein 1, a DNA binding cytokine, induces arthritis. Arthritis Rheum 2003; 48: 1693-1700. [PubMed] |
| 20. | Ulloa L, Batliwalla F M, Andersson U, Gregersen PK, Tracey KJ. High mobility group box chromosomal protein. [PubMed] |
| 21. | as a nuclear protein, cytokin, and potential therapeutic target in arthritis. Arthritis Rheum. 2003;48:876-881. |
| 22. | Kalinina N, Agrotis A, Antropova Y, DiVitto G, Kanellakis P, Kostolias G, Ilyinskaya O, Tararak E, Bobik A. Increased expression of the DNA-binding cytokine HMGB1 in human atherosclerotic lesions : role of activated macrophages and cytokines. Arterioscler Thromb Vasc Biol. 2004;24:2320-2325. [PubMed] |
| 23. | Nestl A, Von Stein OD, Zatloukal K, Thies WG, Herrlich P, Hofmann M, Sleeman JP. Gene expression patterns associated with the metastatic phenotype in rodent and human tumors. Cancer Res. 2001;61:1569-1577. [PubMed] |
| 24. | Poser I, Golob M, Buettner R, Bosserhoff AK. Upregulation of HMG1 leads to melanoma inhibitory activity expression in malignant melanoma cells and contributes to their malignancy phenotype. Mol Cell Biol. 2003;23:2991-2998. [PubMed] |
| 25. | Sappington PL, Yang R, Yang H, Tracey KJ, Delude RL, Fink MP. HMGB1 B box increases the permeability of Caco-2 enterocytic monolayers and impairs intestinal barrier function in mice. Gastroenterology. 2002;123:790-802. [PubMed] |
| 26. | Agnello D, Wang H, Yang H, Tracey KJ, Ghezzi P. HMGB-1, a DNA-binding protein with cytokine activity, induces brain TNF and IL-6 production, and mediates anorexia and taste aversion. Cytokine. 2002;18:231-236. [PubMed] |
| 27. | O'Connor KA, Hansen MK, Rachal Pugh C, Deak MM, Biedenkapp JC, Milligan ED, Johnson JD, Wang H, Maier SF, Tracey KJ. Further characterization of high mobility group box 1 (HMGB1) as a proinflammatory cytokine: central nervous system effects. Cytokine. 2003;24:254-265. [PubMed] |
| 28. | Fiuza C, Bustin M, Talwar S, Tropea M, Gerstenberger E, Shelhamer JH, Suffredini AF. Inflammation-promoting activity of HMGB1 on human microvascular endothelial cells. Blood. 2003;101:2652-2660. [PubMed] |
| 29. | Park JS, Arcaroli J, Yum HK, Yang H, Wang H, Yang KY, Choe KH, Strassheim D, Pitts TM, Tracey KJ. Activation of gene expression in human neutrophils by high mobility group box 1 protein. Am J Physiol Cell Physiol 2003; 284: 870-879. [PubMed] |