修回日期: 2005-10-27
接受日期: 2005-10-28
在线出版日期: 2006-01-18
目的: 探讨前列腺素E2(PGE2)在内毒素(LPS)腹腔注射(ip)诱导的幼鼠急性胃黏膜损伤中的保护作用.
方法: 18日龄Wistar大鼠, 随机分为对照组、LPS 组、PAF受体拮抗剂预防组和治疗组四组. 用内毒素(E coli O55: B5脂多糖)5 mg/kg ip制备幼年大鼠内毒素血症模型, 同等量生理盐水ip为对照组, 于注射后1.5, 3, 6, 24, 48, 72 h处死动物, 大体及光学显微镜下观察胃黏膜损伤情况, 用放射免疫方法测定胃黏膜PGE2浓度. 观察分别于内毒素ip前和注射后0.5 h应用血小板活化因子(PAF)受体拮抗剂BN52021(GinkgolideB)5 mg/kg ip对胃黏膜损伤和胃黏膜PGE2浓度影响.
结果: 内毒素组6 h胃黏膜损伤最重, 黏膜表面可见大片糜烂、出血、条索状坏死, 光镜下上皮脱落, 黏膜内有出血, 核碎裂、固缩, 凋亡小体出现; 应用PAF受体拮抗剂后黏膜表面上皮仅见充血水肿, 光镜下损伤仅限于黏膜上皮; 内毒素组6 h胃黏膜PGE2浓度最低, 此时PGE2浓度在LPS组(134.5 mg/L±9.3 mg/L)与对照组(245.1 mg/L±8.9 mg/L)间差异显著(P<0.01); 在PAF受体拮抗剂预防组(304.4 mg/L±15.0 mg/L)、PAF受体拮抗剂治疗组(315.9 mg/L±43.7 mg/L)与LPS组(134.5 mg/L±9.3 mg/L)间均差异显著(P<0.01); PAF受体拮抗剂预防组(304.4 mg/L±15.0 mg/L)和治疗组(315.9 mg/L±43.7 mg/L)与对照组(245.1 mg/L±8.9 mg/L)间差异显著(P<0.05).
结论: 内毒素血症时胃黏膜PGE2下降, PAF受体拮抗剂可以改善这种 PGE2下降; PGE2对内毒素造成的幼鼠急性胃黏膜损伤有保护作用.
引文著录: 刘春英, 王丽杰, 孙梅, 赵恂, 胡月, 赵雅娟, 李军. PGE2在内毒素诱导的幼鼠急性胃黏膜损伤中的变化及PAF受体拮抗剂对其影响. 世界华人消化杂志 2006; 14(2): 163-166
Revised: October 27, 2005
Accepted: October 28, 2005
Published online: January 18, 2006
AIM: To investigate the protective effect of prostaglandin E2 (PGE2) in endotoxin-induced acute gastric mucosal injury in young rats.
METHODS: Eighteen-day old Wistar rats were randomly divided into normal control, model, platelet activating factor (PAF) antagonist prevention and treatment groups. The model of endotoxemia of young rats was established by intraperitoneal injection of endotoxin (5 mg/kg E coli O55: B5 lipopolysaccharide, LPS). The rats in PAF prevention and treatment group were administered with PAF antagonist 0.5 h before and after modeling, respectively. The animals were killed 1.5, 3, 6, 24, 48, and 72 h after LPS injection. The pathological changes of gastric mucosa were observed by hematoxylin-eosin (HE) staining. The content of PGE2 was measured by radioimmunoassay method.
RESULTS: The pathological changes of gastric mucosa were significant 6 h after LPS injection. Erosion, bleeding and necrosis of gastric mucosa were observed. Swelled epithelial cells and developing degeneration were also observed. However, no remarkable changes occurred in both PAF antagonist groups. In model group, the level of PGE2 in gastric mucosa were significantly lower than that in the control (134.5 ± 9.3 g/L vs 245.1 ± 8.9 μg/L, P < 0.01) 6 h after LPS injection. In PAF antagonist prevention and treatment groups, the levels of PGE2 were markedly higher than those in the model and control group (304.4 ± 15.0, 315.9 ± 43.7 g/L vs 134.5 ± 9.3, 245.1 ± 8.9 g/L, P < 0.01 or P < 0.05) 6 h after LPS injection.
CONCLUSION: The level of PGE2 in gastric mucosa is significantly decreased in endotoxemia, but it can be improved by PAF antagonist. PGE2 has protective effect against LPS-induced acute gastric mucosal injury in young rats.
- Citation: Liu CY, Wang LJ, Sun M, Zhao X, Hu Y, Zhao YJ, Li J. Change of prostaglandin E2 and effect of platelet activating factor antagonist on prostaglandin E2 in endotoxin-induced acute gastric mucosal injury in young rats. Shijie Huaren Xiaohua Zazhi 2006; 14(2): 163-166
- URL: https://www.wjgnet.com/1009-3079/full/v14/i2/163.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i2.163
急性胃黏膜损伤是严重感染、外伤、休克等危重症的常见并发症, 在上述疾病中发病率可高达60%-100%; 未经治疗者大出血率达15%, 常常危及生命[1]. 其发生原因是由于胃黏膜保护机制削弱, 损伤因素相对增强所致[2]. 近年研究发现前列腺素E2(prostaglandin E2, PGE2)在胃黏膜损伤的保护和修复方面发挥重要作用[3]. 我们通过给幼年大鼠腹腔注射(intraperitoneal injection, ip)内毒素(lipopolysaccharide, LPS), 在内毒素血症时观察幼鼠急性胃黏膜损伤, 探讨在急性胃黏膜损伤和修复过程中, 以及应用血小板活化因子(platelet activating factor, PAF)受体拮抗剂后胃黏膜PGE2浓度变化, 研究PGE2对急性胃黏膜损伤的保护作用.
健康18日龄Wistar大鼠, 平均体质量32.37±6.32 g, 与母鼠共同饲养(由中国医科大学第二临床学院实验动物中心提供). 内毒素O55:B5脂多糖为美国 Sigma公司产品, PAF受体拮抗剂BN52021GinkgolideB为美国Sigma公司产品. PGE2放射免疫试剂盒购于北京东亚免疫研究所. 液体闪烁计数器(美国BECKMAN).
随机分为对照组、LPS 组、PAF受体拮抗剂预防组和治疗组四组, 每组每一时相点(1.5, 3, 6, 24, 48, 72 h)各8只. 对照组仅生理盐水1 mL/kg ip; LPS组内毒素(O55:B5脂多糖)5 mg/kg ip, 配比浓度5 g/L, 用生理盐水溶解. PAF受体拮抗剂预防组于内毒素ip前0.5 h、治疗组于内毒素ip后0.5 h给予PAF受体拮抗剂BN52021(GinkgolideB)5 mg/kg ip. 用药后各组均放回鼠笼, 继续哺乳. 分别于内毒素ip后1.5, 3, 6, 24, 48, 72 h处死动物, 迅速开腹取胃, 沿胃大弯剪开, 大体观察胃黏膜损伤情况, 在腺胃区胃大弯处取0.5 cm×0.5 cm胃组织置入40 g/L甲醛溶液中固定24 h, 常规石蜡包埋、切片、H-E染色光学显微镜检查.其余部分用生理盐水冲洗3次, 深低温冰箱-70℃保存. 胃黏膜PGE2浓度测定: 取低温保存腺胃区黏膜20 mg, 制成100 g/L匀浆, 离心, 取上清液, -20℃以下保存; 测量时将上清液中加入重蒸馏乙酸乙酯, 混匀, 离心, 吸取上清液, 按试剂盒说明PGE2放免测定加液程序加入3H标记物等试剂, 离心后将上清液倒入预先加有闪烁液的瓶中, 在液体闪烁计数器上测放射性. 根据放射性得出PGE2浓度.
统计学处理 连续数据以平均值±标准差(mean±SD)表示, 使用SPSS 10.0软件系统对实验结果进行统计学分析, 组间比较采用方差分析, P<0.05认为有统计学意义.
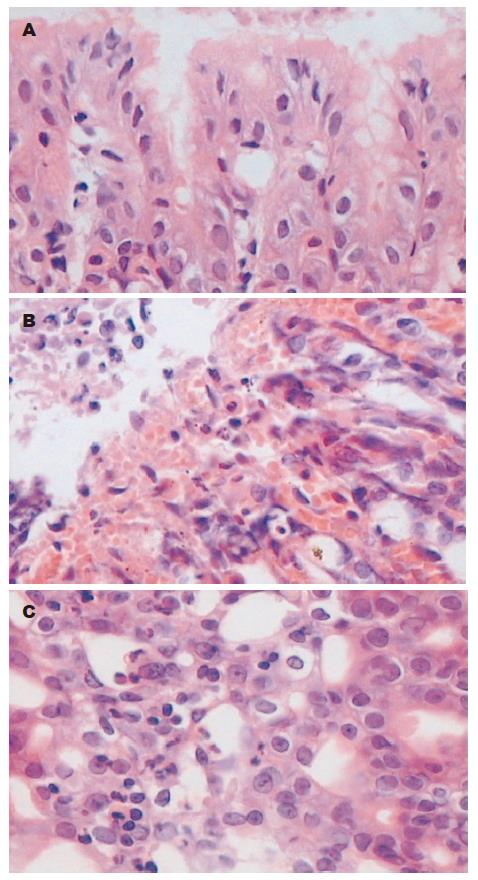
大体观察见LPS组1.5 h胃黏膜轻度水肿, 3 h胃黏膜充血、水肿, 6 h黏膜表面可见大片糜烂、出血、条索状坏死, 与胃纵轴平行, 损伤主要见于腺胃区, 窦部少见, 前胃部无损伤, 24 h黏膜糜烂、出血、坏死灶陈旧、缩小, 48 h黏膜轻度萎缩, 72 h胃黏膜基本恢复正常; 光镜下1.5 h 黏膜上皮细胞水肿, 3 h组织充血、水肿, 6 h胃黏膜损伤最重, 黏膜表面上皮广泛脱落, 黏膜内有出血, 炎性细胞浸润, 核碎裂、固缩, 凋亡小体出现, 腺体受损, 24 h上皮脱落、中性粒细胞浸润, 48 h黏膜层变薄、腺体少, 72 h未见明显异常. PAF受体拮抗剂预防组和治疗组6 h仅见胃黏膜充血水肿, 镜下见黏膜上皮细胞肿胀、充血. 对照组胃黏膜表面上皮隐窝细胞形态学正常, 腺体结构完整(图1).
LPS组6 h PGE2浓度最低, 此时PGE2浓度在LPS组(134.5±9.3 mg/L)与对照组(245.1±8.9 mg/L)间差异显著(P<0.01); 在PAF受体拮抗剂预防组(304.4±15.0 mg/L)、PAF受体拮抗剂治疗组(315.9±43.7 mg/L)与LPS组(134.5±9.3 mg/L)间均差异显著(P<0.01); PAF受体拮抗剂预防组(304.4±15.0 mg/L)和治疗组(315.9±43.7 mg/L)间无明显差异(P>0.05); 在PAF受体拮抗剂预防组(304.4±15.0 mg/L)、PAF受体拮抗剂治疗组(315.9±43.7 mg/L)与对照组(245.1±8.9 mg/L)间均差异显著(P<0.05)(表1).
前列腺素(PG)是一种脂质, 主要在精囊、肾髓质、肺和胃肠道中合成[4]. PG不在细胞内贮存, 而在分泌瞬间合成, PG的产生和释放是由于组织损害的结果[5]. 早在1978年Robert et al[6]首先观察到PG可以抑制胃酸分泌, 且非抗酸剂量的PG可以完全防止酒精、强酸、强碱等物质引起的急性胃黏膜损伤. 国外大量资料证实十二指肠溃疡患者胃窦部及十二指肠球部黏膜PGE2含量下降, 溃疡活动期下降明显[7]. 本实验腹腔注射内毒素后6 h胃黏膜损伤最重, PGE2浓度最低; 此后, PGE2浓度逐渐上升, 胃黏膜损伤逐渐愈合. 因此, 内毒素血症时急性胃黏膜损伤可能与PGE2合成抑制有关, PG的不断产生和释放对胃黏膜细胞起保护作用, 促进胃黏膜细胞愈合.PG对胃黏膜的保护作用在多种动物模型中得到证实, 这种不依赖于抗酸的作用Robert et al[8]称之为"细胞保护". 文献[9]报道PG可能通过刺激胃黏液的生成和分泌, 促进HCO3-的分泌, 增加表面磷脂的生成, 加强胃黏膜屏障的疏水性; 以及保护胃黏膜微循环结构的完整, 维持胃黏膜血液供应, 保护增殖区细胞, 促进黏膜上皮的更新及修复和抑制胃运动过强等机制来实现对胃黏膜保护作用. PG在胃黏膜保护机制中居中心地位, 起到加强其他因素的作用.
PAF是迄今发现的内源性溃疡形成介质中最强的一个, 作为炎性细胞因子放大网络中心放大器, 对其他炎性细胞因子的作用起增强作用[10]. 目前认为PAF引起胃黏膜损害主要与以下因素有关: (1)通过增加血管通透性, 引起血压下降和缩血管作用, 减少胃黏膜血流量; (2)作用于胃肠道中的中性粒细胞, 使其活化、黏附、游出, 通过"呼吸爆发"产生氧自由基、白三烯(LT3)等炎性介质, 释放消化酶, 引起胃肠道黏膜损害; (3)在PAF、肿瘤环死因子(TNF)、白介素1 (IL-1)和粒单核细胞克隆刺激因子等诱导、合成、释放和协同作用中, 起动血管组织损伤的正反馈机制, PAF和TNF在开始阶段起关键作用[11]. 已经证明, 巨噬细胞、中性粒细胞、血小板、嗜酸性粒细胞、肥大细胞等受到内毒素刺激后产生PAF[12,13]. PAF受体拮抗剂能显著改变内毒素或PAF引起的血流动力学改变及组织器官的损伤, 还可抑制花生四烯酸类介质的释放和氧自由基的产生[14,15]. 本实验中预先及腹腔注射内毒素后给予PAF受体拮抗剂, 减轻了内毒素诱导的幼鼠急性胃黏膜损伤, 改善了胃黏膜PGE2的浓度. 因此, PAF受体拮抗剂可能通过增加胃黏膜PGE2的浓度来保护胃黏膜.
总之, 内毒素血症可致幼鼠急性胃黏膜损伤, 胃黏膜PGE2下降, PAF受体拮抗剂可减轻内毒素诱导的幼鼠急性胃黏膜损伤, 改善胃黏膜PGE2的浓度. PGE2对内毒素造成的幼鼠急性胃黏膜损伤有保护作用.
急性胃黏膜损伤是严重感染、外伤、休克等危重症的常见并发症, 在上述疾病中发病率可高达60%-100%, 未经治疗者大出血率达15%, 常常危及生命.
目前认为急性胃黏膜损伤发生原因是由于胃黏膜保护机制削弱, 损伤因素相对增强所致. 近年研究发现前列腺素E2(PGE2)在胃黏膜损伤的保护和修复方面发挥重要作用.
早在1978年Robertetal首先观察到前列腺素可以抑制胃酸分泌, 可以防止酒精、强酸、强碱等物质引起的急性胃黏膜损伤.2002年姚新生etal观察了应激性溃疡中血小板活化因子的变化及银杏叶提取物的防治作用.
内毒素血症时胃黏膜PGE2下降, PAF受体拮抗剂可以改善这种PGE2下降;PGE2对内毒素造成的幼鼠急性胃黏膜损伤有保护作用. PGE2及PAF受体拮抗剂可用于防治内毒素造成急性胃黏膜损伤.
编辑: 潘伯荣 审读: 张海宁 电编: 李琪
| 2. | 夏 敏, 陶 嘉泳, 俞 蔼谣. 急性胃黏膜损伤的机制研究. 上海第二医科大学学报. 2001;21:517-519. |
| 3. | Chiou SK, Tanigawa T, Akahoshi T, Abdelkarim B, Jones MK, Tarnawski AS. Survivin: a novel target for indomethacin-induced gastric injury. Gastroenterology. 2005;128:63-73. [PubMed] |
| 4. | 王 长洪. 前列腺素与胃黏膜病变. 中国中西医结合脾胃杂志. 1995;3:50-51. |
| 5. | Konturek SJ, Bowman J, Lancaster C, Hanchar AJ, Robert A. Cytoprotection of the canine gastric mucosa by prostaglandins possible mediation by increased mucosal blood flow. Gastroenterology. 1979;76:1173. |
| 6. | Robert A, Lancaster C, Hanchar AJ, Nezamis JE. Mild irritant prevent gastric necrosis through prostaglandin formation:histological study. Gastroenterology. 1978;74:1086. |
| 8. | Robert A, Lancaster C, Nezamis JE, Hanchar AJ. cytoprotection. prostaglands, exogenous or endogenous, can mintain gastric secretory function. Gastroenterology. 1978;74:1086. |
| 10. | Montrucchio G, Alloatti G, Camussi G. Role of platelet-activating factor in cardiovascular pathophysiology. Physiol Rev. 2000;80:1669-1699. [PubMed] |
| 11. | Ishii S, Shimizu T. Platelet-activating factor (PAF) receptor and genetically engineered PAF receptor mutant mice. Prog Lipid Res. 2000;39:41-82. [PubMed] |
| 13. | 姚 新生, 孙 万邦. 血小板活化因子的生理、病理作用及机制. 国外医学 生理、病理科学与临床分册. 2002;21:61-64. |