修回日期: 2005-11-21
接受日期: 2005-11-24
在线出版日期: 2006-01-18
目的: 研究中药肝炎平对CCl4诱导的大鼠肝纤维化肝脏TGFβ1及其受体TβRⅠ, TbRⅡ水平和Smad3, Smad7及前胶原a2(Ⅰ)(Col1a2) mRNA表达的影响, 探讨其抗纤维化的作用机制.
方法: 健康Wistar大鼠38只随机分为正常对照组(N组)、模型对照组(A组)以及肝炎平治疗组(B组). N组每日以生理盐水10 mL/g灌胃, A组及B组用CCl4制备大鼠肝纤维化模型, B组4 wk后开始以肝炎平10 mL/g灌胃给药, A组同时以生理盐水10 mL/g灌胃, 每日1次. 9 wk后处死大鼠, 取肝组织作病理学检查, 免疫组化检测TGFβ1及其受体TβRⅠ, TβRⅡ的表达, RT-PCR检测胞内信号蛋白Smad3, Smad7以及Col1a2 mRNA的表达.
结果: 与正常对照组相比, 模型组TGFβ1、 TβRⅠ、TβRⅡ、Smad3、Col1a2表达明显增强, Smad7表达明显下降. 经肝炎平治疗后大鼠肝脏TGFβ1及其受体TβRⅠ, TβRⅡ表达均比模型组减弱(TGFβ1: 4.30±0.16 vs 4.18±0.17, P<0.05; TβRⅠ: 4.35±0.14 vs 4.24±0.10, P<0.05; TβRⅡ: 4.37±0.11 vs 4.27±0.08, P<0.05). 肝炎平同时下调Smad3和Col1a2 mRNA的表达(Smad3: 0.93±0.05 vs 0.90±0.41, P<0.05; Col1a2: 0.95±0.03 vs 0.92±0.03, P<0.05), 上调Smad7 mRNA的表达(0.84±0.05 vs 0.87±0.03, P<0.05). 另外, 肝炎平组大鼠肝脏病理变化显著改善.
结论: 肝炎平对大鼠肝纤维化肝脏TGFβ1/Smad信号通路有明显的影响, 能抑制CCl4诱导的大鼠肝纤维化, 其作用机制可能为抑制TGFβ1及其受体TβRⅠ, TβRⅡ蛋白表达, 下调Smad3 mRNA, 上调Smad7 mRNA的表达, 并最终下调了作为主要细胞外基质的Col1a2 mRNA的表达.
引文著录: 熊章鄂, 但自力, 唐望先, 严红梅. 中药肝炎平对 CCl4 诱导的肝纤维化大鼠 TGFβ1/Smad 信号通路的影响. 世界华人消化杂志 2006; 14(2): 152-157
Revised: November 21, 2005
Accepted: November 24, 2005
Published online: January 18, 2006
AIM: To study the effects of Ganyanping on the experimental hepatic fibrosis induced by carbon tetrachloride (CCl4) in rats, and to explore its anti-fibrotic molecular mechanism.
METHODS: Thirty-eight healthy Wistar rats were randomly divided into normal control (N), model control (A), and Ganyanping therapeutic group (B). The rats in group N was treated with normal saline by intragastrical irrigation, and those in group A and B were subcutaneous injected with CCl4 to establish hepatic fibrosis model. Four weeks later, the animas in group B were treated with Ganyanping (10 L/g) and those in group A were treated with normal saline by intragastrical irrigation at the same time. The histological changes of the liver tissues were examined by pathological examination. The protein expression of transforming growth factor beta 1 (TGFβ1) and its receptors (TβRⅠ and TβRⅡ) were measured by immunohistochemical technique. The changes of Smad3, Smad7 and Col1a2 mRNA expression were observed by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: The levels of TGFβ1, TβRT, TβRU, Smad3 and Col1a2 expression were elevated, and that of Smad7 was reduced in the model rats. In comparison with those in group A, the levels of TGFβ1 and its receptors protein expression in group B were significantly decreased after treatment with Ganyanping (TGFβ1: 4.18 ± 0.17 vs 4.30 ± 0.16, P < 0.05; TβRⅠ: 4.24 ± 0.10 vs 4.35 ± 0.14, P < 0.05; TβRⅡ: 4.27 ± 0.08 vs 4.37 ± 0.11, P < 0.05). Meanwhile, the levels of Smad3 and Col1a2 mRNA expression were also down-regulated (Smad3: 0.90 ± 0.41 vs 0.93 ± 0.05, P < 0.05; Col1a2: 0.92 ± 0.03 vs 0.95 ± 0.03, P < 0.05). However, the level of Smad7 mRNA expression was significantly up-regulated (0.87 ± 0.03 vs 0.84 ± 0.05, P < 0.05). The pathological changes of liver tissues in group B were also markedly alleviated.
CONCLUSION: Ganyanping has significant inhibitory effects on CCl4-induced hepatic fibrosis in rats, and its mechanism may be associated with the inhibition of TGFβ1 and its receptors protein expression, down-regulation of Smad3 mRNA expression and up-regulation of Smad7 mRNA expression.
- Citation: Xiong ZE, Dan ZL, Tang WX, Yan HM. Effects of traditional Chinese medicine Ganyanping on TGFβ1/Smad signaling pathway in carbon tetrachloride-induced hepatic fibrosis of rats. Shijie Huaren Xiaohua Zazhi 2006; 14(2): 152-157
- URL: https://www.wjgnet.com/1009-3079/full/v14/i2/152.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i2.152
中药肝炎平由黄芪、丹参、虎杖等多味中药组方而成, 具有清热解毒、化湿化瘀、活血通络之功效, 经多年临床应用, 显示出了良好的抗肝纤维化作用. 转化生长因子β1(transforming growth factor-beta1, TGF-β1)是肝纤维化过程中重要的细胞因子[1-4]. 肝炎平的抗纤维化作用亦可能与TGF-β1/Smad信号通路有关, 为了探讨其抗肝纤维化作用的机制, 我们采用CCl4诱导大鼠肝纤维化模型, 用免疫组化和RT-PCR方法检测TGF-β1及其受体TbRⅠ,TbRⅡ蛋白水平及Smad3, Smad7, 前胶原a2(Ⅰ)(Col1a2)mRNA水平的表达, 观察肝炎平对肝纤维化时肝脏TGF-β1/Smad信号通路的影响.
肝炎平由华中科技大学同济医学院附属同济医院药厂提供, 批号: 20041110. 所用一抗均购自武汉博士德公司, 免疫组化试剂盒及辣根过氧化物酶标记的二抗购自北京中山公司. RNA抽提试剂RNArose Reagent购自上海华舜生物工程有限公司. 逆转录酶M-MLV, Oligo(dT)15, RNase inhibitor, dNTP购自Promega公司, Taq酶购自MBI公司. 引物由上海生工生物工程技术服务有限公司合成, 用三蒸水溶解配成10 mmol/L工作浓度备用. 清洁级♂Wistar大鼠38只, 体质量180-220 g, 由华中科技大学同济医学院实验医学动物中心提供. 采用CCl4制造肝纤维化模型, 以400 mL/L CCl4色À油溶液按3 mL/g sc, 每周2次, 共9 wk. 大鼠随机分为3组: N组(正常对照组, 8只), A组(模型对照组, 15只), B组(肝炎平治疗组, 15只). N组正常饲养, 每日以生理盐水10 mL/g灌胃. 其余两组按上述方法造模, B组4 wk后开始以肝炎平10 mL/g灌胃给药, A组同时以生理盐水10 mL/g灌胃, 每日1次. 9 wk后, 处死大鼠, 取部分肝脏组织(每只大鼠部位相同), 40 g/L中性甲醛固定, 石蜡包埋, 切片行HE染色.
1.2.1 肝脏TGF-β1、TbRⅠ、TbRⅡ表达的检测: 石蜡切片常规脱蜡至水, 30 mL/L H202孵育15 min, 抗原修复, 正常血清封闭, 1:50稀释的一抗4℃孵育过夜, 生物素化二抗37℃孵育15 min, SP 37℃孵育15 min, DAB染色. PBS代替一抗作空白对照. 每张切片随机选取不重叠的10个视野摄取图像, 用HPIAS-1000型多媒体彩色病理图文分析系统进行图像半定量分析, 测定每张切片阳性表达区域的平均光密度值, 求平均值并取对数作为该张切片的阳性表达强度.
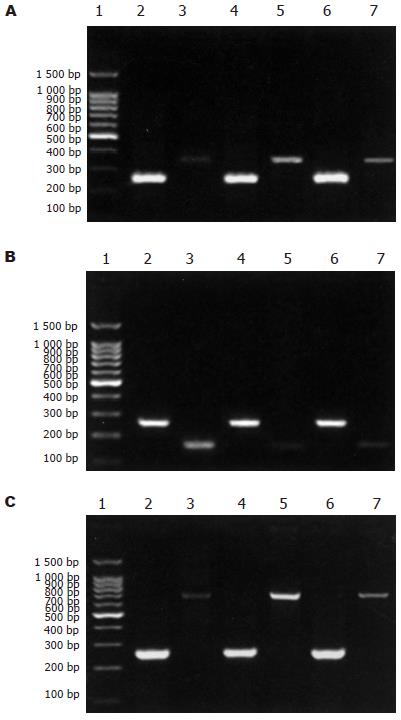
1.2.2 Smad3、Smad7及Col1a2在mRNA水平的表达: 按照RNA抽提试剂RNArose Reagent使用说明进行. 紫外分光光度计测RNA浓度及纯度. 取总RNA 2 mg在50 mL体系下逆转录反应合成cDNA, 取cDNA 4 mL作为模板进行PCR反应. Smad3上游引物5'-CAGGGCTTTGAGGCTGTCTA-3', 下游引物5'-CTGGCATCTTCTGTGGTTTC-3', 扩增片断长度357 bp, 退火温度54℃; Smad7上游引物5'-ACTGGTGCGTGGTGGCATACTGG-3', 下游引物5'-GCCGATCTTGCTCCTCACTTTCTG-3', 扩增片断长度176 bp, 退火温度60℃; Col1a2上游引物5'-CAGCGGAGGAGGCTATGACTTT-3', 下游引物5'-GGCGAGATGGCTTATTCGTTTT-3', 扩增片断长度707 bp, 退火温度58℃; 亲环素CYC作为内参, 上游引物5'-CTTCGACATCACGGCTGATGG-3', 下游引物5'-CAGGACCTGTATGCTTCAGG-3', 扩增片断长度265 bp, 退火温度56℃. 取PCR反应产物6 mL在20 g/L琼脂糖凝胶上电泳45 min, 电压80 V, 电泳缓冲液为0.5×TBE. 图像分析仪采图, Bandscan5.0软件分析图像灰度值, 并以单位面积的扩增片断/单位面积的CYC的灰度值(取对数)表示所扩增目的基因片断的相对表达水平, 作半定量分析.
统计学处理 采用SPSS 11.5统计软件包, 组间比较用t检验, 结果以mean±SD表示.
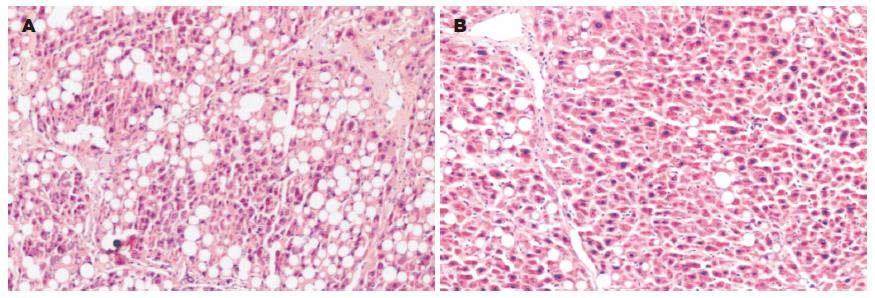
正常组肝细胞以中央静脉为中心向四周呈放射状排列, 结构正常. 模型组肝组织病理损害严重, 正常结构被破坏, 肝索排列紊乱, 肝细胞明显肿胀变性, 其中多为脂肪变性, 肝小叶中央区明显坏死. 间质内有炎性细胞浸润, 胶原增生显著, 增生结缔组织分割肝小叶, 接近形成假小叶. 肝炎平治疗组与模型组相比, 肝组织结构破坏不明显, 肝细胞脂肪变性程度显著减轻, 可见少量炎性细胞浸润, 肝细胞坏死减轻, 少见纤维结缔组织增生(图1A, B).
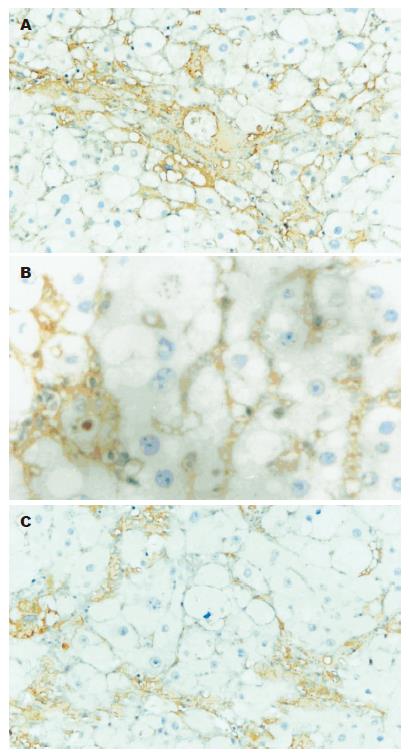
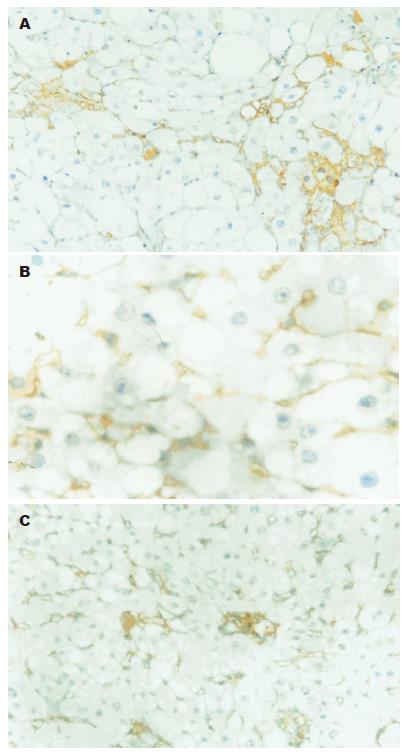
TGF-β1在正常组肝组织肝窦处有阳性着色, 与正常组比较模型组TGF-β1表达明显增强(P<0.01), 主要分布于纤维组织增多的区域以及汇管区、肝血窦、坏死灶等处, 以纤维隔中炎性细胞胞质及其周围多见, 提示肝脏间质细胞是TGF-β1的主要来源细胞(图2A). 肝炎平治疗组阳性染色程度较模型组明显减轻(P<0.05), 纤维隔中炎性细胞胞质阳性染色明显减少(图3A). 正常对照组肝细胞和间质细胞可见TbRⅠ和TbRⅡ阳性染色, 模型组TbRⅠ和TbRⅡ阳性染色显著增强(P<0.01), 尤以纤维增生组织和炎性细胞周围多见(图2B, C). 肝炎平治疗组阳性染色程度较模型组明显减轻(图3B, C)(P<0.05, 表1).
与正常组相比, 模型组Smad3, Col1a2 mRNA表达增强(P<0.01), 肝炎平治疗组较模型组表达减弱(P<0.05)肝炎平治疗组与模型组相比有显著差异; 模型组Smad7较正常组表达降低(P<0.01), 而与模型组比较, 肝炎平治疗组表达增强(P<0.05), 肝炎平治疗组与模型组相比有显著差异(表1, 图4).
转化生长因子β1(transforming growth factor-beta1, TGF-β1)是最重要的促纤维化生长因子, 活化后的TGF-β1结合于特异性受体后进入信号转导途径, 发挥其生物学作用[5,6]. TGF-β受体存在于体内所有细胞并仅能结合激活的TGF-β. TGF-β受体属丝氨酸(Ser)/苏氨酸(Thr)蛋白激酶受体[7], 分为3型: Ⅰ型(TbRⅠ), Ⅱ型(TbRⅡ), Ⅲ型(TbRⅢ). TbRⅠ和TbRⅡ参与信号转导. TbRⅡ是一种结构性激酶, 有自身磷酸化的功能. TGF-β1在TbRⅢ递呈作用下结合于TbRⅡ, 然后TbRⅠ被迅速募集到TGF-β-TbRⅡ二聚体中, 并被TbRⅡ磷酸化, 磷酸化后的TbRⅠ具有激酶活性并传递信号给下游底物. TbRⅡ在胞质区域有丝氨酸/苏氨酸激酶活性, 在功能上对信号传递起闸门作用[6]. 被TbRⅡ激活的TbRⅠ能够激活胞质中转导信号至核内的信号蛋白Smads[8]. 迄今为止, Smad蛋白是TGF-β受体胞内激酶的唯一底物[8], 他既是胞内信号分子, 又有转录激活作用. 目前所知的8种Smad蛋白中, 只有Smad2、Smad3是TbRⅠ的底物, 介导TGF-β1信号[9]. TGF-β1介导的受体调节型Smad2和Smad3的磷酸化导致的构象变化使之易于与Smad4相互作用, 并转移至核内. 在核内, 一旦Smad2/3-Smad4复合物结合到靶基因的启动子, 可根据细胞类型的不同, 激活或抑制转录[10]. 经Smad通路的TGF-β信号转导途径的研究表明[11], Col1a2, Col3a1, Col6a1, Col6a3, TIMP-Ⅰ以及PAI-1均是受其调控的靶基因. Smad3与Smad4形成复合物并转移至核内, 并在核内转录调节TGF-β靶基因的启动子, 如纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1, PAI-1)和Ⅰ型胶原a链, 他们在多种组织的纤维化进程中均有重要作用. Ⅰ型胶原是纤维化进程中主要的胞外基质, 已有研究表明[5], Smad3是HSC活化的重要媒介, 减少Smad3的激活被认为是调节下游Ⅰ型胶原表达的关键步骤. Smad7是一种抑制型Smad, 他与TbRⅠ结合后阻止其招募Smad3及磷酸化, 从而抑制TGF-β1信号的传导. Smad7也能使E3泛素连接酶Smurfs 1和2(Smad ubiquitination regulatory factors 1 and 2)结合于TbRⅠ, 随后使之泛素化而降解. 在慢性肝损伤过程中Smad7的水平降低[12], 失去了对TGF-β信号潜在的抑制作用, 而诱导Smad7的表达[13], 能够竞争性抑制Smad2/3的核转位, 阻断TGF-β1信号的传导, 减少Ⅰ和Ⅲ型胶原的表达.
本结果显示, 肝炎平治疗组肝纤维化程度较模型组明显减轻, 肝炎平能够显著抑制TGF-β1及其受体TbRⅠ, TbRⅡ的表达(P<0.05), 拮抗胞内关键信号分子Smad3, 上调Smad7在mRNA水平的表达(P<0.05), 并最终抑制了Col1a2 mRNA的表达(P<0.05). 目前认为[14], 阻断TGF-β1的合成和信号是抗纤维化治疗的主要目标, 随着细胞生物学的发展, 开展了在多种水平上抑制TGF-β1的尝试. 这些主要包括抗氧化剂的应用[15-19], 中和性抗体[20]以及中草药[21-23], 起负性作用可溶性受体的表达[24,25], 拮抗性细胞因子的应用[26-28]以及运用反义寡核苷酸阻断TGF-β1的合成等[29]. 祖国医学认为, 肝纤维化的形成主要是由于湿热、气虚、血瘀所致. 肝炎平主要由黄芪、丹参、虎杖等多味中药组成, 具有活血化瘀、清热解毒、疏肝利胆、益气化湿的功效, 正是针对肝纤维化的病理环节组方. 我们以前的研究发现[30,31], 肝炎平能有效调节免疫机制, 降低TNF-α, IL-6, IL-8等细胞因子的生成和释放, 减少肝损害时肝组织氧自由基的产生, 提高细胞SOD活性, 对急慢性肝损伤有很好的保护作用, 并具有防治肝纤维化的作用, 但一直对其作用的分子机制不甚明确. 本研究表明, 肝炎平可在多层次、多靶点通过TGF-β1/Smad信号通路发挥作用从而抑制肝纤维化的发生与发展, 这可能是其抗肝纤维化作用的重要机制.
TGFβ1及其信号转导通路在肝纤维化的发生与发展中有着重要作用, 干预其信号转导的各个环节已成为目前抗肝纤维化治疗的重要目标.
本文结果显示中药肝炎平能在多水平、多靶点作用于TGFβ1及其信号通路, 为其良好的抗肝纤维化作用提供了有力的实验依据, 为进一步深入研究祖国中草药的抗肝纤维化作用提供了重要思路.
本研究从TGF-β1与Smad, 2, 3作用的线索出发, 研究了肝炎平的抗肝纤维化机制. 方法思路比较先进, 结论与结果相符. 图片资料清晰, 对读者有启发作用.
编辑: 潘伯荣 审读: 张海宁 电编: 张敏
| 1. | Schnabl B, Kweon YO, Frederick JP, Wang XF, Rippe RA, Brenner DA. The role of Smad3 in mediating mouse hepatic stellate cell activation. Hepatology. 2001;34:89-100. [PubMed] |
| 2. | Reeves HL, Friedman SL. Activation of hepatic stellate cells-a key issue in liver fibrosis. Front Biosci. 2002;7:d808-d826. [PubMed] |
| 3. | Flisiak R, Wiercinska-Drapalo A, Tynecka E. Trans-forming growth factor beta in pathogenesis of liver diseases. Wiad Lek. 2000;53:530-537. [PubMed] |
| 4. | Bissell DM, Roulot D, George J. Transforming growth factor beta and the liver. Hepatology. 2001;34:859-867. [PubMed] |
| 5. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming grow-th factor beta response and signaling during trans-differentiation of rat hepatic stellate cells to myofi-broblasts. Hepatology. 2000;31:1094-1106. [PubMed] |
| 6. | Hernandez-Canaveral I, Gonzalez J, Lopez-Casillas F, Armendariz-Borunda J. Amplified expression of dominant-negative transforming growth factor-beta type II receptor inhibits collagen type I production via reduced Smad-3 activity. J Gastroenterol Hepatol. 2004;19:380-387. [PubMed] |
| 7. | ten Dijke P, Hill CS. New insights into TGF-beta-Smad signalling. Trends Biochem Sci. 2004;29:265-273. [PubMed] |
| 8. | Massague J, Wotton D. Transcriptional control by the TGF-beta/Smad signaling system. EMBO J. 2000;19:1745-1754. [PubMed] |
| 9. | Attisano L, Wrana JL. Mads and Smads in TGF beta signalling. Curr Opin Cell Biol. 1998;10:188-194. [PubMed] |
| 10. | Ellis LR, Warner DR, Greene RM, Pisano MM. Interaction of Smads with collagen types I, III, and V. Biochem Biophys Res Commun. 2003;310:1117-1123. [PubMed] |
| 11. | Verrecchia F, Chu ML, Mauviel A. Identification of novel TGF-beta /Smad gene targets in dermal fibroblasts using a combined cDNA microarray/promoter transactivation approach. J Biol Chem. 2001;276:17058-17062. [PubMed] |
| 12. | Tahashi Y, Matsuzaki K, Date M, Yoshida K, Furu-kawa F, Sugano Y, Matsushita M, Himeno Y, Inaga-ki Y, Inoue K. Differential regulation of TGF-beta signal in hepatic stellate cells between acute and chronic rat liver injury. Hepatology 2002; 35: 49-61. [PubMed] |
| 13. | Terada Y, Hanada S, Nakao A, Kuwahara M, Sasaki S, Marumo F. Gene transfer of Smad7 using electro-poration of adenovirus prevents renal fibrosis in post-obstructed kidney. Kidney Int. 2002;61:94-98. [PubMed] |
| 14. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] |
| 15. | De Bleser PJ, Xu G, Rombouts K, Rogiers V, Geerts A. Glutathione levels discriminate between oxidative stress and transforming growth factor-beta signaling in activated rat hepatic stellate cells. J Biol Chem. 1999;274:33881-33887. [PubMed] |
| 16. | Cao Q, Mak KM, Lieber CS. DLPC decreases TGF-beta1-induced collagen mRNA by inhibiting p38 MAPK in hepatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2002;283:G1051-G1061. [PubMed] |
| 17. | Meurer SK, Lahme B, Tihaa L, Weiskirchen R, Gressner AM. N-acetyl-L-cysteine suppresses TGF-beta signaling at distinct molecular steps: the biochemical and biological efficacy of a multifunc-tional, antifibrotic drug. Biochem Pharmacol. 2005;70:1026-1034. [PubMed] |
| 18. | Lee CH, Jang YS, Her SJ, Moon YM, Baek SJ, Eling T. Nordihydroguaiaretic acid, an antioxidant, inhibits transforming growth factor-beta activity through the inhibition of Smad signaling pathway. Exp Cell Res. 2003;289:335-341. [PubMed] |
| 19. | Miyazaki T, Karube M, Matsuzaki Y, Ikegami T, Doy M, Tanaka N, Bouscarel B. Taurine inhibits oxidative damage and prevents fibrosis in carbon tetrachloride-induced hepatic fibrosis. J Hepatol. 2005;43:117-125. [PubMed] |
| 20. | Schuftan GG, Bachem MG. Alpha2-macroglobulin reduces paracrine- and autocrine-stimulated matrix synthesis of cultured rat hepatic stellate cells. Eur J Clin Invest. 1999;29:519-528. [PubMed] |
| 21. | Shimizu I, Ma YR, Mizobuchi Y, Liu F, Miura T, Nakai Y, Yasuda M, Shiba M, Horie T, Amagaya S. Effects of Sho-saiko-to, a Japanese herbal medicine, on hepatic fibrosis in rats. Hepatology. 1999;29:149-160. [PubMed] |
| 22. | Ochi T, Kawakita T, Nomoto K. Effects of Hochu-ekki-to and Ninjin-youei-to, traditional Japanese medicines, on porcine serum-induced liver fibrosis in rats. Immunopharmacol Immunotoxicol. 2004;26:285-298. [PubMed] |
| 23. | Song SL, Gong ZJ, Zhang QR, Huang TX. Effects of Chinese traditional compound, JinSanE, on expression of TGF-beta1 and TGF-beta1 type II receptor mRNA, Smad3 and Smad7 on experimen-tal hepatic fibrosis in vivo. World J Gastroenterol. 2005;11:2269-2276. [PubMed] |
| 24. | Kanzler S, Meyer E, Lohse AW, Schirmacher P, Henninger J, Galle PR, Blessing M. Hepatocellular expression of a dominant-negative mutant TGF-beta type II receptor accelerates chemically induced hepatocarcinogenesis. Oncogene. 2001;20:5015-5024. [PubMed] |
| 25. | Cui X, Shimizu I, Lu G, Itonaga M, Inoue H, Shono M, Tamaki K, Fukuno H, Ueno H, Ito S. Inhibitory effect of a soluble transforming growth factor beta type II receptor on the activation of rat hepatic stellate cells in primary culture. J Hepatol. 2003;39:731-737. [PubMed] |
| 26. | Ueki T, Kaneda Y, Tsutsui H, Nakanishi K, Sawa Y, Morishita R, Matsumoto K, Nakamura T, Takahashi H, Okamoto E. Hepatocyte growth factor gene therapy of liver cirrhosis in rats. Nat Med. 1999;5:226-230. [PubMed] |
| 27. | Liu XJ, Ruan CM, Gong XF, Li XZ, Wang HL, Wang MW, Yin JQ. Antagonism of transforming growth factor-Beta signaling inhibits fibrosis-related genes. Biotechnol Lett. 2005;27:1609-1615. [PubMed] |
| 28. | Inagaki Y, Kushida M, Higashi K, Itoh J, Higashiya-ma R, Hong YY, Kawada N, Namikawa K, Kiyama H, Bou-Gharios G. Cell type-specific intervention of transforming growth factor beta/Smad signaling suppresses coll-agen gene expression and hepatic fibrosis in mice. Gastroenterology. 2005;129:259-268. [PubMed] |
| 29. | Ueno H, Sakamoto T, Nakamura T, Qi Z, Astuchi N, Takeshita A, Shimizu K, Ohashi H. A soluble transforming growth factor beta receptor expressed in muscle prevents liver fibrogenesis and dysfuncti-on in rats. Hum Gene Ther. 2000;11:33-42. [PubMed] |
| 30. | Tang WX, Dan ZL, Yan HM, Wu CH, Zhang G, Liu M, Li Q, Li SB. Experimental study of effect of Ganyanping on fibrosis in rat livers. World J Gastroenterol. 2003;9:1292-1295. [PubMed] |