修回日期: 2005-10-21
接受日期: 2005-10-31
在线出版日期: 2006-01-18
目的: 探讨温热对人胃癌细胞株增殖、生存以及黏附、侵袭能力的影响.
方法: 对人胃癌细胞株(AGS, h的温热处理, MKN45, SGC7901, NCI-N87, SNU-1和SNU-16)行43℃ 2 以37℃常温培养为对照. 处理后用MTT法绘制生长曲线并比较增殖抑制情况; 光镜下动态观察细胞生长情况和形态学变化; Hoechst33342/PI荧光染色观察细胞核染色等形态学变化; 透射电镜(transmission electron microscopy, TEM)观察细胞超微结构和死亡的具体形式; 流式细胞术(flow cytometry, FCM)定量分析细胞的凋亡和坏死比例; 黏附和侵袭试验观察胃癌细胞的黏附和侵袭能力.
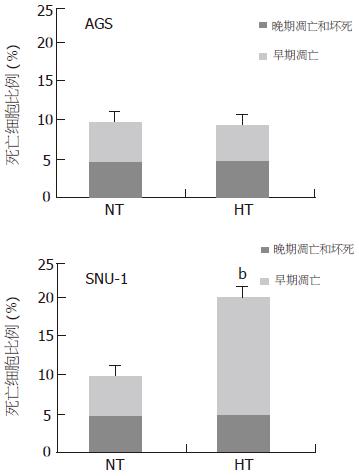
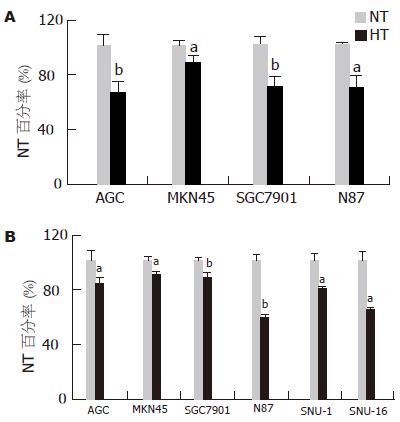
结果: MTT提示, 温热对SNU-1有显著的增殖抑制作用(P<0.01), 对SNU-16则无显著影响(P>0.05), 对4株贴壁细胞则表现为暂时性的增殖抑制(d1-d2, P<0.05); 光镜观察发现温热处理后SNU-1细胞出现死亡, 而其他细胞无; 荧光染色和透射电镜未发现AGS在温热处理后24 h有显著的形态学改变, 而SNU-1则出现凋亡和坏死; FCM提示温热处理不增加AGS的自然死亡率(t = 0.45, P = 0.678 8), 但能诱导SNU-1发生凋亡和坏死, 增加细胞死亡率(9.7%±1.1% vs 20.1%±2.5%, t = 6.54, P = 0.002 8); 黏附试验表明温热能不同程度降低4株贴壁细胞的黏附能力[AGS(t = 4.86, P = 0.008 3), MKN45(t = 4.50, P = 0.010 8), SGC7901(t = 6.83, P = 0.002 4), N87(t = 4.16, P = 0.014 1)]; 侵袭试验表明温热能不同程度降低6株细胞的侵袭能力[AGS(t = 2.94, P = 0.042 5), MKN45(t = 3.60, P = 0.022 7), SGC7901(t = 4.70, P = 0.009 3), N87(t = 12.41, P = 0.000 2), SNU-1(t = 3.63, P = 0.022 2), SNU-16(t = 4.13, P = 0.014 5)].
结论: 大多数的胃癌细胞株表现对短时间温热的耐受, 除了暂时性的增殖抑制作用外, 温热并无细胞杀伤作用, SNU-1是一个例外, 温热能导致SNU-1细胞的凋亡和坏死; 同时, 温热处理能降低细胞的黏附和侵袭能力.
引文著录: 汤睿, 朱正纲, 瞿颖, 李建芳, 纪玉宝, 刘炳亚, 燕敏, 林言箴. 温热体外对人胃癌细胞株生物学行为的影响. 世界华人消化杂志 2006; 14(2): 144-151
Revised: October 21, 2005
Accepted: October 31, 2005
Published online: January 18, 2006
AIM: To investigate the impact of hyperthermia (HT) on human gastric cell lines in vitro.
METHODS: Six human gastric cancer cell lines (AGS, MKN45, SGC7901, NCI-N87, SNU-1 and SNU-16) were used in this study. HT was achieved by incubating cells at 43 ℃ for 2 h, and cells incubated at 37 ℃ served as normothermia (NT) control. MTT assay was adopted to evaluate cell proliferation and cytotoxicity after HT. The preliminary morphological changes were observed by light microscopy (LM) and fluorescent microscopy (FM) while the ultrastructure changes and the specific cell death styles were determined by transmission electron microscopy (TEM). Flow cytometry (FCM) was used for further quantitatively analysis of the proportion of apoptosis and necrosis after an annexin V-FITC and PI double staining. Adhesion and invasion test in vitro was also adopted in this study to evaluate the impact of HT on cells' adhesive and invasive ability.
RESULTS: According to the data of MTT, HT inhibited proliferation of SNU-1 cells significantly (P < 0.05), while it had no marked proliferation inhibition effect on SNU-16 cells (P > 0.05). For the other four adherent cell lines, HT only inhibited cell proliferation temporarily (d1-d2, P < 0.05). LM found that HT had no cell-killing effect on most of gastric cancer cell lines except SNU-1. FM and TEM indicated there were no significant morphological changes of AGS cells at 24 h after HT treatment, while apoptosis and necrosis appeared in SNU-1 cells. FCM showed that HT therapy did not increase spontaneous mortality rate of AGS cell (t = 0.45, P = 0.678 8), but raised apoptotic and necrotic rate of SNU-1 (mortality rate from 9.71 ± 1.14% of NT to 20.05 ± 2.49% of HT, t = 6.54, P = 0.002 8). Adhesion test indicated that HT reduced adhesive ability of four adherent cell lines (AGS: t = 4.86, P = 0.008 3; MKN45: t = 4.50, P = 0.0108; SGC7901: t = 6.83, P = 0.0024; N87: t = 4.16, P = 0.0141). Invasion test also illustrated that HT decreased adhesive ability of all six cell lines (AGS: t = 2.94, P = 0.0425; MKN45: t = 3.60, P = 0.0227; SGC7901: t = 4.70, P = 0.0093; N87: t = 12.41, P = 0.0002; SNU-1: t = 3.63, P = 0.0222; SNU-16: t = 4.13, P = 0.0145).
CONCLUSION: Most of gastric cancer cell lines used in our study is thermotolerant to time-limited HT therapy. HT can temporarily inhibit cell proliferation while had no cell-killing effect on most of gastric cancer cell lines. SNU-1 is an exception, and HT can induce both apoptosis and necrosis. In addition, HT can reduce cancer cells' adhesiveness and invasiveness.
- Citation: Tang R, Zhu ZG, Qu Y, Li JF, Ji YB, Liu BY, Yan M, Lin YZ. Impact of hyperthermia on human gastric cancer cell lines in vitro. Shijie Huaren Xiaohua Zazhi 2006; 14(2): 144-151
- URL: https://www.wjgnet.com/1009-3079/full/v14/i2/144.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i2.144
热疗是最古老的肿瘤治疗方式之一, 现代医学也证实热疗对一些肿瘤具有治疗效果, 临床上也常作为一种辅助手段与放化疗等结合应用[1-4]. 在胃癌的治疗中, 腹腔内温热化疗对防治胃癌腹膜转移复发具有较好的疗效[5-8]. 与微波或高强度聚焦超声(high intensity focused ultrasound, HIFU)等[9]治疗实质性脏器肿瘤不同的是: 治疗胃癌这类空腔脏器肿瘤采用的非高热而是43℃左右的温热, 其可能机制要比高热直接杀伤肿瘤细胞复杂得多, 在胃癌方面, 有关的研究报道很少, 且与临床实际条件不一致[10-14]. 因此我们采用了临床有效且相对安全的43℃作为温热的条件, 在体外较为系统地观察了温热对胃癌细胞生物学行为的影响, 为临床应用提供理论基础.
人胃癌细胞株AGS(ATCC Number: CRL-1739), MKN45, SGC7901, NCI-N87(CRL- 5822), SNU-1(CRL-5971), SNU-16(CRL-5974)由瑞金医院上海消化外科研究所传代培养保存. 含100 mL/L胎牛血清的RPMI 1640培养液(Gibco), 37℃, 50 mL/L CO2饱和湿度条件下传代培养, 选用对数生长期细胞进行实验.
温热(HT)处理时温度为43℃, 常温(NT)为37℃, 温控由CO2细胞培养箱实现, 误差±0.1℃, 细胞均放置于50 mL/L CO2饱和湿度条件下, 温热处理时间为2 h.
1.2.1 细胞毒和增殖抑制试验(MTT法): 收集对数生长期的胃癌细胞均匀接种96孔板, 每孔细胞数量1-2×103, 体积200 mL, 37℃, 50 mL/L CO2培养24 h后进行温热处理, 非温热处理组作为常温对照, 同时设不加细胞的背景对照, 处理后继续常规培养. 到达时间设定点时每孔加入5 g/L MTT 20 mL, 37℃孵育4 h, 使MTT还原为甲臜; 离心弃上清, 每孔加入DMSO 150 mL; 水平摇床37℃振荡5 min, 紫色结晶充分溶解混匀后, 应用酶标仪(mQuant, Bio-Tek)于波长570 nm检测吸光度A值, 扣除背景对照的A570值即代表存活细胞数量. 分别测量处理后24, 48, 72, 96和120 h的A570值, 制作细胞生长曲线; 并比较HT与NT时的细胞毒和增殖抑制情况(将常温对照组的值固定为1, 温热组取其A值与常温对照组A值之比). 每个细胞每次实验的两组各设置5-6个复孔, 重复3-4次. 上述胃癌细胞还分别在处理后不同时间点于倒置显微镜(Olympus IX70)下观察细胞生长、活力和形态变化并拍照.
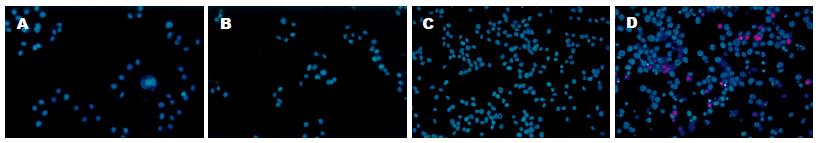
1.2.2 Hoechst: AGS和SNU-1, 处理后继续培养24 h, 收集细胞, 细胞悬液中加入Hoechst 33342(终浓度5 mg/L), 37℃孵育15 min; 离心弃上清并重悬细胞, 加入PI(终浓度1-2 mg/L), 4℃染色10 min; 离心弃上清, 调整细胞浓度至5×108/L; 取细胞悬液50 mL, 500 r/min离心5 min制成甩片; 10 g/L多聚甲醛固定, 4℃ 5 min; 蒸馏水冲洗后拭干; 荧光显微镜(Olympus U-SPT)紫外和绿光下读片并拍照, 观察细胞形态结构及胞核的变化, 整个过程避光. 结果评判标准: 正常细胞胞核为Hoechst(HO)蓝色µ染, 浓染或成颗粒状为阳性, 正常细胞PI拒染, 染色即为阳性. 因此, HO(-)/PI (-)为活细胞; HO(+)/PI (-)为凋亡细胞; PI(+)为坏死细胞.
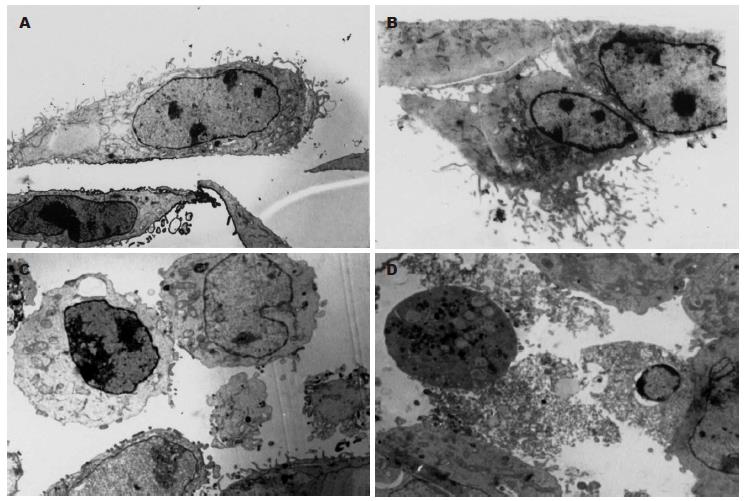
1.2.3 透射电镜观察细胞死亡形式: AGS和SNU-1, 约2.5×106接种于75 cm2培养瓶内, 24 h后温热处理, 处理后继续培养24 h, 收集细胞, 制备透射电镜样本, 步骤如下: 20 g/L戊二醛PBS固定液4℃前固定2 h; PBS缓冲液4℃漂洗二次, 每次10 min; 10 g/L锇酸PBS固定液4℃后固定2 h; 乙醇逐级脱水, 每次10 min, 700 mL/L乙醇(含30 g/L醋酸双氧铀)4℃块染, 乙醇逐级脱水, 每次10 min; 环氧丙烷置换2次, 每次10 min; 618包埋液与环氧丙烷1:1 2 h, 618包埋液与环氧丙烷2:1过夜, 纯618包埋液37℃浸透6 h; 60℃烘箱内包埋48 h; LVB Ⅴ型超薄切片机切片; 枸橼酸铅电子染色; 样本制备完成后, HITACHI H-500或PHILIP CM-120透射电镜观察并摄片.
1.2.4 流式细胞术定量分析细胞凋亡和坏死比例: AGS和SNU-1, 六孔板中每孔约4-6×104铺板, 铺板24 h后处理, 处理后继续培养24 h检测收集细胞, 采用Annexin V-FITC Apoptosis Kit(BD), 染色步骤, 详见操作手册, 染色后送流式(FACSCalibur, BD)检测分析. 结果判断标准: 双变量流式细胞仪所测得的散点图中, 左下象限为活细胞, 表现为Annexin-/PI-; 右下象限为早期凋亡细胞, 表现为Annexin+/PI-; 右上象限为晚期凋亡和坏死细胞, 表现为Annexin+/PI+; 左上象限为死亡细胞, 表现为Annexin-/PI+. 以上温热或常温处理均为3复孔, 最后结果为3复孔的均值.
1.2.5 黏附和侵袭试验: 黏附试验采用Chemicon公司黏附试验试剂盒(CytoMatrixTM cell adhesion strips, ECM 105), 评价细胞对细胞外基质主要成分Ⅳ胶原的黏附能力, 具体步骤详见操作手册. 侵袭试验采用Chemicon公司侵袭试验试剂盒(QCMTM cell invasion assay, ECM 555), 试剂盒依据Boyden小室原理, 上室底部有8mm孔径膜, 膜上覆盖有细胞外基质, 通过荧光染色检测穿过细胞外基质和8 mm孔到达膜背面的细胞数量, 评价细胞的侵袭能力, 具体步骤详见操作手册.
统计学处理 计量数据采用mean±SD表示, 温热与对照两组间的比较采用t检验, 统计分析由SAS统计软件包(v6.12)完成, P<0.05认为差异具有统计学意义.
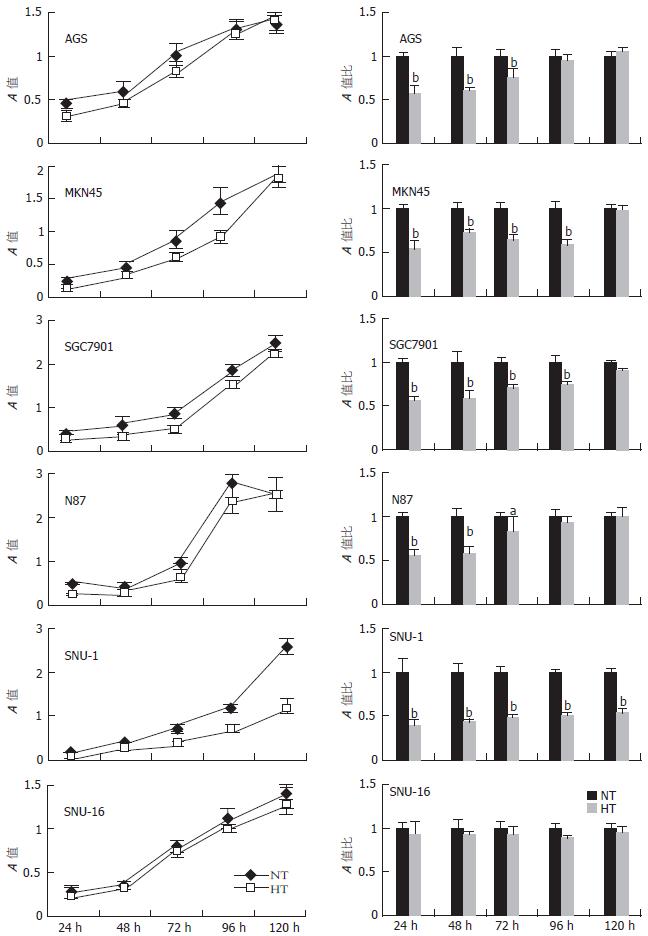
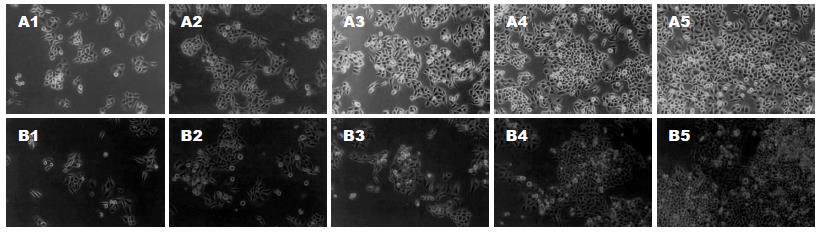
SNU-1对温热处理最为敏感, 温热组与对照组A值的比值始终在50%以下; SNU-16耐热, 两组的生长曲线基本重合, 温热组与常温对照组A值的比值始终在90%以上; 对其他细胞的增殖则存在一定影响, 但其增殖抑制作用有一定时限, 随时间延长而消失, 至温热处理后120 h, 温热组的A值都接近甚至超过常温对照组(图1). 光镜可见AGS细胞, 温热处理后24-96 h细胞呈现一定程度的增殖抑制, 细胞密度低于常温对照组, 至120 h细胞密度与对照组的差别已缩小, 除温热处理后24 h内有少量的细胞变圆、脱壁以外, 形态与常温对照组无明显不同(图2), 其余3株贴壁细胞的情况与AGS类似; 悬浮细胞SNU-16温热处理后无明显外观形态变化, 而SNU-1较为特殊, 温热处理后24 h即可见到细胞死亡现象(图3). 荧光染色与透射电镜均未见温热对AGS有显著形态学影响, 也无明显的细胞死亡; 对于SNU-1, 温热处理能引起细胞死亡, 死亡形式包括凋亡和坏死(图4, 图5). 流式分析提示: 单纯温热并不增加AGS细胞的死亡率(10.4%±1.0% vs 10.0%±1.2%, t = 0.45, P = 0.678 8), 但可增加SNU-1细胞的死亡率(9.7%±1.1% vs 20.1%±2.5%, t = 6.54, P = 0.002 8), 凋亡和坏死各占一定比例(图6).
4株贴壁细胞温热处理后黏附能力均呈现不同程度的降低(图7A), 与常温对照比较, 分别为AGS(100%±9.0% vs 69.3%±10.0%, t = 4.86, P = 0.008 3), MKN45(100%±2.9% vs 90.0%±2.5%, t = 4.50, P = 0.010 8), SGC7901(100%±4.8% vs 65.6%±7.3%, t = 6.83, P = 0.002 4), N87(100%±0.8% vs 78.8%±10.4%, t = 4.16, P = 0.014 1). 所有6株细胞温热处理后侵袭能力均呈现不同程度的降低(图7B), 与常温对照比较, 分别为AGS(100%±7.1% vs 85.2%±5.1%, t = 2.94, P = 0.042 5), MKN45(100%±2.6% vs 91.6%±3.1%, t = 3.60, P = 0.022 7), SGC7901(100%±1.1% vs 87.9%±4.3%, t = 4.70, P = 0.009 3), N87(100%±4.8% vs 59.9%±3.0%, t = 12.41, P = 0.000 2), SNU-1(100%±9.1% vs 80.3%±2.4%, t = 3.63, P = 0.022 2), SNU-16(100%±10.0% vs 74.9%±1.7%, t = 4.13, P = 0.014 5).
一些肿瘤的体外研究发现, 较短时间的温热处理即能杀伤肿瘤细胞[15-21]. 对于胃癌, Buell et al[10]报道持续2 h的42.5℃-43.5℃温热处理能够杀伤SNU-5细胞; 而Shchepotin et al[11]则报道连续4 d, 每天持续1 h的42℃温热处理不能够杀伤AGS细胞且对细胞增殖无明显影响; Goto et al[12]应用46℃对MKN28、MKN74和KATO-Ⅲ三株胃癌细胞进行15, 30或60 min的热处理, 结果发现60 min热处理导致细胞坏死而15或30 min的热处理主要诱导细胞凋亡, 各株细胞的凋亡率略有差异; 在国内, 杨耀琴 et al[13]未发现100 min 42℃的温热处理能杀伤BGC-823细胞, 陈卫星 et al[14]则报道43℃ 30 min的热处理即能诱导MKN28细胞发生凋亡. 可以看出, 以上研究结果并不一致, 可能与应用的细胞株以及温热处理与临床条件不同有关. 因此我们共选择了6株国内外较为常用的细胞, 包括了不同分化程度、不同病灶来源和不同生长方式的胃癌细胞株, 以期从整体上了解温热对胃癌细胞的影响. 同时模拟了临床腹腔内温热化疗的作用温度和时间, 43℃ 2 h, 并在温热处理后作了较长时间的动态观察. 出乎意料的是, 在我们的实验条件下, 温热除对SNU-1一株细胞能够产生直接杀伤作用之外, 对其他5株细胞无杀伤作用, 其中对SNU-16基本无影响, 对贴壁细胞只产生了短暂的增殖抑制效应, 说明温热直接杀伤胃癌细胞并非普遍现象, 胃癌细胞似乎相对耐热, 这也提示我们在临床的实际应用中仅用温热处理是不够的, 还是应结合放化疗等其他措施联合治疗. 目前还不了解胃癌细胞与其他肿瘤细胞热敏感差异的具体机制, 可能与不同类型细胞对热的反应和敏感性不同有关. 从近年来的理论进展来看, 温热处理后引起的细胞内部基因和蛋白质的变化也比我们以前认识的要复杂得多. 温热作为一种应激原, 一方面使许多功能基因关闭, 另一方面也诱导一些应激相关基因的开放保护细胞, 如HSP[2,22], 细胞是否死亡取决于细胞类型和抗凋亡基因的表达情况[2,22-24].
以往报道温热杀伤肿瘤细胞的形式包括坏死和凋亡两种, 早期认为温热杀伤肿瘤细胞是引起细胞的坏死, 随着凋亡现象的发现和深入研究, 目前更多学者认为温热杀伤肿瘤细胞的机制主要是诱导凋亡[24]. 比如以往认为温热处理可导致细胞膜的流动性和通透性发生改变, 引起细胞膜起泡等现象, 现认为此改变并非代表温热引起的原发损害, 而是细胞凋亡的典型特征, 胞膜损伤可能是细胞凋亡的继发改变[25]. 当然, 由于研究的细胞类型不同, 进行温热处理的温度和持续时间不同, 不同学者报道的结果也有差异. 尽管如此, 凋亡与坏死在许多病理状态下的界限并不清楚, 也不易完全区分, 能诱导细胞凋亡的大多数刺激如强度或时间延长也能导致细胞死亡[26]. 从我们的实验结果来看, 43℃ 2 h的温热处理可引起SNU-1肿瘤细胞的坏死和凋亡, 且两种形式均占了一定的比例, 不能完全辨别哪个是主要形式.
腹膜转移是胃癌术后复发的最常见原因. 腹膜转移由腹腔内游离癌细胞着床于腹膜后增殖发展而来, 而手术的挤压以及由切断的血管和淋巴管溢出的癌细胞也是产生游离癌细胞的重要原因之一. 根据腹膜转移的"种子-土壤"学说, 手术创伤使腹膜间皮下组织裸露, 形成所谓的"土壤", 同时残留的血凝块和创伤修复过程中大量纤维素渗出也有利于保护肿瘤细胞[27], 是否着床则最终取决于"种子"的能力--即肿瘤细胞的黏附和侵袭能力, 因此胃癌细胞的黏附和侵袭能力是腹膜转移发生的重要原因之一. 我们的实验证实, 多数情况下, 持续2 h的43℃温热不足以杀伤肿瘤细胞, 但通过光镜观察也发现温热作用后有细胞变圆, 伪足减少等变化, 存在影响肿瘤细胞黏附、侵袭能力的可能, 所以我们也对此进行了检测, 结果发现温热处理能够显著降低各株胃癌细胞的黏附和侵袭能力. 既往的有关研究也表明, 温热能使贴壁肿瘤细胞表面的整合素等黏附分子表达降低[28], 抑制黏着斑激酶(focal adhesion kinase, FAK)的活性, 从而导致黏着斑成分的脱磷酸化和解离、细胞骨架肌动蛋白和微管的解聚, 影响肿瘤细胞的黏附能力和MAKP信号转导通路; 温热能降低uPA表达, 减弱蛋白水解从而抑制肿瘤细胞的浸润和转移[29]; 也能抑制有关MMP的活性, 增加TIMP的释放, 降低侵袭能力[30]. 因此胃癌细胞黏附和侵袭能力的降低可能使腹腔内游离癌细胞不能着床, 有利于自身的免疫系统和化疗药物杀伤癌细胞, 从而减少由于手术因素导致的术后腹膜复发.
总之, 单纯温热并不足以防治胃癌腹膜转移的发生, 应与其他手段联合治疗; 但温热能够降低细胞的黏附和侵袭能力, 有利于预防手术导致腹膜转移的发生.
热疗是一古老的肿瘤治法, 近年一些肿瘤的体外研究发现, 短时温热能杀伤肿瘤细胞, 目前的研究热点集中在温热作用机制及与其他手段的联合应用上(可阅文献3, 15, 17等).
胃癌的现代治疗中, 腹腔内温热化疗对防治胃癌腹膜转移具良好疗效, 但基础研究很少, 且与临床条件不一致. 本研究模拟了临床温热的条件, 在体外较系统地观察了温热对胃癌细胞生物学行为的影响, 发现大多数胃癌细胞株能够耐受43℃2h的短时温热, 但其黏附和侵袭能力有所降低, 提示了临床应用的可能机制, 也说明了治疗胃癌温热仍需与其他手段联合使用.
温热(Hyperther-mia): 热疗在临床实践中可通过各种方法实现局部或全身升温, 通常将温度42℃-45℃的热处理称为温热, 临床上多与放化疗等其他手段联合应用.
本文通过系统的实验研究对温热对人胃癌细胞株的作用进行比较全面细致的观察, 选题具有重要的理论和实际意义.研究设计合理, 方法严密, 手段较先进, 全文结构规范, 体现出较高的学术水平.
编辑: 潘伯荣 审读: 张海宁 电编: 张敏
| 1. | 赵 世俊, 郭 启勇. 肿瘤热疗研究进展. 国外医学·临床放射学分册. 2004;27:252-255. |
| 2. | Hildebrandt B, Wust P, Ahlers O, Dieing A, Sreeni-vasa G, Kerner T, Felix R, Riess H. The cellular and molecular basis of hyperthermia. Crit Rev Oncol Hematol. 2002;43:33-56. [PubMed] |
| 3. | Falk MH, Issels RD. Hyperthermia in oncology. Int J Hyperthermia. 2001;17:1-18. [PubMed] |
| 4. | Wust P, Hildebrandt B, Sreenivasa G, Rau B, Geller-mann J, Riess H, Felix R, Schlag PM. Hyperther-mia in combined treatment of cancer. Lancet Oncol. 2002;3:487-497. [PubMed] |
| 5. | Yonemura Y, de Aretxabala X, Fujimura T, Fushida S, Katayama K, Bandou E, Sugiyama K, Kawamura T, Kinoshita K, Endou Y. Intraoperative chemohyperthermic peritoneal perfusion as an adju-vant to gastric cancer: final results of a randomized controlled study. Hepatogastroenterology. 2001;48:1776-1782. [PubMed] |
| 6. | Fujimoto S, Takahashi M, Mutou T, Kobayashi K, Toyosawa T. Successful intraperitoneal hyperthermic chemoperfusion for the prevention of postoperative peritoneal recurrence in patients with advanced gastric carcinoma. Cancer. 1999;85:529-534. [PubMed] |
| 7. | Kuhn JA, McLoughlin JM, Harris DC, Talaasen LJ, Sutton SW, McCarty TM. Intraperitoneal hyper-thermic chemotherapy: experience at Baylor Uni-versity Medical Center. Proc. 2002;15:359-362. [PubMed] |
| 8. | Hirose K, Katayama K, Iida A, Yamaguchi A, Naka-gawara G, Umeda S, Kusaka Y. Efficacy of continu-ous hyperthermic peritoneal perfusion for the pro-phylaxis and treatment of peritoneal metastasis of advanced gastric cancer: evaluation by multivariate regression analysis. Oncology. 1999;57:106-114. [PubMed] |
| 9. | Kennedy JE, Ter Haar GR, Cranston D. High inten-sity focused ultrasound: surgery of the future? Br J Radiol. 2003;76:590-599. [PubMed] |
| 10. | Buell JF, Reed E, Lee KB, Parker RJ, Venzon DJ, Amikura K, Arnold S, Fraker DL, Alexander HR. Synergistic effect and possible mechanisms of tumor necrosis factor and cisplatin cytotoxicity under moderate hyperthermia against gastric cancer cells. Ann Surg Oncol. 1997;4:141-148. [PubMed] |
| 11. | Shchepotin IB, Shabahang M, Nauta RJ, Buras RR, Brenner RV, Evans SR. Antitumour activity of 5-fluorouracil, verapamil and hyperthermia against human gastric adenocarcinoma cell (AGS) in vitro. Surg Oncol. 1994;3:287-294. [PubMed] |
| 12. | Goto A, Shomori K, Ohkumo T, Tanaka F, Sato K, Ito H. Hyperthermia-induced apoptosis occurs both in a p53 gene-dependent and -independent manner in three human gastric carcinoma cell lines. Oncol Rep. 1999;6:335-339. [PubMed] |
| 13. | 杨 耀琴, 陈 斌, 陶 惠红, 杨 虎川. 吐温80合并温热诱导 BGC-823胃癌细胞凋亡及对Hsp70, Bcl-2和Bax表达的影响. 中国组织化学与细胞化学杂志. 2002;11:306-309. |
| 15. | Choi EK, Park SR, Lee JH, Chung HS, Ahn HE, Rhee YH, Lim BU, Park HJ. Induction of apoptosis by carboplatin and hyperthermia alone or combined in WERI human retinoblastoma cells. Int J Hyperthermia. 2003;19:431-443. [PubMed] |
| 16. | Wan SL, Zhang J, Yang DS, Fan SW. Cytotoxic effect of thermo-chemotherapy with cisplatin on osteos-arcoma OS-732 cell line. Zhejiang Daxue Xuebao Yixueban. 2003;32:427-432. [PubMed] |
| 17. | Rong Y, Mack P. Apoptosis induced by hyperther-mia in Dunn osteosarcoma cell line in vitro. Int J Hyperthermia. 2000;16:19-27. [PubMed] |
| 18. | Fuse T, Yoon KW, Kato T, Yamada K. Heat-induced apoptosis in human glioblastoma cell line A172. Neurosurgery. 1998;42:843-849. [PubMed] |
| 19. | Journee-de Korver HG, Midena E, Singh AD. Infrared thermotherapy: from laboratory to clinic. Ophthalmol Clin North Am. 2005;18:99-110. [PubMed] |
| 20. | Han JS, Storck CW, Wachsberger PR, Leeper DB, Berd D, Wahl ML, Coss RA. Acute extracellular acidification increases nuclear associated protein levels in human melanoma cells during 42 degrees C hyperthermia and enhances cell killing. Int J Hyperthermia. 2002;18:404-415. [PubMed] |
| 21. | 张 炼, 刘 仁刚, 周 洁萍, 余 达经, 刘 云华. 加热诱导肝癌细胞系HepA凋亡的研究. 华中科技大学学报(医学版). 2002;31:621-625. |
| 22. | Sreedhar AS, Csermely P. Heat shock proteins in the regulation of apoptosis: new strategies in tumor therapy: a comprehensive review. Pharmacol Ther. 2004;101:227-257. [PubMed] |
| 23. | Falcieri E, Luchetti F, Burattini S, Canonico B, Santi S, Papa S. Lineage-related sensitivity to apoptosis in human tumor cells undergoing hyperthermia. Histochem Cell Biol. 2000;113:135-144. [PubMed] |
| 24. | Honma T. Characteristics of hyperthermia-induced apoptotic cell death. Nippon Rinsho. 1996;54:1949-1954. [PubMed] |
| 25. | Tomasovic SP, Vasey TA, Story MD, Stephens LC, Klostergaard J. Cytotoxic manifestations of the interaction between hyperthermia and TNF: DNA fragmentation. Int J Hyperthermia. 1994;10:247-262. [PubMed] |
| 27. | 丁 友成, 朱 正纲. 胃肠道肿瘤腹膜转移的基础与临床. 胃肠道肿瘤外科综合治疗新技术. 2002;317-335. |
| 28. | Luchetti F, Mannello F, Canonico B, Battistelli M, Burattini S, Falcieri E, Papa S. Integrin and cytoskeleton behaviour in human neuroblastoma cells during hyperthermia-related apoptosis. Apoptosis. 2004;9:635-648. [PubMed] |
| 29. | Liang X, Xiao G, Mao Z. The effect of heat shock on the expression of urokinase-type plasminogen activator in human tongue squamous cell carcinoma cell line (Tca8113). Huaxi Kouqiang Yixue Zazhi. 2003;21:150-152. [PubMed] |
| 30. | Sawaji Y, Sato T, Takeuchi A, Hirata M, Ito A. Anti-angiogenic action of hyperthermia by suppressing gene expression and production of tumour-derived vascular endothelial growth factor in vivo and in vitro. Br J Cancer. 2002;86:1597-1603. [PubMed] |