修回日期: 2006-05-02
接受日期: 2006-05-17
在线出版日期: 2006-07-08
目的: 研究亚砷酸(As2O3)对人食管癌EC109细胞株细胞周期蛋白依赖性激酶抑制因子p15INK4B (p15)基因表达的影响.
方法: 终浓度2 μmol/L的As2O3加入食管癌EC109细胞系, 采用甲基化特异PCR (MSP)检测食管癌EC109细胞系中p15基因甲基化, 采用RT-PCR和Western blot方法检测As2O3处理前后p15的mRNA和蛋白质水平的表达情况. 用Scion Image软件测量条带灰度值, P15蛋白与ACTB条带的灰度比进行半定量分析.
结果: EC109细胞p15基因发生高甲基化, p15基因不表达. As2O3作用后p15基因甲基化程度明显下降, As2O3作用72, 48, 24 h组和未加药组之间差异均有统计学意义(37.11±3.62, 50.92±5.47, 72.07±7.53 vs 97.23±9.80, P<0.05). As2O3作用24 h后出现p15 mRNA表达, 随As2O3作用时间延长p15 mRNA表达逐渐增强, 各个时间组之间比较, 除了未加药组和加药24 h组之间及加药24 h组和加药48 h组之间差异无统计学意义外, 其余各个时间组之间差异有统计学意义(0.72±0.07 vs 0.58±0.06 vs 0.48±0.07 vs 0.41±0.08, P<0.05). As2O3作用24 h后P15蛋白出现表达, 2 μmol/L作用24-72 h中P15蛋白条带灰度逐渐增强, As2O3作用72, 48, 24 h组和未加药组之间差异均有统计学意义(0.51±0.02 vs 0.21±0.01 vs 0.16±0.02 vs 0.06±0.01, P<0.05), 说明其表达随As2O3作用时间延长而逐渐增强.
结论: As2O3可使食管癌EC109细胞p15基因去甲基化, 使p15基因表达上调, 从而抑制细胞周期进程.
引文著录: 张学彦, 刘铁夫, 刘伟, 崔希威. 亚砷酸诱导人食管癌细胞株EC109细胞p15INK4B基因的表达. 世界华人消化杂志 2006; 14(19): 1859-1863
Revised: May 2, 2006
Accepted: May 17, 2006
Published online: July 8, 2006
AIM: To investigate the effects of arsenic trioxide (As2O3) on the expression of cyclin dependent kinase inhibitor p15INK4B (p15) gene in esophageal cancer cell line EC109.
METHODS: As2O3 was added to EC109 cells for succedent experiments (final concentration 2 μmol/L). Methylation of p15 gene in EC109 cells was detected by polymerase chain reaction (PCR) using a methylation specific primer (MSP), and the expression of p15 gene was detected by reverse transcription PCR (RT-PCR) and Western blot at the mRNA and protein level.
RESULTS: p15 gene failed to express in EC109 cells due to hypermethylation. As2O3 (2 μmol/L) significantly down-regulate the methylation of p15 gene at DNA level, and the difference between As2O3 action 72, 48, 24 h and no drug groups had statistical significance (37.11 ± 3.62 vs 50.92 ± 5.47 vs 72.07 ± 7.53 vs 97.23 ± 9.80, P < 0.05). After As2O3 action 24 h, p15 mRNA expression appeared. Along with the continuance of As2O3 action, the p15 mRNA expression became stronger. Except between no drug group and As2O3 action 24 h group as well as between As2O3 action 24 and 48 h group, the difference between all groups had statistical significance (0.72 ± 0.07, 0.58 ± 0.06, 0.48 ± 0.07 vs 0.41 ± 0.08, P < 0.05). After As2O3 action 24 h, the expression of p15 protein appeared. Along with the continuance of As2O3 action, the p15 protein expression became stronger. The differences between all the groups were significant (0.51 ± 0.02 vs 0.21 ± 0.01 vs 0.16 ± 0.02 vs 0.06 ± 0.01, P < 0.05).
CONCLUSION: As2O3 can activate the expression of the p15 gene by demethylation and inhibit the cell cycle progress of esophageal cancer cell line.
- Citation: Zhang XY, Liu TF, Liu W, Cui XW. Expression of p15INK4B gene induced by arsenic trioxide in esophageal cancer cell line EC109. Shijie Huaren Xiaohua Zazhi 2006; 14(19): 1859-1863
- URL: https://www.wjgnet.com/1009-3079/full/v14/i19/1859.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i19.1859
亚砷酸(As2O3)用于治疗白血病获得成功以来, 人们将As2O3用于实体肿瘤, 并取得显著疗效[1-7], 但全面认识其抗肿瘤作用机制尚待深入研究. 我们以人食管癌EC109细胞株作为研究对象, 在发现其细胞周期负性调控因子p15INK4B(简称p15)失活由高甲基化引起后, 采用As2O3对EC109细胞进行处理, 进一步研究As2O3对p15表达的影响, 以期从分子水平探讨As2O3对人实体瘤的作用机制.
EC109细胞株购自中科院上海细胞所. 1 g/L的亚砷酸溶液由哈尔滨伊达公司生产, 用生理盐水配成1 mmol/L的贮存液, 使用前用完全培养基稀释至所需浓度. Trizol试剂盒是Gibco公司产品, Taq酶为上海生工公司产品, 逆转录试剂盒是Promega公司产品, DNA Marker DL2000为宝生物公司产品. 预染蛋白标准是纽英伦公司产品. p15小鼠抗人单克隆IgG是Neo Markers公司产品, β-actin (ACTB)抗体和Western blotting发光试剂是Santa Cruz公司产品, 辣根酶标记山羊抗小鼠IgG为北京中杉公司产品. 引物由上海生工公司合成(表1).
| 引物 | 引物序列 | 产物长度 (bp) | 退火温度 ( ℃) | |
| p15甲基化引物 (p15M) | sense | 5'-GCGTTCGTATTTTGCGGTT-3' | 148 | 60 |
| antisense | 5'-CGTACAATAACCGAACGACCGA-3' | |||
| p15非甲基化引物 (p15U) | sense | 5'-TGTGATGTGTTTGTATTTTGTGGTT-3' | 154 | 60 |
| antisense | 5'-CCATACAATAACCAAACAACCAA-3' | |||
| p15外显子1引物 | sense | 5'-CCAGAAGCAATCCAGGCGCG-3' | 532 | 59 |
| antisense | 5'-AATGCACACCTCGCCAACG-3' | |||
| p15外显子2引物 | sense | 5'-CCTTAAATGGCTCCACCTGC-3' | 434 | 58 |
| antisense | 5'-CGTTGGCAGCCTTCATCG-3' | |||
| p15RT-PCR引物 | sense | 5'-CCAGAAGCAATCCAGGCGCG-3' | 753 | 58 |
| antisense | 5'-CGTTGGCAGCCTTCATCG-3' | |||
| β-actin引物 | sense | 5'-TCCTCCTGAGCGCAAGTAC-3' | 301 | 57 |
| antisense | 5'-GTCACCTTCACCGTTCCAG-3' | |||
人食管癌EC109细胞株在37 ℃, 50 mL/L CO2饱和湿度条件下, 用含100 mL/L胎牛血清的DMEM高糖培养基培养. 取对数生长期细胞, 加入亚砷酸, 终浓度为2 μmol/L, 培养3 d, 以不加药的同期培养的细胞作为阴性对照, 常规酚/氯仿法提取细胞基因组DNA.
1.2.1 PCR检测p15外显子有无缺失:p15共有2个外显子, 以基因组DNA为模板分别用其引物进行PCR扩增. PCR总体系25 μL, 含引物各0.4 μmol/L, dNTP各0.5 mmol/L, Taq DNA合成酶2 U, Mg2+ 2.5 mmol/L, 1×PCR缓冲液, 基因组DNA 100 ng. PCR反应条件: 95 ℃预变性2 min, 95 ℃变性30 s, 退火1 min, 70 ℃延伸1 min, 共35个循环, 70 ℃延伸10 min, 反应产物15 g/L琼脂糖凝胶电泳.
1.2.2 甲基化PCR (MSP): 参考Herman et al[8]的实验方法并加以改进. 取DNA 10 μg溶于40 μL去离子水中, 加入1 mol/L NaOH 10 μL, 37 ℃水浴10 min, 加入新鲜配制的10 mmol/L氢醌30 μL和3 mol/L NaHSO3 520 μL, 液体石蜡覆盖, 55 ℃反应16 h后, 用Wizard DNA Clean up System除盐, 洗脱在100 μL去离子水中, 加入1 mol/L NaOH 50 μL, 室温放置5 min, 无水乙醇沉淀, 750 mL/L的乙醇洗涤, DNA溶于20 μL去离子水中, -20 ℃保存. PCR反应条件为: 95 ℃预变性5 min, 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 共40个循环, 72 ℃延伸10 min, 反应产物行20 g/L琼脂糖凝胶电泳.
1.2.3 RNA抽提和RT-PCR: RNA抽提用Trizol试剂盒提取细胞总RNA后测定其浓度和纯度, RT反应. 逆转录cDNA第1链合成: 反应体系20 μL,含随机引物0.5 μg, 逆转录酶200 U, RNA 1.0 μg, dNTP 0.5 mmol/L, Rnasin 20 U, 37 ℃反应60 min, 95 ℃灭活逆转录酶5 min. PCR反应: 反应体系25 μL, 含Mg2+ 2.5 mmol/L, dNTP 0.5 mmol/L, cDNA 2 μL, 上下游引物各0.4 μmol/L, Taq DNA合成酶2 U, 反应35个循环, 产物经12 g/L琼脂糖凝胶电泳, 以表达p15的Hela细胞为阳性对照, 以目的基因与β-actin的灰度比进行半定量分析.
1.2.4 Western blot: 提取As2O3细胞处理前后的蛋白, 用Bradford法定量. 50 g/L积层胶, 120 g/L SDS-聚丙烯酰胺凝胶电泳, 转膜, 进行一抗、二抗孵育和显色, 并照相. 以表达P15蛋白的Hela细胞为阳性对照, 以目的蛋白与ACTB的灰度比进行半定量分析.
统计学处理 应用SPSS 11.0统计软件, 采用单因素方差分析, 多个均数之间两两比较q检验.
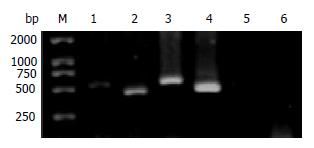
p15基因共有2个外显子, 分别为外显子1和外显子2, 经PCR检测EC109细胞中p15的2个外显子均无缺失, 和阳性对照正常人白细胞基因组DNA均可扩增出目的条带(图1). RT-PCR发现EC109细胞p15基因mRNA无表达, 而阳性对照Hela细胞有p15 mRNA表达(图2). 由此推断EC109细胞p15基因不表达可能因为启动子区发生高甲基化, 于是进行甲基化检测.
甲基化特异PCR (MSP)检测发现(图3), EC109细胞p15基因为高甲基化状态, 呈MSP阳性(p15M阳性, p15U阴性), 对照Hela细胞MSP阴性(p15M阴性, p15U阳性). 2 μmol/L As2O3作用的24-72 h内, 随作用时间延长, 条带灰度减弱, 说明甲基化程度逐渐降低, 至72 h已检测不出甲基化. 以As2O3作用72, 48, 24 h组和未加药组之间差异均有统计学意义(37.11±3.62 vs 50.92±5.47 vs 72.07±7.53 vs 97.23±9.80, P<0.05). 2 μmol/L As2O3作用EC109细胞24 h后, 非甲基化引物可以扩增出目的条带, 随时间延长, 条带灰度增强. 以As2O3作用72, 48, 24 h组和未加药组之间差异均有统计学意义(117.97±18.15 vs 87.93±8.50 vs 53.68±4.50 vs 31.55±2.96, P<0.05).
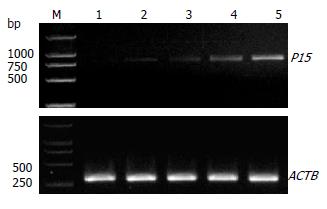
RT-PCR检测发现EC109细胞p15基因mRNA无表达, 2 μmol/L As2O3作用24 h后可见p15基因目的条带, 说明p15基因mRNA出现表达, As2O3作用24-72 h中p15基因目的条带灰度逐渐增强, 说明p15基因mRNA表达随As2O3作用时间延长而逐渐增强(图2), 用Scion Image软件测量条带灰度值, 以目的基因与b-actin条带的灰度比进行半定量分析, 各个时间组之间比较显示, 除了未加药组和加药24 h组之间及加药24 h组和加药48 h组之间差异无统计学意义外, 其余各个时间组之间差异有统计学意义(0.72±0.07 vs 0.58±0.06 vs 0.48±0.07 vs 0.41±0.08, P<0.05).
经Western blot检测证实, EC109细胞无P15蛋白表达, 2 μmol/L As2O3作用24 h后出现P15蛋白目的条带, 说明P15蛋白出现表达, 作用24-72 h中P15蛋白条带灰度逐渐增强, 说明其表达随As2O3作用时间延长而逐渐增强(图4), 用Scion Image软件测量条带灰度值, 以P15蛋白与ACTB条带的灰度比进行半定量分析, As2O3作用72, 48, 24 h组和未加药组之间差异均有统计学意义(0.51±0.02 vs 0.21±0.01 vs 0.16±0.02 vs 0.06±0.01, P<0.05).
食管癌在我国占恶性肿瘤发病的第4位[9-10], 预后较差. As2O3是一种有广阔应用前景的抗癌中药, 探寻其对食管癌的抑制效应具有重要意义, 并有助于揭示As2O3对实体瘤的作用机制. 随着对肿瘤发病机制的研究, 人们认识到, 肿瘤是一类细胞周期异常性疾病[11]. 细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitors, CKI)作用丧失, 可使G1/S调控点出现异常, 导致肿瘤发生和发展. p15是近年来发现的一类CKI分子, 被认为是除了p53, Rb等之外的重要抑癌基因[12], 能特异地与cylinD/CDK4或cylinD/CDK6结合并阻抑他们的活性, 控制细胞G1/S期的转移, 负调空细胞周期. DNA甲基化是肿瘤发生的重要机制, 抑癌基因失活与其启动子区CpG岛高甲基化状态直接相关[13-14]. 多种肿瘤细胞中都有p15基因启动子区CpG岛异常高甲基化[15-22]. p15基因启动子区CpG岛高甲基化是导致该基因失活的重要方式. 食管鳞癌中p15基因高甲基化发生率约为12.5%[23]. 我们发现, 食管癌EC109细胞p15高甲基化, 故以之为模型, 研究As2O3对实体瘤p15基因去甲基化和诱导其表达的作用.
MSP检测时, 我们在亚硫酸氢盐处理DNA前将基因组DNA进行定量, PCR反应体系加入相同量的纯化DNA, 以达到实验结果的可比性. 结果发现EC109细胞存在p15基因高甲基化, 经2 μmol/L的As2O3作用24 h后该细胞甲基化程度明显降低, 至72 h后甲基化基本消失, 已检测不出. 临床上以10 mg/d的As2O3治疗肿瘤的血药浓度峰值约是5 μmol/L, 2 μmol/L的体外实验剂量是根据临床用药量推算而来. 童迎凯 et al[12]发现, p15基因的表达可引起c-myc表达降低而产生细胞周期抑制. 邓友平 et al[24]发现, 2 μmol/L As2O3作用2 d可使EC109细胞出现凋亡特征, 并伴随c-myc表达的降调节, 这与本研究相吻合, As2O3治疗剂量使p15基因去甲基化, 并在mRNA和蛋白质水平上调p15基因的表达, 抑制细胞周期进程并引起c-myc表达降低. 佟红艳 et al[25]和金哈斯 et al[26]报道, 使用As2O3可诱导非实体瘤骨髓增生异常综合征细胞株MUTZ1细胞和急性淋巴细胞白血病细胞株Molt4细胞p15基因去甲基化, 使此二细胞株p15 mRNA表达. 我们首次证实, As2O3对实体瘤EC109细胞p15 DNA有去甲基化作用, 在mRNA水平诱导p15表达, 并首次证实在蛋白质水平亦诱导p15表达, 从而揭示了As2O3对实体瘤的一个分子水平的药理作用.
甲基化是由DNMTs催化完成的, 迄今发现有3种与DNA甲基化相关的酶, 分别是DNMT1, DNMT3a和DNMT3b. As2O3干扰DNMT的催化反应. As2O3以S-腺苷蛋氨酸为甲基供体[27], 消耗S-腺苷蛋氨酸, 产生一甲基砷酸和二甲基砷酸, 而DNMT催化甲基化过程也以S-腺苷蛋氨酸为甲基供体[28], DNA甲基化的可逆性特征为临床抗肿瘤治疗提供一种新途径. As2O3可能导致DNMT催化甲基化过程中甲基供体的相对或绝对不足. 砷是巯基酶抑制剂, DNMT3a和DNMT3b羧基端催化域都含有丰富的半胱氨酸巯基[29], As2O3可能直接抑制DNMT3a和DNMT3b的活性. As2O3代谢产生的S-腺苷同型半胱氨酸是DNMT的抑制物[30], 因而, As2O3使因高甲基化而不能表达的p15去甲基化而表达. 佟红艳 et al[25]发现, 骨髓增生异常综合征细胞株MUTZ1细胞3种甲基转移酶的表达均明显增高, As2O3能在mRNA水平下调DNMT3a和DNMT3b的表达并呈剂量依赖性, 推测As2O3在实体瘤食管癌中可能有类似作用.
总之, As2O3对EC109细胞抑癌基因p15的去甲基化作用为我们提供了用去甲基化药物治疗实体肿瘤的一种新思路, 并提示As2O3用于实体瘤的治疗的药理作用机制之一, 是对p15的去甲基化效应所引起的细胞周期阻滞.
我国是世界上食管癌发病率和死亡率最高的国家, 对人们健康构成极大威胁. 近年来学者对食管癌进行了大量的基础研究, 我们进一步研究了As2O3对p15基因表达的影响和意义.
p15基因的失活存在于大多数肿瘤中, 他的失活机制包括缺失和甲基化等, 近年来对甲基化引起p15基因失活的研究已经日益受到重视. As2O3用于治疗白血病获得成功以来, 人们将As2O3用于实体肿瘤,并取得显著疗效, 但其抗肿瘤作用机制尚待深入研究.
本实验在既往研究的基础上首次证实As2O3对实体瘤高甲基化的p15基因有去甲基化作用, 首次报道As2O3使实体瘤高甲基化的p15在mRNA和蛋白水平表达均有上调, 在国内外未见报道.
本实验提示可用去甲基化药物治疗实体肿瘤, 揭示了As2O3对实体瘤的分子水平的一个药理作用, 对今后的研究有一定的借鉴意义.
DNA甲基化常发生在抑癌基因的启动子区, 可以在转录水平抑制基因表达. CpG岛的异常甲基化是指DNA基因启动子区CG重复50%区域, 在甲基化转移酶的作用下, 使DNA上的胞嘧啶转变为5-甲基胞嘧啶, 引起基因表达降低, 而DNA序列不变, 是导致基因组不稳定而引发肿瘤的重要机制.
本文研究目的明确, 实验设计合理, 研究方法和实验证据可靠, 有创新性, 能较好地反映我国食管癌基础研究的水平, 具有较好的学术参考价值.
电编: 张敏 编辑:潘伯荣
| 1. | 吴 顺华, 郑 玉建, 成 军, 刘 妍, 张 跃新, 刘 开泰, 钟 彦伟, 吴 煜. 低剂量三氧化二砷对HepG2细胞基因表达谱调节的影响. 世界华人消化杂志. 2005;13:100-104. [DOI] |
| 2. | 唐 印华, 田 永刚, 刘 铁夫, 徐 洪雨, 庄 丽维, 梁 桃, 姜 爱民. 三氧化二砷抑制小鼠体内肝癌细胞增殖的实验研究. 世界华人消化杂志. 2005;13:2074-2077. [DOI] |
| 5. | 吴 顺华, 成 军, 郑 玉建, 张 跃新, 刘 妍, 郭 江, 张 黎颍, 王 国荃. 应用抑制性消减杂交技术筛选三氧化二砷对肝细胞调节的差异表达基因. 世界华人消化杂志. 2005;13:1535-1539. [DOI] |
| 8. | Herman JG, Graff JR, Myohanen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci USA. 1996;93:9821-9826. [PubMed] [DOI] |
| 11. | 张 学彦, 刘 铁夫, 于 旸, 刘 伟, 崔 希威. p15INK4B基因转染对人食管鳞癌细胞EC109增殖的抑制作用. 世界华人消化杂志. 2005;13:1945-1950. [DOI] |
| 12. | 童 迎凯, 刘 军, 柳 惠图. CKI p15INK4B高表达对人黑色素瘤细胞cyclinD1和c-myc表达的影响及生长特性的改变. 中国生物化学与分子生物学报. 2000;16:514-519. |
| 13. | Grunstein M. Histone acetylation in chromatin stru-cture and transcription. Nature. 1997;389:349-352. [PubMed] [DOI] |
| 15. | Herman JG, Jen J, Merlo A, Baylin SB. Hypermethy-lation-associated inactivation indicates a tumor suppressor role for p15INK4B. Cancer Res. 1996;56:722-727. [PubMed] |
| 16. | Aggerholm A, Holm MS, Guldberg P, Olesen LH, Hokland P. Promoter hypermethylation of p15INK4B, HIC1, CDH1, and ER is frequent in myelodysplastic syndrome and predicts poor prognosis in early-stage patients. Eur J Haematol. 2006;76:23-32. [PubMed] [DOI] |
| 17. | Fukai K, Yokosuka O, Imazeki F, Tada M, Mikata R, Miyazaki M, Ochiai T, Saisho H. Methylation status of p14ARF, p15INK4b, and p16INK4a genes in human hepatocellular carcinoma. Liver Int. 2005;25:1209-1216. [PubMed] [DOI] |
| 18. | Liu Z, Wang LE, Wang L, Lu KH, Mills GB, Bondy ML, Wei Q. Methylation and messenger RNA expression of p15INK4b but not p16INK4a are independent risk factors for ovarian cancer. Clin Cancer Res. 2005;11:4968-4976. [PubMed] [DOI] |
| 19. | Shimamoto T, Ohyashiki JH, Ohyashiki K. Methyla-tion of p15(INK4b) and E-cadherin genes is inde-pendently correlated with poor prognosis in acute myeloid leukemia. Leuk Res. 2005;29:653-659. [PubMed] [DOI] |
| 20. | Furonaka O, Takeshima Y, Awaya H, Ishida H, Kohno N, Inai K. Aberrant methylation of p14(ARF), p15(INK4b) and p16(INK4a) genes and location of the primary site in pulmonary squamous cell carcinoma. Pathol Int. 2004;54:549-555. [PubMed] [DOI] |
| 21. | Yang B, Guo M, Herman JG, Clark DP. Aberrant promoter methylation profiles of tumor suppressor genes in hepatocellular carcinoma. Am J Pathol. 2003;163:1101-1107. [PubMed] [DOI] |
| 22. | Wong TS, Man MW, Lam AK, Wei WI, Kwong YL, Yuen AP. The study of p16 and p15 gene methyla-tion in head and neck squamous cell carcinoma and their quantitative evaluation in plasma by real-time PCR. Eur J Cancer. 2003;39:1881-1887. [PubMed] [DOI] |
| 23. | Nie Y, Liao J, Zhao X, Song Y, Yang GY, Wang LD, Yang CS. Detection of multiple gene hypermethy-lation in the development of esophageal squamous cell carcinoma. Carcinogenesis. 2002;23:1713-1720. [PubMed] [DOI] |
| 27. | Vahter M. Mechanisms of arsenic biotransformation. Toxicology. 2002;181-182:211-217. [PubMed] [DOI] |
| 28. | Gonzalez-Fraile MI, Garcia-Sanz R, Mateos MV, Balanzategui A, Gonzalez M, Vaquez L, San Miguel JF. Methylenetetrahydrofolate reductase genotype does not play a role in multiple myeloma pathogenesis. Br J Haematol. 2002;117:890-892. [PubMed] [DOI] |