修回日期: 2006-05-20
接受日期: 2006-05-22
在线出版日期: 2006-06-28
目的: 应用快速蛋白液相色谱(FPLC)系统从肝癌组织中分离和纯化HSP70-肽复合物, 并研究其对肝癌细胞系HepG-2增殖的影响.
方法: 将组织进行匀浆、高速离心提取总蛋白后依次进行ConA-Sepharose亲和层析和DEAE-Sephacel离子交换层析分离纯化, 所得蛋白经SDS-聚丙烯酰胺凝胶电泳和Western blot进行蛋白分子质量及性质鉴定, Bradford法测定蛋白浓度; 利用MTT方法检测HSP70-肽复合物对HepG-2细胞增长的情况.
结果: 分离、纯化得到的蛋白经SDS-聚丙烯酰胺凝胶电泳、考马斯量蓝鉴定为单一带, 分子质量为70 kDa; Western blot结果证实为HSP70, 每10 g组织最终获得1.5 mg的HSP70; HSP70刺激组12, 48, 72 h与对照组的A值之间有显著差异(0.1 mg/L: t = - 0.2500, P = 0.00; t = -0.1777, P = 0.001; t = -0.3094, P = 0.001; 0.5 mg/L: t = -0.2878, P = 0.00; t = -0.2044, P = 0.00; t = -0.3285, P = 0.00; 1 mg/L: t = -0.3118, P = 0.00; t = -0.2592, P = 0.00; t = -0.1994, P = 0.025; 5 mg/L: t = -0.4007, P = 0.00; t = -0.1302, P = 0.016; t = -0.2537, P = 0.005), 细胞存活率明显高于对照组(P<0.01).
结论: 使用本分离纯化方法可获得高纯度HSP70肽复合物; HSP70肽复合物可以促进HepG-2细胞的生长.
引文著录: 隋春阳, 李航宇, 胡勇, 宗志红, 李洪秀, 郭仁宣. HSP70-肿瘤肽复合物的纯化及其对肝癌细胞株HepG-2增殖的作用. 世界华人消化杂志 2006; 14(18): 1775-1779
Revised: May 20, 2006
Accepted: May 22, 2006
Published online: June 28, 2006
AIM: To separate and purify heat shock protein 70 (HSP70) peptide complex from hepatocellular carcinoma (HCC) tissues by fast protein liquid chromatography (FPLC), and investigate its effect on the proliferation of HepG-2 cells.
METHODS: The mixture of proteins was derived from HCC tissues by means of splitting and centrifugation. Then the proteins were purified by affinity chromatography on concanavalin A-Sepharose and ion exchange chromatography with DEAE-Sephacel. The obtained protein was identified by SDS-PAGE and Western blot for its molecular weight and property. Bradford method was used to measure the concentration of the protein. The growth of HepG-2 cells, which were stimulated by HSP-70 peptide complex (0.1, 0.5, 1, and 5 mg/L), was observed by MTT assay.
RESULTS: A protein band with a molecular weight of about 70 kDa was obtained and shown by SDS-PAGE, and it was confirmed to be the HSP70 by Western blot. Bradford method showed that a quantity of 1.5 mg HSP70 protein was obtained from every 10 g HCC tissues. After treatment with HSP-70 peptide complex, the value of optical density (OD) in HSP70 group was significantly higher at 24, 48, and 72 h than that in control group (0.1 mg/L: t = - 0.2500, P = 0.00; t = -0.1777, P = 0.001; t = -0.3094, P = 0.001; 0.5 mg/L: t = -0.2878, P = 0.00; t = -0.2044, P = 0.00; t = -0.3285, P = 0.00; 1 mg/L: t = -0.3118, P = 0.00; t = -0.2592, P = 0.00; t = -0.1994, P = 0.025; 5 mg/L: t = -0.4007, P = 0.00; t = -0.1302, P = 0.016; t = -0.2537, P = 0.005), and the cell livability in HSP70 group was also significantly higher (P < 0.01).
CONCLUSION: The pure HSP70-peptide complex is obtained, and it can promote the growth of HepG-2 cells.
- Citation: Sui CY, Li HY, Hu Y, Zong ZH, Li HX, Guo RX. Purification of heat shock protein 70 peptide complex and its effect on proliferation of HepG-2 cells. Shijie Huaren Xiaohua Zazhi 2006; 14(18): 1775-1779
- URL: https://www.wjgnet.com/1009-3079/full/v14/i18/1775.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i18.1775
热休克蛋白(heat shock protein, HSP)是广泛存在于生物界(从原核生物到真核生物)中具有高度保守性质的蛋白质[1]. 大量的研究表明HSP70在包括肝癌在内的大多数的肿瘤中均有高表达[2-6]. HSP70在肿瘤细胞中过度表达, 不仅对肿瘤细胞的保护、维持细胞的稳定有重要的作用, 而且在抑制肿瘤细胞凋亡的过程中也发挥着重要的作用[7-12]. 同时, 源自肿瘤组织的HSP-肿瘤肽免疫宿主可激发持久的T细胞免疫, 产生特异的抗肿瘤免疫效应[13-16]. 我们应用快速蛋白液相色谱(FPLC)系统从肝癌组织中分离和纯化HSP70-肿瘤肽复合物, 并研究其对肝癌细胞系HepG-2增殖的影响.
伴刀豆凝集素A琼脂糖凝胶(ConA-Sepharose)及DEAE-Sephacel (Pharmacia); 兔抗人HSP70多克隆抗体(武汉博士德); HepG-2细胞株(我院肿瘤研究所); 标准胎牛血清(天津TBD生物技术有限公司); RPMI 1640培养液(美国Hyclone公司); FPLC层析系统.
取肝癌组织(我院肝癌患者行手术切除后的肝癌组织)10 g剪碎后, 加入10倍体积的Buffer A (NaHCO3 30 mmol/L pH 7.1, 内含0.1 mmol/L EDTA, 0.1 mmol/L DTT及0.5 mmol/L PMSF), 匀浆, 4℃ 150 000 r/min超速离心3 h; 取上清, 过ConA-Sepharose 4B亲合层析柱(柱高15 cm, 直径1.5 cm), 收集不结合的洗脱液, 透析液1 (Tris-HCl 10 mmol/L, 乙酸钠10 mmol/L, NaCl 10 mmol/L, EDTA 0.1 mmol/L, pH 7.5)过夜; Buffer C (Tris-HCl 20 mmol/L, 乙酸钠20 mmol/L, NaCl 20 mmol/L, EDTA 0.1 mmol/L, pH 7.5)平衡DEAE柱(DEAE-Sephacel, 柱高15 cm, 直径1.0 cm), 取浓缩后的样品上样, Buffer B (Tris-HCl 20 mmol/L, pH 7.4, 内含0.5 mmol/L NaCl)洗脱后, 再用FPLC系统, Buffer D (NaCl 0.5 mol/L用Buffer C调)梯度洗脱后, 收集各洗脱峰的蛋白, 透析液2 (Tris-HCl 10 mmol/L)透析. 上述洗脱液3/4100 g/L SDS-聚丙烯酰胺凝胶电泳进行分子量及纯度的鉴定. 常规制备100 g/L分离胶及40 g/L浓缩胶, 样品经煮沸、离心处理后上样, 浓缩胶电泳电压70 V, 分离胶电压110 V, 电泳时间约3 h, 电泳后采用考马斯亮蓝染色. 根据电泳结果, 取含70 kDa蛋白的样品, 用于Western blot试验: 常规100 g/L SDS-聚丙烯酰胺凝胶电泳后, 转移至硝酸纤维素薄膜上, 50 g/L脱脂奶粉包被2 h, 兔抗人HSP70多克隆抗体(1∶300)为一抗, 辣根过氧化物标记的羊抗兔抗体(1∶2000)作为二抗, DAB进行显色, 观察并记录结果. 蛋白质浓度测定采用Bradford法[17]. HepG-2肝癌细胞株在含100 mL/L胎牛血清(FBS)的RPMI 1640培养基中常规培养, 950 mL/L湿度, 50 mL/L CO2, 37℃. 选生长状态好, 处于对数生长期的细胞, 按5×107/L的细胞浓度接种于96孔板, 每孔100 μL, 培养24 h后更换培养基, 对照组继续用RPMI 1640培养基, 第2, 3, 4, 5组分别用含0.1, 0.5, 1.0, 5.0 mg/L HSP70-肿瘤肽复合物的RPMI 1640培养液继续培养, 分别于24, 48, 72 h后行MTT分析. 每孔加入MTT 20 μL, 37℃继续培养4 h, 小心吸弃孔内培养液, 每孔加DMSO 200 μL, 震荡15 min, 分别于0, 10, 30 min在酶标仪上测出波长570 nm处的吸光度A值. 每组设3个复孔, 取3次实验的平均数, 比较各组细胞的存活率. 各组细胞存活率(%) = (实验组吸光度-空白组吸光度)/对照组吸光度-空白组吸光度)×100%.
统计学处理 结果用SPSS 13.0软件包进行统计学分析, 各组间进行t检验; P<0.05为差异有显著意义.
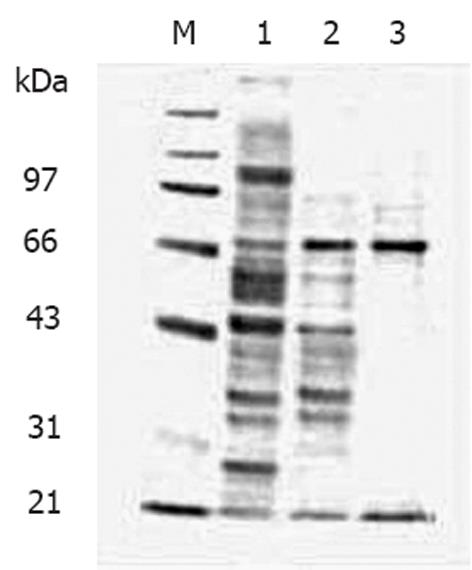
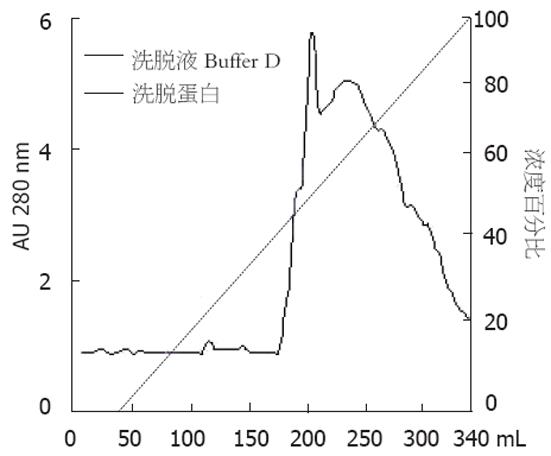
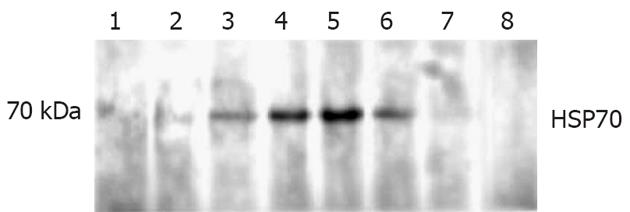
细胞裂解液经ConA-Sepharose 4B层析后, 可分为ConA结合部分和不结合部分. 不结合部分经电泳后在70 000处有一µ染的条带, 而在43 000以下也可见几条µ染的条带(图1). 将ConA不结合部分进一步用FPLC经DEAE柱进行分离, 梯度盐洗脱, 收集各洗脱峰的蛋白, 共有2个蛋白洗脱峰(图2), 电泳后于第2个峰发现为70 000的蛋白. 上述Mr 70 000的蛋白质用特异性Western blot法鉴定, 证实该蛋白确系热休克蛋白HSP70(图3). 10 g肝癌组织经上述分离纯化过程最终获得HSP70-肿瘤肽复合物总量为1.5 mg.
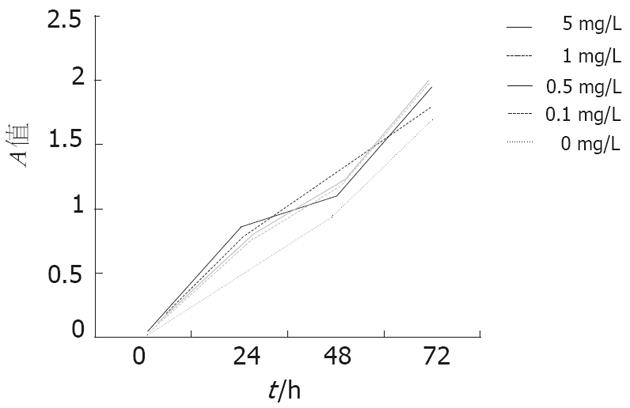
不同浓度在不同时间点的各组与对照组相比较, HSP70-肿瘤肽复合物均对肝癌细胞株HepG-2有促进增殖作用(P<0.01, 表1, 图4). 而各浓度在同一时间内各组之间对肝癌细胞株HepG-2增殖的影响则无明显差异(P>0.05).
| (mg/L) | n | A平均值(mean±SD) | 细胞存活率(%) | t值 | P值 | |
| 24 h | 0 | 24 | 0.446±0.174 | 100.0 | ||
| 0.1 | 9 | 0.696±0.855 | 156.1 | -0.250000 | 0.00 | |
| 0.5 | 9 | 0.733±0.864 | 164.6 | -0.287778 | 0.00 | |
| 1 | 9 | 0.757±0.123 | 170.0 | -0.311778 | 0.00 | |
| 5 | 9 | 0.846±0.091 | 190.0 | -0.400667 | 0.00 | |
| 48h | 0 | 24 | 0.971±0.112 | 100.0 | ||
| 0.1 | 9 | 1.149±0.207 | 118.3 | -0.177653 | 0.001 | |
| 0.5 | 9 | 1.176±0.134 | 121.1 | -0.204431 | 0.00 | |
| 1 | 9 | 1.230±0.064 | 126.7 | -0.259208 | 0.00 | |
| 5 | 9 | 1.101±0.148 | 113.4 | -0.130208 | 0.016 | |
| 72 h | 0 | 24 | 1.698±0.200 | 100.0 | ||
| 0.1 | 9 | 2.007±0.307 | 118.2 | -0.309389 | 0.001 | |
| 0.5 | 9 | 2.026±0.266 | 119.4 | -0.328500 | 0.00 | |
| 1 | 9 | 1.897±0.181 | 111.7 | -0.199389 | 0.025 | |
| 5 | 9 | 1.952±0.155 | 114.9 | -0.253722 | 0.005 |
HSP70是分子质量在70 kDa左右的热休克蛋白, 是热休克蛋白家族中最重要的一员, 被称为主要热休克蛋白. HSP70被称为分子伴侣, 因为他不参与目的蛋白的构成, 但可以通过与目的蛋白质或多肽在细胞中构成复合体, 并通过这种复合体的形成和解离而参与相关蛋白质的构象、折叠、跨膜转运及降解等重要生理功能[18-20]. 更为重要的是在应激状态下HSP可以为细胞提供保护[1,21]. 正常细胞中, HSP70的表达受细胞周期调控, 而肿瘤细胞中突变或异常蛋白质的存在刺激HSP70的合成, 使其呈现持续的高表达. 研究结果显示肝癌组织中HSP70蛋白的表达与肿瘤的肝癌分化程度密切相关, 低分化的肝癌组织中HSP70蛋白的表达显著高于高分化的肝癌组织. 可见, HSP70蛋白与肝癌的进展密切相关[22-24]. HSP70在肿瘤细胞中过度表达, 不仅对肿瘤细胞的保护、维持细胞的稳定有重要的作用, 而且在抑制肿瘤细胞凋亡的过程中也发挥着重要的作用[7-12]. 同时, 源自肿瘤组织的HSP-肿瘤肽免疫宿主可激发持久的T细胞免疫, 产生特异的抗肿瘤免疫效应[13-16]. 然而, HSP70在肿瘤细胞中的作用机制及其对肿瘤细胞的发生、发展的影响, 仍有许多不清楚甚至矛盾的地方, 因此, 提取肿瘤细胞中的HSP70-肽复合物成为进一步研究其作用的前提.
HSP70在细胞中的含量低, 提取HSP70-肽复合物工艺极其复杂. 我们采用二步蛋白纯化法, 即ConA亲和层析法、阴离子交换蛋白亲和层析法等二个步骤, 从人肝癌组织中成功提取了HSP70-肽复合物并获得较高的效率. ConA亲和层析法选择性强、分离效率高, 是提取过程中的一个重要环节. 已知糖蛋白可与ConA特异性结合, 利用这种生物大分子与其配体之间所具有的专一性亲和力作亲和层析, 能产生纯化作用, 而且其分离快速的优点对分离含量少又极不稳定的活性物质更有利. 本实验中, 样品经过ConA亲和层析柱后, 能与ConA相互作用的糖蛋白则被阻留在柱上, 从而将糖蛋白与非糖蛋白分离. DEAE层析应用快速蛋白纯化仪可缩短实验准备和运行所需的时间, 减少HSP70蛋白降解, 提高实验结果的可靠性和重复性. 对蛋白质进一步的定性定量分析证实: 采用此分离纯化方法得到的蛋白质确系HSP70. 肿瘤在发生、发展过程中同时也伴随着肿瘤细胞的死亡, 这也就意味着有大量的HSP70-肽复合物释放到肿瘤细胞外, 这些细胞外的HSP70-肽复合物对肿瘤细胞的直接作用目前尚不清楚. 本实验通过从肝癌组织中提取的HSP70-肽复合物刺激肝癌细胞株HepG-2, 利用MTT方法观察HSP70-肽复合物对肝癌细胞株HepG-2增殖的影响. 实验结果表明, 与对照组相比, 不同浓度组在不同的观察时间点均显示出HSP70-肽复合物可以促进肝癌细胞株HepG-2增殖(P<0.01), 各浓度之间对肝癌细胞株HepG-2增殖的影响则无差异(P>0.05).
本结果表明不仅细胞内的HSP70可以保护肝癌细胞, 细胞外的HSP70-肽复合物同样也可以促进肝癌细胞的增殖. 至于HSP70-肽复合物如何作用于肝癌细胞, 我们考虑可能是HSP70-肽复合物通过肝癌细胞表面表达的某些受体(如TLR4, CD40等)或直接穿过细胞膜而对细胞的增殖发生影响. Novoselova et al[25]的研究表明HSP70可以通过穿过细胞膜而保护细胞、抑制凋亡. Jones et al[26]的研究表明外源性HSP70是前列腺凋亡的抑制子. 至于细胞外的HSP70-肽复合物对肝癌细胞株HepG-2增殖的影响是否也与细胞内的HSP70的作用机制一样, 则需进一步的实验证实.
热休克蛋白70是生物界广泛存在的具有高度保守性质的蛋白, 他在肿瘤细胞中过度表达, 不仅对肿瘤细胞的保护、维持细胞的稳定有重要的作用, 而且在肿瘤细胞的免疫中也有重要的作用. 因此, 建立一种简便可行的提取肿瘤细胞中的HSP70-肽复合物的方法并研究其对肿瘤细胞的作用机制成为今后更好的应用HSP70-肽复合物的一个前提.
提取并纯化肿瘤组织中的HSP70-肽复合物是研究HSP70作用机制的一个重要前提, 细胞外的HSP70-肽复合物对肿瘤细胞的作用上不清楚, 因此探讨细胞外的HSP70-肽复合物对肝癌细胞系HepG-2增殖的影响成为我们研究的重点.
本研究借鉴国外一些研究方法, 结合国内一般实验室的条件, 建立了一种较方便有效的提取纯化方法, 同时证明了不仅细胞内的HSP70可以保护肝癌细胞, 细胞外的HSP70-肽复合物同样也可以促进肝癌细胞的增殖.
层析分离技术: 是一种物理分离方法, 利用混合物中各组分物理化学性质的差别(如吸引力, 分子形状和大小、分子极性、分子亲和力等), 使各组分以不同程度分布在固定相和流动相中, 从而使各组分以不同的速度移动而达到分离.
肝癌组织HSP70表达与肝癌分化密切相关, 并在维持肝癌细胞稳定及抑制凋亡中起重要作用, 本研究采用二步纯化法获得高比率HSP70-肽复合物, 并证明可促进HepG-2细胞生长, 故对肝癌实验研究具有重要意义. 设计观测科学, 结论可信, 能较好地反映我国或国际胃肠病学基础研究的先进水平.
电编: 张敏 编辑:潘伯荣
| 2. | Garcia-Bermejo L, Vilaboa NE, Perez C, Galan A, De Blas E, Aller P. Modulation of heat-shock protein 70 (HSP70) gene expression by sodium butyrate in U-937 promonocytic cells: relationships with differentiation and apoptosis. Exp Cell Res. 1997;236:268-274. [PubMed] [DOI] |
| 3. | Lebret T, Watson RW, Molinie V, O'Neill A, Gabriel C, Fitzpatrick JM, Botto H. Heat shock proteins HSP27, HSP60, HSP70, and HSP90: expression in bladder carcinoma. Cancer. 2003;98:970-977. [PubMed] [DOI] |
| 4. | Wang XP, Qiu FR, Liu GZ, Chen RF. Correlation between clinicopathology and expression of heat shock protein 70 and glucose-regulated protein 94 in human colonic adenocarcinoma. World J Gastroenterol. 2005;11:1056-1059. [PubMed] [DOI] |
| 5. | Joo M, Chi JG, Lee H. Expressions of HSP70 and HSP27 in hepatocellular carcinoma. J Korean Med Sci. 2005;20:829-834. [PubMed] [DOI] |
| 6. | Wang XP, Wang QX, Li HY, Chen RF. Heat shock protein 70 chaperoned alpha-fetoprotein in human hepatocellular carcinoma cell line BEL-7402. World J Gastroenterol. 2005;11:5561-5564. [PubMed] [DOI] |
| 7. | Wei YQ, Zhao X, Kariya Y, Teshigawara K, Uchida A. Inhibition of proliferation and induction of apoptosis by abrogation of heat-shock protein (HSP) 70 expression in tumor cells. Cancer Immunol Immunother. 1995;40:73-78. [PubMed] [DOI] |
| 8. | Nylandsted J, Rohde M, Brand K, Bastholm L, Elling F, Jaattela M. Selective depletion of heat shock protein 70 (Hsp70) activates a tumor-specific death program that is independent of caspases and bypasses Bcl-2. Proc Natl Acad Sci USA. 2000;97:7871-7876. [PubMed] [DOI] |
| 9. | Nylandsted J, Wick W, Hirt UA, Brand K, Rohde M, Leist M, Weller M, Jaattela M. Eradication of glioblastoma, and breast and colon carcinoma xenografts by Hsp70 depletion. Cancer Res. 2002;62:7139-7142. [PubMed] |
| 10. | Sreedhar AS, Csermely P. Heat shock proteins in the regulation of apoptosis: new strategies in tumor therapy: a comprehensive review. Pharmacol Ther. 2004;101:227-257. [PubMed] [DOI] |
| 11. | Didelot C, Schmitt E, Brunet M, Maingret L, Parce-llier A, Garrido C. Heat shock proteins: endogenous modulators of apoptotic cell death. Handb Exp Pharmacol. 2006;171-198. [PubMed] [DOI] |
| 12. | Schmitt E, Maingret L, Puig PE, Rerole AL, Ghiringhelli F, Hammann A, Solary E, Kroemer G, Garrido C. Heat shock protein 70 neutralization exerts potent antitumor effects in animal models of colon cancer and melanoma. Cancer Res. 2006;66:4191-4197. [PubMed] [DOI] |
| 13. | Li Z. Priming of T cells by heat shock protein-peptide complexes as the basis of tumor vaccines. Semin Immunol. 1997;9:315-322. [PubMed] [DOI] |
| 15. | Wang XH, Qin Y, Hu MH, Xie Y. Dendritic cells pulsed with hsp70-peptide complexes derived from human hepatocellular carcinoma induce specific anti-tumor immune responses. World J Gastroenterol. 2005;11:5614-5620. [PubMed] [DOI] |
| 16. | Robert J. Evolution of heat shock protein and immunity. Dev Comp Immunol. 2003;27:449-464. [PubMed] [DOI] |
| 17. | 汪 家政, 范 明. 蛋白质技术手册. 北京: 科学出版社 2001; 41-46. |
| 18. | Hartl FU, Hayer-Hartl M. Molecular chaperones in the cytosol: from nascent chain to folded protein. Science. 2002;295:1852-1858. [PubMed] [DOI] |
| 19. | Arispe N, Doh M, Simakova O, Kurganov B, De Maio A. Hsc70 and Hsp70 interact with phosphati-dylserine on the surface of PC12 cells resulting in a decrease of viability. FASEB J. 2004;18:1636-1645. [PubMed] [DOI] |
| 20. | Mayer MP, Bukau B. Hsp70 chaperones: cellular functions and molecular mechanism. Cell Mol Life Sci. 2005;62:670-684. [PubMed] [DOI] |
| 21. | Morimoto RI. Cells in stress: transcriptional activation of heat shock genes. Science. 1993;259:1409-1410. [PubMed] [DOI] |
| 23. | Lim SO, Park SG, Yoo JH, Park YM, Kim HJ, Jang KT, Cho JW, Yoo BC, Jung GH, Park CK. Expression of heat shock proteins (HSP27, HSP60, HSP70, HSP90, GRP78, GRP94) in hepatitis B virus-related hepatocellular carcinomas and dysplastic nodules. World J Gastroenterol. 2005;11:2072-2079. [PubMed] [DOI] |
| 25. | Novoselova TV, Margulis BA, Novoselov SS, Sapozhnikov AM, van der Spuy J, Cheetham ME, Guzhova IV. Treatment with extracellular HSP70/HSC70 protein can reduce polyglutamine toxicity and aggregation. J Neurochem. 2005;94:597-606. [PubMed] [DOI] |
| 26. | Jones EL, Zhao MJ, Stevenson MA, Calderwood SK. The 70 kilodalton heat shock protein is an inhibitor of apoptosis in prostate cancer. Int J Hyperthermia. 2004;20:835-849. [PubMed] [DOI] |