修回日期: 2006-04-15
接受日期: 2006-05-25
在线出版日期: 2006-06-28
目的: 观察大鼠慢性酒精性肝损伤过程中VEGF的表达, 探讨其在慢性酒精性肝损伤发生、发展中的作用.
方法: 56度的白酒(560 mL/L)平均以7 g/kg的剂量每日早晨灌胃一次制备肝纤维化模型, 灌胃4 wk、12 wk及24 wk采用股静脉放血法分别处死大鼠, 观察肝脏病理变化并采用半定量逆转录聚合酶链反应(RT-PCR)检测VEGF mRNA的表达.
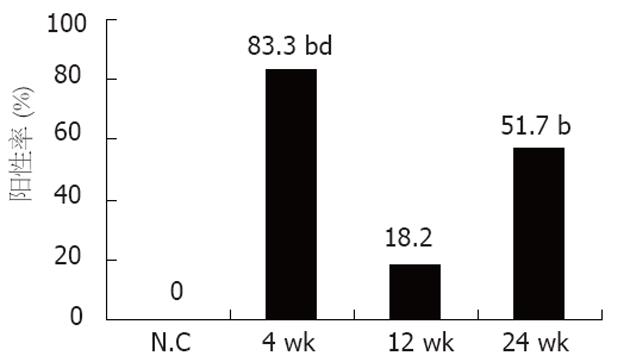
结果: 对照组的VEGF未见表达, 饲酒4 wk组表达VEGF mRNA比例最高, 达到83.3%(5/6), 与对照组相比有非常显著性差异(P<0.01), 12 wk时下降到18.2%(2/11), 且其表达与对照组相比无差异(P>0.05), 而至24 wk VEGF表达阳性率上升到57.1%(4/7), 与对照组相比有非常显著性差异(P<0.01). 另外, 饲酒4 wk组VEGF表达阳性率与12周相比差异也有非常显著性(P<0.01), 而与24 wk相比无统计学差异. 试验组大鼠肝细胞出现明显脂肪、空泡变性, 坏死及胶原增生等病变.
结论: VEGF可能在酒精性肝病中起重要作用, 主要与酒精性肝炎及酒精性肝纤维化有关.
引文著录: 李伟平, 任浩洋, 张宝阳, 虞朝辉, 厉有名. VEGF在大鼠慢性酒精性肝损伤中的表达. 世界华人消化杂志 2006; 14(18): 1766-1770
Revised: April 15, 2006
Accepted: May 25, 2006
Published online: June 28, 2006
AIM: To investigate the expression of vascular endothelial growth factor (VEGF) and its role in the pathogenesis and development of chronic alcoholic liver fibrosis in rats.
METHODS: Liver fibrosis models were established in 24 SD rats by intragastric administration (7 g/kg) of alcohol (56º, 560 mL/L) every morning, and 10 normal rats served as controls. The rats in model group were killed by exsanguination from femoral vein at 4, 12 and 24 wk. Pathological changes of liver tissues in rats were identified by Masson staining, and the expression of VEGF mRNA was detected by semiquantitative reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: VEGF mRNA expression was not detected in the control rats. The expression of VEGF mRNA in model rats was the highest at 4 wk, reaching 83.3% (5/6), which was significantly higher than that in the controls (P < 0.01). The positive rate of VEGF mRNA expression dropped to 18.2% (2/11) at 12 wk, and then rose up again to 57.1% (4/7) at 24 wk, which was markedly higher than that in the controls. The expression of VEGF mRNA was also notably different between 4 and 12 wk (P < 0.01), but not between 4 and 24 wk (P > 0.05). Fatty and vacuole-like degeneration, necrosis and production of collagen were observed in the model rats.
CONCLUSION: VEGF plays an important role in the pathogenesis and development of chronic alcoholic liver fibrosis.
- Citation: Li WP, Ren HY, Zhang BY, Yu CH, Li YM. Expression of vascular endothelial growth factor in chronic alcoholic liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(18): 1766-1770
- URL: https://www.wjgnet.com/1009-3079/full/v14/i18/1766.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i18.1766
在西方国家, 酒精性肝病是其肝病的主要类型之一. 在我国, 乙肝疫苗等病毒性肝炎预防的逐步普及, 乙肝等病毒性肝炎的发病率开始下降; 同时随着生活水平的提高, 临床发现酒精性肝病的发病率呈上升趋势, 浙江省酒精性肝病流行病学调查的人群中酒精性肝病患病率达4.34%[1]. 尽管酒精性肝病病因单一, 但其发病机制复杂, 尚未完全明了.
1983年Senger et al[2]首先从肿瘤腹水中发现血管内皮生长因子(VEGF), 并证实他是一种分子量为40-50 kDa的分泌性糖蛋白, 有强烈提高血管通透性的作用, 能引起血浆蛋白(包括纤维蛋白原)渗出血管, 其效果相当于组织胺的5000倍. 进一步的研究证实, 他是内皮细胞的一种特异性丝裂原, 具有选择性诱导内皮细胞增殖、血管生成的作用, 其与各种肝病的关系也越来越受到关注. 在蛋白及分子水平各类肝病中VEGF的作用已被广泛研究, 已证实VEGF在肝窦内皮细胞的生长, 肝细胞再生以及原发性、继发性的肝癌发生、发展, 各种良性肝病如血管瘤、肝炎等中起重要作用, 但至今VEGF在酒精性肝病中的研究尚不多, 且对其在其中所起的作用了解甚少. 我们利用大鼠长期摄入酒精, 复制慢性酒精性肝损伤的动物模型, 通过RT-PCR检测VEGF mRNA表达水平的变化, 探讨其在酒精性肝病发病机制中的作用.
采用健康, 性成熟, 一级质量标准的S-D大鼠34只, 体质量180-210 g, 分笼喂养. 大鼠由浙江大学医学院动物中心提供并以清洁Ⅱ级饲养. 红星牌56度二锅头白酒(560 mL/L)由北京酿酒总厂生产, Trizol试剂、M-MLV逆转录酶试剂盒由GIBCOBRL公司提供, 无水乙醇购自杭州长征化工厂, 异丙醇购自杭州双林化工试剂厂, 氯仿购自浙江迪耳药业有限公司, DEPC水、琼脂糖、三羟甲基氨基甲烷(TRIS)及Taq酶购自上海生工生物工程有限公司, 乙二胺四乙酸二钠(EDTA)购自广东安平化学厂, 25 mmol/L氯化镁购自Promega公司.
1.2.1 实验动物处理: 大鼠分为2组, 模型组24只, 正常对照组10只. 模型组以红星牌56度二锅头白酒平均以7 g/kg的剂量每日早晨灌胃一次, 正常对照组则以等量生理盐水灌注. 各组大鼠实验期间均予以饮用水及全价营养颗粒饲料喂养. 模型组在4, 12及24 wk采用股静脉放血法分别处死6只、11只及7只, 取肝脏标本, 一部分置于液氮中快速冷冻, -80℃冰箱保存待测; 另一部分于40 g/L福尔马林固定, 用于纤维化组织病理学检测.
1.2.2 肝脏组织病理学检测: 肝组织石蜡包埋, 常规病理检测, 并行Masson三色染色检测肝纤维化程度.
1.2.3 RNA抽提及RT-PCR: 用Trizol提取肝脏组织总RNA, 按GIBCOBRL公司M-MLV逆转录酶试剂盒说明书逆转录成cDNA, 并进行PCR扩增, VEGF引物: 正义: 5'-TGC ACC CAC GAC AGA AGG GGA-3', 反义: 5'-TCA CCG CCT TGG CTT GTC ACA T-3', 扩增片段为568 bp. "看家基因"磷酸甘油醛脱氢酶(GAPDH)为内参照, 正义: 5'-CAT GGT CTA CAT GTT CCA GT-3', 反义: 5'-GGC TAA GCA GTT GGT GGT GC-3', 扩增片段为349 bp. 以上引物均由上海生工生物工程有限公司合成. 取逆转录产物2 μL为模板, 1 U Taq酶, 上下游引物各0.1 μg, 10 mmol/L dNTP 0.8 μL, 25 mmol/L MgCl2 1.2 μL(终浓度为1.5 mmol/L) 10×Buffer 2 μL, 加水至总反应体积为20 μL, 混匀. 置PCR仪94℃ 5 min, 以后94℃ 45 s→66℃ 45 s (GAPDH退火温度为61℃)→72℃ 45 s, 共30个循环, 72℃ 5 min终止反应. 取5 μL PCR产物经20 g/L琼脂糖凝胶(含0.5 mg/L溴化已锭)电泳, 所得目标条带用紫外快速成像仪拍照, 计所得目标条带数, 与各组总数相比求得其阳性率.
统计学处理 所有数据用SPSS 10.0统计软件进行χ2检验.
长期摄入酒精后, 大鼠肝细胞浆出现不同程度的空泡变性, 重者胞体肿大气球样变; 肝细胞脂肪变性分布于小叶各带(主要位于小叶3区带), 内含脂滴以中小脂滴为主, 小叶各带可见不同程度的点状坏死, 主要见于中央静脉周围带, 肝小叶的坏死灶及肝窦内可见较多量多核细胞、淋巴细胞及单核细胞浸润.
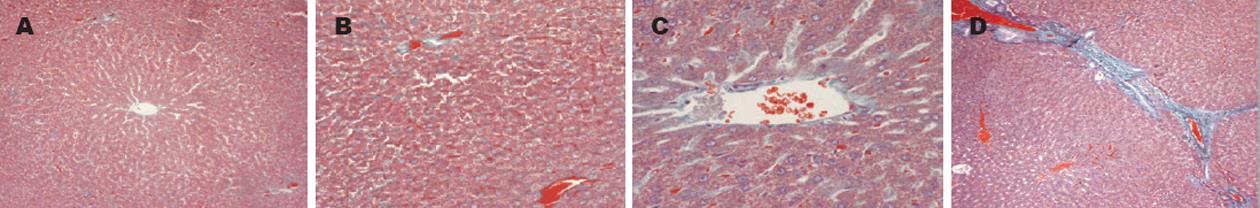
正常对照组大鼠Masson三色染色观察肝小叶, 除中央静脉外少见绿染胶原纤维分布, 汇管区管壁偶尔有少许细小的绿染胶原纤维包围, 但未见明显增生. 实验4 wk末, 可见少数大鼠汇管区边缘有绿染胶原纤维少量包绕增生, 肝窦中几乎无绿染胶原纤维分布. 实验12 wk末, 肝小叶中央静脉外也可见散在绿染胶原纤维分布, 汇管区周围有明显绿染胶原纤维包绕, 其中某些汇管区周围所包绕的纤维组织则向周围肝小叶内浸润, 呈星状放射, 少量切片中可见中央静脉管壁增厚现象. 而至实验24 wk末, 则可见汇管区胶原增多或扩大, 轻中度的窦周纤维化、轻中度静脉周纤维化明显, 可见少数纤维间隔形成(图1).
肝纤维化(SSS)半定量计分结果表明, 4 wk酒精组大鼠肝脏SSS计分与正常对照组大鼠比较, 无统计学差异. 实验12及24 wk末, 大鼠肝脏SSS计分与正常对照组及实验第4周末大鼠比较, 均明显增高, 具显著统计学意义(P<0.01). 且大鼠肝脏SSS计分值与饲酒时间呈明显的相关性(表1).
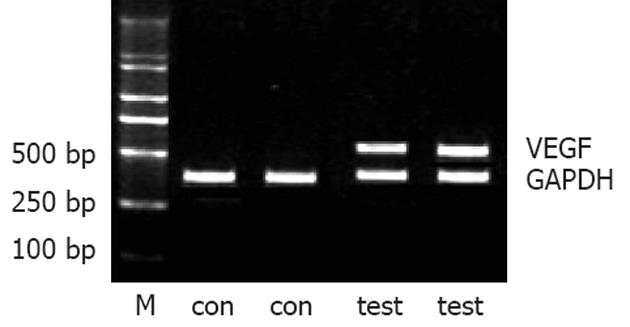
提取实验大鼠肝组织RNA, 以RT-PCR方法检测VEGF在正常及酒精致肝损伤过程中的表达及变化情况. 正常对照组大鼠肝组织中未见表达, 饲酒组中部分大鼠肝组织检测到VEGF表达(以看家基因GAPDH为内参照, 电泳结果见图2).
考察各实验组中VEGF表达阳性大鼠所占比例. 对照组的VEGF未见表达, 饲酒4 wk组VEGF表达阳性率最高, 达到83.3% (5/6), 与对照组相比有非常显著的统计学差异(P<0.01); 饲酒12 wk时下降到18.2% (2/11), 且其表达与对照组相比无统计学意义(P>0.05); 饲酒24 wk VEGF表达阳性率上升到57.1% (4/7), 与对照组相比有非常显著的统计学意义(P<0.01). 另外, 饲酒4 wk组VEGF表达阳性率与12 wk相比也有非常显著的统计学意义(P<0.01), 与24 wk相比无统计学意义(图3).
VEGF能提高毛细血管通透性, 肝细胞再生及新生血管形成, 肝脏炎症急性期反应包括细胞因子IL-1, IL-6, TNF-α的释放和血浆急性期蛋白浓度的改变. 由于提高了毛细血管的通透性, VEGF增强了这些蛋白的释放, 从而在急性炎症期起关键作用.
Akiyoshi et al[3]用酶联免疫吸附法测得急性肝炎患者血清VEGF平均值为172.7 ng/L, 显著高于对照组(65.0 ng/L)和慢性肝炎组(58.0 ng/L). 在CCl4所致的大鼠急性肝坏死模型中VEGF mRNA表达增加, 免疫组化显示VEGF主要位于激活的肝星状细胞、枯否细胞及巨噬细胞, 并发现在肝坏死区血管内皮细胞数量丰富, 而在肝坏死恢复时则以肝窦内皮细胞为主, VEGF主要位于肝细胞, 提示来源于非实质细胞的VEGF有助于血管内皮细胞增生, 而肝细胞来源的VEGF促进肝窦内皮细胞再生, 说明VEGF在肝病变组织的血管生成中起关键作用[4]. 250例慢性乙肝患者肝组织通过免疫组化发现VEGF在肝炎轻度组表达阳性占多数, 而在肝炎较重组强阳性占多数, 且在肝内血管炎症、破坏及阻塞部位尤其在碎屑坏死区的肝细胞及窦间隙表达较明显, 表明VEGF在肝组织内表达随肝组织变性坏死加重而上升[5]. 本实验发现在饲酒4 wk后VEGF的表达率达最高峰(83.3%), 与其他研究结果基本一致, 其机制可能是在持续酒精的刺激下, 肝组织缺血缺氧, 肝细胞变性坏死, 炎症细胞浸润, VEGF表达的增加刺激血管增生, 增加血管的通透性, 并减少细胞凋亡和坏死, 有利于组织修复. 随着饲酒时间的进一步延长, VEGF的表达率开始下降, 12 wk时与对照组相比无统计学差异, 认为可能是因为在这一阶段肝组织缺氧有所减轻所致. 但关于VEGF在急慢性肝炎中的确切作用仍需作进一步研究.
窦周纤维化为酒精性肝病的较特征性变化. 肝窦内皮具有大量窗孔及高通透性, 可通过循环中的大分子而进行代谢物质交换. 酒精性肝纤维化时细胞外基质合成增多, 引起窦周纤维化及肝窦毛细血管化, 后者即肝血窦呈现毛细血管的结构特征, 窦内皮细胞的窗孔消失, 并在窦内皮细胞下形成基底膜. 250例慢性乙肝患者肝组织通过免疫组化发现VEGF表达阳性组多数集中在肝纤维化指数1分段, 而表达强阳性组则多数集中在肝纤维化指数2-4分段, 表明VEGF在肝组织内表达的强弱与肝纤维化程度有关. 我们的实验也发现一旦肝纤维化显著(24 wk), VEGF的表达率就明显上升, 和4 wk时相当, 并与上述研究一致. 而类似的报道也见于其他纤维化脏器中. Kang et al[6]发现在进行性肾衰大鼠中加入VEGF可促进肾小球内皮细胞和肾小管周毛细血管内皮细胞的增生. 而在博莱霉素所致的大鼠肺纤维化中, 用免疫组化证实VEGF及其受体的表达增加[7]. 同样, 有慢性肾移植排斥反应的患者存在间质纤维化和血管病变, 实验证实VEGF存在于巨噬细胞中, 在间质其蛋白水平显著上升, 提示VEGF的上调对纤维化和炎症起重要作用[8]. 肝纤维化时肝内血流减少, 氧分压降低, 其他因子如TGF-β等强力上调VEGF的表达, VEGF从而诱导肝窦内皮细胞、肝细胞、血管内皮细胞有丝分裂, 有利于肝纤维化.
总之, 我们的实验进一步证实了VEGF可能在酒精性肝病中起重要作用, 主要与酒精性肝炎及酒精性肝纤维化有关, 但对于VEGF的来源、确切的作用机制以及一些细胞因子对其调节作用等尚需进一步阐述, 而这些更深入的研究将有助于更好的防治酒精性肝病.
在西方国家, 酒精性肝病是其肝病的主要类型之一. 在我国, 随着生活水平的提高, 临床发现酒精性肝病的发病率呈上升趋势, 浙江省酒精性肝病流行病学调查的人群中酒精性肝病患病率达4.34%.
尽管酒精性肝病病因单一, 但其发病机制复杂, 尚未完全明了. 血管内皮生长因子(VEGF)是内皮细胞的一种特异性丝裂原, 具有选择性诱导内皮细胞增殖、血管生成的作用, 其与各种肝病的关系也越来越受到关注.
本实验通过对酒精性肝纤维化小鼠模型的病理观察及对VEGF表达变化研究, 证实VEGF在酒精性肝病中起重要作用, 主要与酒精性肝炎及酒精性肝纤维化有关.
本实验进一步证实了VEGF可能在酒精性肝病中起重要作用, 主要与酒精性肝炎及酒精性肝纤维化有关, 为进一步提高对酒精性肝病的基础研究和防治措施提供线索.
本文研究提示VEGF可能在酒精性肝病中起重要作用, 可能与酒精性肝炎及酒精性肝纤维化有关. 论文书写规范, 表述准确, 行文流畅, 论证层次分明, 理论依据充分. 不足之处是设计内容较少, 研究方法单一.
电编: 张敏 编辑:张海宁
| 2. | Senger DR, Galli SJ, Dvorak AM, Perruzzi CA, Harvey VS, Dvorak HF. Tumor cells secrete a vascular permeability factor that promotes accumu-lation of ascites fluid. Science. 1983;219:983-985. [PubMed] [DOI] |
| 3. | Akiyoshi F, Sata M, Suzuki H, Uchimura Y, Mitsu-yama K, Matsuo K, Tanikawa K. Serum vascular endothelial growth factor levels in various liver diseases. Dig Dis Sci. 1998;43:41-45. [PubMed] [DOI] |
| 4. | Ishikawa K, Mochida S, Mashiba S, Inao M, Matsui A, Ikeda H, Ohno A, Shibuya M, Fujiwara K. Expressions of vascular endothelial growth factor in nonparenchymal as well as parenchymal cells in rat liver after necrosis. Biochem Biophys Res Commun. 1999;254:587-593. [PubMed] [DOI] |
| 6. | Kang DH, Hughes J, Mazzali M, Schreiner GF, Johnson RJ. Impaired angiogenesis in the remnant kidney model: II. Vascular endothelial growth factor administration reduces renal fibrosis and stabilizes renal function. J Am Soc Nephrol. 2001;12:1448-1457. [PubMed] |
| 7. | Fehrenbach H, Haase M, Kasper M, Koslowski R, Schuh D, Muller M. Alterations in the immuno-histochemical distribution patterns of vascular endothelial growth factor receptors Flk1 and Flt1 in bleomycin-induced rat lung fibrosis. Virchows Arch. 1999;435:20-31. [PubMed] [DOI] |
| 8. | Pilmore HL, Eris JM, Painter DM, Bishop GA, McCaughan GW. Vascular endothelial growth factor expression in human chronic renal allograft rejection. Transplantation. 1999;67:929-933. [PubMed] [DOI] |