修回日期: 2006-04-25
接受日期: 2006-05-08
在线出版日期: 2006-06-18
目的: 研究慢病毒介导的KDR启动子驱动CD/TK双自杀基因系统对大肠肿瘤细胞选择性杀伤作用.
方法: 构建的重组质粒pLenti6/V5-D-KDR-CDglyTK及阳性对照质粒pLenti6/V5-D-GFP在lipofectamine 2000介导下转染293FT细胞, 包装扩增后获得病毒颗粒, 体外感染表达KDR的SW620细胞株和不表达KDR的LS174T细胞株, 荧光显微镜下计数确定阳性对照质粒的感染效率并以RT-PCR方法检测转基因细胞CDglyTK的表达, 然后给予不同浓度的前药5-FC及GCV处理, 观察该体系对不同细胞株的杀伤效应及其旁观者效应.
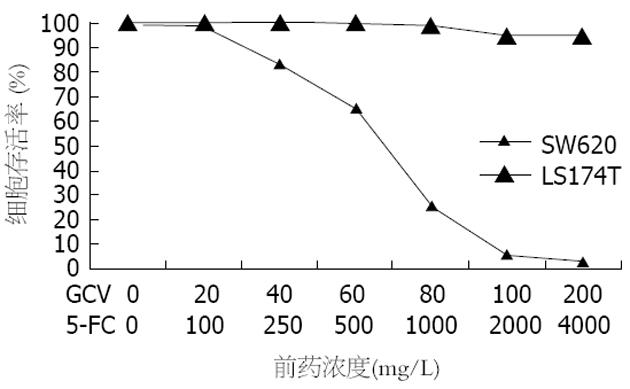
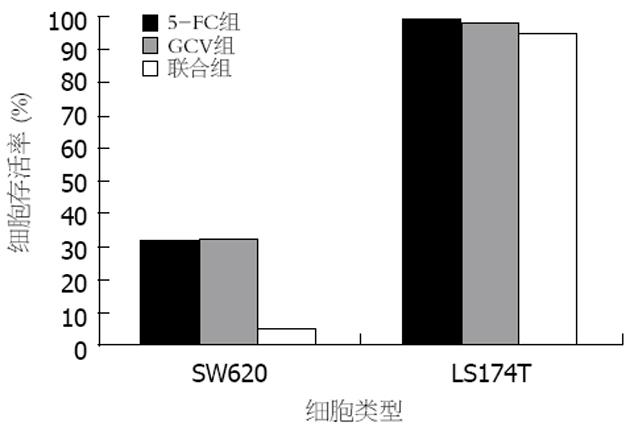
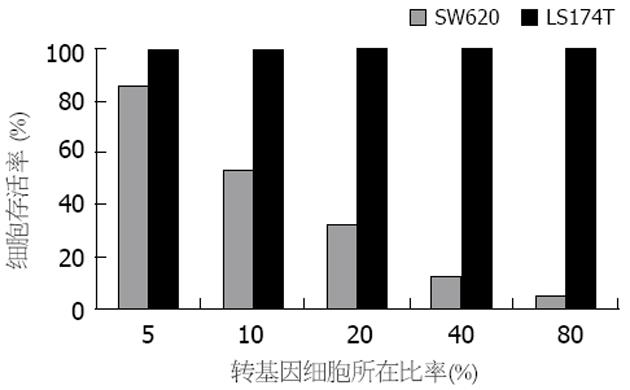
结果: 重组体对各细胞株的感染率相似, 其感染率随慢病毒滴度的增高而递增. RT-PCR方法检测发现: 除LS174T细胞外, SW620细胞有目的基因CDglyTK的表达. 对于转基因的SW620细胞, 单用GCV(100 mg/L)时, 其存活率为32.34%±2.42%. 单用5-FC(2.0 g/L)时, 存活率为30.56%±2.14%. 而联合应用两者时, SW620细胞存活率为5.36%±1.55%, LS174T细胞存活率为95.48%±1.70%. SW620细胞对前药具有较高的敏感性, SW620与LS174T细胞株对前药敏感性有显著性差异(P<0.001), 双自杀基因的疗效优于任一单自杀基因的疗效(P<0.001). 当转基因细胞比率为40%时, 加入前药GCV和5-FC, SW620细胞存活率为11.42%±2.66%, 而LS174T细胞存活率为99.54%±2.61%, 二者比较差异有显著性意义(P<0.001), 该体系旁观者效应明显.
结论: 慢病毒作为载体有较高的转染效率, KDR基因启动子可调控双自杀基因系统选择性杀伤表达KDR的大肠肿瘤细胞.
引文著录: 陈海金, 黄宗海, 苏国强, 吴爱国, 俞金龙. 慢病毒介导的双自杀基因对大肠癌细胞的靶向杀伤作用. 世界华人消化杂志 2006; 14(17): 1681-1687
Revised: April 25, 2006
Accepted: May 8, 2006
Published online: June 18, 2006
AIM: To investigate the killing effect of lentivirus-mediated double suicide genes under the regulation of kinase domain-containing receptor (KDR) promoter targeted on colorectal carcinoma cells.
METHODS: 293FT packaging cells were transfected by the constructed plasmids pLenti6/V5-D-KDR-CDglyTK and pLenti6/V5-D-GFP. After blasticidin selection and cell cloning, the infectious viruses were generated. Then SW620 (with KDR expression) and LS174T cells (without KDR expression) were transfected with the obtained viruses by lipofectamin 2000. The transfection efficacy was evaluated by the fluorecence microscopy. The expression of CDglyTK was detected by reverse transcription-polymerase chain reaction (RT-PCR). After treatment with 5-FC and GCV, the killing effects and bystander effect of CD/TK suicide genes on the two kinds of cell lines were assessed.
RESULTS: The transfection efficacy was not significantly different between SW620 and LS174T cells, and elevated with the increase of virus titer. RT-PCR demonstrated that CDglyTK was expressed only in SW620 cells infected by pLenti6/V5-D-KDR-CDglyTK but not in LS147T cells. For the transfected SW620 cells, the survival rate was 32.34% ± 2.42% or 30.56% ± 2.14% when GCV (100 mg/L) or 5-FC (2.0 g/L) was used alone, respectively, and it was 5.36% ± 1.55% when GCV and 5-FC were used in combination. For the transfected LS174T cells, the survival rate was 95.48% ± 1.70% when GCV and 5-FC were used in combination. SW620 cells had a higher sensitivity to the prodrugs than LS174T cells did (P < 0.001), and the effects of double suicide genes were markedly stranger than that of either single gene (P < 0.001). Considerable bystander effect was also observed. When the infected cells covered a percentage of 40%, the survival rate of SW620 cells was 11.42% ± 2.66%, while that of LS174T cells was 99.54% ± 2.61% after treatment with GCV and 5-FC. There was significant difference between the two kinds of cells (P < 0.001).
CONCLUSION: Lentivirus-mediated CD/TK suicide genes driven by KDR promoter have specific killing effect on colorectal carcinoma cells with KDR expression.
- Citation: Chen HJ, Huang ZH, Su GQ, Wu AG, Yu JL. Targeted killing effect of lentivirus-mediated CD/TK suicide genes on colorectal carcinoma cells. Shijie Huaren Xiaohua Zazhi 2006; 14(17): 1681-1687
- URL: https://www.wjgnet.com/1009-3079/full/v14/i17/1681.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i17.1681
自杀基因治疗是肿瘤基因治疗中一个重要的研究策略[1-3]. 但基因转移的低效率是这一疗法广泛开展的主要障碍. 实验研究中大多使用逆转录病毒载体和腺病毒载体进行基因转染治疗. 逆转录病毒载体虽可使目的基因整合至靶细胞基因组实现稳定表达, 但只能转导分裂期细胞, 不能转导非分裂期细胞. 腺病毒载体虽能转导分裂期细胞和静止期细胞, 转导效率也较高, 但目的基因不整合至靶细胞基因组, 仅能短暂表达, 而且腺病毒蛋白可引起人体免疫反应及炎症反应. 慢病毒载体可感染非分裂细胞, 目的基因整合至靶细胞基因组长期表达, 转染效率很高, 从而提供长期、稳定的目的基因表达, 并且生物安全性很高, 有望成为理想的基因转移载体[4]. 血管内皮细胞生长因子受体(kinase insert domain-containing receptor, KDR)既表达于肿瘤新生血管内皮细胞, 又表达于恶性程度高的肿瘤细胞. 这为以肿瘤细胞及滋养血管为治疗靶点的基因治疗提供了研究基础. 如果将KDR启动子引入该体系驱动基因治疗则既可避免该方案的副作用, 又可放大其治疗效应. 本研究即探讨慢病毒介导的以KDR为启动子的CD/TK双自杀基因系统对大肠肿瘤细胞的选择性杀伤效应, 为其进一步体内应用提供依据.
ViraPowerTM Bsd Lentiviral Support Kit, pLenti6/V5-Directional TOPO® Cloning Kit, 293FT Cell Line (Invitrogen). 质粒pLenti6/V5-D-GFP珠江医院普通外科构建. pMKD-K(大连宝生物公司). pcDNA3, JM109细菌(南方医科大学细胞生物教研室). 各种核酸内切酶, T4连接酶, Taq DNA聚合酶(New England Biolabs). 大肠癌SW620细胞引自美国ATCC全球生物资源中心, 大肠癌细胞株LS174T来源于中科院上海细胞库. DMEM, 小牛血清及Trizol Reagent试剂盒为Gibco公司产品. GCV为Roche Pharma (Switzerland)公司产品, 5-FC购自Sigma公司. KDR启动子, CD及TK基因引物合成以及DNA测序由上海申友生物技术有限公司完成.
1.2.1 PCR扩增KDR启动子序列: 根据GenBank X89776中KDR启动子序列设计引物(包括KDR启动子最小核心序列-226至+268), 另根据pLenti6/V5-D-TOPO质粒引物设计的要求,在KDR启动子起始密码子ATG前加上4个碱基CACC, 并在5'端和3'端分别加BglⅡ和HindⅢ酶切位点. 引物上游序列为: 5'-GGAAGATCTCACCATGAGTTGCTCAGCGCCCGTTAC-3', 下游序列为: 5'-CCCAAGCTTGGCGAAATGCCCAGAACTCG-3'. 抽提正常人外周血基因组DNA为模板, 以TacDNA聚合酶扩增出KDR启动子片段, PCR反应参数为: 94℃变性5 min后30个循环, 94℃ 30 s, 55℃ 30 s, 72℃ 59 s, 最后一循环再72℃ 10 min, 4℃ 2 h. 并将其与T载体连接, 构成pMD-18KDR质粒.
1.2.2 pcDNA3-CDglyTK的构建: 根据GenBank S56903中E.coli CD的序列, 设计CD引物, 以JM109细菌基因组为模板, 扩增CD片段, 使扩增出的CD基因起始密码子改为ATG, 终止密码子TGA改为编码甘氨酸的GGA, 并在5'端和3'端分别加以HindⅢ和BamHⅠ酶切位点. CD上下游引物分别为: 5'-GGGAAGCTTAGGCTAGCAATGTCGAATAACGCT-3'与5'-GGGGGATCCTCCACGTTTGTAATCGATGGCTTC-3'. 将GenBank V00470中TK序列与pREP8-TK中的HSV-TK序列核对无误, 以pREP8-TK为模板, 应用Oligo6.0软件设计引物, 使TK基因5'端加上8个编码甘氨酸的密码子和BamHⅠ酶切位点, 3'端加上XbaⅠ酶切位点, 此TK引物为: 5'-GGGGGATCCGGCGGGGGCGGTGGAGGAGGGGGTATGGCTTCGTAC-3'及5'-GGGTCTAGATTAGTTAGCCTCCCCCATCTC-3'. 将所扩增的CD及TK片段亚克隆入pcDNA3载体构建成质粒pcDNA3-CDglyTK.
1.2.3 pLenti6/V5-D-KDR-CDglyTK的构建: 自质粒pMD-18KDR中BglⅡ和HindⅢ双酶切出KDR片段, 经与相同酶切的pcDNA3-CDglyTK连接构成pcDNA3-KDR-CDglyTK, 转化DH5α感受态筛选鉴定正确后, 抽提质粒, 分别以BglⅡ, PvuⅡ单酶切取出3.3 kb的KDR-CDglyTK-PA片段, 将目的基因片段与pLenti6/V5-D-TOPO载体按照pLenti6/V5-D-TOPO克隆试剂盒的说明书要求,取2 μL PCR产物, 1 μL载体(尽量保证PCR产物与载体的摩尔比为0.5∶1-2∶1), 2 μL无菌水, 1 μL盐(1.2 mol/L NaCl+0.06 mol/L MgCl2), 共计6 μL, 混合并室温温育5 min, 使PCR产物和载体连接, 然后转化至Stb13TM感受态大肠杆菌, 将转化菌在含氨苄青霉素的LB培养皿中克隆后, 挑单菌落扩增, 取菌液行PCR鉴定.
1.2.4 重组慢病毒液的制备: 制备转染液(溶液A: 分别将含3 μg pLenti6/V5-D-KDR-CDglyTK和pLenti6/V5-D-GFP的重组体质粒和9 μg ViraPowerTM Packaging Mix溶于1.5 mL无血清的Opti-MEMI培养基中. 溶液B: 将LipofectamineTM 2000 36 μL稀释于1.5 mL无血清的Opti-MEMI培养基中). 混匀A、B溶液, 室温孵育20 min, 让DNA-脂质体复合物形成. 将DNA-脂质体复合物加入10 cm组织培养皿中(含5 mL Opti-MEMI生长培养基和血清). 将5 mL 293FT细胞悬液(共6×106个细胞)加入含Opti-MEMI培养基和DNA-脂质体复合物的培养皿内, 细胞置于CO2孵箱内, 37℃孵育过夜后用含1 mmol/L丙酮酸钠的DMEM完全培养基置换. 转染后48-72 h去除培养基, 将含病毒的上清液移入15 mL无菌锥形管中, 4℃ 3000 r/min离心15 min, 将悬液分装后, -80℃保存备用. SW620细胞经2.5 mL/L胰酶消化并计数, 将适量细胞平铺于6孔板, 24 h后细胞达30%-50%汇合, 加入不同稀释度(10-2到10-6)的病毒上清1 mL, 每孔内加入polybrene达到终浓度为6 μg/L. 转染后2 d加入2 mL RPMI 1640完全培养基. 24 h后换含适量杀稻瘟菌素(blasticidin)的选择培养液, 经10-12 d, 筛选获得的blasticidin抗性集落, 通过计数不同稀释度病毒上清液感染SW620细胞所产生的blasticidin抗性集落形成单位, 确定病毒滴度(1×105 TU/L). 采用PCR方法, 以病毒基因组DNA为模板, 应用CD基因的上游引物和TK基因的下游引物扩增CDglyTK融合基因. 以KDR启动子的上下游引物进行PCR反应, 鉴定KDR启动子.
1.2.5 重组慢病毒对SW620, LS174T的感染: SW620及LS174T以含100 mL/L胎牛血清的DMEM培养. 取对数生长期的上述细胞, 以2×105个细胞数接种于6孔培养板, 待细胞丰度达约90%, 加入不同感染复数(multiplicity of infection, MOI)的质粒为pLenti6/V5-D-GFP重组慢病毒, 加少许培养基振荡2-3 h后, 补足培养基继续在37℃, 50 mL/L CO2孵箱内培养, 12-14 h后在荧光显微镜下计数GFP阳性细胞百分比. 按照Trizol Reagent试剂盒说明提取转基因细胞总RNA, 逆转录合成cDNA, 利用CDglyTK的上下游引物进行PCR反应, 电泳鉴定其产物. 将SW620, LS174T以1×104个细胞/孔接种于96孔培养板中, 次日丰度达90%后用40 MOI的重组慢病毒感染之, 培养24 h后弃去培养液, 分别加入以50 mL/L血清培养基稀释的不同浓度的前药GCV和5-FC, 设GCV组、5-FC组、GCV+5-FC组、阴性对照及空白对照组, 加药72 h后, 以MTT法检测细胞生长抑制率. 分别取对数生长期的转基因和未转基因的细胞, 以不同比例进行混合, 以1×104个细胞/孔接种于96孔培养板中, 24-48 h后不同组别分别加入GCV和5-FC(GCV浓度为100 mg/L, 5-FC浓度为2.0 g/L). 72 h以后MTT法检测细胞存活率.
统计学处理 应用SPSS 10.0软件进行数据处理, 采用配对计量资料t检验及单向方差分析(组间多重比较应用LSD法).
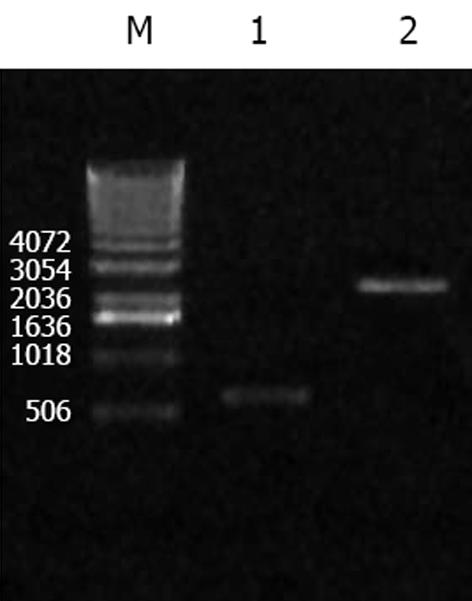
转染重组慢病毒质粒的293FT细胞, 培养10-12 d后收集细胞, PCR鉴定扩增出目的基因片段(图1). 重组慢病毒表达克隆的滴度为4.55×105 TU/L.
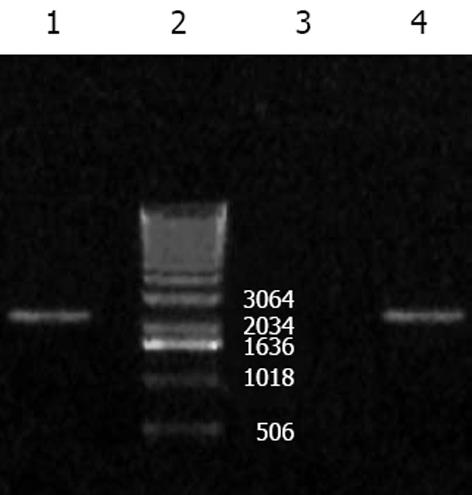
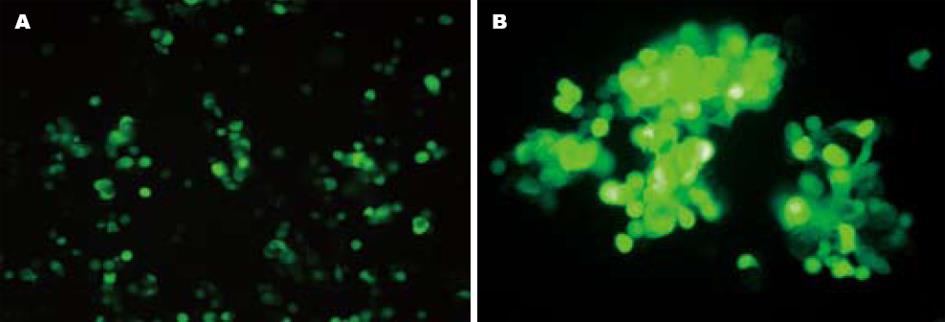
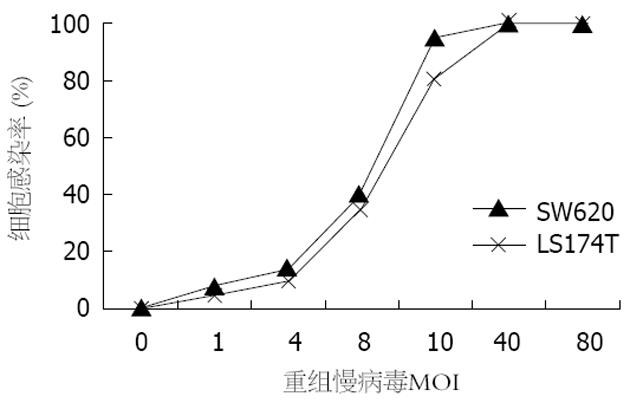
以质粒pLenti6/V5-D-GFP为对照质粒, 用LipofectamineTM 2000转染293FT细胞后获得病毒上清, 采用不同MOI的重组慢病毒分别感染SW620, LS174T细胞, 48 h后观察结果. 细胞的感染率随腺病毒滴度的增加而递增, 当MOI = 1时, 仅少数细胞有荧光. 当MOI = 10时, LS174T 80%表达, 余细胞均有95%以上的GFP表达. MOI = 40时, 几乎所有的细胞均被感染, 且各种细胞具有相似的感染效率(图3, 4). 通过RT-PCR检测发现, 除LS174T细胞外, 感染pLenti6/V5-D-KDR-CDglyTK的SW620细胞检测到目的基因的表达(图2).
对于转基因的SW620细胞, 单用GCV(100 mg/L)时, 其存活率为32.34%±2.42%. 单用5-FC(2.0 g/L)时, 存活率为30.56%±2.14%. 而联合应用两者时, SW620细胞存活率为5.36%±1.55%, LS174T细胞存活率仍有95.48%±1.70%. SW620细胞对前药具有较高的敏感性, SW620与LS174T细胞株对前药敏感性有显著性差异(P<0.001), 双自杀基因的疗效优于任一单自杀基因的疗效(P<0.001)(图5, 6).
当转基因细胞的比率为40%时, SW620细胞存活率为11.42%±2.66%, 而LS174T细胞存活率为99.54%±2.61%, 二者比较差异有显著性意义(P<0.001)(图7).
肿瘤的自杀基因治疗已成为其基因治疗中研究热点之一, 但目的基因的靶向性及基因转移的低效率是这一疗法广泛开展的主要障碍. 实验研究中大多使用逆转录病毒载体和腺病毒载体进行基因转染治疗, 与其他几种常用的病毒载体相比较, 逆转录病毒载体病毒滴度低, 只能感染分裂期细胞[5], 容纳外源基因的DNA片段长度不超过8 kb. 而腺病毒载体感染细胞时, 病毒DNA游离在细胞核内, 并不整合到染色体上, 在体内不能实现稳定的长期表达, 且反复应用容易引起免疫反应, 因而在应用上这两种病毒载体都受到一定的限制[6]. 慢病毒载体最大的特点是可以感染分裂期及非分裂期细胞, 容纳外源性目的基因的片段大, 可以在体内长期地表达, 免疫反应小, 安全性较好[7], 可在更多范围的宿主细胞内生成高滴度的病毒. 己成为当前基因治疗中载体研究的热点. 人们已成功地应用慢病毒载体转染了肝细胞[8-13], 造血干细胞[14-16], 中央神经系统[17-20]以及慢病毒介导的转基因动物[21-24].
Gusella et al[25]己经成功将携带标记基因的慢病毒载体转导到BALB/C小鼠肾脏细胞. Follenzi et al[26]应用改良的慢病毒载体可有效地转导大鼠肝脏实质及非实质细胞、脾脏和骨髓细胞, 并可稳定表达标记基因. 同时, 如能使自杀基因选择性地作用于目的肿瘤细胞而不在正常细胞中表达, 将能使该治疗策略更加完善. 既往研究利用肿瘤特异性基因调控元件调控自杀基因表达, 如以erbB-2, α-人乳白蛋白(hALA)启动子驱动自杀基因进行乳腺癌基因治疗, 甲胎蛋白(AFP)基因启动子用于肝癌自杀基因疗法, 癌胚抗原(CEA)基因启动子用于肠道肿瘤自杀基因疗法等. 上述治疗方案中, 每一特异启动子仅能进行针对某一类型肿瘤的靶向肿瘤细胞的基因治疗, 而绝大多数恶性实体瘤的生物学特性为生长迅速, 致使其滋养血管不能及时供应所有肿瘤细胞, 该特点使前体药物难以接近所有肿瘤细胞. 选择一合适启动子既靶向肿瘤血管内皮细胞, 又靶向肿瘤细胞, 如此既可杀伤肿瘤细胞, 又可靶向破坏肿瘤滋养血管使得其灌流区大量肿瘤细胞缺血性坏死, 这样即高效放大了自杀基因的疗效. 大量研究证明, KDR在正常人体组织中呈低水平表达, 而在绝大多数肿瘤中呈现高表达, 且KDR不仅表达于血管内皮细胞, 还表达于肿瘤细胞, 其表达水平与血管内皮细胞更新速度及肿瘤恶性程度呈正相关[27-28]. 故认为除旁分泌外, 还存在自分泌途径. 他不仅促进血管内皮细胞分裂、增殖, 且诱导肿瘤血管增生, 并促使其肿瘤细胞生长转移. 在肿瘤组织内KDR表达明显高于正常内皮细胞, 血管的发生对于肿瘤的生长和转移起着关键的作用. 因此, 将KDR作为靶点, 可为治疗和诊断肿瘤提供新的理论依据. Harada et al[29]报道KDR在胃癌、结肠、直肠、卵巢、乳腺癌[30]等多数肿瘤组织中的表达明显增高, 并与其生物学行为相关, 并伴随肿瘤分级的上升而表达增强.
我们发现, 具有较高转移潜能的大肠癌细胞株SW620高表达KDR; 而低转移潜能的大肠癌细胞株LS174T不表达KDR. 为研究KDR启动子驱动的自杀基因体系特异性的杀伤作用, 我们将目的慢病毒感染肿瘤细胞株SW620和不表达KDR的LS174T, 并分别给以不同浓度的前药5-FC和GCV, 结果发现感染重组慢病毒的细胞株SW620随前药浓度的增加其生存率递减, 而不表达KDR的LS174T细胞生存率则几乎不受影响. 这充分表明KDR基因启动子调控的自杀基因体系的细胞特异性. 自杀基因的治疗体系也存在不足, 如单自杀基因存在细胞及组织特异性和治疗的耐药性. 但该治疗体系却具有巨大的应用潜力, 因为自杀基因的旁观者效应与基因联合治疗的优势放大了自杀基因治疗的效果, 并克服了单自杀基因治疗的不足. 本研究发现, 相同浓度的两种前药优于任一单药的疗效, 大肠肿瘤细胞株SW620可见巨大的旁观者效应.
总之, 慢病毒介导的双自杀基因治疗体系转染效率较高, 对肿瘤细胞具有较为满意的杀伤作用, KDR启动子的引入优化了该体系的疗效, 使其选择性的作用于目的肿瘤细胞, 而对正常组织无毒副作用, 为该体系进一步研究及临床应用奠定了基础.
理想的病毒载体能同时提供高效的基因转移, 长期稳定的基因表达及生物安全性. 近来, 一些研究者把目光投向了以Ⅰ型人类免疫缺损病毒(HIV-1)为代表的慢病毒. 研究表明, 以HIV-1为基础构建的这类慢病毒载体具有可感染非分裂细胞, 目的基因整合至靶细胞基因组长期表达, 免疫反应小等优点, 适于体内基因治疗, 因此有望成为理想的基因转移载体. 自Folkman提出肿瘤的生长具有血管形成依赖以来, 对实体瘤的血管形成及其相关微循环的研究及抗肿瘤血管生成已成为当今肿瘤研究的热点之一, 以肿瘤血管为靶点, 采用各种途径抑制肿瘤血管的形成, 切断肿瘤的供养, 即能有效抑制肿瘤生长和转移, 因此, 以KDR启动子, 慢病毒介导的双自杀基因疗法可能为基因治疗大肠肿瘤提供一个新的思路.
目前己证实, KDR在肿瘤血管及肿瘤组织细胞中均高表达, 且正常组织表达甚微或不表达. 基于此, 构建以KDR为启动子调控的CD-TK双自杀基因重组慢病毒载体, 一方面通过KDR为启动子介导双自杀基因选择性杀伤肿瘤细胞及肿瘤血管内皮细胞, 并减少内皮细胞表达KDR. 另一方面通过选择性杀伤肿瘤细胞, 抑制肿瘤细胞分裂增殖, 减少VEGF的分泌. 通过二者的协同作用达到抑制肿瘤原发灶生长, 阻断VEGF和KDR的结合, 抑制由VEGF引起的KDR的磷酸化及其后的信号传导通路, 从而抑制肿瘤血管生成, 削减肿瘤发生远处转移.
本实验将目的慢病毒感染表达KDR的肿瘤细胞株SW620和不表达KDR的LS174T, 并分别给以不同浓度的前药5-FC和GCV, 结果发现感染重组慢病毒的细胞株SW620随前药浓度的增加其生存率递减, 而LS174T细胞生存率则几乎不受影响. 这充分表明KDR基因启动子调控的自杀基因体系的细胞特异性.
在对慢病毒载体不断改进的研究前提下, 提高慢病毒的生物安全性, 慢病毒载体高效长期表达目的自杀基因, 不失为肿瘤自杀基因治疗提供一个新途径.
自杀基因: 又称化疗敏感基因, 化疗药物前体活化基因, 是存在于细菌或真菌中的一类基因, 哺乳动物体内往往缺乏. 自杀基因通过编码特异的酶, 将一些低毒或无毒的前体化疗药物转化为具有毒性的代谢产物而发挥抗肿瘤作用.
本研究构建以KDR为启动子的CD/TK双自杀基因系统的慢病毒颗粒, 研究其介导的对大肠肿瘤细胞的选择性杀伤效应, 具有一定新颖性.
电编: 张敏 编辑:潘伯荣
| 1. | DeFatta RJ, Li Y, De Benedetti A. Selective killing of cancer cells based on translational control of a suicide gene. Cancer Gene Ther. 2002;9:573-578. [PubMed] [DOI] |
| 2. | Binley K, Askham Z, Martin L, Spearman H, Day D, Kingsman S, Naylor S. Hypoxia-mediated tumour targeting. Gene Ther. 2003;10:540-549. [PubMed] [DOI] |
| 3. | Gilles SI, Romain S, Casellas P, Ouafik L, Fina F, Combes T, Vuaroquaux V, Seitz JF, Bonnier P, Galiegue S. Mutation analysis in the coding sequence of thymidine kinase 1 in breast and colorectal cancer. Int J Biol Markers. 2003;18:1-6. [PubMed] |
| 5. | Brummelkamp TR, Bernards R, Agami R. Stable suppression of tumorigenicity by virus-mediated RNA interference. Cancer Cell. 2002;2:243-247. [PubMed] [DOI] |
| 6. | 李 振宇, 徐 开林, 潘 秀英. 慢病毒载体构建及结构优化. 国外医学(分子生物学分册). 2002;24:310-313. |
| 7. | Rubinson DA, Dillon CP, Kwiatkowski AV, Sievers C, Yang L, Kopinja J, Rooney DL, Ihrig MM, McManus MT, Gertler FB. A lentivirus-based system to functionally silence genes in primary mammalian cells, stem cells and transgenic mice by RNA interference. Nat Genet. 2003;33:401-406. [PubMed] [DOI] |
| 8. | Follenzi A, Battaglia M, Lombardo A, Annoni A, Roncarolo MG, Naldini L. Targeting lentiviral vector expression to hepatocytes limits transgene-specific immune response and establishes long-term expression of human antihemophilic factor IX in mice. Blood. 2004;103:3700-3709. [PubMed] [DOI] |
| 9. | Nguyen TH, Oberholzer J, Birraux J, Majno P, Morel P, Trono D. Highly efficient lentiviral vector-mediated transduction of nondividing, fully reimplantable primary hepatocytes. Mol Ther. 2002;6:199-209. [PubMed] [DOI] |
| 10. | Kang Y, Stein CS, Heth JA, Sinn PL, Penisten AK, Staber PD, Ratliff KL, Shen H, Barker CK, Martins I. In vivo gene transfer using a nonprimate lentiviral vector pseudotyped with Ross River Virus glycoproteins. J Virol. 2002;76:9378-9388. [PubMed] [DOI] |
| 11. | VandenDriessche T, Thorrez L, Naldini L, Follenzi A, Moons L, Berneman Z, Collen D, Chuah MK. Lentiviral vectors containing the human immunodeficiency virus type-1 central polypurine tract can efficiently transduce nondividing hepato-cytes and antigen-presenting cells in vivo. Blood. 2002;100:813-822. [PubMed] [DOI] |
| 12. | Park F, Ohashi K, Kay MA. The effect of age on hepatic gene transfer with self-inactivating lentiviral vectors in vivo. Mol Ther. 2003;8:314-323. [PubMed] [DOI] |
| 13. | Ohashi K, Park F, Kay MA. Role of hepatocyte direct hyperplasia in lentivirus-mediated liver transduction in vivo. Hum Gene Ther. 2002;13:653-663. [PubMed] [DOI] |
| 14. | Moreau-Gaudry F, Xia P, Jiang G, Perelman NP, Bauer G, Ellis J, Surinya KH, Mavilio F, Shen CK, Malik P. High-level erythroid-specific gene expression in primary human and murine hematopoietic cells with self-inactivating lentiviral vectors. Blood. 2001;98:2664-2672. [PubMed] [DOI] |
| 15. | Hanazono Y, Terao K, Ozawa K. Gene transfer into nonhuman primate hematopoietic stem cells: implications for gene therapy. Stem Cells. 2001;19:12-23. [PubMed] [DOI] |
| 16. | Horn PA, Morris JC, Bukovsky AA, Andrews RG, Naldini L, Kurre P, Kiem HP. Lentivirus-mediated gene transfer into hematopoietic repopulating cells in baboons. Gene Ther. 2002;9:1464-1471. [PubMed] [DOI] |
| 17. | Azzouz M, Ralph GS, Storkebaum E, Walmsley LE, Mitrophanous KA, Kingsman SM, Carmeliet P, Mazarakis ND. VEGF delivery with retrogradely transported lentivector prolongs survival in a mouse ALS model. Nature. 2004;429:413-417. [PubMed] [DOI] |
| 18. | Lo Bianco C, Ridet JL, Schneider BL, Deglon N, Aebischer P. alpha -Synucleinopathy and selective dopaminergic neuron loss in a rat lentiviral-based model of Parkinson's disease. Proc Natl Acad Sci USA. 2002;99:10813-10818. [PubMed] [DOI] |
| 19. | Regulier E, Trottier Y, Perrin V, Aebischer P, Deglon N. Early and reversible neuropathology induced by tetracycline-regulated lentiviral overexpression of mutant huntingtin in rat striatum. Hum Mol Genet. 2003;12:2827-2836. [PubMed] [DOI] |
| 20. | de Almeida LP, Ross CA, Zala D, Aebischer P, Deglon N. Lentiviral-mediated delivery of mutant huntingtin in the striatum of rats induces a selective neuropathology modulated by polyglutamine repeat size, huntingtin expression levels, and protein length. J Neurosci. 2002;22:3473-3483. [PubMed] |
| 21. | Lois C, Hong EJ, Pease S, Brown EJ, Baltimore D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 2002;295:868-872. [PubMed] [DOI] |
| 22. | Pfeifer A, Ikawa M, Dayn Y, Verma IM. Transge-nesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplan-tation embryos. Proc Natl Acad Sci USA. 2002;99:2140-2145. [PubMed] [DOI] |
| 23. | Hofmann A, Kessler B, Ewerling S, Weppert M, Vogg B, Ludwig H, Stojkovic M, Boelhauve M, Brem G, Wolf E. Efficient transgenesis in farm animals by lentiviral vectors. EMBO Rep. 2003;4:1054-1060. [PubMed] [DOI] |
| 24. | Hofmann A, Zakhartchenko V, Weppert M, Sebald H, Wenigerkind H, Brem G, Wolf E, Pfeifer A. Generation of transgenic cattle by lentiviral gene transfer into oocytes. Biol Reprod. 2004;71:405-409. [PubMed] [DOI] |
| 25. | Gusella GL, Fedorova E, Hanss B, Marras D, Klotman ME, Klotman PE. Lentiviral gene transduc-tion of kidney. Hum Gene Ther. 2002;13:407-414. [PubMed] [DOI] |
| 26. | Follenzi A, Sabatino G, Lombardo A, Boccaccio C, Naldini L. Efficient gene delivery and targeted expression to hepatocytes in vivo by improved lentiviral vectors. Hum Gene Ther. 2002;13:243-260. [PubMed] [DOI] |
| 27. | Beierle EA, Dai W, Langham MR Jr, Copeland EM 3rd, Chen MK. Expression of VEGF receptors in cocultured neuroblastoma cells. J Surg Res. 2004;119:56-65. [PubMed] [DOI] |
| 28. | Qi L, Robinson WA, Brady BM, Glode LM. Migra-tion and invasion of human prostate cancer cells is related to expression of VEGF and its receptors. Anticancer Res. 2003;23:3917-3922. [PubMed] |
| 29. | Harada Y, Ogata Y, Shirouzu K. Expression of vascular endothelial growth factor and its receptor KDR (kinase domain-containing receptor)/Flk-1 (fetal liver kinase-1) as prognostic factors in human colorectal cancer. Int J Clin Oncol. 2001;6:221-228. [PubMed] [DOI] |
| 30. | Ryden L, Linderholm B, Nielsen NH, Emdin S, Jonsson PE, Landberg G. Tumor specific VEGF-A and VEGFR2/KDR protein are co-expressed in breast cancer. Breast Cancer Res Treat. 2003;82:147-154. [PubMed] [DOI] |