修回日期: 2006-04-20
接受日期: 2006-05-08
在线出版日期: 2006-06-18
目的: 制备聚乳酸-O-羧甲基壳聚糖纳米粒子并探讨其对培养猪肝细胞形态和功能的影响.
方法: 以聚乳酸和O-羧甲基壳聚糖为基质材料, 采用超声波法制备了聚乳酸-O-羧甲基壳聚糖纳米粒子, 用原子力显微镜对其进行了物理表征, 用X射线光电子光谱法对其表面的化学结构进行了表征. 用聚乳酸-O-羧甲基壳聚糖纳米粒子进行原代猪肝细胞培养, 并以普通培养作为对照组. 观察培养后1 wk内肝细胞的形态和功能变化.
结果: 聚乳酸-O-羧甲基壳聚糖纳米粒子制备成功, 原子力显微镜下其直径300-500 nm. 经过XPS光谱分析显示, C, O, N的比例分别为72.51%, 23.69%, 3.80%. 普通培养的肝细胞, 48 h后逐渐失去多边形特征. 而与PLA-O-CMC共培养48 h后, 肝细胞形成细胞黏附聚集的球形体, 大部分肝细胞重建细胞极性, 呈现较典型、均匀的多边形形态特征. 培养后24 h, 3 d和5 d时, 纳米细胞培养组ALB含量高于普通培养组(3.53±0.052, 3.48±0.075, 3.57±0.137 g/L vs 3.10±0.179, 3.17±0.186, 3.10±0.219 g/L, 均P<0.05); 3, 5, 7 d时, 纳米细胞培养组ALT水平明显低于普通组(15.33±13.05, 8.84±8.87, 7.00±5.22 nkat/L vs 24.17±20.35, 16.17±27.49, 15.50±11.95 nkat/L, 均P<0.05), 而BUN含量虽然有所升高, 但是不显著(P>0.05).
结论: 聚乳酸-O-羧甲基壳聚糖纳米粒子是肝细胞培养的良好材料.
引文著录: 陈钟, 戴新征, 杨欣荣, 祝文彩. 聚乳酸-O-羧甲基壳聚糖纳米粒子的制备及其对培养猪肝细胞的影响. 世界华人消化杂志 2006; 14(17): 1669-1674
Revised: April 20, 2006
Accepted: May 8, 2006
Published online: June 18, 2006
AIM: To prepare polylactic acid-O-carboxyme-thylated chitosan (PLA-O-CMC) nanoparticles and evaluate their influences on the morphology and functions of cultured porcine hepatocytes.
METHODS: PLA-O-CMC nanoparticles were prepared from PLA and O-CMC by ultrasonic method. The nanoparticles were characterized by atomic force microscopy and X-ray photoelectron spectrometry. Isolated porcine hepatocytes were divided into two groups: commonly culturing group and nanomaterial group (co-culturing hepatocytes with PLA-O-CMC nanoparticles). The morphology and functions of the cultured hepatocytes were observed within 1 wk.
RESULTS: PLA-O-CMC nanoparticles were successfully prepared, and the diameter was 300-500 nm under atomic force microscope. X-ray photoelectron spectrometry showed that the proportions of C, O, and N element were 72.51%, 23.69%, and 3.80%, respectively. The hepatocytes lost their features of polygons after common culture for 48 h. However, after co-culture with PLA-O-CMC nanoparticles, the hepatocytes clustered into conglobulations, and most of them restored their cell polarities, shaping as typical polygons. After culture for 1, 3, and 5 d, the content of albumin (ALB) was significantly higher in nanomaterial group than that in commonly culturing group (3.53 ± 0.052, 3.48 ± 0.075, 3.57 ± 0.137 g/L vs 3.10 ± 0.179, 3.17 ± 0.186, 3.10 ± 0.219 g/L, all P < 0.05), while on day 3, 5 and 7, the level of alanine aminotransferase (ALT) was markedly lower (15.33 ± 13.05, 8.84 ± 8.87, 7.00 ± 5.22 nkat/L vs 24.17 ± 20.35, 16.17 ± 27.49, 15.50 ± 11.95 nkat/L, all P < 0.05). From day 3 to 7, the content of supernant blood urea nitrogen (BUN) was higher in nanomaterial group than that in commonly culturing group, but there was no significant difference (P > 0.05).
CONCLUSION: PLA-O-CMC nanoparticles are successfully prepared, and can be used in the culture of hepatocytes.
- Citation: Chen Z, Dai XZ, Yang XR, Zhu WC. Preparation of polylactic acid-O-carboxymethylated chitosan nanoparticles and their influences on the cultured porcine hepatocytes. Shijie Huaren Xiaohua Zazhi 2006; 14(17): 1669-1674
- URL: https://www.wjgnet.com/1009-3079/full/v14/i17/1669.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i17.1669
急性肝衰竭(acute liver failure, ALF)是各种肝脏疾病特别是病毒性肝炎的主要死因之一. 肝细胞移植可以起到一定的肝功能支持作用. 由于其具有操作简单、对机体生理环境干扰小、供体来源广泛等优点, 已引起了众多研究者的广泛关注[1-3]. 然而, 如何提高移植肝细胞的活性和降低免疫排斥反应是急需解决的两大问题. 纳米材料因其结构特点, 可促进肝细胞的生长[4-6]. 为此, 我们制备了聚乳酸-O-羧甲基壳聚糖(polylatic acid-O-carboxymethylated chitosan, PLA-O-CMC)纳米粒子并应用该材料对猪肝细胞进行了体外培养, 观察培养后肝细胞的形态和功能.
中国实验用小型猪, 雌雄不限, 体质量2-4 kg, 由南通大学动物实验中心提供. 聚乳酸(polylatic acid, PLA)、新生牛血清购自美国Sigma公司. O-羧甲基壳聚糖(O-carboxymethy-lated chitosan, O-CMC)自制. RPMI 1640培养基、胶原酶Ⅳ、表皮细胞生长因子、肝细胞生长因子购自Gibco公司. 24孔细胞培养板购自晶美生物工程有限公司. 其他试剂为国产分析纯. JY92-2D型超声均质仪购自宁波新芝生物科技股份有限公司. 恒温水浴箱购自上海医疗器械厂. Avanti J-25型高速离心机、低温超速离心机购自美国Beckman Coulter公司产品. 超净工作台购自苏州净化设备厂. 全自动生化分析仪(Vitros 250)购自美国强生公司. CO2培养箱购自美国Shellab公司. 倒置显微镜购自日本Olympus公司. 真空冷冻浓缩仪购自丹麦Heto公司. CSPM3000原子力显微镜为中科院本原纳米仪器有限公司产品.
1.2.1 PLA-O-CMC纳米粒子的制备: 将10 mL浓度为0.3 g/L PLA二氯甲烷溶液10 mL和1.5 g/L O-CMC溶液10 mL在超声情况下充分反应25 min, 待其中的有机溶剂挥发完全后得到乳光较重的均匀悬浊液. 将此悬浊液先以2000 r/min低速离心5 min, 取上清液以14 000 r/min高速离心10 min, 得到部分白色沉淀, 吸去部分上清液, 将沉淀冷冻抽干取出并置于紫外灯下照射12 h, 消毒后备用.
1.2.2 猪肝细胞的分离和培养: 采用原位胶原酶循环肝灌注法分离猪肝细胞[7-10]. 将分离所得肝细胞分为两组进行培养: (1)普通培养组将肝细胞以5×108个/L的密度接种到培养板上(1 mL/孔), 置于37℃, 50 mL/L CO2条件下静置培养12 h内, 每30 min摇动1次, 每次持续5 min, 以利于细胞集聚形成球形体. (2)纳米材料培养组: 将肝细胞以5×108个/L与40 mg/L的PLA-O-CMC纳米粒子相混合接种到培养板上(1 mL/孔), 置于37℃, 50 mL/L CO2条件下静置培养12 h内每30 min震动1次, 每次持续5 min, 以促进纳米材料与肝细胞的结合, 且有利于细胞集聚形成球形体. 冻干后得到的PLA-O-CMC纳米粒子以PBS缓冲液溶解, 将其置于原子力显微镜下观察其表面形态, X线光电子光谱法(X-ray photoelectron spectrometry, XPS)光谱分析PLA-O-CMC聚合物中C, O, N, S成分.
1.2.3 培养肝细胞形态观察和功能检测: 分别取第0.5, 1, 3, 5, 7天的肝细胞培养上清液测定白蛋白(ALB)、谷丙转氨酶(ALT)、尿素氮(BUN), 倒置显微镜观察肝细胞形态, 扫描电镜观察培养在PLA-O-CMC纳米粒子上的肝细胞形态.
统计学处理 数据以mean±SD表示. 用State 7.0软件行方差分析和配对Student t检验. P<0.05为差异有显著性.
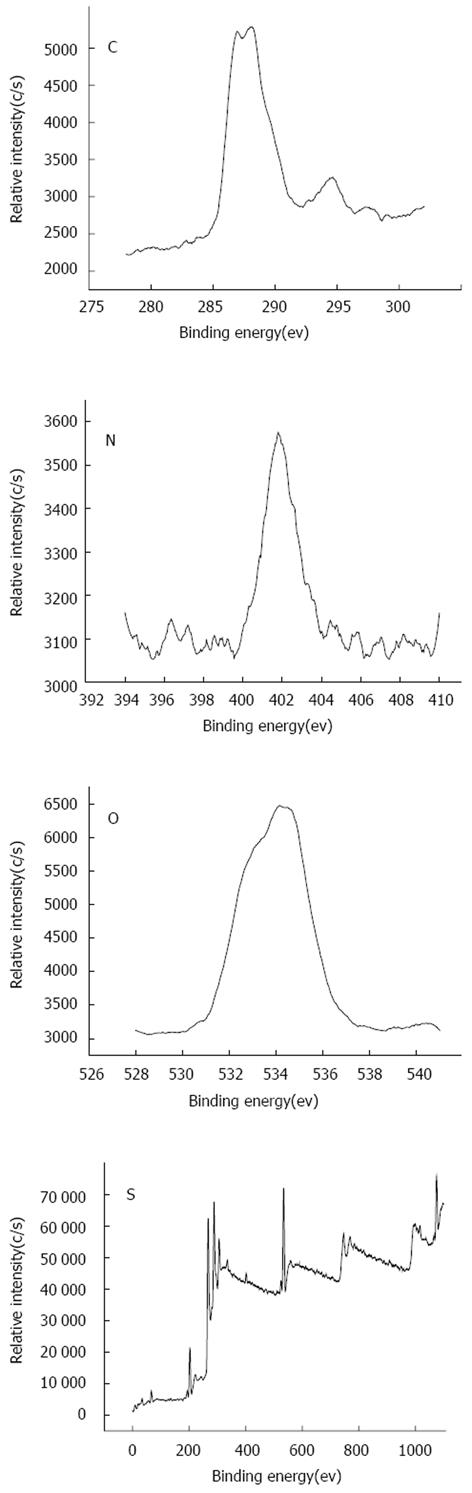
冻干后得到的PLA-O-CMC纳米粒子以PBS缓冲液溶解, 将其置于原子力显微镜下观察, 显示其直径300-500 nm(图1). 经过XPS光谱分析PLA-O-CMC聚合物中C, O, N的比例分别为72.51%, 23.69%, 3.80%, 符合PLA和O-CMC两者聚合后的平均数, 表明新得到的聚合物为PLA-O-CMC.
PLA-O-CMC微球聚合物中C, N, O, S 4种元素的结合能, 见图2. 图中显示, 氮元素的含量约为3.80%. 由于氮元素只存在于O-CMC中, 因此该图谱表明O-CMC位于PLA-O-CMC微球的表面. 这将对微球利用O-CMC带正电的胺基通过静电作用吸附带负电的寡核苷酸非常有利. 这更加有利于细胞在其表面的黏附, 更加有利于细胞的聚集和成团, 为细胞的生长提供了良好的生物支架.
分离的肝细胞呈单个球形状态悬浮于培养基中, 用苔盼蓝拒染法检测细胞活率为95%-98%. 普通培养的肝细胞, 接种后很快沉于培养板底并贴壁生长, 其形态立即由刚分离的圆球形向单层扁平多边形伸展, 48-72 h后细胞进一步变薄, 逐渐失去多边形特征, 肝细胞连接成片生长. 将分离的肝细胞与PLA-O-CMC纳米粒子混合培养, 间歇振荡12 h 后, 细胞黏附在纳米材料上. 培养48 h后, 形成细胞黏附聚集的球形体, 提高了细胞密度. 培养24 h, 大部分肝细胞仍保持圆球状, 部分肝细胞向多边形转变, 多数肝细胞相互黏连, 成束状生长. 约培养48 h后, 大部分肝细胞重建细胞极性, 呈现较典型、均匀的多边形形态特征. 以扫描电镜对PLA-O-CMC纳米材料肝细胞的混合培养物进行了观察, 显示肝细胞成团聚集于PLA-O-CMC纳米材料表面, 生长良好(图3).
2.3.1 两组肝细胞培养上清中白蛋白(ALB)含量比较: 经统计学处理, 培养后24 h、第3天和第5天, 纳米细胞培养组ALB含量高于普通培养组(P<0.05). 培养24 h后, 普通培养组ALB低于培养后12 h值(P<0.05); 纳米培养组ALB高于培养后12 h值, 培养7 d后下降(表1).
| ALB(g/L) | 12 h | 24 h | 3 d | 5 d | 7 d |
| 普通培养组(n = 6) | 3.37±0.121 | 3.10±0.179 | 3.17±0.186 | 3.10±0.219 | 3.13±0.103 |
| 纳米材料培养组(n = 6) | 3.33±0.082 | 3.53±0.052 | 3.48±0.075 | 3.57±0.137 | 3.23±0.137 |
| P值 | >0.05 | <0.05 | <0.05 | <0.05 | >0.05 |
2.3.2 两组肝细胞培养上清中丙氨酸转氨酶(ALT)含量比较: 经统计学处理, 培养后第3-7天, 纳米材料培养组ALT含量低于普通培养组(P<0.05). 两组培养第3天后, ALT含量逐渐降低(P<0.05)(表2).
| ALT(nkat/L) | 12 h | 24 h | 3 d | 5 d | 7 d |
| 普通培养组(n = 6) | 34.17±9.42 | 31.33±8.47 | 24.17±20.35 | 16.17±27.49 | 15.50±11.95 |
| 纳米材料培养组(n = 6) | 33.00±13.04 | 30.84±19.45 | 15.33±13.05 | 8.84±8.87 | 7.00±5.22 |
| P值 | >0.05 | >0.05 | <0.05 | <0.05 | <0.05 |
2.3.3 两组肝细胞培养上清液中尿素氮(BUN)含量比较: 经统计学处理, 培养后第3-7天BUN含量有所增高, 但各组之间及各时段之间相比差异无显著性(P>0.05)(表3).
| BUN(mmol/L) | 12 h | 24 h | 3 d | 5 d | 7 d |
| 普通培养组(n = 6) | 0.65±0.036 | 0.68±0.038 | 0.75±0.038 | 0.80±0.015 | 0.80±0.026 |
| 纳米材料培养组(n = 6) | 0.63±0.029 | 0.64±0.030 | 0.82±0.027 | 0.90±0.037 | 0.86±0.020 |
| P值 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
移植肝细胞功能的维持和提高是肝细胞移植临床应用面临的一大问题. 微载体培养是近年来广泛应用的大规模细胞培养的一种方法, 有利于细胞的高密度培养, 并维持较高的细胞代谢活性. 张立国 et al[11-13]运用壳聚糖制作微米级的微载体来进行大鼠肝细胞的培养, 表明壳聚糖制成的微载体可以提供肝细胞黏附的生物相容性界面, 促进肝细胞之间的相互作用, 维持肝细胞的形态和功能, 能够较好的维持肝细胞的分化和极性, 并且具有良好的组织相容性. Li et al[14]制备了CS/胶原复合载体, 并将该载体与肝细胞混合培养. 结果表明, CS/胶原复合物是内置型生物人工肝的良好载体. Yagi et al[15]以低压冻干法将果糖连接到多孔CS支架的表面, 将改性后的CS支架(50-200 μm)与肝细胞混合培养. 结果肝细胞的数量显著增多, 肝细胞表现为球型, 表面有大量的微绒毛存在, 表明了肝细胞的生长状况良好, 培养肝细胞白蛋白及尿素的合成功能良好. 此外, Park et al[16]制备了半乳糖基壳聚糖, Chung et al[17]制备了海藻酸盐/半乳糖壳聚糖支架用于肝细胞的培养都取得了良好的效果. 纳米材料是近年来兴起的一个崭新的领域. 纳米材料具有大量的界面或自由表面, 各纳米单元之间存在着或强或弱的相互作用. 由于这些结构上的特殊性, 使纳米材料具有一些独特的效应, 如表面与界面效应, 小尺寸效应和量子尺寸效应等[18-19]. Xie et al[4]的研究表明, 纳米尺寸粗糙表面能够适度地调控细胞的黏附、增殖、分化和凋亡.
我们在金胶纳米粒子上培养猪肝细胞的研究中发现, 细胞在纳米材料上能迅速增殖, 表现出良好的功能[20]. 用于肝细胞移植的纳米材料应具有良好的生物相容性和可降解性. 壳聚糖具有良好的生物相容性和生物可降解性, 还有广谱抗菌、抗感染和很强的凝血作用, 以及促进伤口愈合、调节血脂和降低胆固醇、增强免疫和抗肿瘤等多种生理活性作用[21-24]. 但壳聚糖是非水溶性物质, 故我们对其进行了改性得到了O-CMC, 并与PLA聚合制备了PLA-O-CMC纳米粒子, 将其置于原子力显微镜下观察, 显示其直径大约在300-500 nm, 以XPS分析光谱对其化学性质进行了表征, 进一步证实了所得到的聚合物为PLA-O-CMC. 分别以光学显微镜及电子显微镜观察了PLA-O-CMC纳米粒子对培养猪肝细胞的作用. 结果表明, 与普通肝细胞培养相比较, 纳米培养组的肝细胞形成球形聚集体的时间明显缩短, 球形聚集体的比例明显增加, 细胞形态好, 培养后1, 3和5 d, ALB含量增高. PLA和O-CMC是两种性质不同的高分子材料, 将二者结合作为新的细胞培养载体有如下优点: (1)PLA和O-CMC都是具有良好生物相容性和生物降解性的高分子材料, 对机体无毒无害; (2)O-CMC为水溶性高分子, 可解决微载体制备和培养过程中的沉淀问题; (3)PLA带负电荷, O-CMC带正电荷, 将二者制备成纳米微球, 可调节微球结构中正负电荷的比例, 从而降低由过强正电荷产生的载体本身的细胞毒性; (4)PLA和O-CMC都是可生物降解的高分子材料, 可通过纳米生物技术为细胞的生长提供良好的界面[25-26].
研究结果显示, 培养后3和5 d, 纳米培养组ALT含量低于普通培养组(P<0.05). 两组培养3 d后, ALT含量逐渐降低(P<0.05). 表明新制备的肝细胞悬液由于受到胶原酶和其他因素的影响, 肝细胞膜受到不同程度的破坏, 而经培养后肝细胞膜重新修复完整; 纳米材料更有助于肝细胞膜的修复.
肝细胞移植有望成为急性肝衰竭治疗的一种有效手段. 但如何提高移植肝细胞的活性和降低免疫排斥反应是急需解决的两大问题. 移植肝细胞有多种来源, 但除动物肝细胞外, 其他种类肝细胞的研究尚不成熟. 猪肝细胞因其生物功能与人类肝细胞的接近性及易于获得而在肝细胞移植实验和临床研究中受到重视. 探索高活性培养肝细胞的方法仍是目前肝脏组织工程研究的重要内容之一.
用于组织工程的材料需具有良好的生物相容性和生物可降解性, 壳聚糖便成为良好的选择. 但壳聚糖是非水溶性物质, 这限制了其在细胞培养中的应用. 故我们对其进行了改性得到了O-CMC, 并将其与PLA聚合制备了PLA-O-CMC纳米粒子. PLA和O-CMC是两种性质不同的高分子材料, 均具有良好生物相容性、生物降解性, 且对机体无毒无害; O-CMC为水溶性高分子, 可解决微载体制备和培养过程中的沉淀问题; PLA带负电荷, O-CMC带正电荷, 将二者制备成纳米微球, 可调节微球结构中正负电荷的比例, 从而降低由过强正电荷产生的载体本身的细胞毒性.
在肝细胞培养中改性壳聚糖材料已被广泛应用, 但纳米级改性壳聚糖复合材料的使用还鲜见报道. 我们的探索为肝细胞培养中新型生物材料的应用开拓了思路.
本文文笔清晰流畅, 有一定创新性, 有科研的实用性.
电编: 张敏 编辑:潘伯荣
| 1. | Kayler LK, Merion RM, Lee S, Sung RS, Punch JD, Rudich SM, Turcotte JG, Campbell DA Jr, Holmes R, Magee JC. Long-term survival after liver transplantation in children with metabolic disorders. Pediatr Transplant. 2002;6:295-300. [PubMed] [DOI] |
| 2. | Nagata H, Ito M, Cai J, Edge AS, Platt JL, Fox IJ. Treatment of cirrhosis and liver failure in rats by hepatocyte xenotransplantation. Gastroenterology. 2003;124:422-431. [PubMed] [DOI] |
| 3. | Stefan AM, Coulter S, Gray B, LaMorte W, Nikelaeson S, Edge AS, Afdhal NH. Xenogeneic transplantation of porcine hepatocytes into the CCl4 cirrhotic rat model. Cell Transplant. 1999;8:649-659. [PubMed] |
| 4. | Xie Y, Sproule T, Li Y, Powell H, Lannutti JJ, Kniss DA. Nanoscale modifications of PET polymer surfaces via oxygen-plasma discharge yield minimal changes in attachment and growth of mammalian epithelial and mesenchymal cells in vitro. J Biomed Mater Res. 2002;61:234-245. [PubMed] [DOI] |
| 5. | Popat KC, Daniels RH, Dubrow RS, Hardev V, Desai TA. Nanostructured surfaces for bone biotemplating applications. J Orthop Res. 2006;24:619-627. [PubMed] [DOI] |
| 6. | Miller DC, Haberstroh KM, Webster TJ. Mechani-sm(s) of increased vascular cell adhesion on nanostructured poly(lactic-co-glycolic acid) films. J Biomed Mater Res A. 2005;73:476-484. [PubMed] [DOI] |
| 7. | Chen Z, Ding YT. Functional evaluation of a new bioartificial liver system in vitro and in vitro. World J Gastroenterol. 2006;12:1312-1316. [PubMed] [DOI] |
| 8. | Chen Z, Ding Y, Li G. Configuration of a new bioartificial liver support system and in vitro evaluation of its functions. Ann Clin Lab Sci. 2005;35:7-14. [PubMed] |
| 9. | Chen Z, Ding Y, Xu Q, Yu D. Bioartificial liver inoculated with porcine hepatocyte spheroids for treatment of canine acute liver failure model. Artif Organs. 2003;27:613-622. [PubMed] [DOI] |
| 11. | 张 立国, 潘 继伦, 李 结良, 王 连永, 俞 耀庭. 壳聚糖微载体的制备及原代大鼠肝细胞培养. 中国修复重建外科杂志. 2003;17:157-160. |
| 14. | Li J, Pan J, Zhang L, Guo X, Yu Y. Culture of primary rat hepatocytes within porous chitosan scaffolds. J Biomed Mater Res A. 2003;67:938-943. [PubMed] [DOI] |
| 15. | Yagi K, Michibayashi N, Kurikawa N, Nakashima Y, Mizoguchi T, Harada A, Higashiyama S, Muranaka H, Kawase M. Effectiveness of fructose-modified chitosan as a scaffold for hepatocyte attachment. Biol Pharm Bull. 1997;20:1290-1294. [PubMed] [DOI] |
| 16. | Park IK, Yang J, Jeong HJ, Bom HS, Harada I, Akaike T, Kim SI, Cho CS. Galactosylated chitosan as a synthetic extracellular matrix for hepatocytes attachment. Biomaterials. 2003;24:2331-2337. [PubMed] [DOI] |
| 17. | Chung TW, Yang J, Akaike T, Cho KY, Nah JW, Kim SI, Cho CS. Preparation of alginate/galactosylated chitosan scaffold for hepatocyte attachment. Biomaterials. 2002;23:2827-2834. [PubMed] [DOI] |
| 18. | Murphy J, Carr B, Atkinson T. Nanotechnology in medicine and the biosciences. The UK National Symposium on Nanotechnology in Medicine and the Biosciences, London, UK, 16-18 March l994. Trends Biotechnol. 1994;12:289-290. [PubMed] [DOI] |
| 19. | 陈 钟, 吴 振宇. 纳米材料在组织工程中的应用研究. 国外医学·生物医学工程分册. 2004;27:278-280. |
| 20. | Gu HY, Chen Z, Sa RX, Yuan SS, Chen HY, Ding YT, Yu AM. The immobilization of hepatocytes on 24 nm-sized gold colloid for enhanced hepatocytes proliferation. Biomaterials. 2004;25:3445-3451. [PubMed] [DOI] |
| 21. | Khor E, Lim LY. Implantable applications of chitin and chitosan. Biomaterials. 2003;24:2339-2349. [PubMed] [DOI] |
| 22. | VandeVord PJ, Matthew HW, DeSilva SP, Mayton L, Wu B, Wooley PH. Evaluation of the biocompatibility of a chitosan scaffold in mice. J Biomed Mater Res. 2002;59:585-590. [PubMed] [DOI] |
| 23. | Felt O, Buri P, Gurny R. Chitosan: a unique polysac-charide for drug delivery. Drug Dev Ind Pharm. 1998;24:979-993. [PubMed] [DOI] |
| 24. | 吴 振宇, 陈 钟, 黄 华, 田 鹏鹏. 离子凝胶法制备壳聚糖纳米微粒. 南通大学学报(医学版). 2005;25:20-22. |
| 25. | 常 津, 刘 海峰, 许 晓秋, 原 续波, 姚 康德, 尤 永平, 蒲 佩玉. 一种新型纳米基因载体的制备及体外实验. 中国生物医学工程学报. 2002;21:515-519. |
| 26. | Bergsma JE, Rozema FR, Bos RR, Boering G, de Bruijn WC, Pennings AJ. In vivo degradation and biocompatibility study of in vitro pre-degraded as-polymerized polyactide particles. Biomaterials. 1995;16:267-274. [PubMed] [DOI] |