修回日期: 2006-04-06
接受日期: 2006-04-16
在线出版日期: 2006-06-08
目的: 观察幼鼠肠缺血/再灌注损伤(I/R)不同时点肠组织内肿瘤坏死因子a(TNF-a)、c-fos mRNA表达模式, 探讨肠I/R的机制.
方法: 分离幼鼠肠系膜上动脉, 制作动物模型, 应用RT-PCR半定量法分析肠组织TNF-a、c-fos mRNA表达.
结果: 与假手术组相比, 肠组织内TNF-a mRNA缺血30 min显著升高(1.55±0.33 vs 1.07±0.08, P<0.05), 再灌注30 min达峰值(3.05±0.11), 再灌注后60, 90 min逐渐下降; c-fos mRNA表达于缺血30 min后升高(0.95±0.13 vs 0.12±0.02,P<0.05), 再灌注30 min达峰值(1.53±0.11), 再灌注后60 min迅速下降, 再灌注后90 min达基线水平.
结论: 幼鼠肠I/R损伤介导肠组织内TNF-a和c-fos mRNA的表达模式. c-fos mRNA表达伴随TNF-a mRNA表达, 提示二者间可能存在关系.
引文著录: 李春艳, 张莹, 崔泽实, 卢瑶, 于明. 幼鼠肠缺血/再灌注损伤肠组织TNF-α和c-fos mRNA的表达. 世界华人消化杂志 2006; 14(16): 1631-1634
Revised: April 6, 2006
Accepted: April 16, 2006
Published online: June 8, 2006
AIM: To analyze the expression patterns of tumor necrosis factor-a (TNF-a) and c-fos mRNA in immature rats after gut ischemia/reperfusion (I/R) injury.
METHODS: The left laparotomy was performed and the superior mesenteric artery (SMA) was occluded by artery clamp to establish the model of gut I/R injury. The expression of TNF-a and c-fos mRNA were detected by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: In comparison with sham operation group, an increase in TNF-a mRNA was detected after 30-min ischemia (1.55 ± 0.33 vs 1.07 ± 0.08, P < 0.05) and the maximal increase was detected after 30-min reperfusion (3.05 ± 0.11). TNF-a mRNA expression after 60-min reperfusion (2.02 ± 0.10) remained above the control level. The expression of c-fos mRNA in the intestinal tissues was rapidly induced by ischemia, and it increased obviously 30 min after ischemia as compared with that in sham operation group (0.95 ± 0.13 vs 0.12 ± 0.02, P < 0.05). The expression of c-fos mRNA also reached the peak level 30 min after reperfusion (1.53 ± 0.11), and it declined markedly 60 min after reperfusion. After 90-min reperfusion, c-fos mRNA expression returned to the normal level.
CONCLUSION: Gut I/R induces the mRNA expression of both TNF-a and c-fos, suggesting that there is possibly a correlation between the expression of c-fos and TNF-a.
- Citation: Li CY, Zhang Y, Cui ZS, Lu Y, Yu M. Expression of tumor necrosis factor-α and c-fos mRNA in immature rats' model of gut ischemia/reperfusion injury. Shijie Huaren Xiaohua Zazhi 2006; 14(16): 1631-1634
- URL: https://www.wjgnet.com/1009-3079/full/v14/i16/1631.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i16.1631
肠缺血/再灌注损伤(ischemia/reperfusion, I/R)是小儿外科常见的组织器官损伤. 不仅表现在肠梗阻、肠移植等肠道疾病的发展过程中, 同时也是创伤、感染、失血性休克等疾病的关键性病理过程, 所以在幼鼠模型上进行I/R机制的研究是指导临床治疗的要求. 在I/R复杂的病理过程中同时存在生理的、化学的、分子的反应[1], TNF-a和活化蛋白1(AP-1)家族蛋白都是其关键性的因子. 在肝I/R中, TNF-a作为多功能蛋白与其他信号通路相互作用, 介导细胞反应如细胞的增殖和凋亡及炎性介质产生[2]. 在脑I/R研究中, 中和TNF-a可以降低缺血造成的脑水肿[3]. 在肝[4]、脑[5]、肾[6]I/R研究中, I/R启动了即刻早基因c-fos基因、c-jun基因的表达, 且与细胞的增殖和凋亡相关. 在本实验, 我们建立幼龄鼠的肠I/R模型, 观察肠组织的TNF-a、c-fos基因mRNA表达模式, 探讨幼龄鼠的肠I/R机制.
动物模型: 采用♂Wistar大白鼠(体质量130±15 g), 采用盐酸氯胺酮经腹腔注入麻醉, 取右侧卧位, 经腹膜后入路, 分离肠系膜上动脉. 实验分组: 48只♂Wistar大白鼠分成6组(n = 8): 假手术组(shame group, SG), 缺血30 min组(I 30 min G), 缺血30 min/再灌注30 min组(I 30 min/R 30 min G), 缺血30 min/再灌注60 min组(I 30 min/R 60 min G), 缺血30 min/再灌注90 min组(I 30 min/R 90 min), 缺血120 min组(I 120 min G).
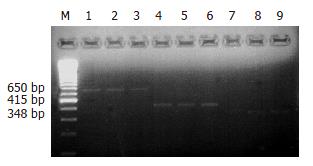
肠组织TNF-a、c-fos基因RT-PCR半定量分析. 用总RNA提取试剂(Promega公司)按说明书操作, 提取总RNA. 逆转录后分别扩增TNF-a和c-fos基因. TNF-a引物序列上游5'AGAACTCCAGGCGGTGTCTGTG3', 下游5'GTGGCAAATCGGGT GACGGTGT3', 扩增片段415 bp. c-fos基因引物序列上游5'ATGATGTTCTCGGGTTTCAA3', 下游5'TGACATGGTCTTCACCAC TC3', 扩增片段348 bp. 用b-actin作内对照(650 bp). TNF-a、b-actin、c-fos扩增产物经2%的琼脂糖凝胶电泳后, 紫外灯下观察照相, 100 bp DNA Ladder (New England Biolabs公司)为分子质量标准, 用凝胶成像分析系统(Kodak Digital Science 1D)扫描扩增带, 以内参照值标准化TNF-a, c-fos的相对含量.
统计学处理 TNF-a, c-fos基因相对含量用mean±SD表示, 样本均数作t检验, 显著差异设为95%.
肠组织TNF-a, c-fos mRNA表达: 肠组织内TNF-a mRNA缺血期升高, I 30 min/R 30 min G达峰值, I 30 min/R 60 min G、I 30 min/R 90 min G时逐渐下降; c-fos mRNA表达于缺血期升高, I 30 min/R 30 min G达峰值, I 30 min/R 60 min G迅速下降, I 30 min/R 90 min G达基线水平(图1, 表1).
TNF-a与受体结合启动下游的多个信号通路, 如MAPK, JNK通路, 是介导炎性反应, 凋亡等细胞反应的主要因子[7]. 而即刻早基因编码的蛋白也调节损伤后的细胞反应, 与组织的修复和细胞的凋亡相关[4,8-9]. 在休克的模型中, 研究者观察到TNF-a, AP-1的异常活化[10]. 在脑的暂时性缺血研究中, TNF-a表达与c-fos的瞬时表达相关[11]. 我们在幼龄鼠的肠I/R模型, 在mRNA水平同时检测TNF-a, c-fos表达. 随着I/R时间的变化, TNF-a, c-fos mRNA表达发生变化, 而且表达模式不同: c-fos mRNA在缺血30 min升高, 再灌注30 min时继续升高, 再灌注60 min迅速下降; TNF-a mRNA在缺血30 min升高, 再灌注30 min达峰值, 再灌注60, 90 min逐渐下降, 提示幼鼠肠I/R损伤特异性启动TNF-a, c-fos转录. 在Shima et al[12]的研究中, c-fos同样在肠缺血30 min后转录上升, 再灌注30 min达峰值, 但在再灌注120-180 min回到基线水平, 这与本实验观察到的c-fosmRNA在再灌注60 min迅速下降结果不同. 分析造成不同的原因之一, 可能是实验所选择动物的周龄和体质量不同. 在肝脏的I/R研究中, 研究者发现缺血预处理的保护效应与c-fos和c-jun的转录水平相关[13]. 此外, c-fos在细胞受到各种刺激时可以增强细胞的增殖. 那么, 上面的不同结果可能提示, 在相同的处理条件下, 幼鼠的肠组织较成年鼠更早地受到I/R损伤, c-fos在此病理过程的保护性作用时间较短. Kwon et al[14]通过人、小鼠、兔、大鼠TNF-a基因顺序的比较研究, 发现大鼠TNF-a基因内存在着AP-1、AP-2、CTF、IFN、NF-kB、Ybox多个潜在的转录因子的结合位点. AP-1是细胞内强化结合蛋白, 具有调节转录活性. 而AP-1恰由FOS-JUN的异物二聚体构成, 而后者正是由即刻早基因c-fos的表达产物FOS与c-jun的产物JUN形成. Wang et al[15]在大脑中动脉阻塞160 min后解除阻塞的大鼠模型中, 同时观察到短暂局部缺血后脑皮质内TNF-a mRNA、c-fos 基因mRNA表达升高; 且c-fos mRNA比TNF-a mRNA较早的高表达, 说明c-fos基因mRNA表达可能调控TNF-a转录. 我们也在本实验中观察到c-fos转录伴随TNF-a转录. 尽管在本实验, 我们不能证明c-fos基因转录翻译成蛋白构成AP-1活化TNF-a转录, 但至少提示在肠I/R损伤中c-fos早表达基因伴随TNF-a表达, 可能与其正向调节后者的转录相关. 反之, 仅就本实验而言, 我们不能排除TNF-a活化AP-1的可能, 所以尚需进一步的实验证明.
缺血/再灌注损伤(I/R)的病理过程直接与缺血后乏氧和循环重建相关, 在这一过程中同时存在生理的、化学的、分子的反应. 就分子反应而言, I/R被分为三个阶段: 再灌注即刻反应, 磷脂酶激活、钙离子内流、脂质分子活化、蛋白激酶和一氧化碳合酶活化等; 再灌注早期反应, 炎性细胞因子的蛋白表达, 启动下游信号通路, 活化核内转录因子, 继续炎性反应; 再灌注晚期反应, 抗炎性因子的出现, 如IL-10、晚期黏附分子等.
目前, 信号通路研究是缺血/再灌注损伤研究的热点和重点. 几个主要的分子信号通路, 如MAPKs, JNK, IKK, ROS, 相互"交谈", 构成复杂的信号网络, 在缺血/再灌注的不同阶段介导损伤及修复.
本研究选择幼鼠作动物模型, 得到实验结果对小儿外科的临床较具有指导意义. 在肠I/R中, 同时观察TNF-α和c-fos的报道较少, 且本文观察到的c-fos表达变化与以往报道不尽相同.
在肠的I/R中, TNF-α和c-fos在转录水平随I/R进程变化而变化, 此将提示如果将二者作为治疗I/R的靶点, 治疗干预的时间点是至关重要的, 同时可以作为选择干预方式(RNA干涉或抗体阻断)的参考依据.
转录因子AP-1是同源二聚体或异二聚体蛋白复合物, 来源于Fos和Jun家族, 包括c-Fos, FosB, Fra-1, Fra-2, c-Jun, JunB和JunD. AP-1异二聚体可与DNA的5'-TGA (C/G)TCA-3序列结合.
电编: 张敏 编辑:潘伯荣
| 1. | Toledo-Pereyra LH, Toledo AH, Walsh J, Lopez-Neblina F. Molecular signaling pathways in ischemia/reperfusion. Exp Clin Transplant. 2004;2:174-177. [PubMed] |
| 2. | Schwabe RF, Brenner DA. Mechanisms of Liver Injury. I. TNF-alpha-induced liver injury: role of IKK, JNK, and ROS pathways. Am J Physiol Gastrointest Liver Physiol. 2006;290:G583-589. [PubMed] [DOI] |
| 3. | Hosomi N, Ban CR, Naya T, Takahashi T, Guo P, Song XY, Kohno M. Tumor necrosis factor-alpha neutralization reduced cerebral edema through inhibition of matrix metalloproteinase production after transient focal cerebral ischemia. J Cereb Blood Flow Metab. 2005;25:959-967. [PubMed] [DOI] |
| 4. | Schlossberg H, Zhang Y, Dudus L, Engelhardt JF. Expression of c-fos and c-jun during hepatocellular remodeling following ischemia/reperfusion in mouse liver. Hepatology. 1996;23:1546-1555. [PubMed] [DOI] |
| 5. | An G, Lin TN, Liu JS, Xue JJ, He YY, Hsu CY. Expression of c-fos and c-jun family genes after focal cerebral ischemia. Ann Neurol. 1993;33:457-464. [PubMed] [DOI] |
| 6. | Megyesi J, Di Mari J, Udvarhelyi N, Price PM, Safirstein R. DNA synthesis is dissociated from the immediate-early gene response in the post-ischemic kidney. Kidney Int. 1995;48:1451-1458. [PubMed] [DOI] |
| 7. | Chen G, Goeddel DV. TNF-R1 signaling: a beautiful pathway. Science. 2002;296:1634-1635. [PubMed] [DOI] |
| 8. | Brown JR, Nigh E, Lee RJ, Ye H, Thompson MA, Saudou F, Pestell RG, Greenberg ME. Fos family members induce cell cycle entry by activating cyclin D1. Mol Cell Biol. 1998;18:5609-5619. [PubMed] [DOI] |
| 9. | Chihab R, Ferry C, Koziel V, Monin P, Daval JL. Sequential activation of activator protein-1-related transcription factors and JNK protein kinases may contribute to apoptotic death induced by transient hypoxia in developing brain neurons. Brain Res Mol Brain Res. 1998;63:105-120. [PubMed] [DOI] |
| 10. | Gaddipati JP, Sundar SV, Calemine J, Seth P, Sidhu GS, Maheshwari RK. Differential regulation of cytokines and transcription factors in liver by curcumin following hemorrhage/resuscitation. Shock. 2003;19:150-156. [PubMed] [DOI] |
| 11. | Sairanen TR, Lindsberg PJ, Brenner M, Carpen O, Siren A. Differential cellular expression of tumor necrosis factor-alpha and Type I tumor necrosis factor receptor after transient global forebrain ischemia. J Neurol Sci. 2001;186:87-99. [PubMed] [DOI] |
| 12. | Shima Y, Tajiri T, Taguchi T, Suita S. Increased expression of c-fos and c-jun in the rat small intestinal epithelium after ischemia-reperfusion injury: a possible correlation with the proliferation or apoptosis of intestinal epithelial cells. J Pediatr Surg. 2006;41:830-836. [PubMed] [DOI] |
| 13. | Xiao JS, Cai FG, Niu Y, Zhang Y, Xu XL, Ye QF. Preconditioning effects on expression of proto-oncogenes c-fos and c-jun after hepatic ischemia/reperfusion in rats. Hepatobiliary Pancreat Dis Int. 2005;4:197-202. [PubMed] |
| 14. | Kwon J, Chung IY, Benveniste EN. Cloning and sequence analysis of the rat tumor necrosis factor-encoding genes. Gene. 1993;132:227-236. [PubMed] [DOI] |
| 15. | Wang X, Yue TL, Barone FC, White RF, Gagnon RC, Feuerstein GZ. Concomitant cortical expression of TNF-alpha and IL-1 beta mRNAs follows early response gene expression in transient focal ischemia. Mol Chem Neuropathol. 1994;23:103-114. [PubMed] [DOI] |