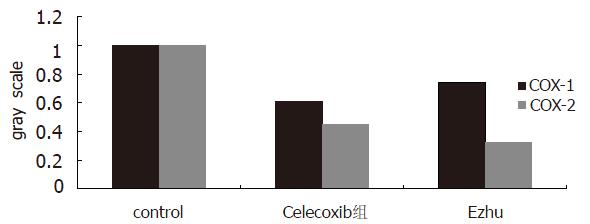修回日期: 2006-03-11
接受日期: 2006-03-30
在线出版日期: 2006-06-08
目的: 观察莪术对人胃癌SGC7901细胞COX-1, COX-2, VEGF和PGE2的影响.
方法: MTT法观察莪术对胃癌细胞的抑制作用, 绘制其抑制率曲线, 选取抑制率为25%时的药物浓度作为加药浓度, 用RT-PCR以及Western blot方法检测加药后人胃癌细胞COX-1, COX-2基因及其蛋白表达的变化. 用ELISA方法检测加药后培养基中VEGF和PGE2的表达情况.
结果: 莪术对胃癌细胞有一定的抑制作用, 且随着浓度的增加, 其抑制作用加强; 将RT-PCR产物经电泳分析, 证实胃癌细胞中有COX-1、COX-2基因的表达, 对各条带进行灰度分析发现: 中西药对COX-1和COX-2均有抑制作用, 莪术对COX-2的抑制作用大于塞来昔布; Western blot曝光结果可见, COX-1各组在70 kDa处可见特异性的蛋白条带, COX-2各组在80 kDa处可见特异性的蛋白条带. 对各条带进行灰度分析发现: 各组中西药对COX-2均有明显的抑制作用, 而对COX-1则无抑制作用, 其中, 莪术对COX-2的抑制作用要强于celecoxib; 西药celecoxib及莪术组可明显降低人胃癌细胞VEGF的表达, 与细胞组相比, 其差别有统计学意义(91.0±18.2, 127.8±12.1 ng/L vs 162.0±15.1 ng/L, P<0.01); 西药celecoxib组PGE2表达低于细胞组, 但其差别无统计学意义, 莪术可明显降低人胃癌细胞PGE2的表达, 与细胞组相比, 其差别有统计学意义(67.5±6.9 ng/L vs78.7±5.6 ng/L, P<0.01).
结论: 莪术可能是通过抑制COX-2及其下游PGE2表达, 使VEGF表达下调而抑制肿瘤.
引文著录: 沈洪, 刘增巍, 朱萱萱, 张坤, 王伟, 郭青龙, 袁胜涛. 莪术对SGC7901胃癌细胞COX-1, COX-2, VEGF和PGE2表达的影响. 世界华人消化杂志 2006; 14(16): 1548-1553
Revised: March 11, 2006
Accepted: March 30, 2006
Published online: June 8, 2006
AIM: To investigate the effect of Ezhu on the expression of cyclooxygenase-1 (COX-1), cyclooxygenase-2 (COX-2), vascular endothelial growth factor (VEGF) and prostaglandin E2 (PGE2) in human gastric cancer cell line SGC7901.
METHODS: The MTT method was used to observe the suppression of the human gastric cancer (SGC7901) cells treated with Ezhu. By drawing the suppression rate curves, we selected the appropriate Ezhu concentration at the 25% proliferation suppression rate as experimental concentration. Reverse transcription-polymerase chain reaction (RT-PCR) and Western blot were adopted, respectively, to examine the expression of COX gene and protein. Furthermore, ELISA method was used to detect the variation of the VEGF and PEG2 expression in culture medium.
RESULTS: Ezhu definitely inhibited the proliferation of human gastric cancer cells in a concentration dependent manner. Electrophoresis of the RT-PCR products demonstrated the expression of COX-1 and COX-2 gene in the human gastric cancer cells. Gray scale analysis showed that both Ezhu and celecoxib inhibited the expression of COX-1 and COX-2 gene, and the inhibitory action of Ezhu was greater than celecoxib. However, Western blot clearly showed that a specific protein strip was observed in COX-1 group at the 70 kDa, while in COX-2 group at the 80 kDa. Gray scale analysis confirmed than both Ezhu and celecoxib had apparent suppression on COX-2 protein, but had no effect on COX-1. Moreover, the suppression function of Ezhu surpassed celecoxib. Ezhu and celecoxib obviously degraded the content of VEGF in gastric cancer cells. In comparison with those in the control group, the results are statistically significant (91.0 ± 18.2, 127.8 ± 12.1 ng/L vs 162.0 ± 15.1 ng/L, P < 0.01). The level of PGE2 in the cells treated with celecoxib was lower than the control group with no statistical significance. Nevertheless, Ezhu decreased the level of PGE2 significantly (67.5 ± 6.9 ng/L vs 78.7 ± 5.6 ng/L, P < 0.01).
CONCLUSION: Ezhu can inhibit COX-2 and its downstream expression of PGE2, and down-regulates VEGF expression, so as to suppress the proliferation of gastric cancer cells.
- Citation: Shen H, Liu ZW, Zhu XX, Zhang K, Wang W, Guo QL, Yuan ST. Effect of Ezhu on expression of cyclooxygenase, vascular endothelial growth factor and prostaglandin E2 in human gastric cancer cell line SGC7901. Shijie Huaren Xiaohua Zazhi 2006; 14(16): 1548-1553
- URL: https://www.wjgnet.com/1009-3079/full/v14/i16/1548.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i16.1548
环氧合酶(cyclooxygenase, COX)为一种膜结合蛋白, 是花生四烯酸转化为前列腺素和其他二十烷类的限速酶. 目前已知细胞中至少有两种COX同工酶: COX-1和COX-2. COX-1多在正常组织中表达, 维持多种组织细胞的正常生理功能. 而COX-2在绝大部分组织细胞中不表达, 只在细胞受到广泛内外刺激因素(细胞因子、生长因子、内毒素、促有丝分裂因子、致癌剂等)作用时, 才呈诱生性表达[1], 且诱导产生的量随细胞类型及刺激因素的不同而改变. COX-2与人类肿瘤具有密切联系[2], 其可能参与了肿瘤的异型、凋亡、肿瘤血管生成及肿瘤侵袭等. 有不少研究报道[3], 食管癌、胃癌、结肠癌、肝癌、胰腺癌等消化道肿瘤中有COX-2 mRNA或蛋白的过度表达, 但COX-1表达无改变[4]. 在慢性萎缩性胃炎伴肠化、不典型增生时也有COX-2的表达上调[5], 且与慢性炎症的程度相关, 而萎缩性胃炎伴肠化及不典型增生被认为是癌前病变. 说明COX-2过度表达在胃癌的形成中起重要作用[6]. 几项研究表明[7], NSIADs的应用可能减少非贲门癌, 甚至贲门癌发生的危险性. 目前已知NSIADs可阻断COX-2而发挥其对胃肠道肿瘤的化学预防作用[8]. 实验研究也发现, NSIADs可在体外抑制胃癌细胞株的增殖, 使其生长受抑, 凋亡增加.
研究报道表明血管内皮生长因子(VEGF)可在很多正常组织中表达, 但一般水平较低, 恶性肿瘤细胞能分泌大量VEGF, 常呈现过量表达. 有研究表明肿瘤组织中VEGF的表达高于正常组织, 其阳性表达肿瘤中微血管密度也明显增高. VEGF是最具特异性的血管活性物质, 高效地作用于血管内皮细胞, 刺激内皮细胞增殖, 促进血管形成. 他诱导产生的新生血管有很高的通透性, 能使循环中的血浆蛋白渗出到细胞外基质, 有利于成纤维细胞和内皮细胞在其中生长, 共同形成一种富含血管的肿瘤基质, 为肿瘤的浸润和转移创造条件. 另外, VEGF可通过特异的受体激活磷脂酶C[9], 快速诱导钙离子对血管内皮细胞直接作用, 增加血管的通透性. 因此, VEGF在肿瘤的发生、生长、转移中起着重要的作用. 而COX-2还可诱导VEGF等血管新生因子[10], 促使肿瘤血管的新生, 从而促进肿瘤的增殖和发展[11].
PGE2是花生四烯酸的主要代谢产物之一, 已有大量研究报道[12], 同正常组织相比较, 胃癌组织产生PGE2的水平增高. PGE2可抑制具有免疫调节功能的淋巴因子产生, 抑制T细胞和B细胞增殖, T细胞母细胞化及抑制NK细胞、LAK细胞和CTL的细胞毒活性. 同时, PGE2还可抑制TNF的产生, 诱导IL-10产生. 因此, 应用环氧化酶抑制剂(如阿斯匹林、苏灵达和消炎痛等)可减低肿瘤引起的免疫抑制作用[13].
近年来, 益气活血法[14]在预防及治疗胃癌及癌前病变中应用较为广泛, 取得了较好的疗效[15], 为进一步探讨中药作用的机制, 我们初步筛选出其中最为常用的活血药莪术作为本研究的主要对象, 采用RT-PCR(COX-1, COX-2 mRNA)、Western blot(COX-1, COX-2 protein)、免疫组化双抗夹心ELISA(VEGF、PGE2)等方法, 测定其在胃癌细胞中的表达及在莪术作用下表达的变化, 从分子生物学角度分析莪术作用的机制.
人胃癌细胞SGC7901为中国药科大学抗肿瘤药理实验室保存. 莪术提取液由江苏省中医院药理实验室提供, celecoxib(塞来昔布)产自西尔大药厂波多黎各分厂. RPMI 1640培养基由Gibco公司生产, COX引物购自上海生工生物工程技术服务有限公司, 小牛血清由杭州四季青公司提供, DMSO(二甲基亚砜)由江苏永华精细化学品有限公司生产, 总RNA tripure抽提试剂盒由Roche Diagnostics公司生产, COX抗体由Santa Cruz公司生产, 100 bp DNA ladder购自大连宝生物工程有限公司, 100 bp蛋白ladder由Piece chemical公司生产. VEGF检测试剂盒由上海森雄科技实业有限公司生产. PGE2检测试剂盒由美国BPB公司生产.
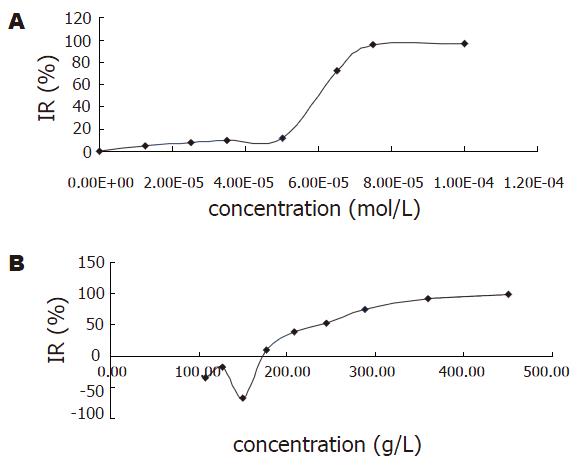
用2.5 g/L胰蛋白酶消化单层培养细胞SGC7901, 制备单细胞悬液. 以每孔1×104个细胞接种于96孔培养板(每孔100 mL), 分别加不同浓度的莪术, 移入37 ℃ CO2孵箱中培养24 h. 然后每孔加入MTT溶液(5 g/L)20 mL, 于37 ℃继续孵育4 h, 终止培养. 吸弃孔中的培养上清, 加入100 mL DMSO振荡10 min, 在酶联免疫检测分析仪测定A490 nm的值. 以只加培养液不加细胞的空白对照孔调零.
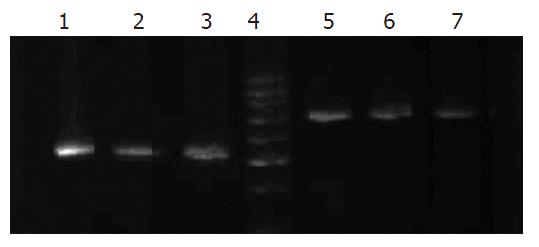
1.2.1 RT-PCR测COX基因: 取对数生长期的细胞, 按每瓶2×106个细胞的量, 分别加入到3个中瓶中, 24 h后细胞贴壁后分别加药(选取抑制率为25%时的药物浓度作为加药浓度): 细胞对照组、celecoxib组(5.75E-5 mol/L)、莪术组(940 g/L), 48 h后收集各组细胞, 用2.5 g/L胰蛋白酶消化, 制成单细胞悬液, 1000 r/min离心10 min, 收集细胞沉淀, 再以0.01 mmol/L pH 7.4 PBS洗涤沉淀2次, 于-70 ℃保存. 应用tripure试剂盒提取RNA, 并用紫外分光光度计测定A260nm及A280nm值, 分析其纯度, 同时进行定量. 于冰上混合2 mg RNA样品及10 mL随机六聚体引物, 于70 ℃退火5 min后, 立即置于冰浴中, 加入5 mL逆转录酶缓冲液, 40 MU/L rRNase抑制剂1 mL, 10 mmol/L dNTP 1.25 mL, 200 kU/LM-MLV逆转录酶1 mL, 并补加水至25 mL充分混合. 然后37 ℃ 1 h; 80 ℃ 5 min终止反应, -20 ℃保存. 引物序列COX-2为: COX-2 F: 5' ATC TAC CCT CCT CAA GTC CC 3'; COX-2 R: 5' TAC CAG AAG GGC AGG ATA CAG 3'. 扩增片段长度为807 bp; 引物序列COX-1为: COX-1 F: 5' CCG GAT GCC AGT CAG GAT GAT G3'; COX-1 R: 5' CTA GAC AGC CAG ATG CTG ACT G3'. 扩增片段长度为529 bp. 反应体系: 10×reaction Buffer 2.5 mL, 25 mmol/L MgCl2 2.0 mL, 10 mmol/L dNTP 0.5 mL, 20 mmol/L上下游引物各0.4 mL, cDNA 2 mL, 及Taq酶0.3 mL, 补加水至25 mL. PCR条件: 94 ℃热启动, 94 ℃变性45 s, 58 ℃复性35 s, 72 ℃延伸55 s, 共35个循环. 最后于72 ℃延伸10 min. 反应完毕后, 取扩增产物10 mL, 于15 g/L的琼脂糖凝胶上进行电泳分析. 为比较各组细胞间表达水平的强弱, 应用图像分析仪对扩增条带做了扫描半定量.
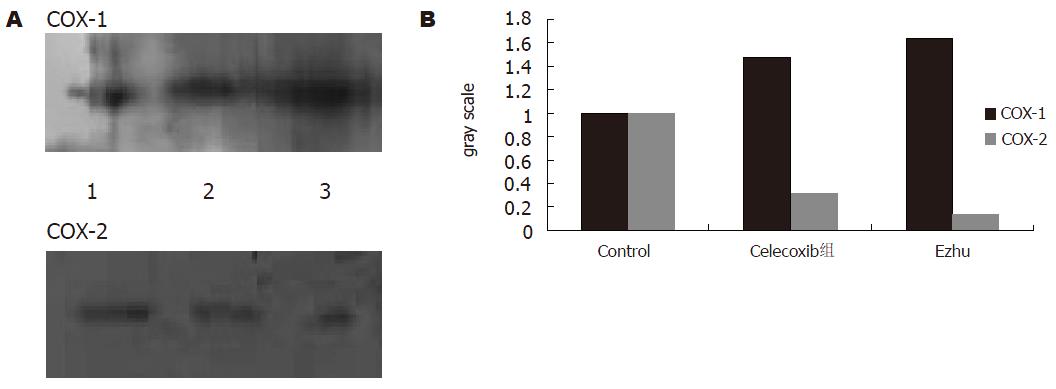
1.2.2 Western blot测COX蛋白: 将细胞的蛋白样品定量(90 mg), 并进行变性(90 ℃, 5 min)处理; 行聚丙烯酰胺凝胶电泳; 转膜: 75 mA, 1 h; 用封闭液(脱脂牛奶)封闭1 h; 用Blot wash液洗2次, 每次10 min; 加入COX-1或COX-2的一抗, 在25 ℃温育1.5 h, COX-1和COX-2的一抗工作浓度分别为1:500和1:800; 用Blot wash液洗3次, 每次10 min; 加入辣根过氧化酶标记的二抗后, 在25 ℃温育1 h, COX-1和COX-2的二抗工作浓度均为1:10 000; 用Blot wash液洗3次, 每次10 min; 加入1:1的发光液, 在25 ℃温育5 min. 立即曝光, 等条带清晰后将胶片取出, 用凝胶成像系统扫描并进行数据分析.
1.2.3 ELISA法测VEGF和PGE2: 取对数生长期的细胞, 按1×108个/L的密度, 每孔500 mL培养基分别加入到2个24孔板中, 24 h细胞贴壁后分别加药(选取抑制率为25%时的药物浓度作为加药浓度): 细胞对照组、celecoxib组(5.75E-5 mol/L)、莪术组(195 g/L), 每个浓度的药物分别加8孔或10孔(n = 8或10), 48 h后收集上层培养基, 离心后上清转入tube管中备用. 将备好的培养基加入已平衡至室温板条的相应孔中(100 mL /孔). 37 ℃孵箱孵育120 min, 取出板充分洗涤5次, 向滤纸上印干后每孔加入一抗工作液50 mL, 充分混匀, 37 ℃孵箱孵育60 min, 洗板5次, 干后每孔加入酶标抗体工作液100 mL, 37 ℃孵箱孵育60 min, 洗板5次, 加入底物工作液100 mL/孔, 37 ℃孵箱暗处反应10 min, 每孔加入终止液1滴, 混匀后即刻测量A492 nm值, 减去空白孔A值, 得各标本的A值, 根据标准品的测定值绘制标准曲线图, 在标准曲线上查出每个标本VEGF浓度. 酶标板每孔加入100 mL标准品, 分别加入100 mL样品, 每孔加入50 mL酶标液, 18-25 ℃反应90 min. 洗板6次, 每孔加入底物A, B液各50 mL. 18-25 ℃反应15 min, 每孔加入50 mL终止液, 终止反应. 于波长250 nm的酶标仪上读取各孔的A值, 根据标准品浓度, 计算出样品中PGE2的浓度.
莪术对胃癌细胞有一定的抑制作用, 且随着浓度的增加, 其抑制作用加强(图1). 将RT-PCR产物经电泳分析, 加入COX-1引物的各组均可见1条约529 bp(符合COX-1位置)的扩增带, 加入COX-2引物的各组均可见1条约807 bp(符合COX-2位置)的扩增带, 特异性好(图2). 说明胃癌细胞中有COX-1 mRNA、COX-2 mRNA的表达. 对各条带进行灰度分析(图3)发现, 中西药对COX-1 mRNA和COX-2 mRNA均有抑制作用, 莪术对COX-2的抑制作用大于塞来昔布. 胃癌细胞的Western blot曝光结果可见, COX-1各组在70 kDa处可见特异性的蛋白条带(图4), COX-2各组在80 kDa处可见特异性的蛋白条带(图4). 对各条带进行灰度分析发现: 各组中西药对COX-2均有明显的抑制作用, 而对COX-1则无抑制作用. 其中, 莪术对COX-2的抑制作用要强于celecoxib.
目前, COX-2促肿瘤发生、发展的机制已有较多阐述, 但其与胃癌诸多病理因素间关系的报道尚不一致[16]. 有实验结果显示[17], COX-2在正常胃黏膜、浅表性胃炎、萎缩性胃炎伴肠化、不典型增生及胃癌组织中的表达呈逐渐递增趋势, 阳性率依次为6.67%, 17.86%, 30.43%, 42.11%和62.26%. 提示COX-2在促胃癌发生、发展的过程中遵循Correa et al[18]提出的肠型胃癌的发生模式: 正常胃黏膜→慢性浅表性胃炎→慢性萎缩性胃炎→肠上皮化生→不典型增生→胃癌的顺序演变过程, 即COX-2参与了胃癌形成的全过程, 可能为其早期事件. COX-2高表达与胃癌组织学分级、浸润深度及有无淋巴结转移有关[19]. 在高中分化胃癌组中的表达显著高于低分化组, 在侵及浆膜组与有淋巴结转移组中的表达亦高于未侵及浆膜组与无淋巴结转移组. 提示COX-2不仅参与了胃癌形成的早期过程, 且与胃癌的侵袭、转移及预后亦有一定的关系. 以往的研究表明在胃癌细胞中COX-1的表达呈阳性[20], 与本试验结果相一致. 从RT-PCR的结果来看, 莪术对COX-2 mRNA和COX-1 mRNA均有明显的抑制作用, 从对COX的选择性来看, 莪术对COX-1和COX-2的抑制无明显差别. 从Western blot的结果来看, 中西药对COX-2均有明显的抑制作用, 而对COX-1则无抑制作用. 其中, 在抑制率相同的情况下, 莪术对COX-2的抑制作用要强于celecoxib. 从ELISA检测可以看出, 西药celecoxib及中药莪术均可明显降低人胃癌细胞VEGF的含量, 且其趋势与各组COX-2的表达基本平行, 中药莪术组可明显降低人胃癌细胞PGE2的含量, 两者趋势与各组COX-2的表达基本平行, 说明COX-2与PGE2、VEGF呈一定的相关性[21], 中药作用的机制可能是通过抑制COX-2表达, 从而抑制PGE2的产生[22], 降低肿瘤的发生; 或者通过对VEGF的诱导作用[23], 使VEGF表达下调, 或直接抑制VEGF表达, 从而抑制肿瘤血管的新生[24], 抑制肿瘤的增殖和发展[25].
总之, 中药抗肿瘤的机制可能是通过抑制COX-2表达, 减少PGE2所引起的炎症[26]及其免疫反应[27], 防止肿瘤发生; 或使VEGF表达下调[28], 或直接抑制VEGF表达[29], 从而抑制肿瘤血管的新生, 达到抗肿瘤的作用[30].
最近COX-2与癌症及癌前病变相关的研究越来越多, 大部分认为COX-2高表达与肿瘤的生物学行为, 如肿瘤的发生、血道转移或淋巴转移等密切相关, COX-2的抑制剂则能阻止或延缓这些生物学行为的发生, 以上研究多是与西医内容为主, 而对于中药的研究较少; 中药对胃癌的作用机制以往虽然有各种报道, 但从COX-2角度研究的则较少, 故本研究进行中药在COX-2作用机制方面的研究.
自从选择性COX-2抑制剂罗非昔布在临床应用后发现心血管方面的副作用后, 关于COX-2的研究进一步深入, 对COX-2在副作用方面的认识也有所加强, 相关研究增多. 有的研究认为选择性COX-2抑制剂也有不少副作用, 而中药在防治肿瘤中副作用较少, 因此寻找具有选择性COX-2抑制作用的副作用更少的中药有效成分成为研究热点.
本文主要不同点及创新之处在于从中药的角度, 研究莪术对胃癌的作用机制.
通过本研究, 对于中药作用的机制有了进一步的了解, 为临床选用中药提供了依据, 而且对于中药作用的机制可围绕COX-2进行进一步深入的研究, 从其上游或下游探讨. 更重要的是, 可进一步筛选具有选择性COX-2抑制作用的有效成分, 开发一类新药.
本研究观察了中药治疗肿瘤的部分机理或机制, 文章设计合理, 分析得恰当, 有较高的科学价值.
电编: 张敏 编辑:潘伯荣
| 1. | Zhang YY, Deng T, Hu ZF, Zhang QP, Zhang J, Jiang H. Mechanisms of Inhibiting Proliferation and Inducing Apoptosis of Human Gastric Cancer Cell Line SGC7901 by Ursolic Acid. Aizheng. 2006;25:432-437. [PubMed] |
| 2. | Yao HB, Wu AG, Chen YJ, Tang BH. Expression of COX-2 protein in colorectal carcinoma and the clinical implication. Diyi Junyi Daxue Xuebao. 2005;25:1524-1528. [PubMed] |
| 3. | Zhang J, Ji J, Yuan F, Yan C, Yu YY, Liu BY, Zhu ZG, Yin HR, Lin YZ. COX- 2 expression in gastric cancer and its relationship with lymphangiogenesis and lymph node metastasis. Zhonghua Weichangwaike Zazhi. 2005;8:348-351. [PubMed] |
| 4. | Sun WH, Sun YL, Fang RN, Ou XL, Xue QP, Shao Y, Xu HC, Cheng YL. Relationship between cyclooxy-genase-2 expression and angiogenesis in patients with gastric cancer. Zhonghua Weichangwaike Zazhi. 2005;8:343-347. [PubMed] |
| 5. | Yasuda H, Yamada M, Endo Y, Inoue K, Yoshiba M. Elevated cyclooxygenase-2 expression in patients with early gastric cancer in the gastric pylorus. J Gastroenterol. 2005;40:690-697. [PubMed] [DOI] |
| 6. | Park JH, Kang KH, Kim SH, Lee JH, Cho CM, Kweon YO, Kim SK, Choi YH, Bae HI, Kim MS. Expression of Cyclooxygenase-2 and Bcl-2 in human gastric adenomas. Korean J Intern Med. 2005;20:198-204. [PubMed] [DOI] |
| 7. | Spugnini EP, Porrello A, Citro G, Baldi A. COX-2 overexpression in canine tumors: potential therapeutic targets in oncology. Histol Histopathol. 2005;20:1309-1312. [PubMed] |
| 8. | Uefuji K, Ichikura T, Mochizuki H. Increased expression of interleukin-1alpha and cyclooxy-genase-2 in human gastric cancer: a possible role in tumor progression. Anticancer Res. 2005;25:3225-3230. [PubMed] |
| 9. | Tsutsumi S, Kuwano H, Shimura T, Morinaga N, Mochiki E, Asao T. Vascular endothelial growth factor C (VEGF-C) expression in pT2 gastric cancer. Hepatogastroenterology. 2005;52:629-632. [PubMed] |
| 10. | Leung WK, To KF, Go MY, Chan KK, Chan FK, Ng EK, Chung SC, Sung JJ. Cyclooxygenase-2 upregulates vascular endothelial growth factor expression and angiogenesis in human gastric carcinoma. Int J Oncol. 2003;23:1317-1322. [PubMed] [DOI] |
| 11. | Zhang J, Ji J, Yuan F, Zhu L, Yan C, Yu YY, Liu BY, Zhu ZG, Lin YZ. Cyclooxygenase-2 expression is associated with VEGF-C and lymph node metasta-ses in gastric cancer patients. Biomed Pharmacother. 2005;59 Suppl 2:S285-288. [PubMed] [DOI] |
| 12. | Ding YB, Shi RH, Tong JD, Li XY, Zhang GX, Xiao WM, Yang JG, Bao Y, Wu J, Yan ZG. PGE2 up-regulates vascular endothelial growth factor expression in MKN28 gastric cancer cells via epidermal growth factor receptor signaling system. Exp Oncol. 2005;27:108-113. [PubMed] |
| 13. | Hu PJ, Yu J, Zeng ZR, Leung WK, Lin HL, Tang BD, Bai AH, Sung JJ. Chemoprevention of gastric cancer by celecoxib in rats. Gut. 2004;53:195-200. [PubMed] [DOI] |
| 14. | Min C, Li Q, Liu H. The effect of "Jian Pi Dao Zhi Fang" on human gastric carcinoma cells. Zhongyaocai. 2004;27:935-937. [PubMed] |
| 15. | Li QM, Kan FJ, Min CY. Effect of Weikangning on gastric cancer cell growth and expression of vascular endothelial growth factor and its receptors KDR and Flt-1. World J Gastroenterol. 2005;11:938-942. [PubMed] [DOI] |
| 16. | Saukkonen K, Rintahaka J, Sivula A, Buskens CJ, Van Rees BP, Rio MC, Haglund C, Van Lanschot JJ, Offerhaus GJ, Ristimaki A. Cyclooxygenase-2 and gastric carcinogenesis. APMIS. 2003;111:915-925. [PubMed] [DOI] |
| 17. | Tatsuguchi A, Matsui K, Shinji Y, Gudis K, Tsukui T, Kishida T, Fukuda Y, Sugisaki Y, Tokunaga A, Tajiri T. Cyclooxygenase-2 expression correlates with angiogenesis and apoptosis in gastric cancer tissue. Hum Pathol. 2004;35:488-495. [PubMed] [DOI] |
| 18. | Correa P. Human gastric carcinogenesis: a multistep and multifactorial process-First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res. 1992;52:6735-6740. [PubMed] |
| 19. | Koga T, Shibahara K, Kabashima A, Sumiyoshi Y, Kimura Y, Takahashi I, Kakeji Y, Maehara Y. Overexpression of cyclooxygenase-2 and tumor angiogenesis in human gastric cancer. Hepatogas-troenterology. 2004;51:1626-1630. [PubMed] |
| 20. | Lu XG, Zhan LB, Feng BA, Qu MY, Yu LH, Xie JH. Inhibition of growth and metastasis of human gastric cancer implanted in nude mice by d-limonene. World J Gastroenterol. 2004;10:2140-2144. [PubMed] [DOI] |
| 21. | Ichinoe M, Mikami T, Shiraishi H, Okayasu I. High microvascular density is correlated with high VEGF, iNOS and COX-2 expression in penetrating growth-type early gastric carcinomas. Histopathology. 2004;45:612-618. [PubMed] [DOI] |
| 22. | Smith GV, Farthing MJ. The effect of ascorbic acid on Helicobacter pylori induced cyclooxygenase 2 expression and prostaglandin E2 production by gastric epithelial cells in vitro. Helicobacter. 2005;10:83-89. [PubMed] [DOI] |
| 23. | Shi H, Xu JM, Hu NZ, Xie HJ. Prognostic significan-ce of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcino-ma. World J Gastroenterol. 2003;9:1421-1426. [PubMed] [DOI] |
| 24. | Jayaprakasam B, Zhang Y, Nair MG. Tumor cell proliferation and cyclooxygenase enzyme inhibitory compounds in Amaranthus tricolor. J Agric Food Chem. 2004;52:6939-6943. [PubMed] [DOI] |
| 25. | Fu YG, Sung JJ, Wu KC, Wu HP, Yu J, Chan M, Chan VY, Chan KK, Fan DM, Leung WK. Inhibition of gastric cancer-associated angiogenesis by antisense COX-2 transfectants. Cancer Lett. 2005;224:243-252. [PubMed] [DOI] |
| 26. | Jang TJ. Expression of proteins related to prostag-landin E2 biosynthesis is increased in human gastric cancer and during gastric carcinogenesis. Virchows Arch. 2004;445:564-571. [PubMed] [DOI] |
| 27. | Chen JH, Wu CW, Kao HL, Chang HM, Li AF, Liu TY, Chi CW. Effects of COX-2 inhibitor on growth of human gastric cancer cells and its relation to hepatocyte growth factor. Cancer Lett. 2005;. [PubMed] |
| 28. | Tendo M, Yashiro M, Nakazawa K, Yamada N, Hirakawa K. Inhibitory effect of a selective cyclo-oxygenase inhibitor on the invasion-stimulating activity of orthotopic fibroblasts for scirrhous gastric cancer cells. Cancer Sci. 2005;96:451-455. [PubMed] [DOI] |
| 29. | Li JY, Yu JP, Luo HS, Yu BP, Tian G, Mei Q, Huang JA. Influence of selective cyclooxygenase-2 inhibitor on proliferation of human gastric cancer cells. Aizheng. 2002;21:625-629. [PubMed] |
| 30. | Yu J, Tang BD, Leung WK, To KF, Bai AH, Zeng ZR, Ma PK, Go MY, Hu PJ, Sung JJ. Different cell kinetic changes in rat stomach cancer after treatment with celecoxib or indomethacin: implications on chemoprevention. World J Gastroenterol. 2005;11:41-45. [PubMed] [DOI] |