修回日期: 2006-04-15
接受日期: 2006-04-18
在线出版日期: 2006-05-28
目的: 分析不同克拉霉素浓度下H. pylori菌株耐药的发生机制, 以期发现新的耐药基因.
方法: 以H. pylori 26695株为初发菌株, 经抗生素压力筛选、转座子Tn5插入失活、E-test检测等实验方法探讨H. pylori对克拉霉素的耐药机制.
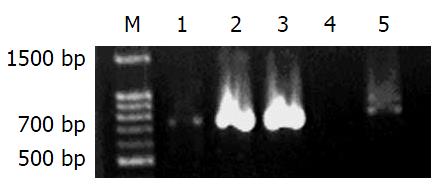
结果: 经12次传代, 在0.5 mg/L克拉霉素浓度下培养出的耐药株经-80 ℃冻存30 d复苏, 仍为抗性菌株; 克拉霉素抗性的转座插入株于700 bp左右出现条带; 经96-168 h培养, 单纯经抗生素选择压力筛选的低浓度耐药株E-test出现椭圆形抑菌环, 而经Tn5插入的克拉霉素抗性菌株无抑菌环出现. 对插入位点基因的测序发现该片段与H. pylori 26695菌株中"H. pylori1469"完全同源, 为编码Omp31的基因.
结论: H. pylori对克拉霉素的低浓度耐药, 经转座后可转化为高浓度耐药, 其耐药性的发生与23S rRNA点突变以外的Omp31基因有关.
引文著录: 姜葵, 何利华, 赵飞, 王邦茂, 张建中. 一种新的幽门螺杆菌克拉霉素耐药相关基因. 世界华人消化杂志 2006; 14(15): 1516-1519
Revised: April 15, 2006
Accepted: April 18, 2006
Published online: May 28, 2006
AIM: To investigate the mechanism of H. pylori resistance to clarithromycin in different concen-trations, and to look for a novel gene associated with clarithromycin resistance.
METHODS: H. pylori 26695 were used as the primary strain. Antibiotic selection pressure test, mutation by transponson (Tn5) containing chloromycetin marker and E-test were performed for the analysis of H. pylori resistance to clarithromycin in different concentrations.
RESULTS: After 12 generations, the 0.5 mg/L clarithromycin resistance strains remained resistant after the storage in -80 ℃ for 30 d. Clarithro-mycin-restant H. pylori which had been inserted by transponson showed a band of 700 bp. After culturing for 98-168 h, the resistant H. pylori from clarithromycin selection pressure test showed an elliptic inhibition ring. On the other hand, clarithromycin-resistant H. pylori inserted by trans-ponson showed no inhibition ring. After sequencing, the gene at the insertion site was homogenous with H. pylori1469, which coded Omp31.
CONCLUSION: The resistant H. pylori from lower concentrations of clarithromycin can be changed into higher concentration resistance strain through transponson insertion, indicating that the mechanism of H. pylori resistance to clarithromycin may be associated with Omp31 apart from 23S rRNA mutation.
- Citation: Jiang K, He LH, Zhao F, Wang BM, Zhang JZ. A novel gene associated with clarithromycin resistance of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2006; 14(15): 1516-1519
- URL: https://www.wjgnet.com/1009-3079/full/v14/i15/1516.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i15.1516
自1982年Warren和Marshall从慢性胃炎患者体内分离出幽门螺杆菌(Helicobacter pylori, H. pylori)后, H. pylori一直备受世界各地学者们的关注[1]. H. pylori是慢性活动性胃炎、消化性溃疡及胃黏膜相关性淋巴样组织(mucosa-associated lymphoid tissue, MALT)淋巴瘤的病因, 是胃癌发生的危险因子, 1994年WHO已将其列为胃癌的Ⅰ类致癌因子, 也是迄今第一个明确作为肿瘤病因的细菌. 随着对H. pylori的深入研究, 发现H. pylori与胃肠外疾病也有关[2]. 我国H. pylori感染率为50%-60%, 全国肿瘤防治中心统计, 近年来胃癌发病率位居20余种肿瘤的第1位, 根除H. pylori可治疗慢性胃炎、消化性溃疡, 可以使消化性溃疡的年复发率从80%降低至4%[3]. 抗H. pylori感染通常采用多药联合治疗, 包括抗生素、质子泵抑制剂(proton pump inhibitor, PPI)和/或铋剂. H. pylori于体外对大多数常见抗生素敏感, 所以从理论上说只要服用足够剂量和疗程的敏感抗生素, H. pylori是很容易被根除的, 但耐药性H. pylori的感染率不断升高, 成为根除失败的主要原因之一. 克拉霉素(clarithromycin, CLA)是新一代的大环内酯类抗生素, 作为目前根除H. pylori治疗方案中的一线药物, 其通过与细菌核糖体紧密结合, 作用于23S rRNA V区的多肽转移酶环, 抑制多肽转移活性, 影响核糖体的移位过程, 阻止肽链延长, 从而抑制细菌蛋白质的合成, 达到杀菌目的[4]. 但是近年来H. pylori对CLA的耐药率国内外均呈上升趋势. 目前对克拉霉素耐药机制的研究主要集中在对H. pylori 23S rRNA基因的分析[5], 其他基因与克拉霉素耐药的关系在国内外未见报道, 但研究中发现许多H. pylori耐药菌株的23S rRNA并未发生突变. 我们拟通过抗生素选择压力、转座子插入失活、E-test检测等方法分析不同CLA浓度下筛选的耐药H. pylori菌株的发生机制, 以期进一步发现新的克拉霉素耐药基因.
H. pylori 26695原始株, 经抗生素选择压力筛选的低浓度(0.5 mg/L克拉霉素)耐药株C3、C4, 来自中国疾病预防控制中心传染病预防控制所诊断室H. pylori菌种保存库. 克拉霉素原药, 购自中国药品及生物制品检定所. 克拉霉素E-test试条, 购自广东倍肯公司. pMOD-2-<camB>质粒, 张建中研究员自美国华盛顿大学医学院分子生物学系实验室构建并带回, 由中国疾病预防控制中心传染病预防控制所传染病诊断室保存并提供. Labconco生物安全柜、混合气体培养箱、Eagle Eye Ⅱ型凝胶成像系统、EquiBio电击转化仪、PCR扩增仪、光学显微镜.
将pMOD-2-<camB> 5 μL, 10×mol/L buffer 2 μL, pvuⅡ(15 MU/L)1 μL, 灭菌TE(pH 7.5)12 μL依次加入到0.5 mL的灭菌Eppendorf管中, 混匀, 封口, 37 ℃水浴4 h酶切. 酶切产物纯化按照Qiagen纯化试剂盒说明书操作. 将酶切纯化后的Tn5-<camB> 2.5 μL, EZ∷TN transpoase 5 μL, 灭菌1000 mL/L glycerol 2.5 μL依次加入到0.5 mL的灭菌Eppendorf管中, 混匀, 封口, 37 ℃水浴0.5 h. 取2 mm电击杯在750 mL/L的乙醇液中浸泡2 h, 取出后在生物安全柜中将乙醇完全挥发, 同时用紫外线照射, 盖紧塞后, 置于-20 ℃冰箱预冷1 h; 在生物安全柜中取1 μL transposome加入到预处理的H. pylori 26695菌悬液中, 用枪吹打均匀, 迅速转移至预冷的电击杯中, 放置在电转化仪上进行电转化. 条件: A1 V: 2500 C: 25; R: 201 T: 5; 延迟时间10 s. A2 V: 120 C: 150; R: 99 T: 14.8. 电击转化后的菌液均匀涂布于普通哥伦比亚血平皿, 在混合气体培养箱内培养复苏24 h, 然后将菌苔全部刮下悬菌于200 μL的灭菌脑心浸液保存管内, 并重新涂布于氯霉素抗性哥伦比亚血平皿, 培养72 h, 再均匀涂布于CLA平皿, 经16, 10, 8, 3, 2, 1, 0.5 mg/L, 7个浓度梯度平皿掺入压力选择. 将挑取的单克隆分别进行过氧化氢酶, 氧化还原酶, 尿素酶鉴定. 选择经转座子插入的耐药单克隆d1、d2、d3及单纯经抗生素选择压力筛选的低浓度耐药株C3、C4进行E-test: 用棉拭子蘸取菌液(菌液浓度为1011 CFU/L)均匀涂布于整个培养基表面, 置干; 镊取克拉霉素试条的E端, 将试条放在已经接种待测H. pylori的琼脂表面, 试条标有MIC刻度面向上, 浓度最大端靠近平皿边缘, 37 ℃微需氧培养72-96 h, 在椭圆抑菌环与试条交界处读取MIC值, 以原始26695 H. pylori菌株为对照.
经36 d 12次传代, 在0.5 mg/L CLA浓度下选择出5株耐药菌, 命名为d1-d5, 置-80 ℃冻存30 d后复苏, d1-d3在无抗性平皿连续传代3次转到含CLA 0.5 mg/L平皿, 生长良好, 加大CLA浓度到1, 2, 3 mg/L, 终浓度为3 mg/L. d1-d5过氧化氢酶实验: 迅速产生大量气泡; 氧化还原酶实验: 菌体变成黑色; 尿素酶实验: 指示剂玫瑰红色. 克拉霉素抗性的转座插入株的检测: d1, d2, d3于700 bp左右出现条带(图1).
经北京博亚公司测序, 结果如下:
AGCCTTCaAGCcTTCAAAACAAGCctGCCCGTAgtGcAAgACCGGCgAGCCTTCgcTgAg
TTGtAACAtGTTTTCgCtCACCAATCCgCcTTGCgACCAAgAGCCGTTTTTATAAgtGGC
GATgAAgCGAAAATCCGTTTTAAtGTAGCTAAAGCCTAAATTTTTCCAGTCtAAaTTTTC
TAAATTTGCCATTTTCACaCCTTTAAAtGGATAGTTTCAGGCGTGATTGTaTCTAAAAAG
GGGTtAAAAAtCCCtCAAGtAACtGATTTGAAACGCAtAAActCTACgCAcaTCAgCCtG
TAAGGtGtAtCCcTTTTCgTTGGTAAgAgAgAAAAgcTGGtGtGtGAtCGtAGGCacTTT
AatCCCTAaTTCtAGGCtATtGtGTTTAGCGAtAtGGGtGCGgACCCCAAAcTTCCATAA
AAACtGGAAATtGGCCGGGCtATAACtGGAATTGCtGtGGtGTTTTGCAtAAtGAGCGAT
TTCTTTACtGAtGCTCGTTGCCCAACTATCCCCCGCTAATtGgATCCCCACCACAAAACC
AAAAACCAtGTTTTCTTTATTCACAAAATTCCACAGCGtATCTAACCCCACGCCATAAGT
GAATAAATTGACATAgTATTGCCCCTGATAGGCTGtCTCTTATACACATCTcAACCCTGA
AGCTCTtGTtGGCTAGtGgcGTAgtcC
将测序结果在http://www.ncbi.nlm.gov/BLAST/中比对分析, 发现该片段与H. pylori 26695菌株中"H. pylori1469"完全同源, 该基因在H. pylori 26695中编码outer membrane protein (omp31).
经96 h培养后单纯经抗生素选择压力筛选的低浓度耐药株C3于6 mg/L可见椭圆形抑菌环, 而d1, d2, d3, C4无抑菌现象出现, 平皿中有菌落发育, 继续培养72 h, C4于8 mg/L也出现椭圆形抑菌环, d1, d2, d3仍无抑菌现象, 平皿中细菌生长良好, 包括试条周围区域.
克拉霉素是目前根除H. pylori治疗方案中的一线药物, 其通过与细菌核糖体紧密结合, 作用于23S rRNA V区的多肽转移酶环, 抑制多肽转移活性, 影响核糖体的移位过程, 阻止肽链延长, 从而抑制细菌蛋白质的合成, 达到杀菌目的. 但是近年来H. pylori对CLA的耐药率国内外均呈上升趋势. 目前对于克拉霉素耐药机制的研究主要集中在H. pylori 23S rRNA基因, 已报道在23S rRNA的V区至少存在5种不同的点突变与CLA的耐药有关, 即: A2115G, G2141A, A2142G, A2142C和A2143G[6], 除此以外基因所致者国内外未见报道. Shen et al[7]以实验室诱导的耐药菌株为研究对象, 采用变性高效液相色谱(DH. PYLORILC)和测序技术, 观察基因突变与耐药性形成的关系, 结果提示, 在实验室诱导CLR耐药过程中, 首先形成的低水平耐药性涉及23S rRNA点突变以外的其他基因的改变, 然后产生23S rRNA的A2143G突变, 进而导致更高水平的耐药性的形成. 我们通过回复稳定性实验研究发现所筛选到的耐药克隆为稳定的基因型耐药, 可传给子代菌, 即使在失去抗性压力的条件下仍然可以将耐药基因型稳定传代保留.
E-test是目前用于检测H. pylori对抗生素敏感性的常用方法之一, 当试条放在一个已接种了一定菌量H. pylori的琼脂平皿后, 抗生素迅速释放入琼脂中, 在试条下方形成一个抗生素浓度的连续梯度, 经孵育后即可见到一个以试条为中心的、对称的椭圆抑菌环, 其边缘与试条交界处的刻度即为MIC值[8-9]. 我们前期工作, 即经过抗生素选择压力实验筛选出的耐克拉霉素单克隆E-test结果显示, 分别在其对应浓度范围(6 mg/L, 8 mg/L)内出现椭圆形抑菌环. 转座子Tn5长期以来被广泛应用于发现新基因、分析基因功能和构建突变体库[10-12]. 近年, 通过对转座酶的结构、DDE模体等的研究, Tn5转座机制、转座频率调控等才得到了较深刻的认识[13-16]. 在Mg2+存在的条件下, 两个转座酶分子末端和活性中心的氨基酸残基分别结合到Tn5末端, 形成发夹结构的复合体, 具有切割DNA的活性. Tn5攻击靶序列, 其插入位点形成9 bp的黏性末端, 转座子插入到靶序列之中. 在DNA聚合酶的作用下补平缺口, 转座子的两端形成9 bp的正向重复序列, 完成转座插入. 我们以EZ∷TN系列转座产品为主要工具, 利用其如下特点: (1)可以随机插入到目的基因, 插入后稳定不会丢失; (2)带有氯霉素标签, 易于筛选; (3)序列已知, 带有测序引物. 通过插入失活和筛选, 以及耐药实验检测发现, H. pylori对克拉霉素的低浓度耐药, 经转座后可转化为高浓度耐药, 推测与23S rRNA点突变以外的其他基因的改变有关. 我们将测序结果在http://www.ncbi.nlm.nih.gov/BLAST/中比对分析, 发现该片段与H. pylori 26695菌株中"H. pylori 1469"完全同源, 该基因在H. pylori 26695中编码outer membrane protein (omp31), 为一新发现的与克拉霉素耐药相关基因; 该基因功能的发现和进一步的研究, 对认识H. pylori的耐药机制[17-20]、指导临床有效的根除H. pylori、控制人群中H. pylori对克拉霉素的原发耐药和继发耐药的发生率都具有重要意义.
H. pylori是慢性活动性胃炎、消化性溃疡及胃黏膜相关性淋巴样组织淋巴瘤的病因, 是胃癌发生的危险因子, 根除H. pylori可治疗慢性胃炎、消化性溃疡. 由于耐药性H. pylori的感染率不断升高, 致使H. pylori根除率不甚理想. 在标准的三联或四联疗法中, 克拉霉素是一线抗生素. 近年来H. pylori对克拉霉素的耐药率国内外均呈上升趋势. 目前对克拉霉素耐药机制的研究主要集中在对H. pylori 23S rRNA 基因的分析, 其他基因与克拉霉素耐药的关系在国内外未见报道.
本文就H. pylori对克拉霉素的耐药机制进行了研究, 并初步筛选出一个新的耐药相关基因.
近年来, 对H. pylori的耐药机制尽管进行了广泛深入研究, 但关于其对克拉霉素的耐药机制, 除23S rRNA外未见报道. 本课题初步筛选出一个新的耐药相关基因, 对于今后临床提高H. pylori根除率具有重要意义.
H. pylori相关的基础与临床研究一直是消化系疾病研究的热点之一. H. pylori的耐药性是临床上急需解决的难题, 深入研究其耐药机制的产生、形成尤为重要. 本研究对H. pylori的耐药机制进行了研究, 并初步筛选出一个新的耐药相关基因, 该研究具有一定的开创性, 选题准确, 实验设计合理, 结果可靠, 具有一定的理论和临床指导意义.
电编: 张敏 编辑:潘伯荣
| 1. | Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1:1311-1315. [PubMed] [DOI] |
| 3. | Nervi G, Liatopoulou S, Cavallaro LG, Gnocchi A, Dal-Bo N, Rugge M, Iori V, Cavestro GM, Maino M, Colla G. Does Helicobacter pylori infection eradication modify peptic ulcer prevalence? A 10 years' endoscopical survey. World J Gastroenterol. 2006;12:2398-2401. [PubMed] [DOI] |
| 4. | Versalovic J, Shortridge D, Kibler K, Griffy MV, Beyer J, Flamm RK, Tanaka SK, Graham DY, Go MF. Mutations in 23S rRNA are associated with clarithromycin resistance in Helicobacter pylori. Antimicrob Agents Chemother. 1996;40:477-480. [PubMed] |
| 5. | Hulten K, Gibreel A, Skold O, Engstrand L. Macrolide resistance in Helicobacter pylori: mechan-ism and stability in strains from clarithromycin-treated patients. Antimicrob Agents Chemother. 1997;41:2550-2553. [PubMed] |
| 6. | Occhialini A, Urdaci M, Doucet-Populaire F, Bebear CM, Lamouliatte H, Megraud F. Macrolide resistance in Helicobacter pylori: rapid detection of point mutations and assays of macrolide binding to ribosomes. Antimicrob Agents Chemother. 1997;41:2724-2728. [PubMed] |
| 7. | Shen J, Zhang JZ, Ke Y, Deng D. Formation of A2143G mutation of 23S rRNA in progression of clarithromycin resistance inHelicobacter pylori 26695. Microb Drug Resist. 2005;11:100-106. [PubMed] [DOI] |
| 8. | 胡 伏莲, 周 殿元. 幽门螺杆菌感染的基础与临床. 北京: 中国科学技术出版社 2002; 309-311. |
| 11. | Jenks PJ, Chevalier C, Ecobichon C, Labigne A. Identification of nonessential Helicobacter pylori genes using random mutagenesis and loop amplifi-cation. Res Microbiol. 2001;152:725-734. [PubMed] [DOI] |
| 12. | Chang KC, Yeh YC, Lin TL, Wang JT. Identification of genes associated with natural competence in Helicobacter pylori by transposon shuttle random mutagenesis. Biochem Biophys Res Commun. 2001;288:961-968. [PubMed] [DOI] |
| 13. | Salama NR, Shepherd B, Falkow S. Global trans-poson mutagenesis and essential gene analysis of Helicobacter pylori. J Bacteriol. 2004;186:7926-7935. [PubMed] [DOI] |
| 14. | Guo BP, Mekalanos JJ. Helicobacter pylori mutagenesis by mariner in vitro transposition. FEMS Immunol Med Microbiol. 2001;30:87-93. [PubMed] [DOI] |
| 15. | Lin TL, Shun CT, Chang KC, Wang JT. Isolation and characterization of a HpyC1I restriction-modification system inHelicobacter pylori. J Biol Chem. 2004;279:11156-11162. [PubMed] [DOI] |
| 16. | Ton-Hoang B, Guynet C, Ronning DR, Cointin-Marty B, Dyda F, Chandler M. Transposition of ISHp608, member of an unusual family of bacterial insertion sequences. EMBO J. 2005;24:3325-3338. [PubMed] [DOI] |
| 17. | Sakharkar KR, Sakharkar MK, Chow VT. Gene fusion in Helicobacter pylori: making the ends meet. Antonie Van Leeuwenhoek. 2006;89:169-180. [PubMed] [DOI] |
| 18. | Moore JM, Salama NR. Mutational analysis of metronidazole resistance in Helicobacter pylori. Antimicrob Agents Chemother. 2005;49:1236-1237. [PubMed] [DOI] |
| 19. | Ribeiro ML, Gerrits MM, Benvengo YH, Berning M, Godoy AP, Kuipers EJ, Mendonca S, van Vliet AH, Pedrazzoli J Jr, Kusters JG. Detection of high-level tetracycline resistance in clinical isolates of Helicobacter pylori using PCR-RFLP. FEMS Immunol Med Microbiol. 2004;40:57-61. [PubMed] [DOI] |
| 20. | Jiang K, Zhang JZ, Pan GZ. Mechanism of metronidazole resistance in Helicobacter pylori. Chin J Dig Dis. 2001;2:95-99. [DOI] |