修回日期: 2006-03-19
接受日期: 2006-03-25
在线出版日期: 2006-05-28
目的: 研究PTEN, MMP-9和Caspase-3在胃癌及正常胃组织中的表达, 探讨他们在胃癌的发生、发展、浸润和转移中的作用.
方法: 选择临床病理资料齐全的胃癌蜡块标本54例, 另取正常胃黏膜标本15例作对照. 采用SP免疫组化方法检测PTEN, MMP-9和Caspase-3在其中的表达.
结果: 胃癌中PTEN低表达(28/54, 51.9%), 且肿瘤浸润深(P = 0.004)、有淋巴(P = 0.003)和远隔转移(P = 0.015)、临床分期高(P = 0.001)、病理分化低(P = 0.008)时降低. 胃癌中MMP-9高表达(41/54, 75.9%), 且肿瘤浸润深(P = 0.040)、有淋巴转移(P = 0.025)、临床分期高(P = 0.039)、病理分化低(P = 0.009)时增高. 胃癌中Caspase-3低表达(12/54, 22.2%), 且有淋巴转移(P = 0.045)、临床分期高(P = 0.015)、病理分化低(P = 0.035)时降低. 胃癌中PTEN与MMP-9 (r = -0.543, P = 0.001), Caspase-3与MMP-9的表达负相关(r = -0.741, P = 0.001), PTEN与Caspase-3的表达正相关(r = 0.515, P = 0.001).
结论: 胃癌中PTEN, Caspase-3低表达, MMP-9高表达; PTEN、MMP-9和Caspase-3可作为胃癌诊断和预后判断的指标.
引文著录: 张丹丹, 郭琳, 王强. 胃癌组织中PTEN, MMP-9和Caspase-3表达的关系. 世界华人消化杂志 2006; 14(15): 1487-1492
Revised: March 19, 2006
Accepted: March 25, 2006
Published online: May 28, 2006
AIM: To study the expression of PTEN, matrix metalloproteinase-9 (MMP-9), and Caspase-3 in gastric cancer, and to discuss their roles and correlations in the occurrence, development, invasion and metastasis of gastric cancer.
METHODS: SP immunohistochemistry was used to measure the expression of PTEN, MMP-9, and Caspase-3 in 54 samples of gastric carcinoma selected from paraffin wax embodied specimens with complete clinicopathological data, and another 15 cases of normal gastric mucosa.
RESULTS: The expression of PTEN in gastric cancer was low (28/54, 51.9%), and reduced with the increased invasive depth (P= 0.004) and clinical stages (P = 0.001), reduced histological differentiation (P = 0.008) and occurrence of lymph node (P = 0.003) and long distance metastasis (P = 0.015). The expression of MMP-9 in gastric cancer was high (41/54, 75.9%), and increased with increased invasive depth (P = 0.04) and clinical stages (P = 0.039), reduced histological differentiation (P = 0.009), and occurrence of lymph node metastasis (P = 0.025). The expression of Caspase-3 in gastric cancers was low (12/54, 22.2%), and reduced with increased clinical stages (P = 0.015), reduced histological differentiation (P = 0.035) and occurrence of lymph node metastasis (P = 0.045). The expression of PTEN and MMP-9 (r = -0.543, P = 0.001), Caspase-3 and MMP-9 (r = -0.741, P = 0.001) were in inversely correlation, while the expression of PTEN and Caspase-3 (r = 0.515, P = 0.001) were in positive correlation in gastric cancer.
CONCLUSION: PTEN and Caspase-3 are lowly expressed in gastric caner, while MMP-9 is highly expressed. PTEN, MMP-9, and Caspase-3 can serve as the markers in the diagnosis and prognosis of gastric cancer.
- Citation: Zhang DD, Guo L, Wang Q. Relationship among PTEN, matrix metalloproteinase-9, and Caspase-3 Expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(15): 1487-1492
- URL: https://www.wjgnet.com/1009-3079/full/v14/i15/1487.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i15.1487
胃癌的发生、发展是一个多因素、多步骤的过程, 涉及到癌基因、抑癌基因表达的失调, 细胞凋亡、细胞运动和迁移调控的异常等多方面机制. PTEN是1997年才发现的新的肿瘤抑制基因, 具有双特异性磷酸酶活性, 他通过诱导细胞周期阻滞和细胞凋亡等抑制肿瘤发生、发展, 并能多途径地抑制肿瘤浸润和转移. 细胞外基质和基底膜降解是恶性肿瘤浸润和转移的关键环节, MMPs的作用底物是细胞外基质和基底膜中的纤维网架分子, 其中MMP-9可特异性地降解其中的Ⅳ型胶原. 细胞凋亡功能的抑制将导致肿瘤的发生及免疫功能的异常, Caspase家族是直接导致细胞凋亡的蛋白酶系统, Caspase-3是人类细胞凋亡的关键蛋白酶. 在多种恶性肿瘤中均可以检测到PTEN、Caspase-3表达缺失及MMP-9过表达. 我们对胃癌组织中PTEN、MMP-9、Caspase-3的表达与临床病理特征相关性的研究如下.
2001-2003年手术切除, 病理证实为腺癌, 临床及病理资料齐全的胃癌蜡块标本54例, 术前均未行化疗或放疗. 男37例, 女17例; 年龄38-78岁; 肿瘤的原发灶大小、深度(T)、淋巴结转移(N)由病理确定, 远处转移(M)由病理学和临床确定. 其中肿瘤直径<5 cm 37例, ≥5 cm 17例; 肿瘤浸润深度在浆膜下者15例, 浸透浆膜者39例; 组织学分型: 高分化19例, 中分化17例, 低分化18例; 局部淋巴结无转移29例, 有转移25例; 远隔无转移42例, 有转移12例. 根椐1997年国际抗癌联盟(IUCC)制定的TNM分期标准进行临床分期, Ⅰ期12例, Ⅱ期14例, Ⅲ期16例, Ⅳ期12例. 另取正常胃黏膜组15例作对照, 标本取自胃溃疡或十二指肠溃疡手术标本中正常的胃黏膜组织, 并经病理观察证实且排除重度不典型增生. 男10例, 女5例, 年龄44-77岁. 浓缩型PTEN鼠抗人mAb(30617665), MMP-9兔抗人mAb(BA0573), Caspase-3鼠抗人mAb(JHM62, ZM-0320)购于北京中山生物制品有限公司, S-P试剂盒及DAB显色试剂盒购自福州市迈新生物技术开发公司(AR1022). 免疫组织化学染色所需的常规试剂: 枸橼酸盐缓冲液(0.01 mol/L, pH 6.0)、磷酸氢二钠、氯化钠、二甲苯、乙醇、过氧化氢、苏木素等, 普通实验室冰箱、切片机、烤片机、高压锅、温育箱、湿盒、恒温振荡器、Olympus BX41显微镜、显微数码照相机Olympus BX40F4等, 均由中国医科大学附属二院病理科提供.
常规HE染色, 确定标本的组织分化程度. 采用链霉素抗生物素蛋白-过氧化酶连接(SP)免疫组织化学方法检测PTEN, MMP-9, Caspase-3在胃癌及正常胃组织中的表达. 具体操作步骤按常规进行, 其一抗工作稀释度: PTEN为1:75, MMP-9为1:100, Caspase-3为1:200. 用已知阳性的乳腺癌切片作为阳性对照, PBS缓冲液代替一抗作阴性对照. 以细胞质内出现明显棕黄色颗粒为阳性细胞. 先于低倍镜下观察, 排除肿瘤坏死出血区及边缘反应区, 于肿瘤内染色相对密集区选取5个视野分别进行细胞计数, 高倍镜下进行观察, 以阳性细胞数占同类计数细胞的百分比为阳性细胞率. 按阳性细胞率, 将3种蛋白染色结果进行半定量测定, (1)PTEN: 阴性(-): 阳性细胞率<5%; 弱阳性(+): 阳性细胞率为5%-25%; 阳性(++): 阳性细胞率为25%-50%; 强阳性(+++): 阳性细胞率>50%. (2)MMP-9: 于肿瘤侵袭边缘及肿瘤内染色相对密集区选取5个视野, 阴性(-): 无明显的阳性细胞; 弱阳性(+): 阳性细胞率<25%; 阳性(++): 阳性细胞率为25%-75%; 强阳性(+++): 阳性细胞率>75%. (3)Caspase-3: 阴性(-): 阳性细胞率<5%; 阳性(+): 阳性细胞率≥5%.
统计学处理 采用SPSS 12.0软件包进行统计分析. PTEN, MMP-9, Caspase-3为计数资料, 各个相关因素的差异性比较采用χ2检验. PTEN, MMP-9, Caspase-3各指标间的相关性研究采用相关分析. 各检验方法皆以P<0.05为差异显著标准.
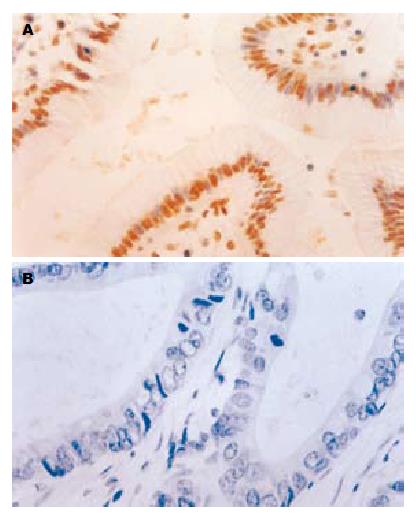
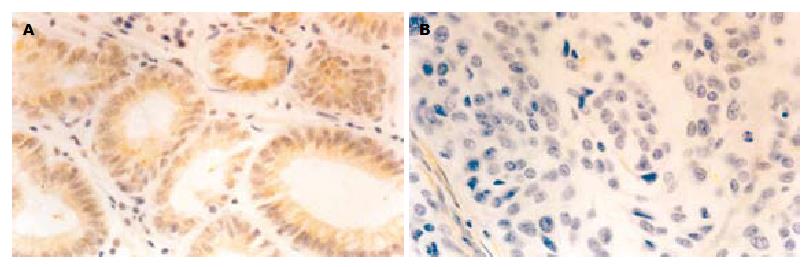
PTEN在正常胃组织中的阳性表达率(+~+++)为100%, 位于胞质. 在胃癌组织中的阳性表达率为51.9%, 明显低于在正常胃组织中的表达(P<0.01, 图1). 与胃癌的肿瘤浸润深度、淋巴转移、远隔转移、临床分期呈负相关(P<0.05), 随肿瘤浸润深度的加深、淋巴转移的产生、远隔转移的发生、临床分期的提高而降低; 与肿瘤的病理分化程度呈正相关(P<0.05), 随肿瘤病理分化程度的降低而降低. 与患者的性别、年龄、肿瘤大小无相关性(P>0.05).
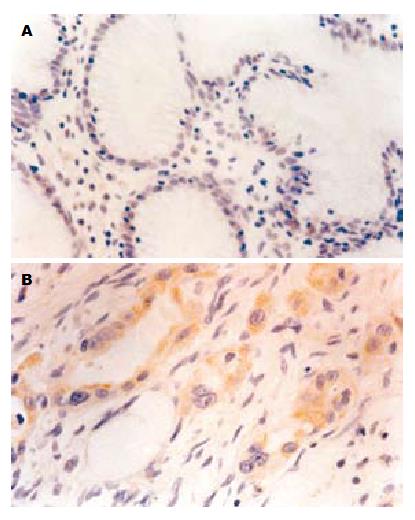
MMP-9在正常胃组织中的阳性表达率(+~+++)为26.7%. 在胃癌组织中的阳性表达率为75.9%, 主要表达于癌巢和正常组织交接部位, 癌细胞及间质细胞都有表达, 多定位于胞质, 明显高于在正常胃组织中的表达(P<0.05, 图2). 与胃癌的肿瘤浸润深度、淋巴转移、临床分期呈正相关(P<0.05), 随肿瘤浸润深度的加深、淋巴转移的产生、临床分期的提高而明显增高; 与肿瘤的病理分化程度呈负相关(P<0.05), 随肿瘤病理分化程度的降低而增高. 与患者的性别、年龄、肿瘤大小、远隔转移无相关性(P>0.05).
Caspase-3在正常胃组织中的阳性表达率为53.3%, 位于胃小凹的黏液上皮细胞, 顶部染色最强, 颈部细胞和固有腺体少见阳性细胞. 在胃癌组织中的阳性表达率为22.2%, 明显低于在正常胃组织中的表达(P<0.05, 图3). 与胃癌的淋巴转移、远隔转移、临床分期呈负相关(P<0.05), 随淋巴转移的产生、临床分期的提高而明显降低; 与肿瘤的病理分化程度呈正相关(P<0.05), 随肿瘤病理分化程度的降低而降低. 与患者的性别、年龄、肿瘤大小、浸润深度、远隔转移无相关性(P>0.05).
胃癌组织中PTEN与MMP-9的表达呈负相关(P<0.001, r = -0.543). PTEN与Caspase-3的表达呈正相关(P<0.001, r = 0.515). Caspase-3与MMP-9的表达呈负相关(P<0.001, r = -0.741). 胃癌PTEN, MMP-9和Caspase-3表达与病理因素的关系见表1.
| 病理因素 | n | PTEN n (%) | MMP-9 n (%) | Caspase-3 n (%) | |
| 浸润深度 | 浆膜下 | 15 | 13(86.7) | 8(53.3) | 6(40.0) |
| 浸透浆膜 | 39 | 15(38.5)b | 33(84.6)a | 6(15.4) | |
| 分化 | 高 | 19 | 12(63.2) | 10(52.6) | 8(42.1) |
| 中 | 17 | 12(70.6) | 14(82.4) | 2(11.8) | |
| 低 | 18 | 4(22.2)b | 17(94.4)b | 2(11.1)a | |
| 淋巴转移 | 无 | 29 | 21(72.4) | 18(62.1) | 10(34.5) |
| 有 | 25 | 7(28.0)b | 23(92.0)a | 2(8.0)a | |
| 远隔转移 | 无 | 42 | 26(61.9) | 31(73.8) | 10(23.8) |
| 有 | 12 | 2(16.7)a | 10(83.3) | 2(16.7) | |
| TNM分期 | Ⅰ+Ⅱ | 26 | 20(76.9) | 16(61.5) | 10(38.5) |
| Ⅲ+Ⅳ | 28 | 8(28.6)b | 25(89.3)a | 2(7.1)a | |
PTEN即与张力蛋白同源的、第10染色体丢失的磷酸酶(phosphatase and tensin homolog deleted in chromosome10, PTEN)基因[1-3], 定位于人类染色体10q23.3, 编码由403个氨基酸残基组成的蛋白质. PTEN蛋白包括氨基端的磷酸酶结构域、C2结构域和羧基端结构域[4], 通过脂质磷酸酶活性特异性的去除磷脂酰肌醇-3, 4, 5-三磷酸(phosphatidylinositol-3, 4, 5-trisphosphate, PIP3)3'位上的磷酸基团, 负性调控PI3K/蛋白激酶B(PKB/Akt)通路, 使细胞周期依赖性激酶(CDK)抑制剂p27去磷酸化, 并可以提高Caspase-3活性, 使细胞周期停滞在G1期, 促进细胞凋亡, 抑制细胞外基质和基底膜的降解而发挥其抑癌作用[5-6]. 研究发现, PTEN在多种良恶性肿瘤中均可以检测到突变与缺失, 胃癌中也可以检测到PTEN表达的异常[7]. 将野生型PTEN基因转导到肿瘤细胞中, 会发现肿瘤细胞的生长明显受到抑制[8]. Sano et al[9]发现, PTEN蛋白表达高低与患者的病理分级及预后有关, 预后越差, 恶性程度越高, PTEN蛋白表达水平越低. 我们发现, PTEN在胃癌组织中的表达率明显低于在正常胃组织中的表达, 并随肿瘤病理分化程度的降低、浸润深度的加深、淋巴转移的发生、远隔转移的产生及临床分期的增高而降低(P<0.05), 与文献报道相符, 提示PTEN基因表达的缺失与胃癌的发生、发展、浸润和转移密切相关, 而且可能为判断胃癌的恶性程度提供依据.
细胞外基质(extracellular matrix, ECM)和基底膜(basement membrane)降解是恶性肿瘤浸润和转移的关键环节. 基质金属蛋白酶(matrixmetallo-proteinases, MMPs)的作用底物是细胞外基质和基底膜中的纤维网架分子. 基质金属蛋白酶-9(metrix metalloproteinase-9, MMP-9)属于其中的明胶酶类, 通常以酶原的形式合成, 被激活后可特异性地降解细胞外基质和基底膜中的主要成分Ⅳ型胶原. MMP-9不仅主要在癌细胞中表达, 而且基质中的纤维母细胞、单核吞噬细胞中也有表达, 其阳性表达以浸润癌巢周围最明显, 说明他与肿瘤的浸润密切相关[10]. MMP-9还能和VEGF协同作用参与肿瘤血管的生成[11]. 研究发现MMP-9在胃癌中的表达与肿瘤生长方式、浸润深度、淋巴转移、病理分化、远隔转移及患者的不良预后相关[12-13]. 我们发现, MMP-9在胃癌组织中的表达率明显高于在正常胃组织中的表达, 并随肿瘤病理分化程度的降低、浸润深度的加深、淋巴转移的发生、临床分期的增高而增加(P<0.05), 与文献报道相符, 提示MMP-9的高表达与胃癌的发生、发展、侵袭与转移密切相关. MMP-9在胃癌组织中的表达与肿瘤的远隔转移无相关性, 可能与样本量较小有关. 研究发现PTEN能负性调控MMP-9而抑制细胞外基质和基底膜降解, 抑制肿瘤浸润和转移[14-19]. 我们发现, PTEN和MMP-9在胃癌组织中的表达呈负相关(P<0.001, r = -0.543), MMP-9的表达随PTEN的降低而升高, 提示胃癌组织中PTEN表达的缺失, 导致了对MMP-9的抑制作用降低, 而使MMP-9高表达, 促进了肿瘤细胞的侵袭和转移.
半胱氨酸蛋白酶(Caspase)家族是直接导致细胞凋亡的蛋白酶系统, Caspase-3(cysteine protease p32 Yama, 又称CPP32, Apopain)是细胞凋亡下游的关键蛋白酶[20-22]. Hoshi et al[23]发现, Caspase-3在胃癌发生过程中表达下调. Leonardos et al[24]发现, Caspase-3的表达下调与恶性肿瘤的浸润、转移和临床病理分期等生物学行为特征密切相关, 并与肿瘤患者生存期的缩短关系密切. 我们发现, Caspase-3在胃癌组织中的表达率明显低于在正常胃组织中的表达, 并随肿瘤病理分化程度的降低、淋巴转移的产生、临床分期的增高而降低(P<0.05), 与文献报道相符, 提示Caspase-3表达的降低与胃癌的发生、发展密切相关. Caspase-3在胃癌组织中的表达与肿瘤浸润深度及远隔转移无相关性, 可能与样本量较小有关. 研究发现PTEN可通过上调Caspase-3活性而促进细胞凋亡[25-28]. 我们发现, 胃癌组织中PTEN与Caspase-3的表达呈正相关(P<0.001, r= 0.515), 且Caspase-3的表达随PTEN的降低而降低, 提示PTEN基因表达的缺失, 丧失了对Caspase-3活性的促进作用, 而降低了其促进肿瘤细胞凋亡的作用, 导致癌细胞的无限制生长.
Riedel et al[29]发现, 在头颈部鳞状细胞癌中Caspase-3和MMP-9的表达呈负相关, 且有统计学意义. 我们亦发现胃癌组织中Caspase-3与MMP-9的表达呈负相关(P<0.001, r = -0.741), MMP-9的阳性表达率随Caspase-3的降低而升高, 提示Caspase-3介导的细胞凋亡和MMP-9降解细胞外基质和基底膜而促进的细胞迁移和侵袭在胃癌的发生、发展中互相制约而共同起作用.
总之, PTEN, MMP-9, Caspase-3的表达在胃癌的发生、发展和浸润转移过程中起重要作用, 其作用途径和形式复杂且相互关联, 需要进一步研究其作用机制及其对胃癌的预防、诊断、治疗和预后判断的意义.
PTEN是肿瘤抑制基因, 可抑制肿瘤发生、发展、浸润和转移. MMP-9可降解细胞外基质和基底膜而促进恶性肿瘤浸润和转移. Caspase-3细胞凋亡蛋白酶, 其功能的抑制将导致肿瘤的发生. 在多种恶性肿瘤包括胃癌中均可以检测到他们表达的异常. PTEN具有双特异性磷酸酶活性, 是迄今为止发现的第一个具有磷酸酶活性的抑癌基因, 涉及三磷脂酰肌醇激酶、FAK、促细胞分裂素激活的蛋白激酶途径, 其抑癌机制还很不清楚.
肿瘤早期便发生PTEN完全缺失的只有子宫内膜癌和卵巢癌里, 其他肿瘤的PTEN的完全失活发生在肿瘤晚期, 所以PTEN基因的缺失被认为是恶变过程中的后期事件.
胃癌中PTEN, MMP-9, Caspase-3的相互关系及其机制的研究, 目前较为少见. MMP-9和Caspase-3之间关系的研究更为少见. 研究他们之间的关系对认识PTEN的抑癌机制有提示作用.
PTEN, MMP-9, Caspase-3各自都可以作为胃癌诊断和预后判断的指标, 这在胃癌的诊断和预后的判断有指导价值, 并对胃癌的手术方案、放化疗方案的选择及新药的研究有提示作用.
本文讨论了PTEN这一新型抑癌基因与转移相关基因MMPs和凋亡相关基因Caspase在胃癌中的表达及其相关性, 有一定新意, 但其仅系回顾性研究, 且病例数尚少.
电编: 张敏 编辑:潘伯荣
| 1. | Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science. 1997;275:1943-1947. [PubMed] [DOI] |
| 2. | Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet. 1997;15:356-362. [PubMed] [DOI] |
| 3. | Li DM, Sun H. TEP1, encoded by a candidate tumor suppressor locus, is a novel protein tyrosine phosphatase regulated by transforming growth factor beta. Cancer Res. 1997;57:2124-2129. [PubMed] |
| 4. | Waite KA, Eng C. Protean PTEN: form and func-tion. Am J Hum Genet. 2002;70:829-844. [PubMed] [DOI] |
| 5. | Besson A, Robbins SM, Yong VW. PTEN/MMAC1/TEP1 in signal transduction and tumorigenesis. Eur J Biochem. 1999;263:605-611. [PubMed] [DOI] |
| 6. | Simpson L, Parsons R. PTEN: life as a tumor supp-ressor. Exp Cell Res. 2001;264:29-41. [PubMed] [DOI] |
| 7. | Sato K, Tamura G, Tsuchiya T, Endoh Y, Sakata K, Motoyama T, Usuba O, Kimura W, Terashima M, Nishizuka S. Analysis of genetic and epigenetic alterations of the PTEN gene in gastric cancer. Virchows Arch. 2002;440:160-165. [PubMed] [DOI] |
| 8. | Wu Y, Karas M, Dupont J, Zhao H, Toyoshima Y, Le Roith D. Multiple signaling pathways are involved in the regulation of IGF-I receptor inhibition of PTEN-enhanced apoptosis. Growth Horm IGF Res. 2004;14:52-58. [PubMed] [DOI] |
| 9. | Sano T, Lin H, Chen X, Langford LA, Koul D, Bondy ML, Hess KR, Myers JN, Hong YK, Yung WK. Differential expression of MMAC/PTEN in glioblastoma multiforme: relationship to localization and prognosis. Cancer Res. 1999;59:1820-1824. [PubMed] |
| 10. | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2:161-174. [PubMed] [DOI] |
| 11. | Hofmann UB, Westphal JR, Van Muijen GN, Ruiter DJ. Matrix metalloproteinases in human melanoma. J Invest Dermatol. 2000;115:337-344. [PubMed] [DOI] |
| 12. | Senota A, Itoh F, Yamamoto H, Adachi Y, Hinoda Y, Imai K. Relation of matrilysin messenger RNA expression with invasive activity in human gastric cancer. Clin Exp Metastasis. 1998;16:313-321. [PubMed] [DOI] |
| 13. | Koumura H, Sugiyama Y, Kunieda K, Saji S. Significance in gene expression of matrix metalloproteinase-9, urokinase-type plasminogen activator and tissue inhibitor of metalloproteinase for metastases of gastric and/or colo-rectal cancer. Gan To Kagaku Ryoho. 1997;24 Suppl 2:324-331. [PubMed] |
| 14. | Park MJ, Kim MS, Park IC, Kang HS, Yoo H, Park SH, Rhee CH, Hong SI, Lee SH. PTEN suppresses hyaluronic acid-induced matrix metalloproteinase-9 expression in U87MG glioblastoma cells through focal adhesion kinase dephosphorylation. Cancer Res. 2002;62:6318-6322. [PubMed] |
| 15. | Chung TW, Lee YC, Kim CH. Hepatitis B viral HBx induces matrix metalloproteinase-9 gene expression through activation of ERK and PI-3K/AKT pathways: involvement of invasive potential. FASEB J. 2004;18:1123-1125. [PubMed] [DOI] |
| 16. | Moon SK, Kim HM, Kim CH. PTEN induces G1 cell cycle arrest and inhibits MMP-9 expression via the regulation of NF-kappaB and AP-1 in vascular smooth muscle cells. Arch Biochem Biophys. 2004;421:267-276. [PubMed] [DOI] |
| 17. | Dolo V, Ginestra A, Cassara D, Violini S, Lucania G, Torrisi MR, Nagase H, Canevari S, Pavan A, Vittorelli ML. Selective localization of matrix metalloproteinase 9, beta1 integrins, and human lymphocyte antigen class I molecules on membrane vesicles shed by 8701-BC breast carcinoma cells. Cancer Res. 1998;58:4468-4474. [PubMed] |
| 18. | Koul D, Parthasarathy R, Shen R, Davies MA, Jasser SA, Chintala SK, Rao JS, Sun Y, Benvenisite EN, Liu TJ. Suppression of matrix metallopro-teinase-2 gene expression and invasion in human glioma cells by MMAC/PTEN. Oncogene. 2001;20:6669-6678. [PubMed] [DOI] |
| 19. | Forsyth PA, Wong H, Laing TD, Rewcastle NB, Morris DG, Muzik H, Leco KJ, Johnston RN, Brasher PM, Sutherland G. Gelatinase-A (MMP-2), gelatinase-B (MMP-9) and membrane type matrix metalloproteinase-1 (MT1-MMP) are involved in different aspects of the pathophysiology of malignant gliomas. Br J Cancer. 1999;79:1828-1835. [PubMed] [DOI] |
| 20. | Porter AG, Janicke RU. Emerging roles of caspase-3 in apoptosis. Cell Death Differ. 1999;6:99-104. [PubMed] [DOI] |
| 21. | Hishikawa K, Nakaki T, Fujii T. Connective tissue growth factor induces apoptosis via caspase 3 in cultured human aortic smooth muscle cells. Eur J Pharmacol. 2000;392:19-22. [PubMed] [DOI] |
| 22. | Hensel F, Hermann R, Schubert C, Abe N, Schmidt K, Franke A, Shevchenko A, Mann M, Muller-Hermelink HK, Vollmers HP. Characterization of glycosylphosphatidylinositol-linked molecule CD55/decay-accelerating factor as the receptor for antibody SC-1-induced apoptosis. Cancer Res. 1999;59:5299-5306. [PubMed] |
| 23. | Hoshi T, Sasano H, Kato K, Yabuki N, Ohara S, Konno R, Asaki S, Toyota T, Tateno H, Nagura H. Immunohistochemistry of Caspase3/CPP32 in human stomach and its correlation with cell proliferation and apoptosis. Anticancer Res. 1998;18:4347-4353. [PubMed] |
| 24. | Leonardos L, Butler LM, Hewett PJ, Zalewski PD, Cowled PA. The activity of caspase-3-like proteases is elevated during the development of colorectal carcinoma. Cancer Lett. 1999;143:29-35. [PubMed] [DOI] |
| 25. | Schwartzbauer G, Robbins J. The tumor suppressor gene PTEN can regulate cardiac hypertrophy and survival. J Biol Chem. 2001;276:35786-35793. [PubMed] [DOI] |
| 26. | Yeon JE, Califano S, Xu J, Wands JR, De La Monte SM. Potential role of PTEN phosphatase in ethanol-impaired survival signaling in the liver. Hepatology. 2003;38:703-714. [PubMed] [DOI] |
| 27. | Yuan XJ, Whang YE. PTEN sensitizes prostate cancer cells to death receptor-mediated and drug-induced apoptosis through a FADD-dependent pathway. Oncogene. 2002;21:319-327. [PubMed] [DOI] |