修回日期: 2006-02-09
接受日期: 2006-02-21
在线出版日期: 2006-05-28
目的: 研究CCl4诱导大鼠肝硬化形成过程中门静脉内毒素与Child-Pugh分级, 探讨肠道在大鼠肠源性内毒素及大鼠肝硬化代偿向失代偿转化中的作用.
方法: 20只Wistar大鼠采用CCl4复合因素诱发大鼠肝硬化模型, 6只作为对照. 于制模开始后的6及10 wk分别测定凝血酶原时间, 白蛋白, 胆红素, 腹水情况, 脑电图情况及门静脉内毒素水平, 并依据Child-Pugh分级系统确定大鼠肝功能分级, 比较Child分级与门静脉内毒素的关系.
结果: 经Spearman等级相关分析, Child-Pugh分级指标与白蛋白、凝血酶原时间显著相关 (r = -0.695, P<0.05; r = 0.649, P<0.05), 而与胆红素没有显著相关性(r = 0.111, P = 0.732). 门静脉内毒素水平随着肝硬化模型制作时间的延长而逐渐加重, 正常大鼠门静脉内毒素水平与6及10 wk毒素门静脉内毒素水平比较均有统计学差异(925.1±527.7 mEU/L vs1983.7±586.4, 2600.7±343.8 mEU/L, 均P<0.01), 门静脉内毒素水平与时间相关(r = 0.624, P<0.01), 与Child-Pugh分级之间有显著相关(r = 0.680, P<0.01).
结论: 肝硬化大鼠门静脉高内毒素血症与肝功能分级有显著相关关系, 说明肠源性内毒素在大鼠肝硬化代偿向失代偿转化中起着重要作用.
引文著录: 殷云勤, 韩德五, 王新国. 肝硬化大鼠门静脉内毒素水平与Child-Pugh分级之间的关系. 世界华人消化杂志 2006; 14(15): 1471-1474
Revised: February 9, 2006
Accepted: February 21, 2006
Published online: May 28, 2006
AIM: To evaluate the association between the Child-Pugh classification and portal endotoxe-mia during the course of rat liver cirrhosis induced by carbon tetrachloride (CCl4) plus ethanol and cholesterol.
METHODS: Liver cirrhosis model was induced in 20 Wistar rats using CCl4 plus ethanol and cholesterol, while 6 rats were treated as controls. At 6 and 10 wk, serum samples were collected from portal vein for the detection of prothrombin time, albumin, bilirubin and endotoxin level, and the ascites and brain wave were also tested. The liver function was evaluated by Child-Pugh scoring system and the relationship between Child-Pugh classification and portal endotoxemia was assessed.
RESULTS: Spearman rank correlation analysis showed that Child-Pugh grading was correlated with albumin level and prothrombin time (r = -0.695, P < 0.05; r = 0.649, P < 0.05), but not with bilirubin level (P > 0.05). The level of endotoxin in portal vein was elevated with prolonging of cirrhosis time, and it was significantly higher at 6 or 10 wk than that in the controls (1983.7 ± 586.4, 2600.7 ± 343.8 mEU/L vs 925.1 ± 527.7 mEU/L, both P < 0.01). Endotoxin level was correlated with cirrhosis time (r = 0.624, P < 0.01) and Child-Pugh classification (r = 0.680, P < 0.01).
CONCLUSION: Portal endotoxemia is significantly correlated with Child-Pugh classification, indicating that intestinal endotoxemia plays an important role during the course of complex pathogens-induced cirrhosis in rats.
- Citation: Yin YQ, Han DW, Wang XG. Association between portal endotoxemia and Child-Pugh classification in complex pathogens-induced hepatic cirrhosis in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(15): 1471-1474
- URL: https://www.wjgnet.com/1009-3079/full/v14/i15/1471.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i15.1471
急慢性肝病伴发肠源性内毒素血症(IETM)的事实已无可争辩, 其出现主要是由于肝脏Kupffer细胞功能减退, 使得从肠道来源的内毒素不能被有效地清除而溢出到体循环[1-2]. 研究表明, 体循环内毒素水平随着肝病病程的延长及病情的加重而增高[3-5]. 肝硬化动物腹腔或尾静脉给予显著低于致死量的内毒素即可诱使动物出现肝功能衰竭、肝性脑病、肝肾综合征或肝肺综合征[6-7]. 这些研究多是基于体循环内毒素血症的产生及其对机体的影响, 因为门静脉是肠道来源的内毒素进入肝脏的主要通道, 而这些肠源性内毒素首先要在肝脏进行代谢, 只有肝脏对内毒素的代谢减少、进入肝脏的内毒素过多以及门体侧支循环存在时, 才出现体循环的内毒素血症. 为了进一步明确肠道在肝硬化发生、发展中的作用, 故取门静脉血以观察内毒素水平与Child分级的关系.
♂Wistar大鼠由山西医科大学实验动物中心提供, 26只, 体质量220-260 g. 20只大鼠采用我室多年来建立的复合因素复制肝硬化模型[8], 另6只动物为正常对照, 同期普通饲料自由饮水饲养, 待10 wk时处理.
分别于实验开始后的第6, 10周各取存活动物6只. 各时段动物处理前3 d先从眼眶静脉采血1.8 mL, 用1×109mmol/L枸橼酸钠0.2 mL抗凝, 分离血清后在自动分析仪上进行凝血酶原时间检测, 检测试剂盒购自北京世第科学仪器公司. 同日于乙醚麻醉无菌条件下在头部安置螺丝电极, 用以描记脑电图. 脑电图按照正常(脑电频率8-9次/s, 电压100 µV)、中度异常(脑电频率5-7次/s, 电压150 µV)和重度异常(脑电频率4-5次/s, 电压310 µV)进行分级[9]. 处理当日禁食12 h, 清醒状态下描记脑电图后用30 g/L的戊巴比妥钠3 mL/kg麻醉, 无菌腹正中切口, 先观察腹水情况, 分为无、中量(2-5 mL)、大量(>5 mL)3个等级分别计分. 充分暴露门静脉, 然后从门静脉主干用无菌肝素抗凝注射器采集门静脉血4 mL, 分离血清后-70 ℃备检. 检测指标包括血内毒素、血总胆红素和血浆白蛋白水平. 按照各组动物凝血酶原时间、血清白蛋白水平、血清胆红素水平、腹水及脑病存在情况进行Child的综合评定(表1)[10-12]. 同时留取肝右叶组织, 中性甲醛固定, 常规VG染色, 显微镜下观察肝脏组织学变化情况.
| 项目 | 1 | 2 | 3 |
| 凝血酶原时间 (s) | ≤14 | 15-17 | ≥18 |
| 白蛋白 (g/L) | >35 | 28-35 | <28 |
| 胆红素 (mmol/L) | <34 | 34-51 | >51 |
| 腹水 | 无 | 中量 | 大量 |
| 肝性脑病 | 无 | 中度 | 重度 |
统计学处理 计量资料的数据采用mean±SD表示, 计数资料用数字表示, 用SPSS 11.5软件进行统计分析. P<0.05视为统计学上有显著性差异.
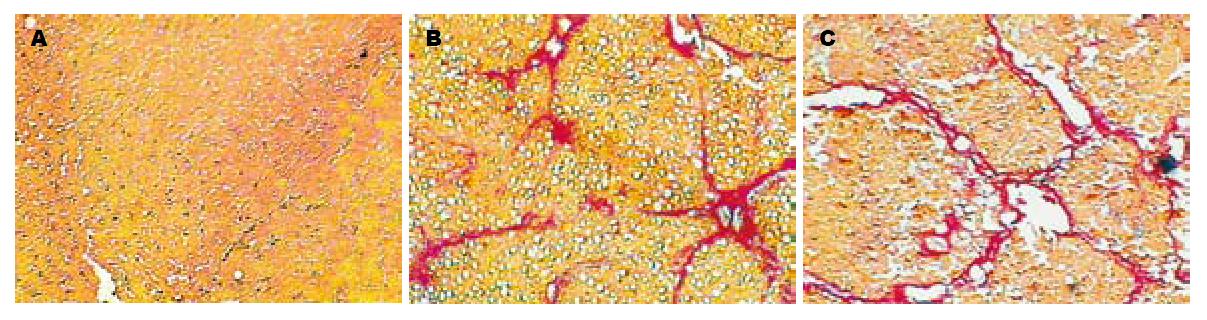
10 wk模型组动物较6 wk时腹水发生率高, 且腹水量较多, 最多达15 mL. 肝脏表面结节亦更明显. VG染色显示正常动物无明显纤维间隔形成, 6 wk时有纤维间隔形成, 10 wk时已明显形成假小叶(图1A-C). 6 wk时(前6只动物)有2只动物处于A级, 4只处于B级; 10 wk时, 2只处于B级, 4只已进入C级. 说明在我们观察的时段, 6 wk左右大鼠肝功能多处于代偿与失代偿的交界阶段, 而10 wk左右多在失代偿阶段(表2). 经Spearman等级相关分析Child-Pugh分级指标与白蛋白之间r = -0.695, P<0.05, 有统计学差异. Child-Pugh分级指标与凝血酶原时间之间r = 0.649, P<0.05, 有统计学意义. 但Child-Pugh分级与胆红素之间r = 0.111, P = 0.732, 统计学上无显著性差异(表2).
| No | 凝血酶原时间(s) | 白蛋白 (g/L) | 胆红素(mmol/L) | 腹水 | 脑病 | 总分 | 分级 |
| 1 | 13.2 | 30.86 | 2.28 | 无 | 无 | 6 | A |
| 2 | 12.3 | 28.52 | 25.08 | 无 | 无 | 6 | A |
| 3 | 12.8 | 25.01 | 8.44 | 无 | 无 | 7 | B |
| 4 | 10.5 | 26.77 | 7.07 | 无 | 无 | 7 | B |
| 5 | 14.0 | 25.74 | 1.82 | 无 | 无 | 7 | B |
| 6 | 11.6 | 25.59 | 6.61 | 无 | 无 | 7 | B |
| 7 | 16.4 | 20.48 | 7.52 | 中度 | 无 | 9 | B |
| 8 | 27.6 | 29.40 | 2.74 | 中度 | 无 | 9 | B |
| 9 | 20.1 | 26.03 | 1.60 | 无 | 中度 | 10 | C |
| 10 | 21.0 | 11.41 | 8.44 | 中度 | 无 | 10 | C |
| 11 | 28.6 | 17.40 | 10.72 | 无 | 中度 | 10 | C |
| 12 | 17.6 | 12.72 | 13.00 | 重度 | 无 | 10 | C |
经Spearman等级相关分析门静脉内毒素水平与不同时间(6 wk及10 wk) r = 0.624, P<0.01. 两两之间比较, 正常动物(925.1±527.7 mEU/L)与6 wk (1983.7±586.4 mEU/L)及10 wk (2600.7±343.8 mEU/L)时比较均有统计学差异, P<0.01. 6 wk与10 wk之间比较也有统计学差异(P<0.05). 门静脉内毒素与Child-Pugh分级之间r = 0.680, P<0.01. 虽然Child A级动物仅有2只, 但分级指标与不同时间(6 wk及10 wk) r = 0.738, P<0.01. 说明肝硬化的严重程度与门静脉内毒素水平、动物处理时间均有显著的相关性.
我们采用我室的CCl4复合因素诱发大鼠肝硬化的模型, 其特点是分期较明确, 一般在4 wk左右形成较明显的肝纤维化, 6-8 wk形成代偿期肝硬化, 8-10 wk左右为失代偿期肝硬化阶段, 往往在诱因的作用下发生肝衰竭而死亡. 多数观测指标与人类肝硬化的情况相近, 成模率高. Child-Pugh分级结果表明, 6 wk时6只动物中肝功能处于A级的有2只, B级4只; 10 wk时, 6只动物中有2只为B级, 4只为C级. 从Child-Pugh分级与白蛋白、凝血酶原时间、胆红素的关系上看, 前两个指标与Child分级指标有显著的相关性(P<0.05). 说明肝脏的合成功能受损更加明显. 两个时段大鼠门静脉内毒素水平随着时间的延长而逐渐升高, 相关分析表明, 门静脉血内毒素水平与肝功能的Child-Pugh分级有显著的相关关系(P<0.01). 说明在肝硬化的发生、发展过程中, 门静脉内毒素血症起着重要作用[13]. 门静脉高内毒素血症产生的原因主要是肠黏膜屏障功能的减退同时存在肠道菌群的失调, 其结果是引起细菌易位[14-19]. 由于肝病病因的作用, 一方面影响肝细胞的功能, 包括合成、代谢和分泌功能, 另一方面使Kupffer细胞功能受损, 不能有效清除从门静脉进入肝脏的内毒素, 形成体循环肠源性内毒素血症. 这种体循环内毒素血症, 不仅通过激活肝脏Kupffer细胞使其释放大量细胞因子和炎症因子, 对肝脏形成"二次打击", 加重肝脏的损害, 还可以损害其他器官, 如肺、肾、肠道[20-21]. 但此时体循环内毒素血症可不很明显[22-23]. 由于肠道的损害使得更多的肠源性内毒素进入肝脏, 加重肝脏的损害. 而随着肝脏Kupffer细胞长久的损害加之肝硬化形成后结构的改建, Kupffer细胞功能将衰退, 体循环内毒素血症必将加重, 此时外周单核巨噬系统的活性占有一定优势, 他们的激活可能在肝硬化肝功能衰竭的发病过程中起重要作用[24-28]. 我室先前的研究中使用小剂量的内毒素sc可短期内诱发肝硬化大鼠出现肝性脑病或肝肾综合征也说明在肝功能损害的基础上, 体循环内毒素在肝衰竭进程中的作用.
总之, CCl4复合因素诱导的肝硬化大鼠高门静脉内毒素血症与肝功能Child-Pugh分级有显著的相关关系, 而门静脉高内毒素血症的发生与肠黏膜屏障功能和细菌易位直接相关, 进一步说明肠道在肝硬化病程发生、发展中的重要作用, 由于我们选择的是肝硬化代偿到失代偿两个阶段所进行的研究, 故本结果也提示, 肠道来源的内毒素在大鼠的肝硬化代偿向失代偿转化中也起着重要作用. 也正是由于门静脉内毒素对肝脏的直接和间接的作用最终影响了肝病的结局.
肝硬化往往伴有内毒素血症, 其产生原因与肠黏膜通透性升高及肠道内菌群失调有关, 这种肠源性内毒素血症对肝硬化肝功能的影响如何, 有待深入的研究.
肠源性内毒素血症在应激、创伤、休克等病理过程中有重要的促进作用, 肝硬化发生、发展过程中常常伴有内毒素血症, 他是肝硬化的结果, 同时也是肝病慢性化及重型化的重要因素.
以往报道多研究肝硬化时体循环内毒素与肝功能损害之间的关系, 因只有肝脏Kupffer细胞功能减退或存在门体侧支循环时, 才出现体循环内毒素血症, 故这些研究不利于深入理解肠道在肝硬化肝功能损害中的作用.
由于门静脉高内毒素血症对肝脏会产生更直接的损害作用, 故本文将门静脉内毒素与肝功能Child分级两者联系起来, 试图找到两者的内在联系.
肠源性内毒素血症是肝功能失代偿的重要促进因素, 进一步研究的重点是如何有效地控制肠源性内毒素血症的发生, 以改善肝硬化患者的预后.
1 肠源性内毒素血症: 在严重创伤、烧伤、应激、休克、肠缺血、肝病时都可发生体循环内毒素血症, 由于这些内毒素来自肠道, 与肠黏膜屏障功能减退和Kupffer细胞吞噬清除功能障碍有关, 故称为肠源性内毒素血症.
2 Child-Pugh分级: 最初用来评价肝硬化门体分流手术前的肝功能状况, 目前也常用于一般肝硬化患者的临床评价, 是最常用的肝功能分级指标之一.
本文探讨了肝硬化大鼠门静脉内毒素水平与Child-Pugh分级之间的关系, 有一定的创新性和借鉴价值.
电编: 张敏 编辑:潘伯荣
| 2. | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol. 2002;8:961-965. [PubMed] [DOI] |
| 3. | Wang L, Ren CS. Progress of endotoxin and chronic liver diseas. Zhonghua Ganzangbing Zazhi. 2003;11:251-253. [PubMed] |
| 7. | Zhang HY, Han DW, Wang XG, Zhao YC, Zhou X, Zhao HZ. Experimental study on the role of endotoxin in the development of hepatopulmonary syndrome. World J Gastroenterol. 2005;11:567-572. [PubMed] [DOI] |
| 9. | Oppong KN, Bartlett K, Record CO, al Mardini H. Synaptosomal glutamate transport in thioaceta-mide-induced hepatic encephalopathy in the rat. Hepatology. 1995;22:553-558. [PubMed] |
| 10. | Li Q, Wang BE, Jia JD. The evolution and characteri-stics of liver function classification: from Child to MELD. Zhonghua Ganzangbing Zazhi. 2004;12:319-320. [PubMed] |
| 11. | Christensen E. Prognostic models including the Child-Pugh, MELD and Mayo risk scores-where are we and where should we go? J Hepatol. 2004;41:344-350. [PubMed] [DOI] |
| 12. | Huo TI, Wu JC, Lin HC, Lee FY, Hou MC, Lee PC, Chang FY, Lee SD. Evaluation of the increase in model for end-stage liver disease (DeltaMELD) score over time as a prognostic predictor in patients with advanced cirrhosis: risk factor analysis and comparison with initial MELD and Child-Turcotte-Pugh score. J Hepatol. 2005;42:826-832. [PubMed] [DOI] |
| 13. | 韩 德五. 肠源性内毒素血症与肝病: 肝衰竭的IETM学说. 第1版. 北京: 中国科学技术出版社 2004; 9-24. |
| 14. | Navasa M, Rodes J. Bacterial infections in cirrhosis. Liver Int. 2004;24:277-280. [PubMed] [DOI] |
| 15. | Wiest R, Garcia-Tsao G. Bacterial translocation (BT) in cirrhosis. Hepatology. 2005;41:422-433. [PubMed] [DOI] |
| 16. | Cirera I, Bauer TM, Navasa M, Vila J, Grande L, Taura P, Fuster J, Garcia-Valdecasas JC, Lacy A, Suarez MJ. Bacterial transloca-tion of enteric organisms in patients with cirrhosis. J Hepatol. 2001;34:32-37. [PubMed] [DOI] |
| 17. | Sztrymf B, Libert JM, Mougeot C, Lebrec D, Mazmanian M, Humbert M, Herve P. Cirrhotic rats with bacterial translocation have higher incidence and severity of hepatopulmonary syndrome. J Gastroenterol Hepatol. 2005;20:1538-1544. [PubMed] [DOI] |
| 18. | Guarner C, Soriano G. Bacterial translocation and its consequences in patients with cirrhosis. Eur J Gastroenterol Hepatol. 2005;17:27-31. [PubMed] [DOI] |
| 19. | Pascual S, Such J, Esteban A, Zapater P, Casellas JA, Aparicio JR, Girona E, Gutierrez A, Carnices F, Palazon JM. Intestinal permeability is increased in patients with advanced cirrhosis. Hepatogastroenterology. 2003;50:1482-1486. [PubMed] |
| 20. | Lin RS, Lee FY, Lee SD, Tsai YT, Lin HC, Lu RH, Hsu WC, Huang CC, Wang SS, Lo KJ. Endotoxemia in patients with chronic liver diseases: relationship to severity of liver diseases, presence of esophageal varices, and hyperdynamic circulation. J Hepatol. 1995;22:165-172. [PubMed] [DOI] |
| 21. | Gong JP, Wu CX, Liu CA, Li SW, Shi YJ, Yang K, Li Y, Li XH. Intestinal damage mediated by Kupffer cells in rats with endotoxemia. World J Gastroenterol. 2002;8:923-927. [PubMed] [DOI] |
| 22. | Yano H, Kinoshita S, Kira S. Effects of acute mode-rate exercise on the phagocytosis of Kupffer cells in rats. Acta Physiol Scand. 2004;182:151-160. [PubMed] [DOI] |
| 23. | Luckey SW, Petersen DR. Activation of Kupffer cells during the course of carbon tetrachloride-induced liver injury and fibrosis in rats. Exp Mol Pathol. 2001;71:226-240. [PubMed] [DOI] |
| 24. | Lough J, Rosenthall L, Arzoumanian A, Goresky CA. Kupffer cell depletion associated with capillari-zation of liver sinusoids in carbon tetrachloride-induced rat liver cirrhosis. J Hepatol. 1987;5:190-198. [PubMed] [DOI] |
| 25. | Arii S, Monden K, Itai S, Sasaoki T, Adachi Y, Funaki N, Higashitsuji H, Tobe T. Depressed function of Kupffer cells in rats with CCl4-induced liver cirrhosis. Res Exp Med (Berl). 1990;190:173-182. [PubMed] [DOI] |
| 26. | Maianskii DN, Shvarts IaSh, Tsyrendorzhiev DD, Kutina SN. Functional restructurings of the mononuclear phagocyte system in experimental liver cirrhosis. Biull Eksp Biol Med. 1988;105:214-216. [PubMed] |
| 27. | Mayanski DN, Schwartz YS, Kutina SN, Zubakhin AA, Mayanskaya NN, Tsyrendorjiev DD. Mononu-clear phagocyte system responsiveness in CCl4-induced liver cirrhosis. Int J Exp Pathol. 1993;74:229-236. [PubMed] |