修回日期: 2005-04-25
接受日期: 2006-05-08
在线出版日期: 2006-05-18
目的: 探讨环氧化酶-2(COX-2)在食管癌组织的表达及其与肿瘤血管生成的关系.
方法: 免疫组化法检测食管鳞癌手术切除标本90例和癌旁正常黏膜34例中COX-2表达, 采用抗CD34抗体标记微血管内皮细胞, 计算微血管密度(MVD). 分析COX-2表达与MVD及其与食管癌主要临床病理特征的相关性.
结果: 食管癌组织COX-2阳性表达率为84.4%显著高于癌旁正常黏膜的20.6% (χ2 = 45.47, P = 0.00). COX-2表达与肿瘤细胞分化程度、临床TNM分期和淋巴结转移密切相关, TNM分期中Ⅲ+ Ⅳ期的食管鳞癌组织中COX-2表达率为92.9%,显著高于Ⅰ+Ⅱ期的70.6% (χ2 = 7.99, P = 0.005). 高、中分化的食管鳞癌组织中COX-2表达率为92. 9%, 显著高于低分化的70.6% (χ2 = 7.99, P = 0.005). 伴有淋巴结转移的食管鳞癌组织中COX-2表达率为94.3%, 显著高于无淋巴结转移的70.3% (c2 = 9.61, P = 0.002). 食管癌组织MVD值为29.68 ±3.81,显著高于癌旁正常黏膜的15.12±2.80 (t = 20.28, P = 0.00). MVD与肿瘤的TNM分期和淋巴结转移密切相关, TNM分期中Ⅲ+ Ⅳ期的食管鳞癌组织中MVD值为31.46±3.52, 显著高于Ⅰ+Ⅱ期的26.74±2.06 (t = -7.09, P = 0.00). 伴有淋巴结转移的食管鳞癌组织中MVD为31.72±3.43, 显著高于无淋巴结转移的26.76±2.01 (t = -7.90, P = 0.00). Spearman等级相关分析表明, MVD与COX-2表达呈显著正相关(r = 0.607, P = 0.00).
结论: COX-2异常表达及其诱导的血管生成在食管癌的侵袭和淋巴结转移中起重要作用.
引文著录: 产松苗, 欧希龙, 孙为豪, 陈国胜, 颜芳, 邵耘, 许海尘, 薛绮萍. 食管癌组织环氧化酶-2的表达与血管生成的关系. 世界华人消化杂志 2006; 14(14): 1388-1393
Revised: April 25, 2005
Accepted: May 8, 2006
Published online: May 18, 2006
AIM: To investigate the expression of cyclooxygenase-2 (COX-2) and its correlation with the angiogenesis and clinicopathological features in esophageal carcinoma.
METHODS: Ninety tumor specimens resected from patients with squamous cell carcinoma of the esophagus were obtained, and 34 corresponding paracancerous normal tissues were randomly selected as the controls. Immunohistochemical staining was used to detect the expression of COX-2. Monoclonal antiboty against CD34 was used for displaying vascular endothelial cells, and microvascular density (MVD) was determined by counting the CD34-positive cells. The correlations of COX-2 expression with MVD and clinicopathological parameters of the patients were analyzed.
RESULTS: The positive rates of COX-2 and MVD expression in the cancerous tissue were 84.4% and 29.68 ± 3.81, respectively, which were significantly higher than those in the normal esophageal mucosa (20.6%, χ2 = 45.47, P = 0.00; 15.12 ± 2.80, t = 20.28, P = 0.00). COX-2 expression was closely correlated with clinical TNM classification (χ2 = 7.99, P = 0.005), cellular differentiation (χ2 = 7.99, P = 0.005) and lymph node metastasis (χ2 = 9.61, P = 0.002) in squamous cell carcinoma of the esophagus. The mean values of MVD were associated with clinical TNM classification (t = -7.09, P = 0.00) and lymph node metastasis (t = -7.90, P = 0.00). The spearman rank correlation test showed that tumor MVD was positively associated with COX-2 expression (r = 0.607, P = 0.00).
CONCLUSION: Over-expression of COX-2 is correlated with tumor invasion and lymph node metastasis in esophageal carcinoma, suggesting that COX-2 contributes to the development of esophageal cancer by promoting angiogenesis.
- Citation: Chan SM, Ou XL, Sun WH, Chen GS, Yan F, Shao Y, Xu HC, Xue QP. Expression of cyclooxygenase-2 in esophageal carcinoma and its correlation with angiogenesis. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1388-1393
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1388.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1388
环氧化酶(cyclooxygenase, COX)是前列腺素合成的限速酶, 已知COX至少有2种亚型, 即COX-1和COX-2. 国内外研究表明, COX-2在食管癌的发生、发展和转移中起重要作用[1-2] . 血管生成是指从已有的毛细血管或毛细血管后静脉发展而成的新生血管的过程, 恶性肿瘤的生长、浸润和转移必须依赖肿瘤血管生成, 微血管密度(microvascular density, MVD)是反映恶性肿瘤侵袭和转移等生物学行为的一个重要指标[3-4]. 体外研究结果表明, COX-2刺激癌细胞分泌促血管生成因子而诱导血管形成[5]. 然而, 食管癌组织中COX-2表达和血管生成的关系尚不清楚. 因此, 我们采用免疫组化方法, 检测食管鳞癌组织和癌旁正常黏膜中COX-2表达, 旨在探讨COX-2表达与食管癌主要临床病理特征和血管生成的关系.
收集2001-07/2005-07上海梅山医院(南京)手术切除并经病理证实为食管鳞癌90例, 男76例, 女14例; 年龄40-75(中位62)岁. 食管上段13例, 中下段77例; 溃疡型57例, 覃伞型18例, 髓质型10例, 缩Õ型5例; 高分化26例, 中分化30例, 低分化34例. 根据国际抗癌联盟(UICC)美国抗癌联合会(AJCC)的TNM分期标准[6]分为: Ⅰ+Ⅱ期34例, Ⅲ+Ⅳ期56例. 有淋巴结转移者53例, 无淋巴结转移37例. 所有患者手术前均无非甾体类抗炎药治疗及化、放疗或其他针对肿瘤的治疗, 且有完整的临床和病理资料. 所有标本均经40 g/L中性甲醛固定24 h后取肿瘤中心部分制成蜡块, 另随机选择34例距肿瘤2 cm以上且经病理证实为正常食管黏膜作为对照.
免疫组化染色: 采用链霉素-生物素过氧化物酶(SP)染色法, 具体操作步骤按SP免疫组化试剂盒说明书进行. 石蜡包埋的标本层厚4 μm连续切片, 常规脱蜡至水. 切片置10 mmol/L柠檬酸缓冲液(pH 6.1)中, 微波加热(95℃, 10 min)修复抗原, 3 mL/L过氧化氢甲醇溶液室温孵育30 min阻断内源性过氧化物酶活性. 一抗为山羊抗人COX-2多克隆抗体(Santa Cruz, 美国, 工作浓度为1∶200)或鼠抗人CD34mAb(Neo Markers, 美国, 工作浓度为1∶100), 4℃过夜孵育; PBS淋洗3次, 每次5 min, 滴加生物素化二抗, 37℃孵育60 min; PBS淋洗3次, 每次5 min, 滴加链霉素抗生物素-过氧化物酶溶液, 37℃孵育20 min; PBS淋洗3次, 每次5 min, DAB显色. 细胞核用苏木素复染1 min, 中性树脂封片. 用已知COX-2表达强阳性的乳腺癌组织切片作为阳性对照, 以PBS替代一抗作阴性对照. COX-2蛋白阳性染色为细胞质和细胞核出现棕黄色颗粒, 根据阳性染色细胞百分率和阳性细胞着色强度进行半定量分析, 阳性细胞率≤4%为0分, 5%- 29%为1分, 30%-59%为2分, ≥60%为3分. 未着色或染色强度与背景相似者为0分, 着色浅略高于背景色为1分, 中等着色明显高于背景而呈棕黄色为2分, 强染呈深棕黄色者为3分. 根据两项积分将COX-2表达分为4级: 0-1分为阴性(-), 2分为弱阳性(+), 3-4分为中等强度阳性(++), ≥5分者为强阳性(+++). 阳性表达率以表达阳性的病例(包括弱阳性、中等阳性和强阳性之和)占总病例数的百分比表示. 按Weidner[7]推荐的方法在低倍镜下(×100)选择癌灶周围间质血管密集区即"热点"(hot spot), 然后在高倍镜下(×400), 随机计数5个不同视野内微血管数, 再求其平均值为MVD. 计数时管腔直径小于或等于50 μm者判为微血管, 直径大于50 μm或管壁含有肌层者不作为微血管计数, 另外单个染色细胞或成群无管腔的染色细胞也作独立微血管计数.
统计学处理 MVD以均数±标准差表示. 计数资料采用χ2检验与秩和检验; 计量资料采用t检验与方差分析; 等级相关性采用Spearman等级相关分析. 所有数据均采用SPSS 13.0统计软件进行分析, P<0.05表示差异有显著意义.
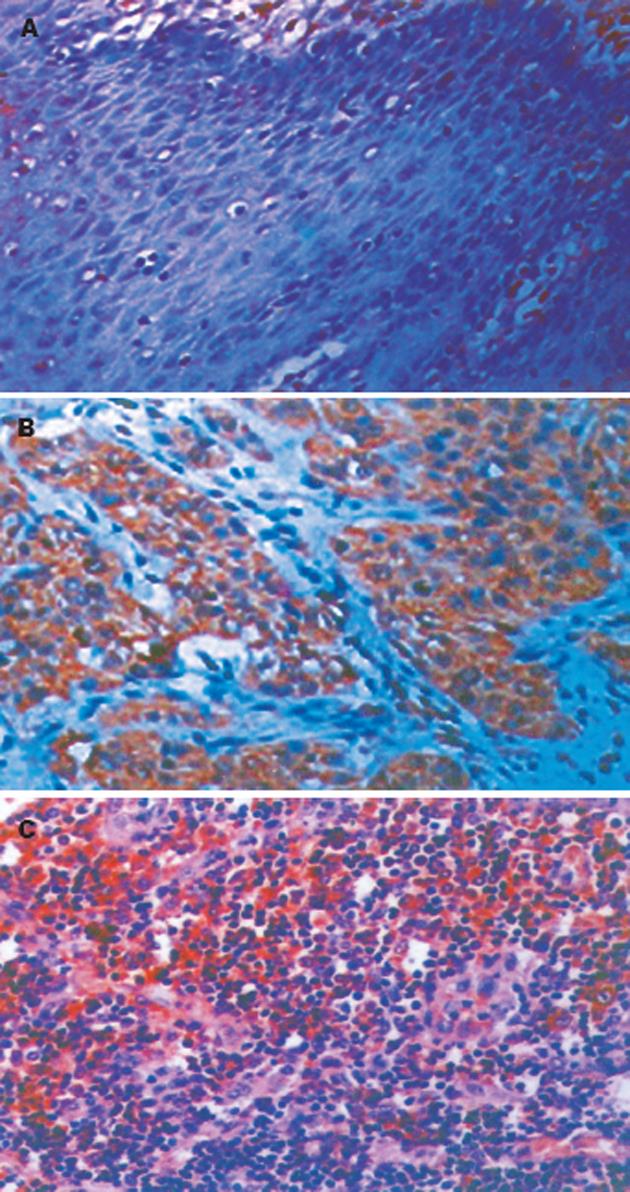
COX-2在正常食管黏膜中表达微弱(图1A), 阳性表达率为20.6%. 而食管鳞癌组织中COX-2表达率为84.4%, 其表达率和表达强度均显著高于癌旁正常黏膜(χ2 = 45.47, P = 0.00<0.01, 表1). 阳性染色主要位于肿瘤细胞的胞质中, 棕黄色颗粒状呈弥漫性分布于整个胞质或沿核膜周边呈线状分布(图1B). 此外, 癌周的炎性细胞、纤维母细胞和血管内皮细胞可见少量COX-2表达, 浸润至淋巴结的癌细胞亦可见阳性染色(图1C). COX-2表达与食管鳞癌患者的年龄、性别、肿瘤的部位及病理形态无关(P>0.05), 而与肿瘤的TNM分期、细胞分化程度和淋巴结转移密切相关(表2). TNM分期中Ⅲ + Ⅳ期的食管鳞癌组织中COX-2表达率为92.9%, 显著高于Ⅰ+Ⅱ期的70.6%(χ2 = 7.99, P = 0.005< 0.01). 高、中分化的食管鳞癌组织中COX-2表达率为92. 9%, 显著高于低分化的70.6%(χ2 = 7.99, P = 0.005< 0.01). 伴有淋巴结转移的食管鳞癌组织中COX-2表达率为94. 3%, 显著高于无淋巴结转移的70.3%(χ2 = 9.61, P = 0.002< 0.01).
| 食管 | n | COX-2表达 | ||||
| - | + | ++ | +++ | 表达率 | ||
| 正常黏膜 | 34 | 27 | 4 | 3 | 0 | 20.6% |
| 鳞癌组织 | 90 | 14 | 2 | 20 | 54 | 84.4%b |
| 临床病理特征 | n | COX-2表达 | 表达率(%) | MVD(mean±SD) | |||
| - | + | ++ | +++ | ||||
| 年龄(岁) | |||||||
| <60 | 33 | 5 | 1 | 10 | 17 | 84.8 | 29.01±2.51 |
| ≥60 | 57 | 9 | 1 | 10 | 37 | 84.2 | 30.06±4.37 |
| 男 | 76 | 10 | 2 | 14 | 48 | 86.8 | 29.68±3.84 |
| 女 | 14 | 4 | 0 | 4 | 6 | 71.4 | 29.67±3.78 |
| 肿瘤部位 | |||||||
| 上段 | 13 | 4 | 2 | 2 | 5 | 69.2 | 31.37±4.31 |
| 中下段 | 77 | 10 | 0 | 18 | 49 | 87 | 29.39±3.67 |
| TNM分期 | |||||||
| I+II | 34 | 10 | 1 | 11 | 12 | 70.6 | 26.74±2.06 |
| III+IV | 56 | 4 | 1 | 9 | 42 | 92.9b | 31.46±3.52b |
| 溃疡型 | 57 | 9 | 1 | 8 | 39 | 84.2 | 29.44±4.10 |
| 覃伞型 | 18 | 2 | 1 | 7 | 8 | 88.9 | 29.50±3.83 |
| 髓质型 | 10 | 2 | 0 | 3 | 5 | 80 | 31.25±2.75 |
| 缩窄型 | 5 | 1 | 0 | 2 | 2 | 80 | 29.90±1.18 |
| 高、中 | 56 | 4 | 1 | 11 | 40 | 92.9 | 29.92±4.27 |
| 低 | 34 | 10 | 1 | 9 | 14 | 70.6b | 29.28±2.93 |
| 有 | 53 | 3 | 0 | 12 | 38 | 94.3b | 31.72±3.43b |
| 无 | 37 | 11 | 2 | 8 | 16 | 70.3 | 26.76±2.01 |
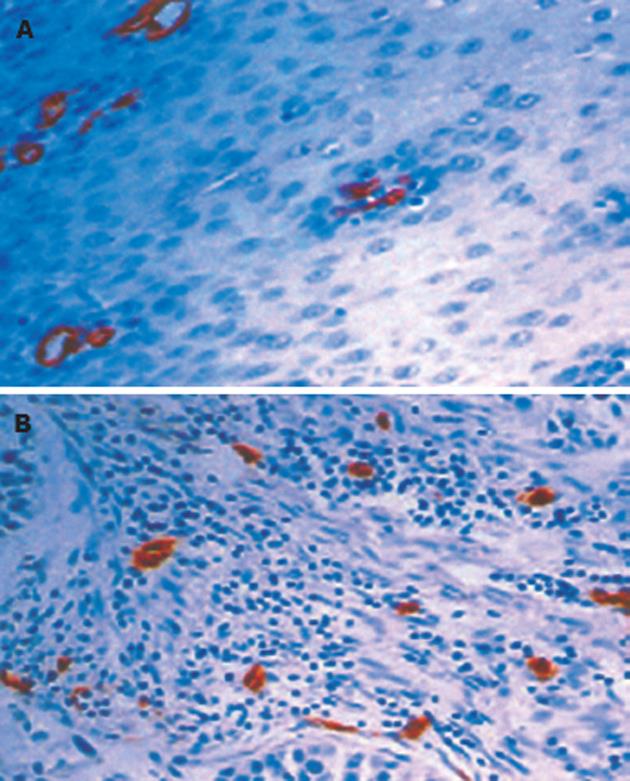
CD34抗体使大部分毛细微血管和单个内皮细胞染色后, 正常食管黏膜和癌组织中微血管均得到很好的显示(图2A,B). 癌组织中微血管形态不规则, 分布不均, 肿瘤与周围组织交界的浸润缘微血管最密集, 呈棕褐色深染, 逗点状、小管状或条索状, 肌间血管也清晰可辨. 食管癌组织MVD范围在23.1-37.9之间, 均数为29.68±3.81, 与正常食管黏膜15.12±2.80相比, 差异有显著性(t = 20.28, P = 0.00<0.01). MVD与食管鳞癌临床病理特征的关系见表2, MVD与肿瘤的TNM分期和淋巴结转移密切相关, TNM分期中Ⅲ+Ⅳ期的食管鳞癌组织中MVD值为31.46±3.52, 显著高于Ⅰ+Ⅱ期的26.74±2.06(t = -7.09, P = 0.00<0.01). 伴有淋巴结转移的食管鳞癌组织中MVD为31.72±3.43, 显著高于无淋巴结转移的26.76±2.01(t = -7.90, P = 0.00<0.01). COX-2表达阴性(-)、弱阳性(+)、中等强度阳性(++)和强阳性(+++)食管癌标本的MVD分别为24.68±0.87、26.45±0.64、29.45±2.95和31.18±3.43. 经方差分析, 组间MVD差异有统计学意义(F = 17.71, P = 0.00<0.01). 经Spearman等级相关分析, COX-2表达与MVD呈显著正相关(r = 0.607, P = 0.00<0.01).
食管癌是一些国家和地区的常见恶性肿瘤, 也是我国高发恶性肿瘤之一, 95%为鳞状细胞癌. 侵袭和转移是恶性肿瘤的主要生物学行为, 也是影响治疗效果和预后的重要因素. 因此, 研究食管癌侵袭和转移的机制并采取有效的措施进行干预, 对防治食管癌降低癌症死亡率具有重要意义. 近年来, 国内外关于COX-2在食管癌发生、发展中的作用方面的研究较多. Zhang et al[8]比较了食管癌高发区河北磁县和低发区黑龙1/2省两地内镜活检标本的COX-2表达差异性, 结果发现鳞癌的COX-2表达率在高、低发区间有显著性差异(6%对90%), 而腺癌的COX-2表达率无显著性差异(60%对75%). Shamma et al[9]用免疫组化和RT-PCR方法检测COX-2在正常食管黏膜、食管黏膜鳞状上皮异型增生(重度和轻度)、原位癌、早期浸润癌和进展期食管鳞癌中的表达, 结果显示, COX-2在重度异型增生的食管鳞状上皮中表达异常增高; Zhi et al[10]也发现COX-2在正常食管黏膜中表达微弱, 在食管黏膜鳞状上皮异型增生、原位癌和浸润癌中的表达明显升高, 提示COX-2表达上调可能是食管鳞癌发生过程中的早期事件之一. 已知COX-2是前列腺素合成的关键酶, 前列腺素是一类具有多重生物学作用的分子, 在肿瘤的发生上有抑制宿主免疫、刺激细胞增殖、减少细胞凋亡等作用. 我们发现COX-2在食管鳞癌组织的表达显著高于癌旁正常黏膜, 且与肿瘤的TNM分期和淋巴结转移呈正相关, 提示COX-2不仅参与肿瘤的发生过程, 并与肿瘤的侵袭和转移密切相关. 这与Nozoe et al[11]报道一致. 我们还发现COX-2表达与食管癌的细胞分化程度有关, 在高、中分化食管鳞癌中COX-2表达率为92.9%, 显著高于低分化的70.6%, Yang et al[12]认为这可能是由NF-kappaB(核转录因子-κB)调控的. 关于COX-2表达与食管鳞癌的关系, 有与上文不同的报道, Yu et al[13]研究表明, COX-2表达水平与食管鳞癌患者的年龄、性别、肿瘤大小、分化程度、临床分期和淋巴结转移等均无相关性. Kawabe et al[14]发现食管鳞癌的COX-2表达仅与肿瘤部位有关, 即位于食管中、下段癌的COX-2表达明显高于颈部和上段食管癌. Kuo et al[15]研究结果显示, COX-2表达水平与食管鳞癌的远处转移和肿瘤分期呈负相关, 但与患者的生存期并无相关性. 而Sivula et al[16]认为COX-2的表达与食管癌的组织学类型和外科术前治疗有关, 术前接受化疗患者低COX-2表达组预后差, 且与远处转移有关. 因此, COX-2表达与食管鳞癌临床病理特性的关系需要进一步探讨.
实体肿瘤的生长分为无血管的缓慢生长阶段和有血管的快速增殖阶段, 无血管期内肿瘤细胞的生长主要依靠细胞周围的营养物质和氧气生存, 如果没有血管生成, 原发肿瘤的生长不会超过1-2 mm3. 随着瘤体的增大, 肿瘤本身或宿主组织将建立新生血管网以供给瘤体营养. 恶性肿瘤的生长、浸润和转移必须依赖肿瘤血管生成, 微血管密度(MVD)是反映恶性肿瘤侵袭和转移等生物学行为的一个重要指标. CD34是存在于血管内皮细胞上的一种抗原, 其分子已被纯化和克隆, 是一种不同于Ⅷ因子相关抗原的蛋白质. 用CD34进行免疫组化染色来显示血管内皮细胞比Ⅷ因子相关抗原更加敏感, 特异性也更强[17]. 近年来国内外有关MVD与肿瘤浸润、转移及预后关系的研究逐渐增多, 内容涉及多系统肿瘤, 结果进一步证实MVD与多数实体性肿瘤侵袭、转移有关[18-21]. 本研究结果显示, 食管鳞癌组织中MVD显著大于癌旁正常黏膜, 食管鳞癌组织中MVD与肿瘤的TNM分期和淋巴结转移密切相关. 此外, MVD随COX-2表达增强而增加, Spearman等级相关分析表明, COX-2表达和MVD呈显著正相关. 因此, COX-2过度表达不但促进细胞增殖、抑制细胞凋亡, 而且可能通过促进肿瘤新生血管形成的机制参与食管癌的发生和发展过程. Kase et al[22]也认为, 食管鳞癌组织中COX-2的表达与高微血管密度及低凋亡指数有关.
近年来,特异性COX-2抑制剂如L-748706[23]、NS-398[24]等在食管癌的化学预防作用方面的研究逐渐增多并取得了一定的成果. 因此, 特异性COX-2抑制剂的开发和应用有望为食管癌预防和治疗开辟新的途径.
近年来, COX-2与肿瘤的关系日益受到人们的重视, 肿瘤的血管形成方面的研究也比较热门. COX-2在食管癌发生、发展及预后中的作用方面的研究较多, 本文旨在探讨COX-2表达与食管癌主要临床病理特征和血管生成的关系.
已有的研究表明, COX-2表达与食管癌主要临床病理特征的关系的报道不一致, Yu et al研究表明, COX-2表达水平与食管鳞癌患者的年龄、性别、肿瘤大小、分化程度、临床分期和淋巴结转移等均无相关性.而Nozoe et al报道COX-2在食管鳞癌组织的表达与肿瘤的TNM分期和淋巴结转移呈正相关.
本文发现COX-2表达与肿瘤细胞分化程度、临床TNM分期和淋巴结转移密切相关, 并且MVD与COX-2表达呈显著正相关, 提示COX-2可能是通过促进肿瘤新生血管形成的机制参与食管癌的发生和发展过程.
COX-2异常表达及其诱导的血管生成在食管癌的侵袭和淋巴结转移中起重要作用, 为特异性COX-2抑制剂在食管癌预防和治疗中的作用提供理论依据.
环氧化酶(cycloo-xygenase, COX)是花生四烯酸(arachidonic acid, AA)合成前列腺素(prostaglandins, PGs)的限速酶.目前已知COX至少有两种, 即 COX-1和COX-2.COX-2是一种诱导酶, 他参与合成的PGs与炎症、细胞增殖等病理生理作用有关.近年来COX-2与肿瘤的关系日益受到人们的重视.
本文探讨COX-2表达与食管癌主要临床病理特征和血管生成的关系, 具有较重要的价值.
电编: 李琪 编辑:潘伯荣
| 2. | Heeren P, Plukker J, van Dullemen H, Nap R, Hollema H. Prognostic role of cyclooxygenase-2 expression in esophageal carcinoma. Cancer Lett. 2005;225:283-289. [PubMed] [DOI] |
| 3. | Neri D, Bicknell R. Tumour vascular targeting. Nat Rev Cancer. 2005;5:436-446. [PubMed] [DOI] |
| 4. | Folkman J, Browder T, Palmblad J. Angiogenesis research: guidelines for translation to clinical application. Thromb Haemost. 2001;86:23-33. [PubMed] |
| 5. | Leung WK, To KF, Go MY, Chan KK, Chan FK, Ng EK, Chung SC, Sung JJ. Cyclooxygenase-2 upregulates vascular endothelial growth factor expression and angiogenesis in human gastric carcinoma. Int J Oncol. 2003;23:1317-1322. [PubMed] [DOI] |
| 6. | Sobin LH, Fleming ID. TNM Classification of Malignant Tumors, fifth edition (1997). Union Internationale Contre le Cancer and the American Joint Committee on Cancer. Cancer. 1997;80:1803-180. [PubMed] |
| 7. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 8. | Zhang W, Wang L, Chang A, Jin Y, Rao J. Immunohistochemical analysis of cyclooxygenase-2 expression in premalignant and malignant esophageal glandular and squamous lesions in Cixian, China. Cancer Detect Prev. 2003;27:243-249. [PubMed] [DOI] |
| 9. | Shamma A, Yamamoto H, Doki Y, Okami J, Kondo M, Fujiwara Y, Yano M, Inoue M, Matsuura N, Shiozaki H. Up-regulation of cyclooxygenase-2 in squamous carcinogenesis of the esophagus. Clin Cancer Res. 2000;6:1229-1238. |
| 10. | Zhi H, Wang L, Zhang J, Zhou C, Ding F, Luo A, Wu M, Zhan Q, Liu Z. Significance of COX-2 expression in human esophageal squamous cell carcinoma. Carcinogenesis. 2005;13. [PubMed] |
| 11. | Nozoe T, Ezaki T, Kabashima A, Baba H, Maehara Y. Significance of immunohistochemical expression of cyclooxygenase-2 in squamous cell carcinoma of the esophagus. Am J Surg. 2005;189:110-115. [PubMed] [DOI] |
| 12. | Yang GZ, Li L, Ding HY, Zhou JS. Cyclooxygenase-2 is over-expressed in Chinese esophageal squamous cell carcinoma, and correlated with NF-kappaB: an immunohistochemical study. Exp Mol Pathol. 2005;79:214-218. [PubMed] [DOI] |
| 13. | Yu HP, Xu SQ, Liu L, Shi LY, Cai XK, Lu WH, Lu B, Su YH, Li YY. Cyclooxygenase-2 expression in squamous dysplasia and squamous cell carcinoma of the esophagus. Cancer Lett. 2003;198:193-201. [PubMed] [DOI] |
| 14. | Kawabe A, Shimada Y, Uchida S, Maeda M, Sato F, Itami A, Imamura M. Expression of cyclooxygenase-2 is associated with carcinogenesis of the lower part of thoracic esophageal squamous cell carcinoma and p53 expression. Oncology. 2002;62:46-54. [PubMed] [DOI] |
| 15. | Kuo KT, Chow KC, Wu YC, Lin CS, Wang HW, Li WY, Wang LS. Clinicopathologic significance of cyclooxygenase-2 overexpression in esophageal squamous cell carcinoma. Ann Thorac Surg. 2003;76:909-914. [PubMed] [DOI] |
| 16. | Sivula A, Buskens CJ, van Rees BP, Haglund C, Offerhaus GJ, van Lanschot JJ, Ristimaki A. Prognostic role of cyclooxygenase-2 in neoadjuvant-treated patients with squamous cell carcinoma of the esophagus. Int J Cancer. 2005;116:903-908. [PubMed] [DOI] |
| 17. | Anthony PP, Ramani P. Endothelial markers in malignant vascular tumours of the liver: superiority of QB-END/10 over von Willebrand factor and Ulex europaeus agglutinin 1. J Clin Pathol. 1991;44:29-32. [PubMed] [DOI] |
| 18. | Goddard JC, Sutton CD, Furness PN, O'Byrne KJ, Kockelbergh RC. Microvessel density at presentation predicts subsequent muscle invasion in superficial bladder cancer. Clin Cancer Res. 2003;9:2583-2586. |
| 19. | Karademir S, Sokmen S, Terzi C, Sagol O, Ozer E, Astarcioglu H, Coker A, Astarcioglu I. Tumor angiogenesis as a prognostic predictor in pancreatic cancer. J Hepatobiliary Pancreat Surg. 2000;7:489-495. [PubMed] [DOI] |
| 20. | Fujioka S, Yoshida K, Yanagisawa S, Kawakami M, Aoki T, Yamazaki Y. Angiogenesis in pancreatic carcinoma: thymidine phosphorylase expression in stromal cells and intratumoral microvessel density as independent predictors of overall and relapse-free survival. Cancer. 2001;92:1788-1797. [PubMed] [DOI] |
| 21. | Sun WH, Sun YL, Fang RN, Ou XL, Xue QP, Shao Y, Xu HC, Cheng YL. Relationship between cyclooxygenase- 2 expression and angiogenesis in patients with gastric cancer. Zhonghua Weichang Waike Zazhi. 2005;8:343-347. [PubMed] |
| 22. | Kase S, Osaki M, Honjo S, Adachi H, Tsujitani S, Kaibara N, Ito H. Expression of cyclo-oxygenase-2 is correlated with high intratumoral microvessel density and low apoptotic index in human esophageal squamous cell carcinomas. Virchows Arch. 2003;442:129-135. [PubMed] |
| 23. | Stoner GD, Qin H, Chen T, Carlton PS, Rose ME, Aziz RM, Dixit R. The effects of L-748706, a selective cyclooxygenase-2 inhibitor, on N-nitrosomethylbenzylamine-induced rat esophageal tumorigenesis. Carcinogenesis. 2005;26:1590-1595. [PubMed] [DOI] |
| 24. | Yu HP, Shi LY, Lu WH, Su YH, Li YY, Xu SQ. Expression of cyclooxygenase-2 (COX-2) in human esophageal cancer and in vitro inhibition by a specific COX-2 inhibitor, NS-398. J Gastroenterol Hepatol. 2004;19:638-642. [PubMed] [DOI] |