修回日期: 2005-10-01
接受日期: 2005-10-09
在线出版日期: 2006-05-18
目的: 从转录水平研究一种新的外源阿片肽YPFPGPIRYG经胃肠道途径对小鼠脑组织和小肠组织阿片受体和肽转运载体基因的影响.
方法: 24只小鼠随机分为阿片肽样品组(n = 12)和对照组(n = 12), 在饮水中分别添加浓度为8×10-7 mol/L的阿片肽样品YPFPGPIRYG和双蒸水(空白对照组), 小鼠连续饮用2 wk. 提取受试小鼠脑组织和小肠组织的总RNA, RT-PCR检测μ阿片受体、δ阿片受体和肽转运载体PepT1 mRNA的变化情况.
结果: 小鼠的脑组织中同时有μ阿片受体和δ阿片受体mRNA的表达, 但阿片肽组小鼠与对照组相比, 脑组织中μ阿片受体和δ阿片受体mRNA的丰度没有变化; 小鼠的小肠中同时有μ阿片受体、δ阿片受体和肽转运载体PepT1 mRNA的表达, 且阿片肽组小鼠小肠中的μ阿片受体和δ阿片受体mRNA的表达与对照组相比明显上调(P<0.05), 而肽转运载体PepT1 mRNA的丰度与对照组相比没有差异.
结论: 小鼠组织中不同阿片受体的表达存在明显的组织特异性, 阿片肽YPFPGPIRYG对小鼠的生理调节不是通过与中枢神经系统上的阿片受体结合发挥作用, 其可能与小肠上的δ和μ阿片受体结合发挥作用.
引文著录: 韩飞, 施用晖, 乐国伟, 郑建良, 刘勇. 一种新的阿片肽对小鼠脑和小肠组织阿片受体和肽转运载体基因的影响. 世界华人消化杂志 2006; 14(14): 1372-1376
Revised: October 1, 2005
Accepted: October 9, 2005
Published online: May 18, 2006
AIM: To investigate the effect of a new opioid peptide, YPFPGPIRYG, on the opioid receptor and peptide transporter gene of brain and small intestinal tissues via gastrointestinal tracts at transcription level.
METHODS: Twenty-four mice were randomly divided into opioid group (n = 12) and control group (n = 12), which were fed with 8×10-7 mol/L YPFPGPIRYG and double distilled water, respectively, for 2 wk. The total RNA was extracted from the brain and small intestinal tissues of mice for the detection of μ-, δ-opioid receptor and peptide transporters PepT1 gene expression by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: In the brain and small intestinal tissues, μ- and δ-opioid receptor transcripts were detected, while peptide transporter PepT1 was only found to be expressed in the small intestine. In comparison with those in the controls, the expression of μ- and δ-opioid receptor were significantly enhanced in the small intestine (P < 0.05), but not in the brain, and PepT1 gene expression was not changed in the intestinal tissues of mice treated with YPFPGPIRYG.
CONCLUSION: Opioid receptor expression has tissue specificity. The immunomodulatory effects of opioid YPFPGPIRYG do not attribute to the interaction with the opioid receptors in central nervous system (CNS), but with d- and m-opioid receptor in small intestine.
- Citation: Han F, Shi YH, Le GW, Zheng JL, Liu Y. Effect of a new opioid peptide on opioid receptor and peptide transporter gene of brain and small intestinal tissues in mice. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1372-1376
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1372.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1372
许多研究表明, 神经内分泌和免疫系统之间存在着紧密的联系[1-2]. 神经肽是一类生物活性多肽, 在神经内分泌与免疫调节中起重要的作用, 而阿片肽是在免疫功能调节中研究较多的神经肽. 一些体外、体内实验结果显示阿片肽具有免疫调节作用, 包括影响淋巴细胞的增殖反应、抗体的产生、T细胞的转化、NK细胞活性以及巨噬细胞活性和粒细胞的趋化性等[3-4]. 但是, 由阿片肽诱导产生的一系列免疫系统变化的机制现在还不清楚. 阿片肽在体内存在相应的阿片受体, 阿片受体属于G蛋白耦联受体, 已发现的受体种类可以分为μ、δ、κ三大类型. 外源阿片肽作为一种小肽, 能否以完整的小分子肽形式吸收入血进而发挥他的免疫调节作用? 肽若完整吸收, 需穿越两个膜屏障, 一是肠上皮细胞的刷状缘膜, 另一个是肠上皮细胞的基底膜. 现已知小肽能借助刷状缘膜上的肽转运载体PepT1进入肠上皮细胞[5]. PepT1是低亲和力/高容量的肽载体, 主要在消化道中表达, 在肾脏中也有微弱的表达[6]. 通过纳酪酮阻断实验证明, 阿片肽对免疫系统的调节作用涉及μ、δ和κ阿片受体[2]. 一些研究结果表明, 在一般情况下, μ受体激动剂, 如吗啡, 有明显的免疫抑制作用, 而δ受体激动剂却有免疫刺激作用[7], 而且关于κ阿片受体与免疫相关的证据较少[8], 因此我们从基因转录水平, 利用RT-PCR方法, 研究一种新的外源阿片肽经胃肠道途径对小鼠体内脑和小肠组织的μ受体, δ受体以及肽转运载体PepT1 mRNA丰度变化的影响情况, 以期探讨阿片肽对小鼠生理调节的作用机制.
4-5周龄健康♂昆明种小白鼠(14-18 g), 由江苏省试验动物中心提供. 阿片肽样品(YPFPGPIRYG)为基因工程毕赤酵母发酵后, 经分离纯化获得[9]. 逆转录酶M-MLV, dATP, dTTP, dCTP, dGTP, RNA酶抑制剂(40 MU/L), 无RNA酶的DNA酶, Promega公司产品; Taq DNA多聚酶, TRIzol试剂, BBI公司产品; PCR标准, 华美生物工程公司产品; 琼脂糖, Sigma公司产品; DEPC(焦碳酸二乙酯), Amresco公司产品; RT-PCR引物, 上海捷倍思基因技术有限公司合成.
24只小鼠, 随机分为两组, 每组12只, 分别为对照组和阿片肽样品组, 自由采食并控制饮水量, 每天按5 mL/只提供饮水, 每日早晨8:00添水, 且样品组饮水中加入阿片肽样品YPFPGPIRYG(浓度为8×10-7 mol/L), 小鼠连续饮用2 wk. 室温25℃, 常规光照. 给药剂量依据: 在预备实验中发现, 当以上述剂量给小鼠饮水中添加阿片肽样品时, 小鼠开始出现明显的免疫反应(以脾脏T淋巴细胞的增殖反应作为考察指标)(P<0.05), 数据略.
TRIzol试剂提取受试小鼠脑和小肠组织的总RNA, 紫外可见分光光度计对RNA进行定量, RT-PCR检测μ阿片受体、δ阿片受体和肽转运载体PepT1 mRNA的表达. PCR引物设计采用oligo6.0: μ阿片受体引物: 上游引物(P1): 5' TGGTC GTGGC TGTAT TTATT 3', 下游引物(P2): 5' CGATT GTGGA GGAAG TTGG 3', 202 bp; δ阿片受体引物: P1: 5' ACATT GCTGT CTGCC ATCCT 3', P2: 5' GGCTG CGGTC CTTCT CCTT 3', 327 bp; 肽转运载体PepT1引物: P1: 5' CCAAA GGCAG TCCAA GAT 3', P2: 5' GCAAT GACCT CCAGA ACAA 3', 324 bp; actin-specific(肌动蛋白引物): P1: 5' GAGGG AAATC GTGCG TGAC 3', P2: 5' GCTGG AAGGT GGACA GTGAG 3', 447 bp. 总RNA的提取和纯化: 分别取对照组和实验组100-200 mg的脑组织和小肠, 放入装有预冷的1 mL TRIzol的匀浆器中, 在冰浴中充分匀浆, 然后转入1.5 mL离心管中, 冰水中静置5 min, 加入0.2 mL CCl4, 剧烈振荡混匀, 冰水中静置5 min, 12 000 r/min离心30 s, 取上层水相于一新的1.5 mL离心管中, 加入0.5 mL异丙醇, 混匀后-20℃静置30 min, 8000 r/min离心10 min, 弃上清, 沉淀用750 mL/L乙醇洗涤后, 8000 r/min离心30 s, 弃去上清, 室温放置, 晾干30 min. 加入50 μL的DEPC水, 75℃水浴10-15 min, 使RNA溶解, 即得总RNA提取液.
1.2.1 逆转录反应: 在-0.5 mL离心管中加入如下试剂: 总RNA, 5 μg; Rnasin (40 MU/L) 0.5 μL; 20 μmol/L Oligo (dT) 4 μL. 75℃水浴5 min, 37℃水浴10 min, 使局部双螺旋破坏, 再加入如下试剂: Rnasin (40 MU/L) 0.5 μL; 5×RT缓冲液 5 μL; dNTPs (10 mmol/L) 2 μL; M-MLV逆转录酶(200 MU/L) 1 μL, 加DEPC处理水使反应体系体积为25 μL, 手指轻弹使溶液混合, 37℃水浴50 min. 95℃, 5 min终止反应, 稍离心, 置于冰上立即进行PCR扩增或-20℃保存.
1.2.2 PCR反应: 在一0.5 mL无菌的Eppendorf管中加入如下试剂: 10×PCR Buffer (含15 mmol/L MgCl2) 5 μL; dNTPs (10 mmol/L) 1 μL; Actin引物, μ阿片受体引物(或δ阿片受体引物或PepT1引物)各10 μL(每种引物浓度为100 pmol/L); cDNA 2 μL; TaqDNA聚合酶(5 MU/L) 0.5 μL, 加无菌双蒸水使总体积为50 μL, 然后加液体石蜡30 μL, 覆盖于上述混合液上. PCR反应条件: 94℃变性2 min; 94℃ 45 s, 55℃ 45 s, 72℃ 1 min, 27个循环; 72℃延伸10 min; 产物-20℃保存.
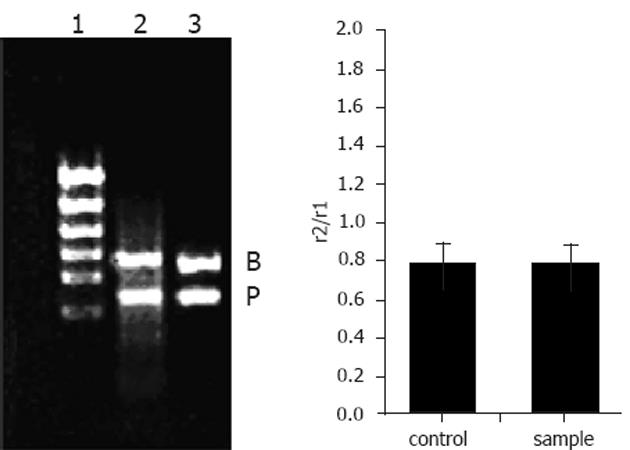
1.2.3 凝胶电泳: PCR产物采用EB染色, 每个加样孔上样量为6 μL (5 μL PCR产物+1 μL上样缓冲液). 琼脂糖凝胶浓度为1.5 g/L, 电泳缓冲液为TBE. 电压121 V, 电流102 mA, 电泳时间为50 min. 拍照用生物凝胶显像系统(Biolmaging systems). 定量分析软件用Image Acquisition和 Analysis Software.Ver.45.
统计学处理 应用SAS统计软件进行统计处理.
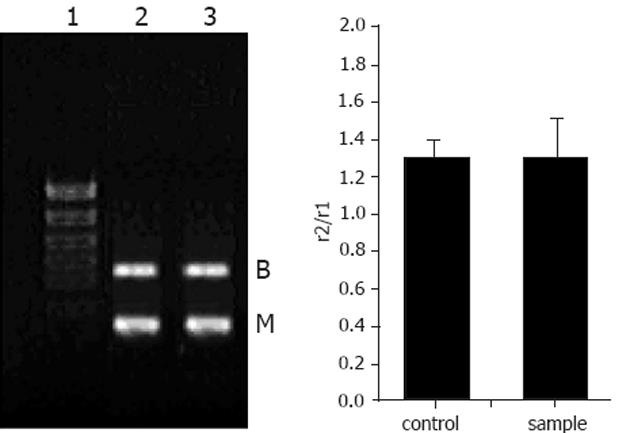
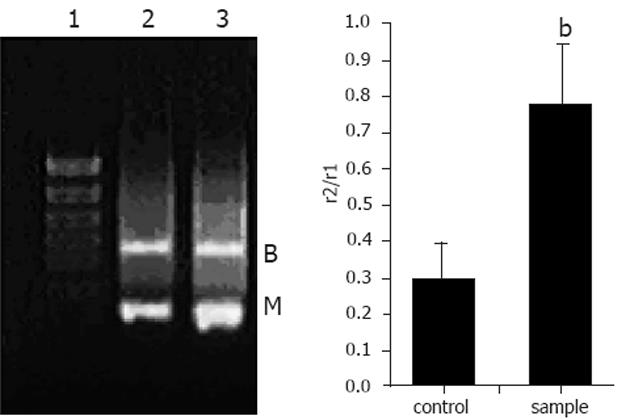
小鼠的脑组织中检测到有μ阿片受体mRNA的表达, 饮水中添加阿片肽与对照组相比, μ阿片受体mRNA的表达没有变化(图1). 小鼠的小肠中检测到有μ阿片受体mRNA的表达. 饮水中添加阿片肽与对照组相比, 小鼠的小肠中μ阿片受体mRNA的表达明显增强(P<0.01)(图2).
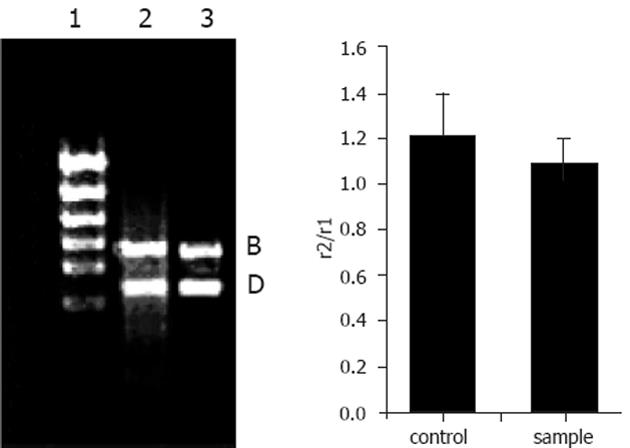
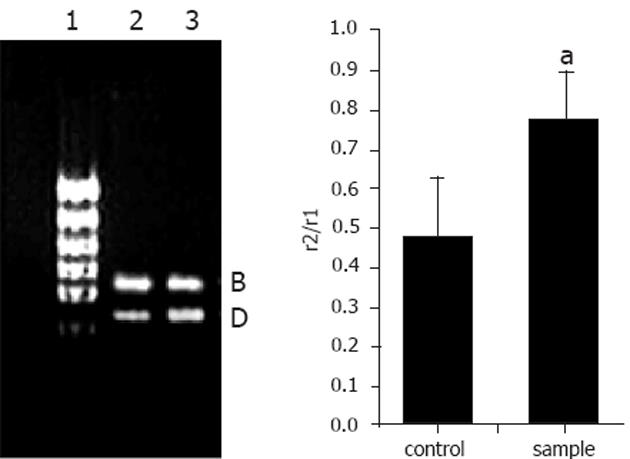
小鼠的脑组织中检测到有δ阿片受体mRNA的表达. 饮水中添加阿片肽, 小鼠连续饮用2 wk后, 与对照组相比, 阿片肽组小鼠的脑组织中δ阿片受体mRNA的表达基本没有变化(图3). 小鼠的小肠中检测到δ阿片受体mRNA的表达. 与对照组相比, 阿片肽组小鼠的小肠中δ阿片受体mRNA的表达显著增强(P<0.05)(图4).
小鼠的小肠中检测到肽转运载体PepT1 mRNA的表达. 饮水中添加阿片肽, 小鼠连续饮用2 wk后, 与对照组相比, 阿片肽组小鼠的小肠中PepT1 mRNA的表达与对照组相比差异不显著(P>0.05)(图5).
actin基因是一看家基因(housekeeping gene), 在动物体内其表达量相对比较恒定, 外界的环境大多不会改变他的表达水平, 在定量mRNA表达量的试验中常被用作内标, 以消除提取总RNA时所取样品量多少造成的误差. 我们用actin作内标, 对饮水中添加阿片肽样品YPFPGPIRYG, 小鼠连续饮用2 wk后, 小鼠小肠组织阿片受体和肠道肽转运载体进行了半定量RT-PCR试验. 有试验结果表明, 三种主要的阿片受体(μ、δ和κ受体)主要在中枢神经系统表达[10-13]. Wittert et al[14]的研究结果表明, 大鼠的脑组织中三种阿片肽受体均有表达. Gaveriaux et al[15]的研究结果显示, 人和小鼠的脑组织中三种阿片受体也都有表达. 另有研究发现, 用阿片类物质慢性处理神经细胞可以导致μ、δ或κ阿片受体数量下调和脱敏现象的发生(即受体的敏感度下降, 产生耐受现象)[13,16]. 本实验研究表明, 小鼠的脑组织中同时有μ阿片受体和δ阿片受体mRNA的表达, 且在饮水中添加阿片肽后, 对照组和阿片肽样品组小鼠脑组织中μ阿片受体和δ阿片受体mRNA的表达没有差异. 可能是由于阿片肽样品YPFPGPIRYG的分子量太大, 不能透过血脑屏障与脑部的阿片受体发生作用, 因而饮水中添加阿片肽, 小鼠脑组织中μ阿片受体和δ阿片受体mRNA的表达未见变化. 而我们在试验研究中发现, 当饮水中添加阿片肽样品YPFPGPIRYG, 小鼠连续饮用2 wk后, 小鼠的许多生理指标都发生了明显的变化(结果尚未发表). 以上研究结果表明, 阿片肽YPFPGPIRYG对小鼠的免疫作用不是通过与中枢神经系统上的阿片受体结合发挥作用的.
本实验结果显示, 小鼠的小肠中同时有μ阿片受体、δ阿片受体和肽转运载体PepT1 mRNA的表达. Fei et al[17]的研究结果显示小鼠的小肠中有肽转运载体PepT1的表达. 饮水中添加阿片肽, 小鼠连续饮用2 wk后, 阿片肽组小鼠小肠中的μ阿片受体和δ阿片受体mRNA的表达与对照组相比明显上调. 且阿片肽组肽转运载体PepT1 mRNA的表达与对照组相比没有差异. 以上研究结果说明, 阿片肽YPFPGPIRYG可能与小肠上的δ和μ阿片受体结合发挥生理调节作用.
以上研究结果表明, 阿片肽可以在不同组织代谢层次影响阿片受体的基因表达, 包括中枢神经系统和消化道, 进而发挥阿片肽广泛的生理功能.
许多研究表明, 神经内分泌和免疫系统之间存在着紧密的联系. 神经肽是一类生物活性多肽, 在神经内分泌与免疫调节中起重要的作用, 而阿片肽是在免疫功能调节中研究较多的神经肽. 一些体外、体内实验结果显示阿片肽具有免疫调节作用, 包括影响淋巴细胞的增殖反应、抗体的产生、T细胞的转化、NK细胞活性以及巨噬细胞活性和粒细胞的趋化性等. 但是, 由阿片肽诱导产生的一系列免疫系统变化的机制现在还不清楚. 我们从基因转录水平, 研究一种新阿片肽对小鼠组织阿片受体和肽转运载体的影响, 以期探讨阿片肽的作用机制.
阿片肽对免疫系统的调节作用; 新型阿片肽类药物的研发等.
YPFPGPIRYG为一种新阿片肽; 本文初步探讨阿片肽对小鼠生理调节的变化机制.
1 阿片受体: 阿片肽在体内存在相应的阿片受体, 阿片受体属于G蛋白耦联受体, 已发现的受体种类可以分为μ、δ、κ三大类型.
2 肽转运载体PepT1: PepT1是低亲和力/高容量的肽载体, 主要在消化道中表达, 在肾脏中也有微弱的表达[6].
电编: 张敏 编辑:张海宁
| 1. | Johnson HM, Smith EM, Torres BA, Blalock JE. Regulation of the in vitro antibody response by neuroendocrine hormones. Proc Natl Acad Sci USA. 1982;79:4171-4174. [PubMed] [DOI] |
| 2. | Livnat S, Felten SY, Carlson SL, Bellinger DL, Felten DL. Involvement of peripheral and central catecholamine systems in neural-immune interactions. J Neuroimmunol. 1985;10:5-30. [PubMed] [DOI] |
| 3. | Roy S, Ramakrishnan S, Loh HH, Lee NM. Chronic morphine treatment selectively suppresses macrophage colony formation in bone marrow. Eur J Pharmacol. 1991;195:359-363. [PubMed] [DOI] |
| 4. | Sibinga NE, Goldstein A. Opioid peptides and opioid receptors in cells of the immune system. Annu Rev Immunol. 1988;6:219-249. [PubMed] [DOI] |
| 6. | Adibi SA. The oligopeptide transporter (Pept-1) in human intestine: biology and function. Gastroen-terology. 1997;113:332-340. [PubMed] [DOI] |
| 7. | Hicks ME, Gomez-Flores R, Wang C, Mosberg HI, Weber RJ. Differential effects of the novel non-peptidic opioid tyrosylamido-6-benzyl-1,2,3,4 tetrahydroquinoline (CGPM-9) on in vitro rat t lymphocyte and macrophage functions. Life Sci. 2001;68:2685-2694. [PubMed] [DOI] |
| 8. | Martin-Kleiner I, Bidlack JM. Chronic opioid treatment of the mouse thymoma cell lines R1.G1 and R1EGO leads to down-regulation of the kappa opioid receptor without desensitization of adenylyl cyclase activity. Int Immunopharmacol. 2001;1:13-20. [PubMed] [DOI] |
| 10. | Kieffer BL. Recent advances in molecular recogni-tion and signal transduction of active peptides: receptors for opioid peptides. Cell Mol Neurobiol. 1995;15:615-635. [PubMed] [DOI] |
| 11. | Yasuda K, Raynor K, Kong H, Breder CD, Takeda J, Reisine T, Bell GI. Cloning and functional comparison of kappa and delta opioid receptors from mouse brain. Proc Natl Acad Sci USA. 1993;90:6736-6740. [PubMed] [DOI] |
| 12. | Satoh M, Minami M. Molecular pharmacology of the opioid receptors. Pharmacol Ther. 1995;68:343-364. [PubMed] [DOI] |
| 13. | Law PY, Hom DS, Loh HH. Opiate receptor down-regulation and desensitization in neuroblastoma X glioma NG108-15 hybrid cells are two separate cellular adaptation processes. Mol Pharmacol. 1983;24:413-424. [PubMed] |
| 14. | Wittert G, Hope P, Pyle D. Tissue distribution of opioid receptor gene expression in the rat. Biochem Biophys Res Commun. 1996;218:877-881. [PubMed] [DOI] |
| 15. | Gaveriaux C, Peluso J, Simonin F, Laforet J, Kieffer B. Identification of kappa- and delta-opioid receptor transcripts in immune cells. FEBS Lett. 1995;369:272-276. [PubMed] [DOI] |
| 16. | Puttfarcken PS, Werling LL, Cox BM. Effects of chronic morphine exposure on opioid inhibition of adenylyl cyclase in 7315c cell membranes: a useful model for the study of tolerance at mu opioid receptors. Mol Pharmacol. 1988;33:520-527. [PubMed] |
| 17. | Fei YJ, Sugawara M, Liu JC, Li HW, Ganapathy V, Ganapathy ME, Leibach FH. cDNA structure, genomic organization, and promoter analysis of the mouse intestinal peptide transporter PEPT1. Biochim Biophys Acta. 2000;1492:145-154. [PubMed] [DOI] |