修回日期: 2006-03-19
接受日期: 2006-03-24
在线出版日期: 2006-05-18
目的: 应用实时荧光定量PCR技术对实验幼兔粪便内双歧杆菌进行定量分析.
方法: 依据双歧杆菌16S rDNA序列设计属特异性引物, 以常规PCR产物经克隆后的质粒DNA为标准品, 经光谱定量、梯度稀释后制备标准曲线. 抽提正常对照组和双歧杆菌喂饲组幼兔粪便内的细菌基因组DNA, 用实时荧光定量PCR技术定量分析样品中双歧杆菌数量.
结果: 两组幼兔粪便内双歧杆菌测定结果均成阳性, 双歧杆菌喂饲组0.05 g湿粪内菌量的对数值较对照组显著升高(6.37±0.58 vs 5.18±0.98, P = 0.004).
结论: 实时荧光定量PCR方法可正确定量实验兔粪便内双歧杆菌数量.
引文著录: 陈津津, 蔡威. 实时荧光定量PCR方法检测幼兔粪便双歧杆菌的实验研究. 世界华人消化杂志 2006; 14(14): 1367-1371
Revised: March 19, 2006
Accepted: March 24, 2006
Published online: May 18, 2006
AIM: To quantitatively detect the bifidobacteria in the fecal samples from infant rabbits by real-time quantitative polymerase chain reaction (RTQ-PCR).
METHODS: Genus-specific primer of bifidobacteria was designed for 16S rDNA-targeted PCR. The standard curve of RTQ-PCR was generated from a grade-dilution of plasmid DNA which was cloned from PCR products and spectroscopically quantified. Bacterial genome DNA in fecal samples was extracted from the bifidobacteria-fed rabbits and the controls for analysis by RTQ-PCR, respectively.
RESULTS: Bifidobacteria was positive in both groups of rabbit fecal samples. The level of bifidobacteria in the bifidobacteria-fed rabbits was significantly higher than that in the control group (logarithm for the numbers of bifidobacteria per 0.05 g feces: 6.37 ± 0.58 vs 5.18 ± 0.98, P = 0.004).
CONCLUSION: Real-time quantitative PCR can accurately quantify the bifidobacteria in fecal samples from infant rabbits.
- Citation: Chen JJ, Cai W. Real-time quantitative PCR procedure for quantification of bifidobacteria in fecal samples from infant rabbits. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1367-1371
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1367.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1367
双歧杆菌(Bifidobacteria)作为恒温动物肠道内重要的原籍菌群, 发挥着维持微生态平衡、生物拮抗、免疫调节、营养等多方面的生理作用. 对肠道内或食品中的双歧杆菌进行准确地定量分析, 对于医疗卫生和营养保健方面的研究具有重要意义. 由于双歧杆菌属于专性厌氧菌, 其送检条件苛刻、培养难度大、存活率低, 检测结果受细菌离体时间、外界环境因素和培养基性能的影响大, 计数结果往往不能真实反映肠道内的菌群数量, 因而长期以来难以成为临床常规检测项目. 尤其在实验动物的研究中由于不能精确把握其肠道排泄时间, 难以实现对含菌粪便的即排即检, 使定量分析难以进行. 实时荧光定量PCR技术(real-time quantitative PCR, real-time Q-PCR)利用细菌基因组的核酸序列为鉴别基础, 不受上述条件的限制, 为双歧杆菌的定量检测提供了新的途径. 本文首先尝试将这一技术用于实验幼兔粪便内双歧杆菌的定量分析, 为后续研究的开展和临床应用进行了初步的摸索.
双歧杆菌冻干菌粉为青春双歧杆菌(Bifidobacterium adolescentis), 乳杆菌冻干菌粉为植物乳杆菌(Lactobacillis plantarum), 来自上海交通大学生物医药研究所, 大肠杆菌菌株来自本院细菌室. 分别取青春双歧杆菌冻干菌粉0.05 g、植物乳杆菌冻干菌粉0.05 g、大肠杆菌菌株培养液1 mL, 用Takara细菌基因组DNA小量纯化试剂盒(Takara MiniBEST Bacterial Genomic DNA Extraction Kit, 大连宝生物公司)抽提细菌基因组DNA, 于-20℃保存.
1.2.1 PCR引物对设计: 参照Malinen et al[1]报道依据双歧杆菌16S rDNA基因序列设计的双歧杆菌属特异性PCR扩增引物对(genium-specific primers), 并在BLAST基因库(http://www.ncbi.nlm.nih.gov/blast)内比对引物序列的特异性, 上下游引物序列见表1, 引物对由中国科学院闪晶生物有限公司合成.
| 引物对 | 序列(5'-3') | 定位 | 长度(bp) |
| Bifido51 | GATTCTGGCTCAGGATGAACG | Im26 | 21 |
| Bifido31 | CGGGTGCTI1CCCACTTTCATG | Im3 | 21 |
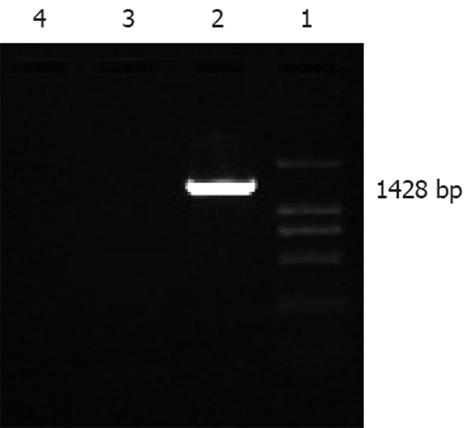
1.2.2 引物对特异性检测: 取菌株基因组DNA抽提液进行常规PCR反应: 50 μL标准PCR反应体系, 10×PCR Buffer 5 μL, 25 mmol/L Mg2+ 3 μL, 10 mmol/L dNTPS 1 μL, 25μmol/L上下游引物各1 μL, DNA模板1 μL , 5 U/μL Taq DNA Polymerase(Promega)0.5 μL , ddH2O 37.5 μL. 反应条件: 94℃变性3 min; 循环35次: 94℃变性40 s, 55℃退火20 s, 72℃延伸1 min 15 s; 72℃延伸5 min. 所有常规PCR反应于PTC-100TM Programmable Thermal Controller(MJ Research INC.)上进行. 用11 g/L的琼脂糖凝胶电泳分析PCR扩增产物, 以DNA Marker DL2000(Takara)为分子量标准, 在1428 bp处应显示扩增物区带.
1.2.3 外标准品制备: 将双歧杆菌的PCR产物经割胶回收后作为目的DNA片段, 与pGEM-T载体(Promega)连接, 转化E.coli DH5α感受态细胞, 克隆后分离质粒DNA, 用紫外分光光度计在260 nm测A值, 换算双歧杆菌外标准品的拷贝数为8.321 23×1016/L, 用于制作标准曲线.
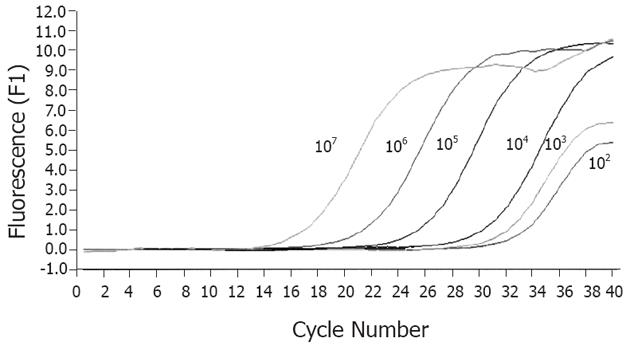
1.2.4 标准曲线制作: 将外标准品做10倍系列稀释, 使其形成1013-108拷贝/L; 按下列条件进行实时荧光定量PCR反应, 反应体系20 μL: 10×PCR Buffer 2 μL, 25 mmol/L Mg2+ 2 μL, 10 mmol/L dNTPS 0.5 μL, 25 mmol/L上下游引物各0.25 μL, DNA模板1 μL , 5U/μL Taq酶(Promega)0.25 μL , 20×SYBR Green Ⅰ 0.5 μL, ddH2O 13.25 μL. 反应条件: 95℃变性3 min; 循环40次: 95℃变性40 s, 61℃退火25 s, 72℃延伸1 min 20 s; 融解95℃ 0 s(20℃/s), 70℃ 15 s(20℃/s), 95℃0 s(0.1℃/s), 冷却40℃ 30 s(20℃/s), 所有实时荧光定量PCR反应在LightCycler(Roche)上进行.
1.2.5 实验对象: 20只2周龄的新西兰幼兔随机分成正常对照组10只、双歧杆菌喂饲组10只, 正常对照组予正常兔食饲养7 d, 双歧杆菌喂饲组除同步正常兔食饲养7 d外, 每日经胃管注入丽珠肠乐溶液1 mL(1粒)/只(丽珠肠乐为丽珠医药集团股份有限公司产品, 每粒胶囊含青春双歧杆菌活菌0.5×108).
1.2.6 样品采集: 实验第8天从实验兔的粪便收集器内收集少量新鲜粪便, 于4℃保存, 样品采集24 h内抽提粪便内细菌基因组DNA.
1.2.7 样品处理: 称取0.05 g湿粪, 用Takara细菌基因组DNA小量纯化试剂盒(Takara MiniBEST Bacterial Genomic DNA Extraction Kit)抽提粪便内所有细菌基因组DNA, 于-20℃保存.
1.2.8 样品检测: 将待测样品DNA抽提液按与标准曲线制备时相同的反应体系和反应条件进行实时荧光定量PCR反应, 每次实验都设阴性对照和标准品校正, 每个样品都做3个平行复孔, 以保证实验数据的有效性.
统计学处理 样品定量数据导入SPSS10.0软件, 计量资料结果以mean±SD表示, 采用t检验比较组间差别. 以P<0.05作为有统计学差异的标准.
用11 g/L的琼脂糖凝胶电泳分析菌株基因组DNA常规PCR扩增产物, 以DNA Marker DL2000 (Takara)为分子量标准, 双歧杆菌菌株基因组DNA在1428 bp处显示了单一扩增物区带(图1), 与相关文献[1]报道吻合, 而乳杆菌和大肠杆菌基因组DNA未见扩增物区带.
利用梯度稀释的外标准品做阳性模板进行实时荧光定量PCR反应, 可得到107-102个拷贝的模板循环数与荧光强度关系图(图2), 其中横坐标代表PCR反应的循环数(cycle number), 纵坐标代表DNA双链与SYBRGreen荧光染料结合后的荧光强度(F1), 从图中可以看出不同拷贝数的模板随循环数的增加, 其荧光强度逐渐增强, 在经过一段指数扩增期后曲线趋于平行, 即出现"平台效应", 指数扩增期模板拷贝数与荧光累积值的一一对应关系形成了双歧杆菌定量的基础. 从扩增曲线图可见少至100个菌仍有特征性曲线生长, 说明该实时荧光定量PCR检测双歧杆菌具有较好的敏感性.
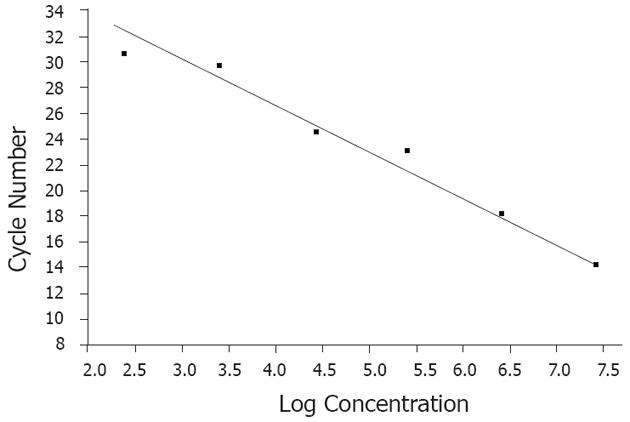
以不同拷贝数的阳性模板的对数为横坐标, 以PCR反应过程中到达荧光阈值的初始循环数(Ct)为纵坐标得到双歧杆菌的标准曲线, 为待测样品的双歧杆菌定量提供了定量检测的参照标准.
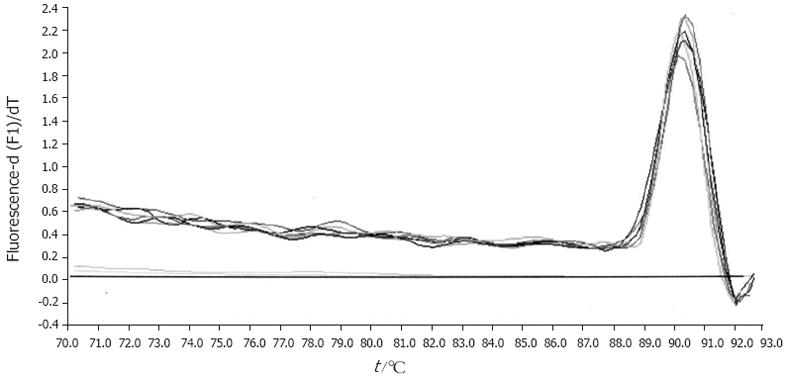
阳性模板在实时荧光定量PCR反应的后期, 产物经融解、冷却后得到溶解曲线, 可见融解曲线成单峰, 说明扩增产物单一, 与SYBRGreen荧光染料结合的为目标DNA片段, 较好地避免了定量检测过程中假阳性结果的出现.
传统的双歧杆菌检测方法是基于细菌的形态学、生理学和生物化学特征, 在特殊培养基上经厌氧培养、菌落计数来实现的, 其过程易受细菌离体时间、外界环境因素、培养基性能和非特异性菌落混杂等多种因素影响, 检测失败率高, 结果缺乏稳定性和可靠性, 且费时费力, 计数不精确, 属半定量检测. 而实时荧光定量PCR技术是以双歧杆菌16S rDNA编码基因特异区的核酸序列为鉴别基础, 设计引物, 经PCR扩增, 扩增产物与荧光染料结合, 再通过荧光信号的测定实现实时定量分析的. 其融会了PCR的灵敏性和光谱技术定量精确的优点, 使定量分析结果更精确、敏感、省时, 同时具有较好的重复性[2]. 不仅避免了传统检测方法的缺陷, 而且由于PCR扩增和产物分析的全过程均在单管封闭条件下进行, 并由微机控制, 消除了产物污染, 提高了检测效率.
本实验采用实时荧光定量PCR技术对实验幼兔粪便内的双歧杆菌进行检测, 实时荧光定量PCR反应条件的选择和优化对于反应成功与否非常关键. 其中荧光染料SYBRGreen Ⅰ的使用浓度是非常关键的因素, 如果SYBRGreen Ⅰ的浓度过低会使荧光信号的变化降低, 这意味着低拷贝的样品可能无法检出, 而SYBRGreen Ⅰ在高浓度时, 又将抑制PCR反应, 降低PCR反应效率, 通过对浓度递减的方法确定SYBRGreen Ⅰ在该体系中的最佳终浓度为0.5×, 从以梯度稀释的外标准品为模板所做的扩增曲线可见少至100个菌仍有阳性曲线生长, 即灵敏度可达102个菌. 同时由于SYBRGreen Ⅰ与DNA双链呈非特异性结合, 为减少引物二聚体双链与SYBRGreen I结合而产生的假阳性结果, 实验将退火温度通过递增的方式最终确定为61℃, 并通过融解曲线分析验证了产物的单一性.
标准曲线是样品定量的参照标准, 而外标准品浓度的精确测定是标准曲线制作的基础, 也是精确定量的关键. 既往采用常规PCR产物直接梯度稀释的方法虽然简便但存在不准确、不稳定的缺点, 本实验是将常规PCR产物克隆到载体上, 然后提出质粒, 经浓度测量和拷贝数换算, 实现了准确定量, 且模板稳定性高, 可较长时间保存, 这对实时荧光定量PCR每次检测样品时, 均需有已知浓度模板做校正参考, 显然是有利的, 同时也利于标准曲线的重复性检验.
本实验利用实时荧光定量PCR技术对两组新西兰幼兔粪便中的双歧杆菌进行了定量分析, 初步发现在常温有氧环境下收集的非新鲜粪便, 其双歧杆菌检测结果均成阳性, 说明利用实时荧光定量PCR技术对实验动物肠道内双歧杆菌进行定量分析是可行的. 比较双歧杆菌喂饲组和正常对照组发现, 喂饲双歧杆菌后其肠道内双歧杆菌数量较正常对照组有升高, 两者差异具有显著的统计学意义, 为动物造模后的干预性研究提供了实验依据.
实时荧光定量PCR技术实现了对双歧杆菌等难培养菌的实时定量分析, 为进一步研究实验动物和人肠道菌群的组成及其动态变化[3-4]提供了有效的检测手段, 具有较好的实验研究和临床应用的前景.
上海交通大学生命科学技术学院杭晓敏博士为本研究所需的纯化冻干菌粉提供了诸多帮助.
双歧杆菌(Bifi-dobacterium)是最重要的益生菌之一, 对肠道内或食品中的双歧杆菌进行准确地定量分析, 对于医疗卫生和营养保健方面的研究具有重要意义. 由于双歧杆菌属专性厌氧菌, 离体后迅速死亡, 传统培养计数法存在送检及培养条件苛刻, 培养存活率低, 计数不准确, 因此目前应用分子生物学技术对其进行定量分析成为该研究领域的热点. 实时荧光定量PCR技术(real-time quantitative PCR, real-time Q-PCR)利用细菌基因组的核酸序列为鉴别基础, 不受上述条件的限制, 为双歧杆菌的定量检测提供了新的途径. 本文首先尝试将这一技术用于实验幼兔粪便内双歧杆菌的定量分析, 为后续研究的开展和临床应用进行了有益地探索.
双歧杆菌由于参与构成宿主微生态系统, 发挥维持微生态平衡、免疫调节、营养等多方面的生理作用, 其在肠道内的总数量反应了机体肠道微生态状况和机体的健康状况. 因此对肠道内或食品中的双歧杆菌进行准确地定量分析, 对于医疗卫生和营养保健方面的研究具有重要意义. 本文, 选题明确, 方法可靠, 书写规范, 所引用的参考文献较新. 该文内容有一定的科学参考价值和可读性, 对双歧杆菌的临床检测具有一定的应用价值.
电编: 李琪 编辑:潘伯荣
| 1. | Malinen E, Kassinen A, Rinttila T, Palva A. Comparison of real-time PCR with SYBR Green I or 5'-nuclease assays and dot-blot hybridization with rDNA-targeted oligonucleotide probes in quantification of selected faecal bacteria. Microbiology. 2003;149:269-277. [PubMed] [DOI] |
| 2. | Satokari RM, Vaughan EE, Akkermans AD, Saarela M, de Vos WM. Bifidobacterial diversity in human feces detected by genus-specific PCR and denaturing gradient gel electrophoresis. Appl Environ Microbiol. 2001;67:504-513. [PubMed] [DOI] |
| 3. | Hopkins MJ, Sharp R, Macfarlane GT. Variation in human intestinal microbiota with age. Dig Liver Dis. 2002;34 Suppl 2:S12-S18. [PubMed] [DOI] |