修回日期: 2006-03-19
接受日期: 2006-03-24
在线出版日期: 2006-05-18
目的: 建立一套稳定的化学发光法体外HBV转录与复制水平检测体系.
方法: 将人肝癌细胞株HepG2和可产生复制型HBV颗粒的HepG2.2.15细胞培养3 d, 收集细胞均分为两份, 分别抽提细胞总RNA和HBV复制中间体DNA. 以地高辛标记的HBV重组质粒pHBV4.1作为探针, 分别进行Northern及Southern吸印杂交, 以化学发光法检测杂交结果. 将pHBV4.1以对数级差稀释后分别点样于尼龙膜用作内标, 同时进行杂交及检测.
结果: HepG2.2.15细胞提取物中检测出较强的HBV转录产物: 3.5 kb, 2.4/2.1 kb HBV mRNA的信号, 及较强的HBV复制产物: HBV复制中间体DNA的信号. HepG2细胞提取物检测结果均为阴性. 内标检测信号强度随点样浓度逐渐递减而减弱, 检测的灵敏度可达到1 pg, 接近同位素法检测的敏感度. 整个实验重复3次以上结果均相似.
结论: 成功建立了一套稳定的高灵敏化学发光法体外转录与复制水平检测体系.
引文著录: 何芳, 唐红, 刘丽, 刘凤君, 王甦, 周陶友, 赵连三, 刘聪. 高灵敏化学发光法体外HBV转录与复制水平的检测体系. 世界华人消化杂志 2006; 14(14): 1346-1351
Revised: March 19, 2006
Accepted: March 24, 2006
Published online: May 18, 2006
AIM: To establish a stable and highly sensitive chemiluminescent detection system for analysis of hepatitis V virus (HBV) transcription and replication level in vitro.
METHODS: Human hepatoma cell line HepG2 and HepG2.2.15, a HepG2 cell line with HBV transcription and replication, were collected after being cultured for 3 d and then divided equally. Total RNA of the cells and HBV replication intermediates were extracted and analyzed by Northern and Southern blot hybridization, respectively, while digoxigenin labeled HBV recombinant plasmid pHBV4.1 was used as the probe of the hybridizations. The results of the hybridizations were detected by chemiluminescent detection system. Thereafter pHBV4.1 was diluted into a series of multi-stage differential log-rank concentrations, and analyzed by dot blot hybridization along with Northern and Southern blot hybridization, which were used as the internal controls.
RESULTS: High levels of HBV specific transcripts (3.5 kb and 2.4/2.1 kb mRNA) and HBV replication intermediate DNAs were detected by Northern and Southern hybridization analysis, respectively, in the HepG2.2.15 cells. No HBV specific transcripts or HBV replication intermediate DNAs were found in the HepG2 cells. Positive dot signals detected in the internal controls were weakened as the decrease of pHBV4.1 concentration. The sensitivity of the chemiluminescent detection system of the Northern and Southern hybridization analysis was 1 pg of the target nucleotides according to the internal controls, which was almost equal to that of isotope detection system. Similar results were obtained after the whole procedures were repeated for more than three times.
CONCLUSION: A stable and highly sensitive chemiluminescent detection system for analysis of HBV transcription and replication level in vitro is successfully established.
- Citation: He F, Tang H, Liu L, Liu FJ, Wang S, Zhou TY, Zhao LS, Liu C. Establishment of a highly sensitive chemiluminescent detection system for analysis of hepatitis B virus transcription and replication level in vitro. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1346-1351
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1346.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1346
乙型肝炎病毒(hepatitis B virus, HBV)是嗜肝DNA病毒, 在细胞内通过逆转录机制进行复制, 转录与复制是HBV生活周期中极为重要的环节, 但目前对其调控机制尚不完全清楚, 这也是目前研究的难点与热点之一[1-6]. 建立一套稳定的体外HBV转录与复制水平检测体系是研究HBV的转录与复制调控机制的前提. 目前常用的也是经典的方法是: Northern及Southern印迹后与同位素标记探针杂交, 然后通过检测放射信号的强弱判断目的核苷酸的含量[7-13]. 尽管同位素法的敏感性和特异性都较高, 但存在半衰期短、对人体和环境有较高的危害性, 对实验设备和人员均有较高的要求等缺点, 因此很有必要发展非同位素法[14]. 同时, 由于HBV复制中间体DNA及mRNA的抽提较为困难, 因此建立稳定的高灵敏非同位素法检测体系显得十分重要. 我们将同位素标记探针改为地高辛标记探针, 以化学发光法检测Northern及Southern吸印杂交结果, 建立了一套稳定的高灵敏化学发光法体外HBV转录与复制水平检测体系.
人肝癌细胞株HepG2和稳定转染复制型HBV重组质粒的HepG2.2.15细胞株是目前常用的研究HBV转录与复制的细胞株及抗HBV药物筛选细胞模型[15-20], 由四川大学华西医院感染性疾病分子生物学研究室保存. HBV DNA重组质粒pHBV4.1由本研究室提供. RPMI 1640培养基干粉、G418、TRIzol和Tris碱购自Invitrogen公司; HEPES [4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid]、焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)、MOPS和去离子甲酰胺(formamide, deionized)等购自Amresco公司; 胰蛋白酶、NP-40、DNase Ⅰ、Pronase、 tRNA和鲑精DNA(Herring test DNA)购自Sigma公司; 化学发光检测试剂盒(DIG Luminescent Detection Kit for Nucleic Acids)和地高辛标记试剂DIG-High Prime购自Roche公司. 按常规方法在直径10 cm的培养皿中传代培养HepG2.2.15细胞和HepG2细胞. HepG2.2.15细胞采用含有100 mL/L小牛血清、10 mmol/L HEPES、5000 U/L青霉素、链霉素和380 mg/L G418的RPMI 1640培养基在37℃, 50 mL/L CO2条件下培养, 每2 d换液1次, 4 d传代. HepG2细胞培养条件除培养基不含G418以外, 其他均与HepG2.2.15细胞相同.
将HepG2.2.15细胞和HepG2细胞培养3 d, 收集细胞均分为两份, 分别用于细胞总RNA和HBV复制中间体DNA抽提. 细胞总RNA抽提采用TRIzol, 方法按试剂盒说明书进行. 储存于-20℃待用. 以地高辛标记试剂DIG-High Prime分别标记HBV表达质粒pHBV4.1和3-磷酸甘油醛脱氢酶(GAPDH)表达质粒phGAPDH, 分别命名为DIG-pHBV4.1和DIG-phGAPDH, 方法按试剂盒说明书进行.
1.2.1 Northern法检测HBV mRNA: 将10 μg细胞总RNA以10 g/L琼脂糖甲醛变性凝胶电泳后, 毛细管法(Capillary Blotting)转印至尼龙膜, 转印后紫外交联每面3 min, 4℃保存待用. 将转印膜片及1条内标同时在42℃预杂交[预杂交液: 5×SSC, 500 mL/L formamide (deionized), 1 g/L N-lauroylsarcosine, 0.2 g/L SDS, 20 g/L blocking solution, 鱼精DNA 0.02 g/L (100℃, 10 min)] 2-4 h, 随后将地高辛标记探针DIG-pHBV4.1和 DIG-phGAPDH 100℃变性10 min, 加入预热杂交液中42℃杂交过夜. 以DIG-phGAPDH同时进行Northern吸印杂交, 其目的是以GAPDH RNA 作为RNA检测的内对照.
1.2.2 Southern法检测HBV复制中间体DNA: HepG2.2.15细胞和HepG2细胞的DNA样品预处理: 30 μL DNA+1.5 μL RNAse (DNAse-free, 20 mg/L)+0.9 μL 10 g/L SDS+1 μL l0 g/L tRNA, 37℃ 15 min. 加10×DNA上样缓冲液 4 μL, 混匀后以10 g/L琼脂糖凝胶电泳. 电泳完成后0.25 mol/L HCl浸泡凝胶10-15 min, 变性液(1.5 mol/L NaCl, 0.5 mol/L NaOH)浸泡凝胶30 min, 复性液(3.0 mol/L NaCl, 0.5 mol/L Tris. HCl, pH 7.5)浸泡凝胶30 min; 毛细管法转印尼龙膜, 转印后紫外交联, 每面3 min, 干燥后, 4℃保存待用. 将转印膜片及1条内标同时在65℃预杂交[预杂交液: 5×SSC, 10 g/L N-lauroylsarcosine, 0.2 g/L SDS, 10 g/L blocking solution, 鱼精DNA 0.02 g/L (100℃, 10 min)] 2-4 h, 随后将地高辛标记探针DIG-pHBV4.1 100℃变性10 min, 加入预热杂交液中65℃杂交过夜.
1.2.3 化学发光法检测Northern及Southern法结果: 方法按试剂盒操作说明进行, 但稍作改进. 吸印杂交后洗膜: 2×SSC/1 g/L SDS, 室温洗膜5 min 2次; 0.1×SSC/1 g/L SDS, 65℃洗膜15 min 2次. 洗液[0.1 mol/L Maleic acid, 0.15 mol/L NaCl, pH 7.5, 3 mL/L Tween 20]室温浸泡膜片1-5 min, 封闭液[10 g/L blocking regeant溶于(0.1 mol/L Maleic acid, 0.15 mol/L NaCl, pH 7.5)]封闭1 h, 按1∶10 000稀释抗-地高辛-Ap于封闭液中, 室温作用1 h, 洗液洗膜20 min 2次; 检测液[0.1 mol/L Tris. HCl, 0.1 mol/L NaCl, pH 9.5]浸泡2-5 min; 膜放入杂交袋中, 加入CSPD(disodium 3-(4-methoxyspiro{1, 2-dioxethane-3, 2'-(5'-chloro)tricyclo[3.3.1.13, 7]decan}-4-yl) phenylphosphate)稀释液(将原液按1∶100稀释于检测液)室温作用5 min, 挤出多余液体, 密封杂交袋, 37℃作用5-15 min以加强荧光反应, X线胶片曝光显影保存结果.
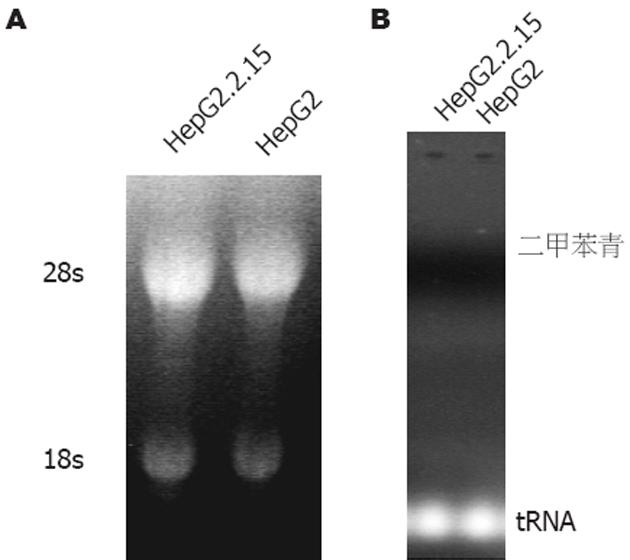
紫外分光光度计分析定量所提取的细胞总RNA, A260/A280比值显示在1.8-1.9之间, 提示所提取的RNA纯度较好, 10 cm培养皿1/2细胞的总RNA产量在25 μg左右. 10 g/L琼脂糖甲醛变性凝胶电泳后, 可见清晰的28s和18s RNA条带(图1A). 由于细胞中HBV复制中间体DNA总含量很少, 经10 g/L琼脂糖凝胶电泳后肉眼难以分辨, 而上样缓冲液中染料二甲苯青在5-14 g/L琼脂糖凝胶中的泳动速率与长约4 kb的双链线状DNA相同[14], 故可用tRNA和二甲苯青在凝胶中的位置判断HBV复制中间体DNA(≤3.2 kb)的位置(图1B), 以便裁取适当大小的凝胶用于转膜.
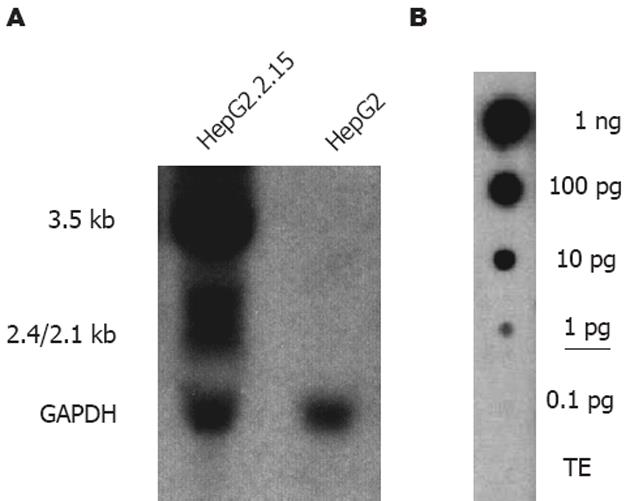
通过Northern法后化学发光法检测, 结果发现HepG2.2.15细胞中检测出有较强的HBV转录产物3.5 kb、2.1/2.4 kb的HBV mRNA的信号, 也即HepG2.2.15细胞中有较高水平的HBV转录产物产生, 与我们既往以pHBV4.1转染HepG2细胞后用同位素法检测的结果相似, 也与其他文献报道同位素方法检测结果一致[5-8,21-24]. 而HepG2细胞提取物中未检测到HBV转录产物的信号(图2A). 内标检测结果为: 1000, 100, 10及1 μg/L的pHBV4.1样品点样处均检出阳性斑点信号, 其强度随样品浓度逐渐递减而减弱, 0.1 μg/L pHBV4.1及TE样品点样处未检出阳性斑点信号(图2B). 本研究中HepG2.2.15细胞和HepG2细胞样品中GAPDH RNA经Northern法检测含量相似, 无明显差异.
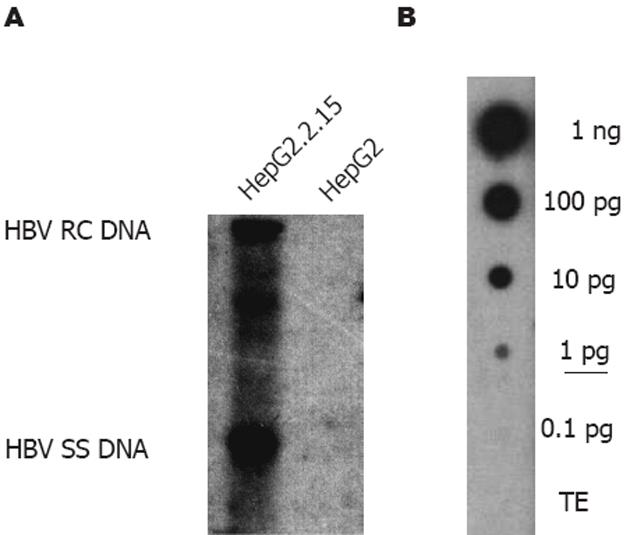
通过Southern法后化学发光法检测, 结果发现HepG2.2.15细胞中检测出有较强的HBV复制中间体DNA信号, 与我们既往以pHBV4.1转染HepG2细胞后用同位素法检测的结果相似, 也与其他与文献报道同位素方法检测结果一致[5-8,22-24]. 而HepG2细胞提取物中未检测到HBV复制中间体DNA的信号(图3A). 内标检测结果为: 1000, 100, 10及1 μg/L的pHBV4.1样品点样处均检出阳性斑点信号, 其强度随样品浓度逐渐递减而减弱, 0.1 μg/L pHBV4.1及TE样品点样处未检出阳性斑点信号(图3B).
经3次以上重复检测HepG2.2.15细胞中HBV 转录与复制水平其结果均相似, 同时检测结果也有良好的背景, 接近同位素法的低背景.
Northern与Southern法均是研究基因转录与复制常用的方法, 分别用于检测待测样品中特定的RNA和DNA的量与分子大小, 并可推出目的基因的表达程度, 具有较高的敏感性与特异性[14]. 故现有检测HBV转录与复制水平的方法中最常用的即是: 以Northern法直接检测细胞中提取的HBV转录产物及以Southern法直接检测细胞中提取的HBV复制中间体DNA[5-8,21-24].
目前Southern和Northern法中多是采用同位素探针, 如最常用的是: 32P. 虽然32P标记的探针有较高的灵敏度, 可检出固定在膜上的微量靶DNA(<1 pg), 但同位素也有其固有的一些缺陷, 如: 同位素的半衰期短(32P的半衰期只有14.3 d), 购买后需尽快标记探针, 并且通常需要标记探针后立即使用, 以免信号衰减; 有放射性可能造成操作人员的身体伤害、可能造成环境污染, 故对实验室设备和操作人员均有较高的要求[14]. 为替代同位素方法, 目前已发展有多种非同位素方法, 如采用地高辛、生物素或荧光素标记探针, 通过桥联反应显色或发光. 其中化学发光法的灵敏度已达到可在Southern法中检测出约1 pg的靶DNA, 接近同位素法的灵敏度[14]. 但目前为止, 由于HBV复制中间体DNA及mRNA在细胞中的含量很少, 抽提较为困难, 尚未见有人报道采用以地高辛、生物素或荧光素标记探针的非同位素法检测体系检测HBV的转录与复制水平. 目前虽有采用其他非同位素方法包括: RT-PCR等检测体系检测HBV的复制水平[25-28], 但由于PCR方法是将目的基因片段扩增后进行检测, 并非直接检测HBV复制中间体DNA, 且由于其敏感性极高, 易出现假阳性[14], 故在国外文献中极少采用此类方法检测HBV的转录与复制水平.
我们首次将高灵敏化学发光法引入HBV转录与复制水平检测体系, 并获得成功. 由于地高辛标记探针比生物素或荧光素标记探针稳定且检测结果的背景更低, 并且CSPD是现有的最灵敏的化学发光底物之一[14], 因此我们将同位素标记探针改为地高辛标记探针, 通过与特异性的抗地高辛-碱性磷酸酶(Anti-Digoxin-AP)结合后, 催化CSPD, 产生荧光, 使X-线胶片曝光而记录结果. 本系统中发光反应可持续1-3 d, 期间可多次曝光X-线胶片, 便于获得最佳图片. 由于我们将实验中封闭和洗涤膜片的时间均进行了延长, 使实验结果的背景大为降低, 同时每次操作均严格遵守实验程序规定的各种条件如温度和时间, 使得本系统获得较高的重复性和稳定性. HepG2细胞是人肝癌细胞株. HepG2.2.15细胞是由2个头尾相连的HBV全基因组DNA重组质粒稳定转染HepG2细胞而成, 可在体外转录并复制HBV, 是体外研究HBV转录与复制的良好模型, 也是常用细胞模型[15-22,29-30]. 因此, 我们将HepG2.2.15细胞作为阳性标本来源, 而将未转染任何HBV表达质粒的HepG2细胞作为阴性标本来源.
HBV的转录产物包括: 3.5, 2.4, 2.1和0.7 kb的mRNA. 其中3.5 kb mRNA作为前基因组RNA (pregenomic RNA), 是病毒逆转录复制的模板. 通常3.5和2.4, 2.1 kb mRNA的含量较高, 而0.7 kb mRNA的含量较低, 同时由于2.4, 2.1 kb mRNA的分子量十分接近, 故检测后往往表现为明显的3.5 kb和2.4/2.1 kb mRNA两条带, 0.7 kb mRNA条带极弱或显示不清楚[5-8,21-24]. 我们通过Northern法后化学发光法检测杂交结果发现, HepG2.2.15细胞中检测出有较强的HBV转录产物3.5, 2.4/2.1 kb的HBV mRNA的信号, 也即HepG2.2.15细胞中有较高水平的HBV转录产物产生, 而HepG2细胞提取物中未检测到HBV转录产物(图2A), 与文献报道一致[21-22,30]. HBV DNA 的合成过程是边包装边复制的过程, 期间会产生不同大小的DNA, 其全长为3.2 kb, 在凝胶电泳及Southern法后表现为3.2 kb以下的拖带, 其中主要是松弛环状的双链DNA (relaxed circular DNA, rcDNA)和单链DNA (single-stranded DNA, ssDNA)[1-2,5-8,30]. 我们通过Southern法后化学发光法检测杂交结果发现HepG2.2.15细胞中检测出有较强的HBV复制中间体DNA信号, 表现为拖带, 而HepG2细胞提取物HBV复制中间体DNA检测结果为阴性(图3A), 与文献报道一致[22,29-30].
内标检测结果发现发光信号强度随HBV表达质粒pHBV4.1的点样浓度逐渐递减而逐渐减弱, 但pHBV4.1样品浓度低至1 μg/L时仍能检出明显的阳性斑点信号, 提示本体系检测的灵敏度可达到1 pg, 接近同位素法检测的灵敏度(图2B, 3B). 同时检测结果的背景亦较低, 接近同位素法的低背景. 经3次以上重复检测HepG2.2.15细胞中HBV转录与复制水平其结果均相似, 提示本检测系统具有良好的稳定性, 适用于体外检测HBV转录与复制水平的实验研究. 事实上, 我们已将本检测体系用于体内实验研究, 将复制型HBV重组质粒pHBV4.1注入小鼠体内制成HBV体内短期复制模型, 取小鼠肝脏组织用本检测体系同样可以检测出HBV转录产物, 即3.5, 2.1/2.4 kb的HBV mRNA和HBV复制中间体DNA, 其信号的强度同样也接近同位素法的检测结果, 检测结果的背景亦较低(结果未出示, 待发表), 此结果进一步证实了本检测系统的稳定性.
总之, 在既往用同位素标记探针进行体外HBV转录与复制水平检测的工作基础上, 将同位素标记探针改为地高辛标记探针, 以化学发光法检测Northern和Southern法结果, 由此建立了一套高灵敏化学发光法体外乙型肝炎病毒转录与复制水平检测体系, 其灵敏度与同位素检测方法的灵敏度相似, 且结果稳定, 背景低, 能够满足体外检测HBV的转录与复制水平的实验研究需要, 如: HBV转录与复制调控机制的研究和抗HBV药物的筛选等, 更重要的是本检测体系避免了同位素操作的危害, 操作方便, 便于推广应用.
建立稳定的体外HBV转录与复制水平检测体系是研究HBV转录与复制调控机制的前提. 目前常用方法是以同位素标记探针进行Northern及Southern杂交. 尽管同位素法的敏感性和特异性都较高, 但存在放射性等缺点, 因此很有必要发展非同位素法.
目前为止, 由于HBV复制中间体DNA及mRNA在细胞中的含量很少, 抽提较为困难, 尚未见有人报道采用以地高辛、生物素或荧光素标记探针的非同位素法检测体系检测HBV的转录与复制水平. 其他非同位素方法主要是RT-PCR等, 但由于PCR方法是将目的基因片段扩增后进行检测, 并非直接检测HBV复制中间体DNA及mRNA, 且由于其敏感性极高, 易出现假阳性, 故在国外文献中极少采用此类方法.
以同位素标记探针进行Northern 及Southern杂交有探针半衰期短、有放射性等缺陷, 对实验室设备和操作人员均有较高的要求. 本文以地高辛标记探针建立了一套高灵敏化学发光法体外HBV转录与复制水平检测体系, 其灵敏度与同位素检测法相似, 且结果稳定, 背景低.
建立稳定的高灵敏化学发光法体外HBV转录与复制水平检测体系能够满足体外检测HBV的转录与复制水平的实验研究需要, 如: HBV转录与复制调控机制的研究和抗HBV药物的筛选等, 更重要的是避免了同位素操作的危害, 操作方便, 便于推广应用.
HBV转录与复制: HBV基因组全长3.2 kb, 具有4个启动子和2个增强子, 分别调控3.5, 2.4, 2.1和0.7 kb HBV mRNA的转录, 进而编码合成HBcAg、HBeAg、DNA多聚酶、HBsAg及HBxAg. 3.5 kb mRNA作为前基因组RNA也是病毒逆转录复制的模板, 在HBV DNA多聚酶催化下逆转录合成负链HBV DNA, 然后再以负链DNA为模板合成正链HBV DNA, 最终形成子代的不完全双链环状DNA. 转录与复制是HBV生活周期中极为重要的环节.
本文用非同位素化学发光法建立了Southern, Northern blot方法, 检测HBV的复制和转录水平, 从其灵敏度分析, 已接近同位素方法, 该实验设计合理, 方法表述详而不繁, 结果明确, 令人信服. 对研究HBV和筛选抗HBV的药物有相当的借鉴意义.
电编: 张敏 编辑:潘伯荣
| 1. | Lee JY, Locarnini S. Hepatitis B virus: pathogenesis, viral intermediates, and viral replication. Clin Liver Dis. 2004;8:301-320. [PubMed] [DOI] |
| 2. | Ganem D, Prince AM. Hepatitis B virus infection-natural history and clinical consequences. N Engl J Med. 2004;350:1118-1129. [PubMed] [DOI] |
| 3. | Melegari M, Wolf SK, Schneider RJ. Hepatitis B virus DNA replication is coordinated by core protein serine phosphorylation and HBx expression. J Virol. 2005;79:9810-9820. [PubMed] [DOI] |
| 4. | Uprichard SL, Wieland SF, Althage A, Chisari FV. Transcriptional and posttranscriptional control of hepatitis B virus gene expression. Proc Natl Acad Sci USA. 2003;100:1310-1315. [PubMed] [DOI] |
| 5. | Tang H, Banks KE, Anderson AL, McLachlan A. Hepatitis B virus transcription and replication. Drug News Perspect. 2001;14:325-334. [PubMed] |
| 6. | Tang H, McLachlan A. Transcriptional regulation of hepatitis B virus by nuclear hormone receptors is a critical determinant of viral tropism. Proc Natl Acad Sci USA. 2001;98:1841-1846. [PubMed] [DOI] |
| 7. | Wang S, Tang H, He F, Liu L, Huang FJ, Zhou TY, Zhao LS. On the role of liver-enriched transcription factors in regulating HBV transcription and replica-tion. Sichuan Daxue Xuebao Yixueban. 2006;37:35-39. [PubMed] |
| 8. | Tang H, Delgermaa L, Huang F, Oishi N, Liu L, He F, Zhao L, Murakami S. The transcriptional transactivation function of HBx protein is important for its augmentation role in hepatitis B virus repli-cation. J Virol. 2005;79:5548-5556. [PubMed] [DOI] |
| 9. | Isogawa M, Robek MD, Furuichi Y, Chisari FV. Toll-like receptor signaling inhibits hepatitis B virus replication in vivo. J Virol. 2005;79:7269-7272. [PubMed] [DOI] |
| 10. | Robek MD, Boyd BS, Wieland SF, Chisari FV. Signal transduction pathways that inhibit hepatitis B virus replication. Proc Natl Acad Sci USA. 2004;101:1743-1747. [PubMed] [DOI] |
| 11. | Kimura K, Kakimi K, Wieland S, Guidotti LG, Chisari FV. Activated intrahepatic antigen-presenting cells inhibit hepatitis B virus replication in the liver of transgenic mice. J Immunol. 2002;169:5188-5195. [PubMed] [DOI] |
| 12. | Kimura K, Kakimi K, Wieland S, Guidotti LG, Chisari FV. Interleukin-18 inhibits hepatitis B virus replication in the livers of transgenic mice. J Virol. 2002;76:10702-10707. [PubMed] [DOI] |
| 13. | Tang H, McLachlan A. Mechanisms of inhibition of nuclear hormone receptor-dependent hepatitis B virus replication by hepatocyte nuclear factor 3beta. J Virol. 2002;76:8572-8581. [PubMed] [DOI] |
| 14. | Sambrook J, Russell DW. Molecular cloning: a laboratory manual. New York: Cold Spring Harbor Laboratory Press 2001; 5.1-5.13; 8.1-8.17; 9.1-9.81. |
| 15. | Ren X, Luo G, Xie Z, Zhou L, Kong X, Xu A. Inhibi-tion of multiple gene expression and virus replica-tion of HBV by stable RNA interference in 2.2.15 cells. J Hepatol. 2006;44:663-670. [PubMed] [DOI] |
| 16. | Ren XR, Zhou LJ, Luo GB, Lin B, Xu A. Inhibition of hepatitis B virus replication in 2.2.15 cells by expressed shRNA. J Viral Hepat. 2005;12:236-242. [PubMed] [DOI] |
| 17. | Iyer RP, Jin Y, Roland A, Morrey JD, Mounir S, Korba B. Phosphorothioate di- and trinucleotides as a novel class of anti-hepatitis B virus agents. Antimicrob Agents Chemother. 2004;48:2199-2205. [DOI] |
| 18. | Semaine W, Johar M, Tyrrell DL, Kumar R, Agrawal B. Inhibition of hepatitis B virus (HBV) replication by pyrimidines bearing an acyclic moiety: effect on wild-type and mutant HBV. J Med Chem. 2006;49:2049-2054. [PubMed] [DOI] |
| 19. | Tang H, Raney AK, McLachlan A. Replication of the wild type and a natural hepatitis B virus nucleo-capsid promoter variant is differentially regulated by nuclear hormone receptors in cell culture. J Virol. 2001;75:8937-8948. [PubMed] [DOI] |
| 20. | Qian ZK, Xuan BQ, Min TS, Xu JF, Li L, Huang WD. Cost-effective method of siRNA preparation and its application to inhibit hepatitis B virus replication in HepG2 cells. World J Gastroenterol. 2005;11:1297-1302. [PubMed] [DOI] |
| 21. | Giladi H, Ketzinel-Gilad M, Rivkin L, Felig Y, Nussbaum O, Galun E. Small interfering RNA inhibits hepatitis B virus replication in mice. Mol Ther. 2003;8:769-776. [PubMed] [DOI] |
| 22. | Tang N, Huang AL, Zhang BQ, Yan G, Xiang MQ, Pu D, Guo H. Construction of recombinant eukaryotic expression plasmid containing 1.3-fold-overlength genome of HBV and its expression in HepG2 cells. Zhonghua Ganzangbing Zazhi. 2003;11:464-466. [PubMed] |
| 23. | McCaffrey AP, Nakai H, Pandey K, Huang Z, Salazar FH, Xu H, Wieland SF, Marion PL, Kay MA. Inhibition of hepatitis B virus in mice by RNA interference. Nat Biotechnol. 2003;21:639-644. [PubMed] [DOI] |
| 24. | Lu X, Tran T, Simsek E, Block TM. The alkylated imino sugar, n-(n-Nonyl)-deoxygalactonojirimycin, reduces the amount of hepatitis B virus nucleoca-psid in tissue culture. J Virol. 2003;77:11933-11940. [PubMed] [DOI] |
| 25. | Wu Y, Huang AL, Tang N, Zhang BQ, Lu NF. RNA interference inhibits replication and expression of hepatitis B virus in mice. Zhonghua Yixue Zazhi. 2005;85:630-634. [PubMed] |
| 26. | Liu J, Li YH, Ding J, Gong WD, Xue CF, Zhao Y, Huang YX. Quantifying anti-HBV effect of targeted ribonuclease by real-time fluorescent PCR. World J Gastroenterol. 2004;10:2883-2885. [PubMed] [DOI] |
| 27. | 崔 敏, 刘 志红, 朱 丽晶, 陈 惠萍, 曾 彩虹, 周 虹, 黎 磊石. 乙型肝炎病毒感染肾炎患者肾组织病毒抗原和复制中间体的检测及其意义. 肾脏病与透析肾移植杂志. 2004;13:301-308, 325. |
| 29. | Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in Hep G2 cells transfected with cloned hepatitis B virus DNA. Proc Natl Acad Sci USA. 1987;84:1005-1009. [PubMed] [DOI] |