修回日期: 2006-03-15
接受日期: 2006-03-20
在线出版日期: 2006-05-08
目的: 探讨EBV相关胃癌(EBVaGC)、EBV阴性胃癌(EBVnGC)及相应癌旁组织中ras基因突变和法尼基转移酶(FTase)的表达意义.
方法: 应用PCR-RFLP技术检测EBVaGCs13例、EBVnGCs45例以及相应癌旁组织58例中H-ras 12和K-ras 12, 13密码子点突变情况; RT-PCR技术检测FTase β亚单位mRNA的表达水平.
结果: 共检测到H-ras 12位点突变2例, 突变率为3.45%(2/58), 均发生在EBVnGCs, 未发现K-ras 12和13密码子点突变. 58例癌组织中FTase β亚单位mRNA表达水平为0.93±0.39, 癌旁组织中FTase β亚单位mRNA表达水平为0.78±0.26, 两者有显著性差异(t = 2.44, P = 0.02). EBVaGCs组织中FTase β亚单位mRNA表达水平为0.80±0.19, EBVnGCs组织中FTase β亚单位mRNA表达水平为0.96±0.43, 两者无显著性差异(t = 1.93, P = 0.06); EBVaGCs和癌旁组织中FTase β亚单位mRNA表达水平无显著性差异(t = 0.54, P = 0.60); EBVnGCs和癌旁组织中FTase β亚单位mRNA表达水平有显著性差异(t = 2.39, P = 0.02); 2例BHRF1阳性和11例BHRF1阴性EBVaGCs组织中FTase β亚单位mRNA表达水平无显著性差异(t = 0.26, P = 0.80); 6例BARF1阳性和7例BARF1阴性EBVaGCs组织中FTase β亚单位mRNA表达水平亦无显著性差异(t = 1.59, P = 0.14).
结论: 胃癌组织ras基因突变率较低, 胃癌组织中FTase β亚单位mRNA明显高于癌旁组织. EBVaGC组织中ras基因突变、FTase β亚单位表达与EBV感染无明显相关性.
引文著录: 孙佰秀, 殷凡, 朱伟, 高玉, 孙淑红, 罗兵. EBV相关胃癌ras基因突变及法尼基转移酶β-亚单位基因的表达. 世界华人消化杂志 2006; 14(13): 1294-1299
Revised: March 15, 2006
Accepted: March 20, 2006
Published online: May 8, 2006
AIM: To investigate ras gene mutations and farnesyltransferase (FTase) β mRNA expression in Epstein-Barr virus(EBV)-associated gastric carcinoma (EBVaGC), EBV-negative gastric carcinoma (EBVnGC) with matched clinico-pathological parameters and corresponding adjacent tissues of gastric carcinoma.
METHODS: The mutations of ras gene were detected by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) and the expression of FTase β mRNA was tested by reverse transcription PCR (RT-PCR) in 13 EBVaGCs, 45 EBVnGCs with matched clinicopathological parameters and 58 corresponding adjacent tissues of gastric carcinoma.
RESULTS: H-ras mutation at codon 12 was detected in 2(3.45%) cases of gastric carcinomas, both of which were EBVnGCs. No K-ras mutations occurred at codon 12 and 13 in all cases. The level of FTase β mRNA expression was 0.93 ± 0.39 in gastric carcinomas and 0.78 ± 0.26 in corresponding adjacent tissues, respectively. The difference between the two groups was significant (t = 2.44, P = 0.02). The level of FTase β mRNA expression was 0.80 ± 0.19 in EBVaGCs and 0.96 ± 0.43 in EBVnGCs respectively. The difference between the two groups was not significant (t = 1.93, P = 0.06). FTase β mRNA expression was not significantly different (t = 0.54, P = 0.60) between EBVaGCs and corresponding adjacent tissues either, while it was significant (t = 2.39, P = 0.02) between EBVnGCs and corresponding adjacent tissues. The level of FTase β mRNA expression had no significant relationship between 2 BHRF1 positive samples and 11 BHRF1 negetive samples of EBVaGCs (t = 0.26, P = 0.80) as well as between 6 BARF1 positive samples and 7 BARF1 negetive samples of EBVaGCs (t = 1.59, P = 0.14).
CONCLUSION: The frequency of ras gene mutations in gastric carcinomas is low in this study. The level of FTase β mRNA expression in gastric carcinomas is much higher than that in normal tissues. EBV infection has no significant correlations with ras mutations and FTase expression in EBVaGC.
- Citation: Sun BX, Yin F, Zhu W, Gao Y, Sun SH, Luo B. Ras mutation and expression of farnesyltransferase β mRNA in Epstein-Barr virus-associated gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(13): 1294-1299
- URL: https://www.wjgnet.com/1009-3079/full/v14/i13/1294.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i13.1294
Epstein-Barr病毒(EBV)是重要的DNA肿瘤病毒, 与人类多种淋巴系统恶性肿瘤如Burkitt淋巴瘤、移植后B淋巴细胞瘤、何杰金病及某些T淋巴细胞瘤等的发生密切相关. 近年来研究表明, 胃癌、肝癌和口腔癌组织中可检测到EBV基因组. 胃腺癌组织中也存在EBV阳性细胞, 同时伴有患者血清EBV抗体效价的升高, 证实EBV感染与胃癌存在一定的相关性[1-2]. 胃癌细胞内存在EBV者, 定义为EBV相关胃癌(EBV-associated gastric carcinoma, EBVaGC)[3]. 目前认为EBV相关肿瘤的发生、发展是病毒基因表达与癌基因、抑癌基因等异常协同作用, 导致正常细胞的生长调控发生障碍所致. EBVaGC组织中ras基因突变和FTase mRNA表达是否由于EBV参与而与EBV阴性胃癌(EBV-negative gastric carcinoma, EBVnGC)有所不同, 目前尚未见报道. 我们选择EBVaGC和各种临床指标与之匹配的EBVnGC作为研究对象, 应用PCR限制性片段长度多态性(PCR-RFLP)技术检测胃癌及相应癌旁组织中H-ras 12和K-ras 12, 13密码子点突变情况; 半定量RT-PCR检测FTase β亚单位mRNA的表达水平. 探讨EBVaGC中EBV基因表达与ras基因异常和FTase mRNA转录水平的关系, 为胃癌病因学研究和防治提供理论依据.
2001-01/2002-12, 收集青岛大学医学院附属医院126例、青岛市市立医院25例和烟台毓璜顶医院34例胃癌患者手术切除的新鲜胃癌组织和相应癌旁组织(距离癌组织5 cm以上), 全部病例均经病理诊断证实.自上述185例胃癌患者中选取病理诊断与原位杂交证实的EBVaGCs 13例, 组织中均检测到EBV核抗原EBNA1基因的mRNA, EBNA2和潜伏膜蛋白LMP1基因mRNA均为阴性, 6例检测到EBV早期基因BARF1的表达, 2例检测到EBV早期基因BHRF1的表达[4] .临床病理资料与之匹配的EBVnGCs 45例, 平均年龄57.9±13.4(31-81)岁, 男48例, 女10例. EBV阳性组和EBV阴性组病例在年龄、性别、肿瘤部位、组织学类型、分化程度、有无淋巴结转移以及临床分期等方面均无显著性差异. 酚、氯仿、异戊醇法常规提取组织DNA, TRIzol一步法提取组织总RNA. cDNA的合成参照逆转录试剂盒要求的标准条件进行cDNA合成. 反应体系为: 10×Buffer 2 μL, MgCl2 5 mmol/L, dNTP 1 mmol/L, AMV反转录酶15 U, 核酸酶抑制剂0.5 U, Oligo(dT)15 0.5 μg, 模板RNA5 μL, 加Nuclease-Free Water至终体积20 μL. 42℃ 1 h, 99℃ 5 min, 然后快速冷却至4℃. 合成的cDNA用作PCR反应模板, -20℃保存备用.
参照文献[5-6]设计并由上海生工生物工程技术服务有限公司合成检测ras基因突变的特异性引物, 同时选择相应的限制性核酸内切酶进行酶切分析, 引物序列、扩增产物大小以及所用限制性内切酶见表1. PCR反应体系为10×Buffer 2.5 μL, MgCl2 1.5 mmol/L, dNTP 0.2 mmol/L, 上下游引物各0.5 μmol/L, Taq DNA聚合酶1.0 U, DNA模板2 μL, 加双蒸水至终体积25 μL. 检测K-ras 12密码子突变的PCR扩增参数为95℃预变性5 min; 然后95℃ 40 s, 60℃ 30 s, 72℃ 30 s, 共35个循环; 最后72℃延伸5 min. 检测K-ras 13密码子突变的扩增参数中退火温度调整为50℃, 其余参数均与检测K-ras 12密码子突变的相同. 检测H-ras 12密码子突变的PCR扩增参数为94℃预变性5 min; 然后94℃ 30 s, 60℃ 30 s, 72℃ 30 s, 35个循环; 最后72℃延伸5 min. 取PCR扩增产物5 μL于含溴化乙锭(0.5 mg/L)的20 g/L琼脂糖凝胶中电泳, 80 V, 1 h, 紫外投射仪下观察结果, 与PCR marker DL2000进行对照分析, 若分别观察到162 bp, 159 bp和170 bp条带表明扩增成功.
| 名称 | 引物序列 | 扩增产物 | 酶 | 突变型 | 野生型 |
| K-ras sense primer | 5'-ACTGAATATAAACTTGTGGTAGTTGGACCT-3' | 162 bp | BstNⅠ | 162 bp | 133 bp+29 bp |
| 12位点 antisense primer | 5'-CTGTATCAAAGAATGGTCCTGCACCAGTA-3' | ||||
| K-ras sense primer | 5'-GTACTGGTGGAGTATTTGATAGTGTATTAA-3' | 159 bp | HaeⅢ | 85 bp+74 bp | 85 bp+48 bp+26 bp |
| 13位点 antisense primer | 5'-GTATCGTCAAGGCACTCTTGCCTAGG-3' | ||||
| H-ras sense primer | 5'-CAGGGCCCTCCTTGGCAGG-3' | 170 bp | HpaⅡ | 122 bp+48 bp | 66 bp+56 bp+48 bp |
| 12位点 antisense primer | 5'-GTCGTATTCGTCCACAAAATGG-3' |
1.2.1 限制性酶切反应: 检测K-ras 12位点突变的限制性酶切反应: BstNⅠ酶切PCR产物, 反应体系为10×NEB Buffer 2 μL, 100×BSA 0.2 μL, BstNⅠ5 U, PCR产物10 μL, 加双蒸水至20 μL, 混匀后60℃水浴过夜. 检测K-ras 13位点突变的限制性酶切反应: HaeⅢ酶切PCR产物, 反应体系为10×Buffer 2 μL, HaeⅢ 5 U, PCR产物5 μL, 加双蒸水至20 μL, 混匀后37℃水浴过夜. 检测 H-ras 12位点突变的限制性酶切反应: HpaⅡ酶切PCR产物, 反应体系为10×Buffer 2 μL, HpaⅡ 10 U, PCR产物5 μL, 加双蒸水至20 μL, 混匀后37℃水浴1 h.酶切产物于80 g/L聚丙烯酰胺凝胶中电泳, 溴化乙锭染色, 紫外投射仪下观察结果并拍照. 野生型和突变型条带结果判断标准见表1.
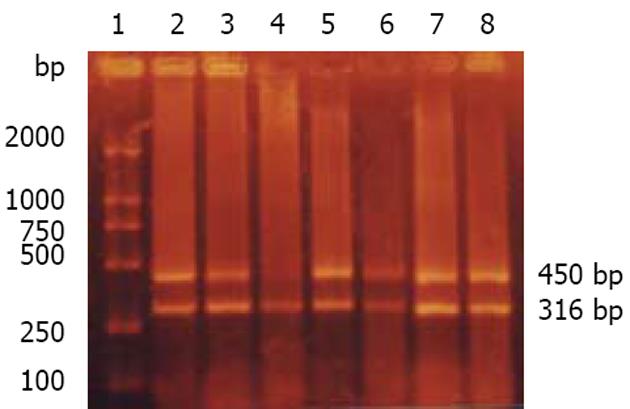
1.2.2 半定量RT-PCR检测FTase β亚单位mRNA表达: 法尼基转移酶β亚单位(FTase β subunit)和内参照基因GAPDH特异性引物参照文献[7,8]设计, 由上海生工生物技术服务公司合成. 引物序列如下: 目的基因sense primer: 5'-ATCCAGGCCACTACATACTTT-3'; antisense primer: 5'-GGCTGATAGATTTTTGGTTTG-3', 扩增产物片段长度为316 bp. 内参照基因sense primer: 5'-CTCAGACACCATGGGGAAGGTGA-3'; antisense primer: 5'-ATGATCTTGAGGCTGTTGTCATA-3', 扩增产物片段长度为450 bp. PCR反应体系为10×Buffer 2.5 μL, MgCl2 1.5 mmol/L, dNTPs 0.2 mmol/L, FTase β亚单位mRNA和内参照基因GAPDH上下游引物均0.3 μmol/L, Taq DNA聚合酶1.0 U, cDNA模板2 μL, 加双蒸水至终体积25 μL. PCR扩增参数为94℃预变性5 min; 94℃ 40 s, 56℃ 40 s, 72℃ 1 min, 35个循环; 最后72℃延伸10 min. 取PCR产物5 μL于含溴化乙锭(0.5mg/L)的20 g/L琼脂糖凝胶中电泳, 80 V, 1 h, 紫外投射仪下观察结果并拍照, 出现316 bp和450 bp扩增条带表明扩增成功. 用凝胶图像分析系统对FTase β亚单位mRNA的表达进行半定量分析, 以FTase β亚单位与GAPDH荧光强度乘面积的比值表示目的基因的表达水平, 大于或等于正常平均值+2SD者确定为过度表达.
统计学处理 应用SPSS10.0统计软件对实验数据进行处理. 采用t检验分析胃癌和癌旁组织FTase β亚单位mRNA表达的配对数据的差异; 多元逐步回归分析胃癌组织中FTase β亚单位mRNA表达水平与临床病理各参数, 前者为应变量, 后者为自变量, P<0.05认为有相关关系.
我们采用PCR-RFLP检测13例EBVaGCs, 45例EBVnGCs以及58例相应癌旁组织中K-ras 12和13密码子以及H-ras 12密码子点突变, 结果检测到2例H-ras 12位点突变, 突变率3.45%(2/58), 均发生在EBVnGCs. 未发现K-ras 12和13密码子点突变, 13例EBVaGCs以及58例相应癌旁组织中均未检测到上述密码子的点突变(图1).
以GAPDH为内参照, 采用半定量RT-PCR技术检测13例EBVaGCs, 45例EBVnGCs以及58例相应癌旁组织FTase β亚单位mRNA表达, 上述组织中均检测到内参照基因GAPDH的表达, 表明cDNA分子完整以及PCR反应成功(图2). 58例胃癌组织中FTase β亚单位mRNA表达水平为0.93±0.39, 癌旁组织中FTase β亚单位mRNA表达水平为0.78±0.26, 统计学分析表明两者有显著性差异(t = 2.44, P = 0.02<0.05); 13例EBVaGCs组织中FTase β亚单位mRNA表达水平为0.80±0.19, 45例EBVnGCs组织中FTase β亚单位mRNA表达水平为0.96±0.43, 统计学分析表明两者无显著性差异(t = 1.93, P = 0.06); EBVaGCs和癌旁组织中FTase β亚单位mRNA表达水平无显著性差异(t = 0.54, P = 0.60); EBVnGCs和癌旁组织中FTase β亚单位mRNA表达水平有显著性差异(t = 2.39, P = 0.02<0.05). FTase β亚单位mRNA有3例过表达, 2例发生于EBVnGCs组织中, 1例发生于癌旁组织, 统计学分析过表达在胃癌以及癌旁组织间无显著性差异; FTase β亚单位mRNA过表达的病例中均无ras突变.
2例BHRF1 阳性EBVaGCs组织中FTase β亚单位mRNA表达水平为0.76±0.24, 11例BHRF1阴性EBVaGCs组织中FTase β亚单位mRNA表达水平为0.86±0.21, 统计学分析表明两者无显著性差异(t = 0.26, P = 0.80); 6例BARF1阳性EBVaGCs组织中FTase β亚单位mRNA表达水平为0.73±0.19, 7例BARF1阴性EBVaGCs组织中FTase β亚单位mRNA表达水平为0.90±0.21, 统计学分析表明两者无显著性差异(t = 1.59, P = 0.14). 以胃癌组织中FTase β亚单位mRNA表达水平为应变量, 临床病理各参数(包括性别、年龄、病理分型、组织学分级、有无淋巴结转移)为自变量, 进行多元逐步回归分析. 结果显示胃癌组织中FTase β亚单位mRNA表达水平增高与患者性别和病理分型有关, 与年龄、组织学分级无关, 发生在女性、病理分型为印戒细胞癌的胃癌组织FTase β亚单位mRNA表达水平有显著升高(表2).
ras基因作为癌基因家族的重要成员, 其基因突变以及编码蛋白过表达与许多肿瘤的发生、发展相关, ras基因家族包括H-ras, K-ras和N-ras, ras癌基因异常导致肿瘤发生的主要方式为点突变. 研究表明约10%-15%的肿瘤中至少有一种ras基因发生点突变, 点突变主要集中在第12, 13以及61位密码子; 胃癌组织中主要是H-ras和K-ras基因的突变. Yoo et al[9]采用PCR技术和DNA序列分析检测140例美国胃腺癌患者癌组织中ras基因突变情况, 结果显示ras基因点突变率为14%, H-ras 2位点突变5例; K-ras 13位点突变7例, 61位点突变3例; 未发现K-ras 12, H-ras 13及61位点突变. 郝莹 et al[10]应用多种方法检测胃癌演变过程中ras基因的突变, 发现肠化生、不典型增生以及胃癌组织中H-ras 12位点突变率分别为16.7%, 31.2%和34.7%, 各组间无显著性差异; 而浅表性胃炎及正常对照组未发现突变. 表明中国人胃癌组织中有一定的H-ras突变率; 而国外研究多显示胃癌组织中H-ras突变率较低甚至检测不到ras基因突变. 本研究结果显示H-ras 12位点突变发生率3.45%(2/58), 且均发生在EBVnGCs; 未发现K-ras 12, 13位点突变; 13例EBVaGCs以及58例相应癌旁组织中均未检测到ras基因突变. 这与Yoo et al的报道有所不同, 推测ras基因突变可能存在地区和种族差异.
ras基因编码产物ras蛋白的持续活性状态可引起细胞增生和转化, 细胞中ras蛋白需经过一系列修饰后才具有生物活性, ras蛋白脂化修饰中的法尼基化是其关键步骤[11-12]. ras蛋白的法尼基化主要由法尼基转移酶(FTase)催化完成, 未法尼基化的ras蛋白不能定位于细胞膜, 因而无法实现其信号传导功能和致癌作用. 目前ras蛋白作为抗肿瘤治疗的靶点, 已成为该领域研究的热点, 法尼基转移酶抑制剂已用于肺癌、头颈部癌和结肠癌等实体癌治疗的Ⅰ期、Ⅱ期和Ⅲ期临床试验[13-16]. FTase是由α, β两种亚单位组成的异二聚体, β-亚单位识别底物序列, 结合ras蛋白; α-亚单位是其底物法尼基二磷酸盐FPP的携带者, FTase的酶催化功能必须由α, β亚单位共同完成, 任何一个亚单位的变性都会影响酶活性. 为探讨FTase是否直接参与细胞增殖, Nagase et al[17]采用DNA重组技术将FTase α和β亚单位编码基因同时转染NIH3T3细胞, 对FTase过表达细胞中ras蛋白的法尼基化以及ras信号传导途径的上下游因子活性进行了研究.结果显示转染细胞呈FTase过表达, α, β亚单位蛋白表达较未转染细胞提高3-13倍, FTase活性提高1.5-3倍, 法尼基化ras蛋白表达增加, 且发现ras法尼基化提高程度低于法尼基酶活性升高程度. 进一步研究发现适量的生长因子如胰岛素样生长因子-1(IGF-1)、血小板衍生生长因子(PDGF)、纤维母细胞生长因子(bFGF)能明显提高FTase过表达细胞的DNA合成和细胞增殖, 若将FTase过表达NIH3T3接种裸鼠则可导致肿瘤形成, 但与ras过表达细胞注入裸鼠形成的肿瘤表型明显不同, 提示FTase直接参与细胞生长转化以及肿瘤形成机制. 本研究结果表明, 胃癌组织中FTase β亚单位mRNA明显高于癌旁组织, 但FTase的高表达与ras突变无相关性. 我们认为胃癌的发生发展是多种基因异常协同作用的结果, ras基因异常在该过程不起主要作用; FTase不是通过活化ras基因发挥其致瘤作用, 可能FTase直接参与细胞的癌变过程. FTase表达水平在EBVaGC及癌旁组织中无显著性差异, 该观点有待扩大标本量深入研究. FTase表达水平在女性和病理分型为印戒细胞癌[18]的胃癌组织中有显著升高, 但由于女性和印戒细胞癌标本例数较少, 目前该观点尚难定论.
我们曾对13例EBV相关胃癌组织中病毒潜伏期基因和早期基因的表达进行了研究[19-21], 结果显示, 13例EBVaGC组织中LMP1表达均缺失, 而6例BARF1阳性, 2例BHRF1阳性, 提示BARF1和 BHRF1可能代替LMP1在胃癌的发生发展过程中发挥重要作用. BARF1可在体外转化原代猴肾上皮细胞和人上皮细胞, 并使鼠成纤维细胞系BALB/c3T3或EBV阴性的B细胞系Louckes产生致瘤转化, 转化的鼠成纤维细胞接种至新生鼠体内, 可形成进行性表达BARF1的肿瘤[22-23]. Sall et al[24]研究认为BARF1具有生长因子作用. BHRF1与bcl-2的基因序列具有高度的同源性, 与bcl-2基因相似, BHRF1可抑制细胞凋亡, 促进细胞的生长和转化, 延长细胞寿命[25-26].本研究结果显示, EBVaGCs组织中FTase β亚单位mRNA表达水平与EBVnGCs中的表达水平无统计学意义, FTase表达与EBV编码基因的表达无明显相关性, 推测胃癌的发生是多因素作用的结果, 病毒感染和FTase高表达通过不同途径参与EBV相关胃癌的发生.
近几年, 罗兵教授在EBV相关胃癌方面作了大量研究, 包括EBV相关基因、癌基因、抑癌基因在胃癌组织的表达及相关性, 发表多篇文章, 并获得山东省教育厅科技进步一等奖. 本文章旨在研究EBVaGC中EBV基因表达与ras基因异常和FTase mRNA转录水平的关系, 为胃癌病因学研究和防治提供理论依据, 尤其为法尼基转移酶抑制剂的临床应用提供理论依据. 本研究13例EBV相关胃癌标本选自185例病例, EBV相关胃癌发生率较低, 标本收集有一定难度, 需在以后作进一步工作.
本研究通过cDNA的合成、PCR检测等方法探讨了EBVaGC、EBVnGC及癌旁组织基因突变中ras基因突变和FTase的表达. 得出胃癌ras基因突变率低、FTaseb亚单位mRNA明显高于癌旁组织. EBVaGC中ras基因突变、FTaseb亚单位表达与EBV感染无相关. 立题新颖, 设计合理, 方法先进, 数据可靠, 是一篇很好的学术论文.
电编: 李琪 编辑:潘伯荣
| 1. | Burke AP, Yen TS, Shekitka KM, Sobin LH. Lymphoepithelial carcinoma of the stomach with Epstein-Barr virus demonstrated by polymerase chain reaction. Mod Pathol. 1990;3:377-380. [PubMed] |
| 2. | Shibata D, Weiss LM. Epstein-Barr virus-associated gastric adenocarcinoma. Am J Pathol. 1992;140:769-774. [PubMed] |
| 3. | Tokunaga M, Land CE, Uemura Y, Tokudome T, Tanaka S, Sato E. Epstein-Barr virus in gastric carcinoma. Am J Pathol. 1993;143:1250-1254. [PubMed] |
| 4. | Luo B, Wang Y, Wang XF, Liang H, Yan LP, Huang BH, Zhao P. Expression of Epstein-Barr virus genes in EBV-associated gastric carcinomas. World J Gastroenterol. 2005;11:629-633. [PubMed] [DOI] |
| 5. | Hatzaki A, Razi E, Anagnostopoulou K, Iliadis K, Kodaxis A, Papaioannou D, Labropoulos S, Vasilaki M, Kosmidis P, Saetta A. A modified mutagenic PCR-RFLP method for K-ras codon 12 and 13 mutations detection in NSCLC patients. Mol Cell Probes. 2001;15:243-247. [PubMed] [DOI] |
| 7. | Khan SG, Dummer R, Siddiqui J, Bickers DR, Agarwal R, Mukhtar H. Farnesyltransferase activity and mRNA expression in human skin basal cell carcinomas. Biochem Biophys Res Commun. 1996;220:795-801. [PubMed] [DOI] |
| 8. | Kijima Y, Hokita S, Yoshinaka H, Itoh T, Koriyama C, Eizuru Y, Akiba S, Aikou T. Amplification and overexpression of c-met gene in Epstein-Barr virus-associated gastric carcinomas. Oncology. 2002;62:60-65. [PubMed] [DOI] |
| 9. | Yoo J, Park SY, Robinson RA, Kang SJ, Ahn WS, Kang CS. ras Gene mutations and expression of Ras signal transduction mediators in gastric adenocarcinomas. Arch Pathol Lab Med. 2002;126:1096-1100. [PubMed] |
| 11. | 熊 舜斌, 唐 朝宇, 许 根俊. Ras的结构和功能及其参与的信号传导. 生物化学与生物物理进展. 1995;6:482-486. |
| 12. | Rowinsky EK, Windle JJ, Von Hoff DD. Ras protein farnesyltransferase: A strategic target for anticancer therapeutic development. J Clin Oncol. 1999;17:3631-3652. [PubMed] |
| 13. | Vogt A, Qian Y, Blaskovich MA, Fossum RD, Hamilton AD, Sebti SM. A non-peptide mimetic of Ras-CAAX: selective inhibition of farnesyltransferase and Ras processing. J Biol Chem. 1995;270:660-664. [PubMed] [DOI] |
| 14. | Zujewski J, Horak ID, Bol CJ, Woestenborghs R, Bowden C, End DW, Piotrovsky VK, Chiao J, Belly RT, Todd A. Phase I and pharmacokinetic study of farnesyl protein transferase inhibitor R115777 in advanced cancer. J Clin Oncol. 2000;18:927-941. [PubMed] |
| 15. | Adjei AA, Erlichman C, Davis JN, Cutler DL, Sloan JA, Marks RS, Hanson LJ, Svingen PA, Atherton P, Bishop WR. A Phase I trial of the farnesyl transferase inhibitor SCH66336: evidence for biological and clinical activity. Cancer Res. 2000;60:1871-1877. [PubMed] |
| 16. | Van Cutsem E, van de Velde H, Karasek P, Oettle H, Vervenne WL, Szawlowski A, Schoffski P, Post S, Verslype C, Neumann H. Phase III trial of gemcitabine plus tipifarnib compared with gemcitabine plus placebo in advanced pancreatic cancer. J Clin Oncol. 2004;22:1430-1438. [PubMed] [DOI] |
| 17. | Nagase T, Kawata S, Nakajima H, Tamura S, Yamasaki E, Fukui K, Yamamoto K, Miyagawa J, Matsumura I, Matsuda Y. Effect of farnesyltransferase overexpression on cell growth and transformation. Int J Cancer. 1999;80:126-133. [PubMed] [DOI] |
| 18. | Luo B, Murakami M, Fukuda M, Fujioka A, Yanagihara K, Sairenji T. Characterization of Epstein-Barr virus infection in a human signet ring cell gastric carcinoma cell line, HSC-39. Microbes Infect. 2004;6:429-439. [PubMed] [DOI] |
| 19. | Wang Y, Luo B, Yan LP, Huang BH, Zhao P. Relationship between Epstein-Barr virus-encoded proteins with cell proliferation, apoptosis, and apoptosis-related proteins in gastric carcinoma. World J Gastroenterol. 2005;11:3234-3239. [PubMed] [DOI] |
| 20. | Wang Y, Luo B, Zhao P, Huang BH. Expression of Epstein-Barr virus genes in EBV-associated gastric carcinoma. Ai Zheng. 2004;23:782-787. [PubMed] |
| 21. | Luo B, Wang Y, Wang XF, Gao Y, Huang BH, Zhao P. Correlation of Epstein-Barr virus and its encoded proteins with Helicobacter pylori and expression of c-met and c-myc in gastric carcinoma. World J Gastroenterol. 2006;12:1842-1848. [PubMed] [DOI] |
| 22. | zur Hausen A, Brink AA, Craanen ME, Middeldorp JM, Meijer CJ, van den Brule AJ. Unique transcription pattern of Epstein-Barr virus (EBV) in EBV-carrying gastric adenocarcinomas: expression of the transforming BARF1 gene. Cancer Res. 2000;60:2745-2748. [PubMed] |
| 23. | Steelman LS, Pohnert SC, Shelton JG, Franklin RA, Bertrand FE, McCubrey JA. JAK/STAT, Raf/MEK/ERK, PI3K/Akt and BCR-ABL in cell cycle progression and leukemogenesis. Leukemia. 2004;18:189-218. [PubMed] [DOI] |
| 24. | Sall A, Caserta S, Jolicoeur P, Franqueville L, de Turenne-Tessier M, Ooka T. Mitogenic activity of Epstein-Barr virus-encoded BARF1 protein. Oncogene. 2004;23:4938-4944. [PubMed] [DOI] |
| 25. | Henderson S, Huen D, Rowe M, Dawson C, Johnson G, Rickinson A. Epstein-Barr virus-coded BHRF1 protein, a viral homologue of Bcl-2, protects human B cells from programmed cell death. Proc Natl Acad Sci USA. 1993;90:8479-8483. [PubMed] [DOI] |