修回日期: 2006-03-05
接受日期: 2006-03-20
在线出版日期: 2006-05-08
目的: 探讨活血化瘀复方中药益肝康抑制大鼠肝星状细胞(HSC)增殖的作用机制.
方法: 采用IL-1β激活HSC, 应用Western blot检测JNK的活化程度; 应用活细胞计数试剂盒-CCK-8检测HSC增殖并观察JNK特异性阻断剂SP600125对IL-1β促HSC增殖的影响. 应用凝胶电泳移动抑制法测定AP-1的活性.
结果: IL-1β有明显促大鼠HSC增殖作用, IL-1β作用培养的HSC 24 h后, 吸光值明显高于对照组(1.573±0.026 vs 1.339±0.073, P = 0.000); 经JNK特异性阻滞剂SP600125预处理后, IL-1β促HSC增殖作用受到抑制, SP600125浓度为10, 20及40 mmol/L时, 吸光值分别为1.427±0.113, 0.772±0.093, 0.675±0.074, 与对照组(1.560±0.110)相比其增殖反应均明显降低(P = 0.03; P = 0.000; P = 0.000); IL-1β可激活大鼠HSCs JNK信号蛋白, 并呈现出一定的时相变化. IL-1β作用HSCs后0, 5, 15, 30, 60及120 min, JNK活性分别为0.982±0.299, 1.501±0.720, 2.133±0.882, 3.360±0.452, 2.181±0.789, 1.385±0.368. 与0(未加IL-1β)相比, 15 min, 30 min及60 min均有显著差异(P = 0.002, P = 0.000, P = 0.001). 益肝康可抑制IL-1β诱导的HSCs JNK活性(1.610±0.242 vs 3.360±0.452, P = 0.000); 益肝康可抑制IL-1β诱导的HSCs AP-1活性, 经益肝康预处理HSCs 1 h后, AP-1活性明显受到抑制(342.43±85.77 vs 597.70±83.96, P = 0.005).
结论: IL-1β可刺激HSC增殖, 细胞内JNK信号转导通路参与了IL-1β促HSC增殖作用; 益肝康可通过阻滞JNK/AP-1通路, 抑制HSC增殖.
引文著录: 张亚平, 姚希贤, 刘晓玲, 赵霞. 复方中药益肝康抑制肝星状细胞增殖的作用机制. 世界华人消化杂志 2006; 14(13): 1272-1276
Revised: March 5, 2006
Accepted: March 20, 2006
Published online: May 8, 2006
AIM: To study the mechanism of Yigankang in the proliferation inhibition of rat hepatic stellate cells (HSCs).
METHODS: The activation of JNK pathway was detected by Western blot, while the proliferation of HSCs was induced by interleukin-1β (IL-1β). The effect of JNK inhibitor SP600125 was measured by cell counting kit-8 (CCK-8) and AP-1 activity was evaluated by electrophoretic mobility shift assay.
RESULTS: Interleukin-1β up-regulated the proliferation of HSCs. After stimulation of IL-1β for 24 h, HSC proliferation increased significantly as compared with that in the controls (1.573 ± 0.026 vs 1.390 ± 0.073, P = 0.000). After treatment with different concentrations of SP600125 (10 µmol/L, 1.427 ± 0.113; 20 µmol/L, 0.772 ± 0.093; 40 µmol/L, 0.675 ± 0.074), HSC proliferation induced by IL-1β decreased significantly in comparison with that in the controls (1.560 ± 0.110) (P = 0.03; P = 0.000; P = 0.000). IL-1β activated JNK pathway in a time-dependent manner in rat HSCs. After stimulation of IL-1β for 0, 5, 15, 30, 60 and 120 min, the JNK activities were 0.982 ± 0.299, 1.501 ± 0.720, 2.133 ± 0.882, 3.360 ± 0.452, 2.181 ± 0.789, 1.385 ± 0.368, respectively. In comparison with those in the cells without IL-1β, JNK activities differed significantly at 15, 30 and 60 min (P = 0.002, P = 0.000, P = 0.001). Yigankang inhibited the activities of JNK (1.610 ± 0.242 vs 3.360 ± 0.452, P = 0.000) and AP-1 (342.43 ± 85.77 vs 597.70 ± 83.96, P < 0.01) obviously.
CONCLUSION: IL-1β can stimulate the proliferation of rat HSCs, and JNK signaling pathway was involved in the process. Yigankang can inhibit HSC proliferation induced by IL-1β through JNK/AP-1 pathway.
- Citation: Zhang YP, Yao XX, Liu XL, Zhao X. Inhibition of Yigankang on proliferation of rat hepatic stellate cells induced by interleukin-1β. Shijie Huaren Xiaohua Zazhi 2006; 14(13): 1272-1276
- URL: https://www.wjgnet.com/1009-3079/full/v14/i13/1272.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i13.1272
肝星状细胞(hepatic stellate cell, HSC)为产生肝脏细胞外基质(extracellular matrix, ECM)的主要细胞, 其活化、增殖是肝纤维化发生的中心环节[1]. 丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路在转导细胞外信号入核的过程中发挥重要作用, 目前已证实, 在哺乳动物中有ERK, JNK, P38, ERK5等4个MAPK家族成员[2-5]. 其中JNK能被多种炎性刺激因子所激活, 并对炎症的发生、发展起重要作用[6-7]. 激活蛋白-1(activator protein-1, AP-1)是具有多向性调节作用的核转录因子, 广泛参与许多基因, 特别是免疫炎症相关基因的转录调节. 许多研究均已证实, 以丹参等活血化瘀药为主组方的益肝康可通过抑制HSC活化, 增殖而发挥抗肝纤维化作用[8-11]. 我们以白细胞介素-1β(interleukin-1β, IL-1β)为刺激因子, 通过测定益肝康对体外培养的大鼠HSC JNK, AP-1活性的影响, 进一步阐明该药抗肝纤维化的作用机制.
IL-1β购自英国PeproTech公司, JNK特异性阻断剂SP600125购自美国Sigma公司, 小鼠抗人P-JNK mAb购自美国Santa Cruz公司, 兔抗人多克隆β-actin抗体购自北京中衫金桥生物公司, HRP标记的山羊抗小鼠IgG抗体、山羊抗兔IgG抗体及ECL发光试剂盒均购自北京中山生物技术公司, 活细胞计数试剂盒-CCK-8(cell counting kit-8)试剂购自日本株式会社同仁化学研究所, LightShift Chemiluminescent EMSA kit购自美国Pierce公司, RPMI 1640培养基购自Gibco公司, 新生牛血清购自杭州四季青生物制品公司. 中药购自石家庄市乐仁堂大药房. 益肝康由丹参、当归、赤勺、黄芪等9味中药组成, 生药浸泡过夜, 文火煮3次, 药液离心去杂质, 置于旋转蒸发仪上蒸去水分. 浓缩药液再次离心去杂质后按1∶3体积比加入950 mL/L乙醇4℃沉淀过夜, 去除蛋白成分, 将上清药液再置于旋转蒸发仪上蒸去乙醇和水制成中药浸膏. HSC细胞株CFSC由美国Greenwel教授建株并惠赠, 其表型为活化的HSCs. 将冷冻保存于液氮中的HSC细胞株复苏后接种于含100 mL/L新生牛血清、100 kU/L青霉素、100 kU/L链霉素、4 mmol/L谷氨酰胺及1 mmol/L HEPES的RPMI 1640培养液中, 37℃ 50 mL/L CO2条件下培养. 培养箱中孵育至细胞80%-90%汇合时, 弃培养液, 换不含血清的RPMI 1640培养液继续培养12 h, 使细胞基本同步于G0期后进行实验.
(1)IL-1β对大鼠HSC增殖的影响. 根据预实验结果, 加入IL-1β(10 μg/L)培养, 于24 h后检测HSC增殖情况, 并与对照组比较; (2)IL-1β作用大鼠HSC时JNK活性的时相观察及益肝康对JNK活性的影响; 加入IL-1β(10 μg/L)培养, 0, 5, 15, 30, 60, 120 min分别检测p-JNK及β-actin活化程度. 益肝康组预先用益肝康浸膏(2 g/L)预处理1 h后再加入IL-1β(10 μg/L)培养, 30 min后检测p-JNK及β-actin活化程度; (3)SP600125抑制IL-1β促HSC增殖作用的观察: 先予不同浓度SP600125(10, 20, 40 μmol/L)预孵育30 min后, 再加入IL-1β(10 μg/L)培养24 h后, 检测HSC增殖情况, SP600125配制方法参照文献[12]. 对照组预先加入SP600125溶剂-10 g/L二甲基亚砜(DMSO)预孵育30 min, 再加入IL-1β(10 mg/L)培养24 h后, 检测HSC增殖情况; (4)益肝康对IL-1β作用大鼠HSC后AP-1活性的影响: 分对照组、IL-1β组及益肝康+IL-1β组, 益肝康+IL-1β组预先用益肝康浸膏(2 g/L)预处理1 h, 后与IL-1β组同时加入IL-1β(10 μg/L)培养, 2 h后3组均检测AP-1活性.
1.2.1 活细胞计数试剂盒-CCK-8检测HSC增殖: 于96孔板培养HSC, 24 h后每孔加入CCK-8试剂10 μL, 继续培养3 h后在酶标仪上读取450 nm的吸光度. 用吸光值(absorbance value, A value)表示. 每组设6个重复孔, 另设空白孔调零[13].
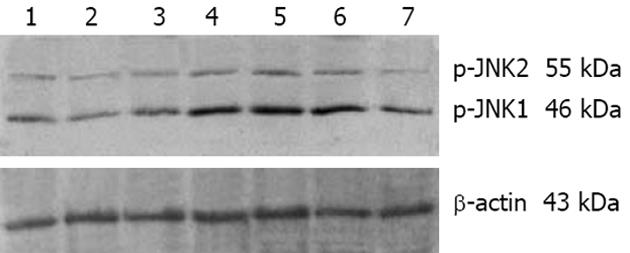
1.2.2 Western blot检测JNK及β-actin活性: 培养于培养瓶中的HSC细胞达到实验要求后, 用细胞刮刀收集细胞, 4℃ 3000 r/min离心10 min. 弃上清, 加入200 μL改良的RIPA裂解缓冲液, 混合器上充分振荡后, 冰上静置30 min, 4℃ 10 000 r/min离心10 min, 取上清并用考马斯亮蓝试剂盒进行蛋白定量. 取含80 μg不同体积的蛋白, 100 g/L SDS-PAGE电泳后转膜至硝酸纤维素膜, 封闭液中4℃过夜. TPBS洗膜后加入小鼠抗人p-JNKmAb(1∶200)或兔抗人β-actin多克隆抗体(1∶200), 置摇床室温5 h. TPBS振摇洗膜后, 再分别用HRP标记的山羊抗小鼠IgG抗体、山羊抗兔IgG抗体, 室温摇动孵育2 h. 洗膜后, 暗室中加入ECL发光剂作用适当时间后, X线胶片曝光30 s-数分钟, 进一步显影、定影后即可见成像条带. 每组实验均重复6次. 采用Gel-Pro凝胶分析软件对Western印迹结果进行半定量分析, 读取各电泳条带的吸光度代表蛋白质的含量, 以磷酸化JNK1、JNK2表示JNK的活化产物, β-actin为内参照, JNK1、JNK2的平均值与β-actin的比值(p-JNK/β-actin)代表JNK的活化程度.
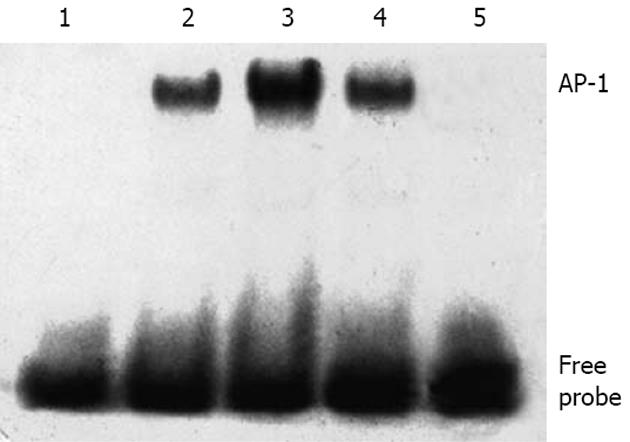
1.2.3 凝胶电泳移动抑制实验测定AP-1活性: PBS洗涤细胞后, 测量压紧后细胞沉淀体积(pressed cell volume, PCV), 用5倍PCV的buffer A(10 mmol/L HEPES pH 7.9, 10 mmol/L KCl, 1.5 mmol/L MgCl2, 0.5 mmol/L DTT, 0.5 mmol/L PMSF, 5 g/L NP-40)裂解细胞, 1850 r/min低温离心10 min. 将细胞沉淀重悬于3倍原PCV的buffer B中(成分同buffer A, 但无NP-40), 冰浴10 min, 3000 r/min低温离心15 min沉淀细胞核. 测量离心后压紧的细胞核沉淀体积(pressed nuclear volume, PNV), 用2/3 PNV的buffer C(20 mmol/L HEPES pH 7.9, 10 mmol/L KCl, 1.5 mmol/L MgCl2, 200 mL/L甘油, 0.2 mmol/L EDTA, 0.5 mmol/L DTT, 0.5 mmol/L PMSF)和1/3 PNV的buffer D中(成分同buffer C, 但KCl为400 mmol/L)重悬细胞核, 冰浴震荡60 min, 15 000 r/min低温离心30 min, 收集上清即细胞核蛋白. 用考马斯亮蓝G250试剂盒测定蛋白浓度. 生物素标记的AP-1同源寡核甘酸片段(北京赛百盛生物有限公司)为: 5'-TTC CGG CTG ACT CAT CAA GCG-3'; 3'-AAG GCC GAC TGA GTA GTT CGC-5'. 取10 mg核蛋白按LightShift Chemiluminescent EMSA kit说明书进行结合反应、60 g/L聚丙烯酰胺凝胶电泳及转膜. 暗室中加入发光剂作用适当时间后, X线胶片曝光30 s-数分钟, 进一步显影、定影后即可见成像条带. 每组实验均重复3次. 采用Gel-Pro凝胶分析软件对电泳条带进行半定量分析, 读取各电泳条带的吸光度代表AP-1的相对活性.
统计学处理 数据用mean±SD表示, 利用SPSS 11.0软件进行统计分析. 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析(one-way ANOVA), 有显著差异者进一步用最小显著差值法进行两两比较.
IL-1β(10 μg/L)作用培养的HSC 24 h后, 应用CCK-8检测, 吸光值(1.573±0.026)明显高于对照组(1.339±0.073), 统计学处理有极显著性差异(P = 0.000<0.01).
IL-1β(10 μg/L)刺激5 min后, 即见JNK活化增强(1.501±0.720), 但无统计学意义, 15 min时明显增强(2.133±0.882), 30 min时达到高峰(3.360±0.452), 随后有所降低, 60 min时仍保持较高的活化状态(2.181±0.789), 120 min后则基本恢复正常水平(1.385±0.368), 与对照组(0.982±0.299)相比, 15, 30及60 min均有显著性差异(P = 0.002<0.01, P = 0.000<0.01, P = 0.001<0.01). 益肝康组JNK活性明显受到抑制(1.610±0.242), 与5相比有显著性差异(P = 0.000<0.01, 图1).
经SP600125预处理后, IL-1β促HSC增殖作用受到抑制, SP600125浓度为10, 20及40 μmol/L时, 吸光值分别为1.427±0.113, 0.772±0.093, 0.675±0.074, 与对照组(1.560±0.110)相比其增殖反应均明显降低(P = 0.03<0.05, P = 0.000<0.01, P = 0.000<0.01).
EMSA结果显示, 正常对照组HSC内有低水平的AP-1活化, IL-1β(10 μg/L)作用HSC 2 h后, AP-1与寡核苷酸探针结合的滞后带较前明显增粗(597.70±83.96 vs 290.03±30.77, P = 0.002<0.01), 提示IL-1可诱导HSC AP-1活性增强; 而用益肝康预处理的HSC AP-1滞后带较IL-1β组显著变浅(342.43±85.77 vs 597.70±83.96, P = 0.005<0.01), 抑制率为42.71%(图2).
多种损害肝脏因素如病毒、药物、酒精以及机械性损伤等导致肝损伤, 在肝细胞炎症、坏死刺激下, 相关细胞分泌多种细胞因子, 如转化生长因子(transforming growth factor, TGF)、血小板衍生生长因子(platelet derived growth factor, PDGF)、TNF、IL-1、IL-6等, 这些细胞因子所蕴涵的信息, 需通过HSC胞内信号转导系统传递, 在某些转录因子的作用下, 转导信号入核, 从而启动DNA复制、转录及翻译表达过程, 实现HSC活化、增殖、转型并分泌ECM, 最终导致肝纤维化的发生[14-17]. 早期肝纤维化是一个可逆的过程, 不少研究表明中药复方抗肝纤维化具有多途径、多层次、多靶点的综合药理学作用[18-19], 我们探讨益肝康是否能通过干预HSC胞内或核内的信号转导过程, 达到抑制肝纤维化发生、发展的目的. 本设想的证实将为抗肝纤维化研究提供新思路.
IL-1为一种具有多种生物学功能的强有力的促炎细胞因子, 几乎作用于所有体内细胞, 调节炎症及多种反应[20-23]. 本结果显示, IL-1β作用于HSC后, HSC增殖反应明显增强(1.573±0.026, P<0.01). 表明IL-1β具有促HSC活化增殖作用, 为肝纤维化发生的重要致病因子. MAPK是生物体内重要的信号转导系统之一, 参与介导细胞生长、分裂、增殖等多种过程. 在哺乳动物细胞中已成功克隆了ERK, JNK/SAPK, p38MAPK, ERK5/BMK1四个MAPK亚族. 这些MAPK亚族能被多种炎性刺激所激活, 并对炎症的发生、发展起重要作用[24-27]. 本研究显示, IL-1β可在短时间内激活JNK通路, 刺激5 min后, JNK开始活化, 30 min时达到高峰, 随后逐渐降低, 2 h后基本恢复正常水平. 而IL-1β作用24 h后, HSC才明显增殖; 应用特异性JNK阻断剂SP600125预处理HSC后再给予IL-1β进行刺激, 结果显著抑制了IL-1β的促HSC增殖作用, 且SP600125浓度越高, 抑制HSC增殖作用愈加明显. 表明JNK活化受到阻断后, IL-1β的促HSC增殖作用明显受到抑制, 进一步说明JNK信号转导通路在IL-1β促HSC增殖中发挥重要作用.
AP-1作为转录调节蛋白, 将细胞外刺激信号传导至细胞核, 激活AP-1位点的靶基因转录. AP-1为Jun家族成员(c-jun, JunB, JunD)组成的同源二聚体, 或Jun家族与Fos家族(c-fos, FosB, △FosB, Fra1, Fra2)组成的异源二聚体[28]. 许多基因(如转化生长因子-β、纤维连接蛋白、层连蛋白、TIMP)的启动子中均存在与AP-1结合的DNA序列. AP-1与之结合即可调节该基因的转录. 因此AP-1活化在细胞增殖、转化及ECM合成中发挥重要作用[29-30]. 我们发现, IL-1β刺激HSC后AP-1活性明显增高, 表明IL-1β可通过激活AP-1发挥生物学作用.
中药复方益肝康系重用丹参, 辅以当归、赤勺等活血化瘀, 并用黄芪等益气健脾药而成. 大量临床与实验研究表明, 该药具有消除症状、改善肝功能等作用. 并可抑制HSC活化增殖, 促进HSC凋亡, 并有抗脂质过氧化、保护肝细胞等功能[31-33]. 此前我们的研究也发现, 益肝康全方、拆方及丹参单味药对IL-1β诱导的HSC增殖均具有明显的抑制作用, 但抑制作用逐渐递减[34]. 说明丹参是益肝康全方中抑制HSC增殖的主要成分, 可能系主药. 而全方对HSC增殖具有更为显著的抑制作用, 可能与药物科学配伍后的相辅相乘作用使抗肝纤维化有效成分增加有关, 充分体现了中医基础理论君臣佐使的优势. 为进一步探讨其作用机制, 我们观察了益肝康对IL-1β作用后HSC JNK通路及AP-1活性的影响. 结果表明益肝康可明显抑制体外培养的HSC中JNK的活性, 并减弱AP-1的活化. 以上表明益肝康可通过JNK/AP-1通路抑制IL-1β诱导的HSC增殖.
HSC为肝脏ECM产生的主要细胞, 其活化、增殖是肝纤维化发生的中心环节.
IL-1在促进HSC活化、增殖等过程中发挥重要作用. IL-1作用于HSC后如何使之激活并促进HSC增殖, 信号分子在细胞内如何转导是当前学者们探究的热点问题之一.
本文通过测定胞内信号分子JNK及核转录因子AP-1, 阐明IL-1在HSC中的信号转导通路, 并阐述"益肝康"抗肝纤维化的机制.
本研究发现阻断HSC的JNK/AP-1通路可抑制HSC增殖, 此有助于抗肝纤维化新药的研发.
君臣佐使: 为中医基础理论中中药合理配伍的原则, 即中药组方讲究根据药性药效配合, 这样就会达到单味药所不及的特殊功效, 以发挥中药的强大疗效.
本文应用免疫学和分子生物学方法探讨活血化瘀中药复方益肝康抑制肝星状细胞增殖、抑制肝脏纤维化的分子生物学和免疫学机制, 对肝脏纤维化的临床中医药研究和治疗有一定指导意义. 论文题目合理, 切题, 实验方法简单可靠, 结论可信.
电编: 张敏 编辑:潘伯荣
| 1. | 姚 希贤, 徐 克成. 肝纤维化的基础与临床. 第1版. 上海: 上海科技教育出版社 2003; 9-21. |
| 2. | Fan JM, Huang XR, Ng YY, Nikolic-Paterson DJ, Mu W, Atkins RC, Lan HY. Interleukin-1 induces tubular epithelial-myofibroblast transdifferentiation through a transforming growth factor-beta1-depen-dent mechanism in vitro. Am J Kidney Dis. 2001;37:820-831. [PubMed] [DOI] |
| 3. | Parker LC, Luheshi GN, Rothwell NJ, Pinteaux E. IL-1 beta signalling in glial cells in wildtype and IL-1RI deficient mice. Br J Pharmacol. 2002;136:312-320. [PubMed] [DOI] |
| 4. | Zhang YP, Yao XX, Zhao X. Interleukin-1 beta up-regulates tissue inhibitor of matrix metallopro-teinase-1 mRNA and phosphorylation of c-jun N-terminal kinase and p38 in hepatic stellate cells. World J Gastroenterol. 2006;12:1392-1396. [PubMed] [DOI] |
| 6. | Huang Q, Yang J, Lin Y, Walker C, Cheng J, Liu ZG, Su B. Differential regulation of interleukin 1 recep-tor and Toll-like receptor signaling by MEKK3. Nat Immunol. 2004;5:98-103. [PubMed] [DOI] |
| 7. | Zhang B, Perpetua M, Fulmer M, Harbrecht BG. JNK signaling involved in the effects of cyclic AMP on IL-1beta plus IFNgamma-induced inducible nitric oxide synthase expression in hepatocytes. Cell Signal. 2004;16:837-846. [PubMed] [DOI] |
| 11. | Yao XX, Tang YW, Yao DM, Xiu HM. Effects of Yigan Decoction on proliferation and apoptosis of hepatic stellate cells. World J Gastroenterol. 2002;8:511-514. [PubMed] [DOI] |
| 12. | Bennett BL, Sasaki DT, Murray BW, O'Leary EC, Sakata ST, Xu W, Leisten JC, Motiwala A, Pierce S, Satoh Y. SP600125, an anthrapyrazolone inhibitor of Jun N-terminal kinase. Proc Natl Acad Sci USA. 2001;98:13681-13686. [PubMed] [DOI] |
| 13. | Hamamoto R, Furukawa Y, Morita M, Iimura Y, Silva FP, Li M, Yagyu R, Nakamura Y. SMYD3 encodes a histone methyltransferase involved in the proli-feration of cancer cells. Nat Cell Biol. 2004;6:731-740. [PubMed] [DOI] |
| 14. | Han YP, Zhou L, Wang J, Xiong S, Garner WL, French SW, Tsukamoto H. Essential role of matrix metalloproteinases in interleukin-1-induced myofi-broblastic activation of hepatic stellate cell in colla-gen. J Biol Chem. 2004;279:4820-4828. [PubMed] [DOI] |
| 15. | Pinzani M, Marra F. Cytokine receptors and signaling in hepatic stellate cells. Semin Liver Dis. 2001;21:397-416. [PubMed] [DOI] |
| 17. | 张 亚平, 姚 希贤. 白细胞介素-1激活肝星状细胞信号转导机制的研究进展. 胃肠病学和肝病学杂志. 2005;14:321-323. |
| 18. | Yao XX, Lv T. Effects of pharmacological serum from normal and liver fibrotic rats on HSCs. World J Gastroenterol. 2005;11:2444-2449. [PubMed] [DOI] |
| 19. | Wang JM, Yao XX, Li XT, Yang SL, Su Z. Effects of Radix Salviae Miltiorrhizae on Ca2+ in hepatic stellate cells. Sichuan Daxue Xuebao Yixueban. 2005;36:221-224. [PubMed] |
| 20. | Subramaniam S, Stansberg C, Cunningham C. The interleukin 1 receptor family. Dev Comp Immunol. 2004;28:415-428. [PubMed] [DOI] |
| 21. | Dunne A, O'Neill LA. The interleukin-1 receptor/Toll-like receptor superfamily: signal transduction during inflammation and host defense. Sci STKE. 2003;2003:re3. [PubMed] |
| 22. | Kida Y, Kobayashi M, Suzuki T, Takeshita A, Okamatsu Y, Hanazawa S, Yasui T, Hasegawa K. Interleukin-1 stimulates cytokines, prostaglandin E2 and matrix metalloproteinase-1 production via acti-vation of MAPK/AP-1 and NF-kappaB in human gingival fibroblasts. Cytokine. 2005;29:159-168. [PubMed] [DOI] |
| 23. | Fernandez L, Mosquera JA. Interleukin-1 increases fibronectin production by cultured rat cardiac fibroblasts. Pathobiology. 2002;70:191-196. [PubMed] [DOI] |
| 26. | Marra F, Delogu W, Petrai I, Pastacaldi S, Bonacchi A, Efsen E, Aleffi S, Bertolani C, Pinzani M, Gentilini P. Differential requirement of members of the MAPK family for CCL2 expression by hepatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2004;287:G18-G26. [PubMed] [DOI] |
| 27. | Wang ZQ, Wu DC, Huang FP, Yang GY. Inhibition of MEK/ERK 1/2 pathway reduces pro-inflam-matory cytokine interleukin-1 expression in focal cerebral ischemia. Brain Res. 2004;996:55-66. [PubMed] [DOI] |
| 28. | Mann DA, Smart DE. Transcriptional regulation of hepatic stellate cell activation. Gut. 2002;50:891-896. [PubMed] [DOI] |
| 29. | Smart DE, Vincent KJ, Arthur MJ, Eickelberg O, Castellazzi M, Mann J, Mann DA. JunD regulates transcription of the tissue inhibitor of metalloprotei-nases-1 and interleukin-6 genes in activated hepatic stellate cells. J Biol Chem. 2001;276:24414-24421. [PubMed] [DOI] |
| 30. | Poulos JE, Weber JD, Bellezzo JM, Di Bisceglie AM, Britton RS, Bacon BR, Baldassare JJ. Fibronectin and cytokines increase JNK, ERK, AP-1 activity, and transin gene expression in rat hepatic stellate cells. Am J Physiol. 1997;273:G804-G811. [PubMed] |
| 32. | Yao XX, Jiang SL, Tang YW, Yao DM, Yao X. Effi-cacy of Chinese medicine Yi-gan-kang granule in prophylaxis and treatment of liver fibrosis in rats. World J Gastroenterol. 2005;11:2583-2590. [PubMed] [DOI] |
| 33. | Yao XX, Cui DL, Sun YF, Feng LY, Sun ZM, Song M. Study on the anti-liver fibrosis effect of benefit liver granule and its mechanism in rats. Chin J Integr Med. 2002;8:118-122. |