修回日期: 2006-03-20
接受日期: 2006-03-29
在线出版日期: 2006-04-28
目的: 建立HCMV先天性潜伏感染再激活致肝脏损伤的BALB/c老年小鼠模型, 初步探讨HCMV潜伏再激活感染的致病机制.
方法: 建立HCMV先天性感染小鼠的模型, 将子代小鼠饲养于SPF级屏障系统中18 mo后, 从子代小鼠中分别取病毒感染组18只、细胞对照组9只, 随机将病毒感染组中半数进行环磷酰胺激活, 建立HCMV潜伏再激活感染鼠模型, 按照实验设计分别处死细胞对照组、病毒潜伏组和病毒潜伏再激活组小鼠, 无菌取出小鼠肝组织, 进行病毒分离、PCR、RT-PCR及HE染色.
结果: 潜伏再激活组小鼠的肝组织匀浆上液中分离出HCMV, 在病毒分离出现细胞病变效应(CPE)的细胞培养液中检测HCMV DNA; HE染色证实肝组织有炎性改变, 肝细胞肿大, 核内有嗜酸性包涵体等; PCR检测到HCMV DNA, RT-PCR检测到组织中HCMV mRNA. 病毒潜伏组仅PCR检测到HCMV DNA, 其它与细胞对照组一样均是阴性.
结论: HCMV先天性潜伏感染再激活导致肝脏病理损伤.
引文著录: 胡雪影, 王明丽. 人巨细胞病毒先天性潜伏感染再激活致老年小鼠肝脏的损伤. 世界华人消化杂志 2006; 14(12): 1146-1150
Revised: March 20, 2006
Accepted: March 29, 2006
Published online: April 28, 2006
AIM: To establish the model of liver damage induced by reactivation of congenital latent infection of human cytomegalovirus (HCMV) in aged mice, and to explore the pathogenic mechanism of HCMV reactivation.
METHODS: Firstly, the mouse model of congenital latent HCMV infection was established. After raised in specific pathogen free (SPF) barrier system for 18 mo, 9 offspring mice served as cell controls and 18 were taken out for experiment, half of which were treated with cyclophosphamide to reactivate the HCMV infection. The mice without HCMV infection were used as normal controls. All the mice were sacrificed to obtain liver tissues for virus isolation, polymerase chain reaction (PCR), reverse transcription PCR (RT-PCR) and HE stainging.
RESULTS: HCMV was isolated from the supernatant of liver tissue homogenate only in the group of infection- reactivated mice. HCMV DNA was detected by PCR in the supernatant of cell culture with cytopathogenic effect (CPE). Pathological changes in liver consisted of swollen cytoplasm, destroyed nuclei of hepatocytes, distinct intranuclear inclusion in the hepatocytes, and predominant infiltration of phagocytic cells. HCMV DNA was found by PCR in the group of infection-reactivated and latently-infected mice, but HCMV mRNA was only found in the group of infection-reactivated mice by RT-PCR.
CONCLUSION: Reactivation of congenital latent HCMV infection can induce liver damage in mice.
- Citation: Hu XY, Wang ML. Study on liver damage induced by reactivation of congenital latent infection of human cytomegalovirus in aged mice. Shijie Huaren Xiaohua Zazhi 2006; 14(12): 1146-1150
- URL: https://www.wjgnet.com/1009-3079/full/v14/i12/1146.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i12.1146
人巨细胞病毒(HCMV)感染非常普遍, 多数感染者是先天性感染或围生期感染且感染率很高. 有报道肝脏是婴幼儿时期HCMV感染的重要靶器官之一, 可以引起肝脏的不同疾病, 其中最常见的是婴儿肝炎综合征[1], 除少数可能出现严重的肝功能损害外, 大多数婴幼儿预后较好, 但是当机体痊愈后, 大部分的病毒并没有从机体清除, 而是以基因组或者部分基因转录产物的形式长期或者终身潜伏于各种器官, 其中肝脏是HCMV易侵犯、潜伏的重要器官之一[2]. 此种潜伏状态可以被外来的刺激因素所激活而形成复发性感染, 从而导致免疫功能尚未成熟或低下的机体器官的损伤, 表现出明显的临床症状. 汤正好et al[3]采用HCMV接种至成年Balb/c雌雄鼠腹腔后配对喂养, 成功建立了HCMV先天性感染胎鼠致肝脏损伤的小鼠模型, 初步探讨了HCMV可以通过胎盘造成胎鼠的先天性感染, 导致肝脏损伤, 并与母体感染的病毒量有关. 但呈HCMV潜伏感染状态的老年小鼠在使用免疫抑制剂的情况下, 病毒对肝脏组织是否有损伤的研究, 目前国内外尚无报道. 因此在本次研究中通过建立HCMV先天性潜伏再激活感染致肝脏损伤的Balb/c小鼠模型, 为进一步研究人类HCMV潜伏感染至中老年时期再激活对肝脏损伤的研究提供有价值的依据.
主要化学和分子生物学试剂分别购自Sigma公司、Promega公司等, HCMV UL83基因PCR引物利用Primer5.0软件设计, 并由上海生工生物工程技术服务有限公司合成: sense: 5'-GAATTCACCGTGGAACTGCGTCAGT-3'; anti-sense: 5'-CTCGAGACCCTGAACCGTAGCCA-3'. 莱卡倒置荧光显微镜(Leica 德国)、基因扩增仪(Hema8000, 珠海黑马医学仪器有限公司)、紫外凝胶成像系统(BioSens SC720型)等. 6-8代的人成纤维细胞株(HF), 安徽医科大学微生物学教研室制备. HCMV AD169株由上海复旦大学医学院微生物学教研室提供, 使用前进行病毒复苏及增毒. 参照文献[2], 建立HCMV先天性感染小鼠的模型, 将子代小鼠(病毒感染组、细胞对照组)饲养于SPF级屏障系统中18 mo, 期间小鼠生长、发育状况正常, SPF级屏障系统由上海市实验动物质量监督检验站检测. 本次实验从子代小鼠中分别取病毒感染组18只、细胞对照组9只. 随机将病毒感染组中半数进行环磷酰胺激活, 建立HCMV潜伏再激活感染鼠模型, 病毒潜伏再激活组即病毒感染组小鼠按照实验计划ip环磷酰胺(剂量150 mg/kg, 每6 d 1次, 共3次), 观察各组小鼠的行为学改变情况及体质量变化, 最后一次激活后6 d颈椎脱臼处死动物, 立即取肝脏标本进行有关检测.
参照文献[4]病毒分离, 无菌取小鼠肝脏, 将其制备成1×109/L肝细胞悬液, 取细胞悬液接种到已经长满单层HF细胞的12孔培养板内, 37 ℃吸附1 h后, 置37 ℃、50 mL/L CO2培养箱培养, 同时设正常细胞对照及HCMV AD169株阳性对照(各组均做3孔). 24 h后换维持液, 1 wk后盲传, 每周1次, 共3次. 观察细胞病变效应(CPE), 对出现特征性CPE者, 取上清液检测HCMV DNA. 按常规碱裂解法抽提小鼠肝组织及细胞中的DNA, 并以此为模板进行PCR扩增(条件: 95 ℃ 2 min, 95 ℃ 1 min, 62 ℃ 45 s, 72 ℃ 1 min, 72 ℃ 10 min, 30个循环), 将PCR扩增产物进行琼脂糖凝胶电泳, 经紫外透射仪观察凝胶电泳情况后, 再利用紫外凝胶成像系统拍照、记录. 按常规方法进行抽提小鼠肝组织中的RNA, 按试剂盒说明书将RNA逆转录成cDNA后, 再进行PCR扩增、电泳检测等. 另在冰盘上无菌取出老年小鼠肝组织, 常规经40 g/L多聚甲醛固定, 石蜡包埋切片, HE染色, 中性树胶封片. 用显微镜(OLYMPUSBX-50)观察后用PM-20型显微摄像系统照相.
统计学处理 用SPSS11.0软件对实验数据进行录入统计, 结果以mean±SD表示, P<0.01为差异有统计学意义.
细胞对照组与病毒潜伏组小鼠无异常表现, 病毒潜伏再激活组小鼠表现竖毛、饮食减少、活动减少、精神萎靡、反应迟钝等, 小鼠平均体质量明显低于对照组(P<0.01), 有统计学意义.
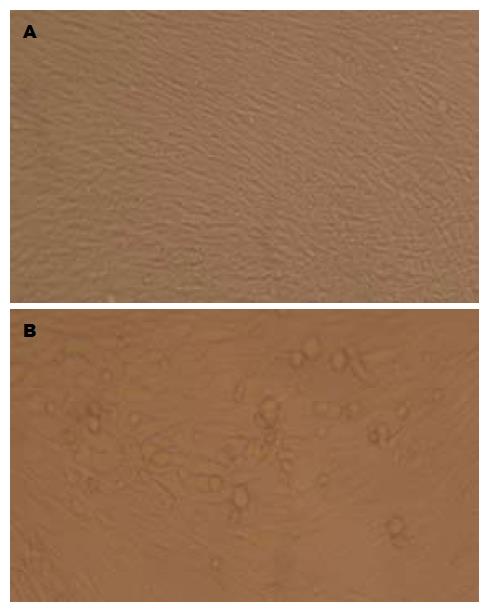
细胞对照组及病毒潜伏组小鼠的肝组织匀浆过滤后接种HF细胞, 2 wk内未观察到HCMV特征性CPE, 盲传3代后, CPE仍为阴性. 用HCMV特异性引物扩增后, 未见特异性条带, 病毒潜伏激活组肝组织匀浆接种HF细胞后3 wk左右, HF细胞开始肿胀、核变大, 形成巨核细胞, 病变在3-4 wk时最明显, 呈局灶性(图1A-B), 用HCMV特异性引物扩增后, 可见特异性条带.
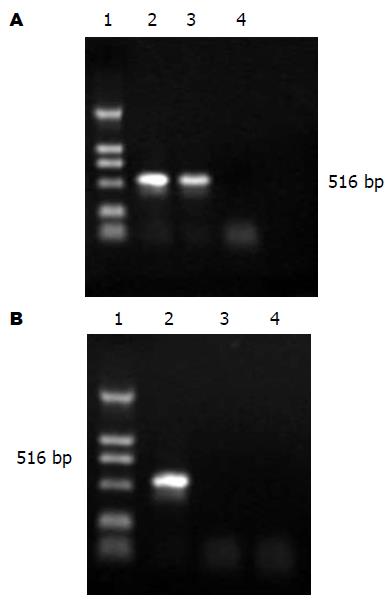
病毒潜伏组激活前后小鼠肝组织在516 bp处均可以检测到UL83基因(序列位点1006-1522)特异性条带, 细胞对照组PCR均为阴性(图2A); RT-PCR产物凝胶电泳中只有病毒潜伏激活组肝组织在516 bp处显示有HCMV UL83基因的转录产物存在(图2B).
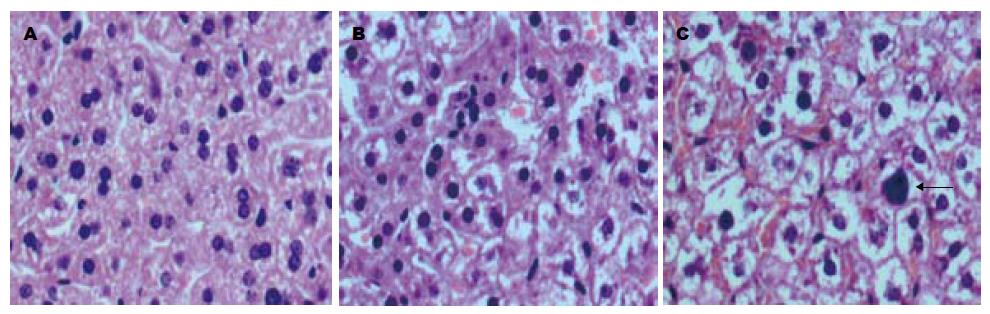
病毒潜伏再激活组小鼠肝脏肿大、呈暗红色; 病毒潜伏组与细胞对照组小鼠肝脏呈粉红色、大小同正常小鼠肝脏. 将各组胎鼠组织进行苏木精-伊红染色发现, 潜伏再激活组小鼠肝组织内呈明显炎性改变、肝小叶结构紊乱、部分肝细胞肿胀、空泡变性、核内有嗜酸性包涵体、部分肝细胞呈坏死、肝窦明显充血等表现(图3C); 病毒潜伏组肝组织轻度炎性改变, 肝小叶结构紊乱程度相对较轻, 肝细胞轻度肿胀, 但未发现核内包涵体, 肝细胞坏死亦不明显(图3B); 细胞对照组肝小叶结构清晰, 排列整齐, 无明显炎性改变(图3A).
HCMV感染在全世界不同种族人群中都是普遍存在的, 其感染率高达70%-100%[5], 而在老年人中HCMV感染率几乎为100%. 在免疫功能正常个体, 经过一段时间后转为潜伏感染, 大多数感染是亚临床型, 但在免疫缺陷的人群(如器官移植、艾滋病感染、应用免疫抑制剂或抗代谢药物等)能引起严重的疾病[6-8]. 因此HCMV感染严重地危害人类的健康, 影响到我国人口素质的提高. 众所周知, 在我国目前有1.32亿60岁以上的老人, 占总人口的10%以上, 并且老人的数量以每年3.2%的速度在增加, 如何提高老年人的生活质量已经是一个很严峻的问题, 因此HCMV潜伏再激活感染致病机制的探索有重要的理论和临床意义.
我们选用了SPF级BALB/c老年小鼠作为HCMV潜伏感染模型, 并通过环磷酰胺(一种氮芥类细胞毒药物)进行再激活, 环磷酰胺对机体的细胞免疫及体液免疫都有一定的抑制作用[9]. 当病毒潜伏组小鼠腹腔注射环磷酰胺后, 机体的体液免疫及细胞免疫均受到抑制, 尤其当细胞毒性T淋巴细胞及自然杀伤细胞数目减少时, 潜伏的病毒基因就会被激活、产生大量有传染性的病毒颗粒[10], 继而引起肝脏的损伤. 另外, SPF级小鼠饲养在屏蔽系统中, 实行严格的微生物控制, 从而排除了其他可能病原的干扰; Balb/c系是小鼠近交系动物, 具有遗传均质性、反应一致性的优点[11]; 老年小鼠可以模拟人类中老年的机体状态, 这类人群整个机体免疫功能与年轻人相比较差. 因此这类人群易患的疾病(如肿瘤、感染等)及对其进行的一些特殊治疗所引起机体免疫系统的损伤与HCMV潜伏感染再激活状态一致. 因此, 该模型的建立为研究HCMV先天性潜伏感染到老年期再激活的致病机制、药物筛选及疫苗的研制和应用提供了可靠的实验平台.
在本实验中, 因为潜伏感染阶段体内没有感染性子代病毒颗粒产生, 但在潜伏感染的细胞内可发现以不同形式存在于细胞核内的病毒基因组, 因此病毒分离阴性、RT-PCR也没有检测到HCMVRNA, 但组织PCR能检测出HCMV DNA. 在潜伏再激活感染阶段, HCMV被激活、并复制大量传染性病毒颗粒, 导致机体器官的损伤. 因此激活组小鼠病毒分离在3 wk左右, HF细胞开始肿胀、核变大、形成巨核细胞, 病变在3-4 wk时最明显, 呈局灶性, 用HCMV特异性引物扩增后, 电泳可见特异性条带(516 bp); 组织RT-PCR检测出HCMV RNA; 小鼠肝组织HE染色结果出现明显的病理变化, 肝组织有炎性改变、肝细胞肿胀、空泡变性、核内有嗜碱性包涵体、部分肝细胞呈坏死表现等. 对实验结果进行综合分析, 说明潜伏感染的HCMV在使用环磷酰胺激活后, 能够导致HCMV的生产性感染, 这为现在临床病人免疫功能低下、AIDS、器官移植等患者并发HCMV感染提供理论解释, 为人类临床研究HCMV与老年肝脏疾病之间的关系提供参考. 但是HCMV潜伏再激活具体的致病机制目前尚不清楚, 还需要进一步的研究、探索.
对于婴儿肝炎综合征患儿及HCMV潜伏感染的人群, 在其免疫功能正常时不表现出任何临床症状, 但并不能排除这类人群具有HCMV再激活感染的风险, 当其步入中老年伴有机体免疫功能降低或丧失时, 临床医生应当考虑到监测HCMV的感染情况, 合理使用免疫抑制剂及一些抗病毒药物, 做到早诊断、早治疗.
近几年关于人巨细胞病毒感染与婴幼儿肝炎之间的关系已经确立, 但其发生的机制尚不明确, 对于疾病的诊断、治疗、预防及其前瞻性研究尚有待探索.
本次研究选用了SPF级BALB/c老年小鼠作为HCMV潜伏感染模型, 并通过环磷酰胺(一种氮芥类细胞毒药物)进行再激活, 该模型状态与中老年人群易患的疾病(如肿瘤、感染等)及对其进行的一些特殊治疗所引起机体免疫系统的损伤状态一致.
长期以来, 人们一直采用鼠巨细胞病毒(MCMV)感染小鼠来制作HCMV感染的动物模型, 但小鼠自然感染MCMV后不能像HCMV一样通过胎盘引起胎鼠的先天性感染. 本研究中所建立的模型成功的解决了以上问题, 为HCMV致病机制的研究提供可靠的平台.
潜伏感染: 当机体初次感染HCMV后, 在机体免疫系统保护性下, 体内的病毒将被局限或者清除, 但是通常不能被完全清除, 在潜伏感染的细胞内可发现以不同形式存在于细胞核内的病毒基因组及部分转录产物, 但此时患者体内没有感染性子代病毒产生;
潜伏再激活感染: 潜伏状态可以被外来的刺激因素所激活而形成复发性感染, 从而导致免疫功能尚未成熟或低下的个体表现出明显的临床症状.
本文通过PCR, RT-PCR, 病毒分离及HE染色从基因、细胞、组织学方面分析了先天性潜伏感染和再激活感染状态下HCMV复制和基因表达以及对宿主的致病作用, 有助于HCMV感染所致婴儿肝炎综合征的发病基础研究.
编辑: 潘伯荣 电编:李琪
| 1. | Shibata Y, Kitajima N, Kawada J, Sugaya N, Nishikawa K, Morishima T, Kimura H. Association of cytomegalovirus with infantile hepatitis. Microbiol Immunol. 2005;49:771-777. [PubMed] |
| 5. | Soderberg-Naucler C. Does cytomegalovirus play a causative role in the development of various inflammatory diseases and cancer? J Intern Med. 2006;259:219-246. [PubMed] |
| 6. | Kottaridi C, Ploumidis G, Grapsas E, Feretis C, Benakis P, Filalithis P, Bouzarelou D, Nasioulas G. Elucidation of cytomegalovirus disease recurrence in an HIV-1-positive patient. J Gastroenterol. 2003;38:643-646. [PubMed] |
| 7. | Ambrose A, Zemlicka J, Kern ER, Drach JC, Gullen E, Cheng YC. Phosphoralaninate pronucleotides of pyrimidine methylenecyclopropane analogues of nucleosides: synthesis and antiviral activity. Nucleosides Nucleotides Nucleic Acids. 2005;24:1763-1774. [PubMed] |
| 8. | Mizuta M, Schuster MG. Cytomegalovirus hepatitis associated with use of anti-tumor necrosis factor-alpha antibody. Clin Infect Dis. 2005;40:1071-1072. [PubMed] |
| 9. | Ma J, Wang YL, Hu HM, Fox BA, Si LS. Mechanism of augmented anti-tumor immunity in reconstituted lymphopenic mice immunized with melanoma vaccine. Zhonghua Zhongliu Zazhi. 2005;27:708-712. [PubMed] |
| 10. | Soderberg-Naucler C, Streblow DN, Fish KN, Allan-Yorke J, Smith PP, Nelson JA. Reactivation of latent human cytomegalovirus in CD14(+) monocytes is differentiation dependent. J Virol. 2001;75:7543-7554. [PubMed] |
| 11. | 魏 泓. 医学实验动物学. 第1版. 成都: 四川科学技术出版社 1998; 24-30. |