修回日期: 2006-02-18
接受日期: 2006-02-20
在线出版日期: 2006-04-28
目的: 探讨反义Survivin核酸(anti-pcDNA3-svv)对胃癌细胞系SGC7901的凋亡诱导、对泰索帝的化疗增敏作用及对化疗耐药的逆转作用.
方法: 采用脂质体转染法转染胃癌细胞系SGC7901, 并筛选阳性克隆, 以Western blot检测Survivin蛋白的表达, RT-PCR检测MDR-1 mRNA的表达, 用透射电镜及TUNEL法观察并检测转染后SGC7901的凋亡变化, 采用MTT法检测转染细胞对泰索帝的敏感性.
结果: 转染anti-pcDNA3-svv的SGC7901细胞系(SGC7901-SVVanti)其Survivin蛋白比未转染者明显降低, 仅为其29.9%(P<0.01); 透射电镜下可见转染组细胞呈凋亡晚期变化, TUNEL显示转染组与未转染组AI分别为0.241和0.083(P<0.01); 转染组MDR-1 mRNA较未转染组明显降低, 转染组与未转染组MDR指数分别为: 0.196±0.013和3.126±0.019(P<0.01); 转染组对泰索帝的IC50值为16.7±1.98 μg/L, 而未转染组为55.7±1.89 μg/L, 差异具有显著的统计学意义(P<0.01).
结论: 反义Survivin核酸可诱导SGC7901细胞凋亡, 增强泰索帝化疗敏感性, 逆转耐药.
引文著录: 马荣, 陈曦海, 张岂凡, 唐丽萍. 反义Survivin核酸诱导凋亡及逆转胃癌耐药机制的实验研究. 世界华人消化杂志 2006; 14(12): 1139-1145
Revised: February 18, 2006
Accepted: February 20, 2006
Published online: April 28, 2006
AIM: To explore the effect of antisense Survivin RNA on the apoptosis, chemosensitivity to taxotere and drug resistance of gastric cancer cells SGC7901.
METHODS: SGC7901 cells were transfected with antisense Survivin eukaryotic vector (anti-pcDNA3-svv) by lipofectamine, and the positive clones were screened out. Survivin protein and multi-drug resistance-1 (MDR-1) mRNA were determined by Western blot and reverse transcription polymerase chain reaction (RT-PCR). The apoptosis of SGC7901 cells was observed by electronic microscopy and TUNEL method, and the sensitivity of the cells to taxotere was examined by MTT assay.
RESULTS: The expression of Survivin protein in the transfected SGC7901 cells (29% of latter) was decreased obviously in comparison with that in the non-transfected cells (P < 0.01). SGC7901-SVVanti cells (transfected) presented terminal apoptosis, and TUNEL showed that the apoptosis index (AI) was 0.241, which was higher as compared with that of non-transferred cells (0.083) (P < 0.01). MDR-1 index was 0.196 ± 0.013 and 3.126 ± 0.019 in the transfected and non-transfected cells, respectively (P < 0.01). The IC50 of taxotere was 16.7 ± 1.98 and 55.7 ± 1.89 μg/L in the transfected cells and non-transfected ones, respectively (P < 0.01).
CONCLUSION: Antisense Surivivin RNA can induce apoptosis, increase the chemosensitivity to taxotere and reverse the drug resistance of SGC7901 cells.
- Citation: Ma R, Chen XH, Zhang QF, Tang LP. Experimental study on inducing apoptosis and reversing drug resistance of gastric cancer cells SGC7901 by antisense Survivin RNA. Shijie Huaren Xiaohua Zazhi 2006; 14(12): 1139-1145
- URL: https://www.wjgnet.com/1009-3079/full/v14/i12/1139.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i12.1139
Survivin是新近发现的凋亡抑制蛋白家族(inhibitor of apoptosis protein, IAP)成员, 能抑制Caspase活性而发挥抗凋亡作用[1-2]. 近年的研究认为, 凋亡是化疗药物诱导肿瘤细胞死亡的主要模式, IAP家族在调节肿瘤细胞对凋亡敏感性方面起着核心作用[3-4]. 已有研究证实, Survivin基因的高表达与化疗耐药有密切关系, 抑制Survivin基因的表达能增加肿瘤组织对化疗的敏感性[5-6]. 我们通过构建反义Survivin真核表达载体, 转染胃癌细胞系SGC7901, 观察其对胃癌细胞凋亡的影响, 对多药耐药基因(multidrug resistance, MDR-1)的影响及对化疗药物泰索帝的化疗增敏作用.
人胃癌细胞株SGC7901(哈尔滨医科大学肿瘤研究所)用含有100 mL/L胎牛血清(Gibco公司)的RPMI 1640(Gibco公司)培养(37 ℃ 50 mL/L CO2). 泰索帝(Aventis Pharma, Dagenham公司)溶解于DMSO(Gibco公司), 4 ℃保存. Survivin基因通过RT-PCR方法克隆获得. 应用Trizol(TaKaRa公司)法从胃癌细胞株SGC7901中抽提总RNA后以RT-PCR法扩增Survivin基因. 上游引物为: 5'-ATATTCTAGACCATGGGTGCCCCGACGTTGC-3', 下游引物为: 5'-AATCGAATTCTCAATCCATGGCAGCCAGCTG-3'(引物由上海生工公司合成). PCR扩增条件为: 94 ℃预变性2 min, 94 ℃ 1 min, 60 ℃ 1 min, 72 ℃ 1 min, 共30循环, 72 ℃延伸10 min, 扩增产物用琼脂糖回收试剂盒(Invitrogen公司)回收提纯并经上海生工公司测序正确后, 产物进行末端连接腺嘌呤(A)反应, 与带有胸腺嘧啶末端(T)的载体pcDNA3.1(Invitrogen公司, DNA3.1/CT-GFP-TOPO)以A-T策略连接. 重组体转化感受态大肠杆菌DH5α, 筛选Amp阳性克隆者小量抽提质粒(质粒抽提试剂盒TaKaRa公司), 送去测序(上海生工公司). 经测序, 选出其中碱基序列正确并且反向连接者, 命名为anti-pcDNA3-svv.
取对数生长期的SGC7901细胞, 传代接种于6孔板, 调整细胞密度, 使每孔的细胞数为5×105, 常规条件下培养48 h. 将细胞分为3组, 未转染的空白对照组(SGC7901)、转染空质粒组(SGC7901-neo)、转染anti-pcDNA3-svv的实验组(SGC7901-SVVanti). 分别将空质粒和重组质粒与脂质体以2:1的浓度比混合, 按照脂质体转染说明书操作, 进行转染. 5 h后更换培养液, 培养48 h后加入含有G418的培养基筛选阳性克隆. 浓度由200 mg/L渐加至800 mg/L, 约3-5 d增加一个浓度梯度, 共筛选48 d, 可见有抗性细胞生长, 命名为SGC7901-SVVanti. 上述同样条件空质粒pcDNA3.1转染SGC7901, 一部分用来加G418后观察细胞生长情况, 一部分传代培养, 命名为SGC7901-neo.
1.2.1 Western blot法检测Survivin蛋白表达: SGC7901-SVVanti, SGC7901-neo, SGC7901细胞培养48 h, 收集6×106个细胞, PBS漂洗3次后加入4 ℃的裂解液50 μL, 冰浴20 min, 12000 r/min离心后取上清液. Bradford法测定蛋白浓度. 取每种样品各40 μg, 100 g/L SDS PAGE凝胶电泳分离, 通过点转移法将蛋白质从SDS PAGE凝胶转移至硝酸纤维素膜后在含有50 g/L脱脂奶粉的TTBS中37 ℃封闭90 min, 加入1:1000羊抗人Survivin(上海中山公司), 4 ℃过夜, TTBS充分漂洗后加入1:4000兔抗羊IgG/HRP(上海中山公司), 室温孵育1 h, TTBS充分漂洗, 洗膜后加入LumiGLO化学发光试剂1 min. X线暗室曝光, 常规显影定影. 图像以Bio Rad图像分析系统分析, 用蛋白条带的平均光强度值表示Survivin表达的相对强度.
1.2.2 电镜观察细胞超微结构: SGC7901-SVVanti、SGC7901细胞传代培养48 h后, 收集1×106个细胞, PBS漂洗3次, 离心后至于1.5 mL eppendorf管中, 4 ℃戊二醛固定, 染色后在电镜下观察细胞超微结构.
1.2.3 TUNEL法观察胃癌细胞转染前后凋亡变化: 胃癌细胞传代培养48 h后, 取消毒后的盖玻片放入6孔板, 取SGC7901-SVVanti和SGC7901细胞各1×106个细胞放入6孔板内, 爬片24 h后取出盖玻片, 以37 mL/L甲醛固定, 依照TUNEL凋亡试剂盒(晶美公司)的实验方法经过水化、PBS浸泡、Cytonin处理细胞样本、dH2O洗涤、30 mL/L H2O2甲醇溶液消除内源性HRP及PBS中和洗涤后用1×TdT标记缓冲液孵育, TdT标记Biotin-dNTP, 经过Streptavidin-HRP及DAB溶液显色并复染后在显微镜下观察细胞染色. 凋亡细胞呈现细胞核褐色染色. 随机取10个视野, 计数凋亡细胞数的比率AI, 两组细胞采用t检验比较凋亡率.
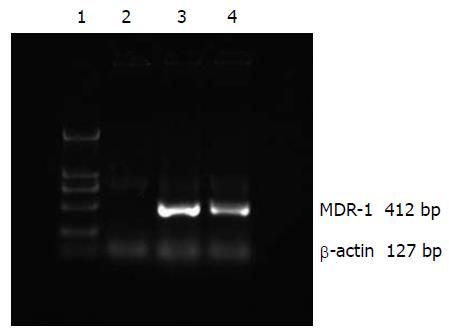
1.2.4 反义 Survivin核酸对MDR-1 mRNA表达的影响: 上述3组细胞利用Trizol(TaKaRa公司)法提取总RNA, RT-PCR法扩增MDR-1 mRNA, 进行比较. MDR的上游引物为: 5'-CTACAATGAGCTGCGTGTGGC-3', 下游引物为: 5'-CAGGTCCAGACGCAGGATGGC-3', 扩增片段长度为412 bp. 以β-actin为内参照, 上游引物为: 5'-CTACAATGAGCTGCGTGTGGC-3', 下游引物为: 5'-CAGGTCCAGACGCAGGATGGC-3', 扩增片段长度127 bp. 扩增产物用20 g/L琼脂糖电泳, 用凝胶图像分析仪根据条带亮度的不同进行分析. MDR指数: MDR值/β-actin值. 实验结果采用方差分析进行比较.
1.2.5 各组细胞对泰索帝敏感性分析(MTT): 备96孔板, 每孔加入100 μL的1×105的SGC7901, SGC7901-neo, SGC7901-SVVanti细胞, 每种细胞加7孔, 其中1孔做调零用, 每孔依次加入0, 1, 10, 20, 50, 100 μg/L泰索帝, 37 ℃培养48 h后, 每孔加入10 g/L MTT 10 μL, 继续培养4 h, 小心去掉上清液, 每孔加入二甲基亚枫(DMSO)150 μL, 振荡10 min, 酶标仪测定490 nm处吸光度(A)值. 根据A值计算细胞存活率, 并描述加泰索帝50 μg/L后0, 24, 48, 72 h细胞生长曲线. 细胞存活率(%) = A实验组/A对照组×100%.
统计学处理 结果以均数±标准差(mean±SD)表示, 采用SPSS10.0软件进行方差分析, t检验.
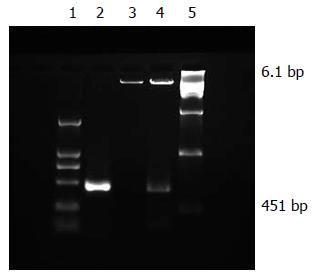
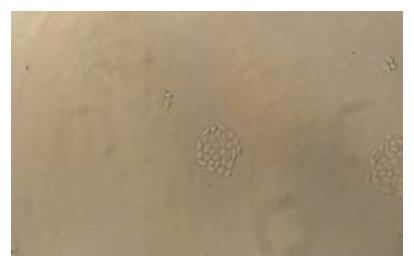
利用RT-PCR方法从SGC7901细胞克隆出Survivin基因, 全长451 bp, 经电泳证实扩增片段与预先设计片段大小一致. 与载体pcDNA3.1以A-T策略连接后转化感受态大肠杆菌, 挑取阳性克隆酶切鉴定, 再经上海生工公司测序, 与GenBank中序列完全符合(图1), 选取其中与pcDNA3.1反向连接者命名为anti-pcDNA3-svv. 由此得到真核表达载体. 转染anti-pcDNA3-svv的实验组(SGC7901-SVVanti)经过48 d筛选, 可见单细胞克隆生长, 采用胰酶定点消化的方法将此细胞群落消化下来并传代培养(图2). 转染空质粒组细胞经G418筛选后全部死亡.
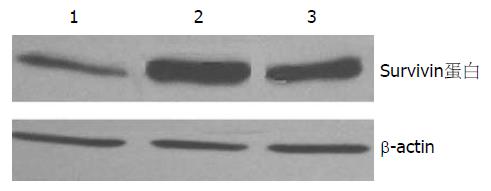
Western blot印迹法显示, SGC7901-SVVanti组Survivin蛋白表达较SGC7901-neo组和SGC7901组明显降低(图3), 应用计算机对条带净密度进行分析, SGC7901-SVVanti组Survivin蛋白的表达仅为SGC7901-neo组的32.7%, 为SGC7901组29.9%. 采用方差分析显示SGC7901-SVVanti组Survivin蛋白的表达较其他两组表达明显降低(P<0.01), SGC7901-neo组和SGC7901组Survivin蛋白表达无显著差异, 说明反义Survivin核酸(anti-pcDNA3-svv)对胃癌细胞内Survivin蛋白表达的阻断作用是确切的.
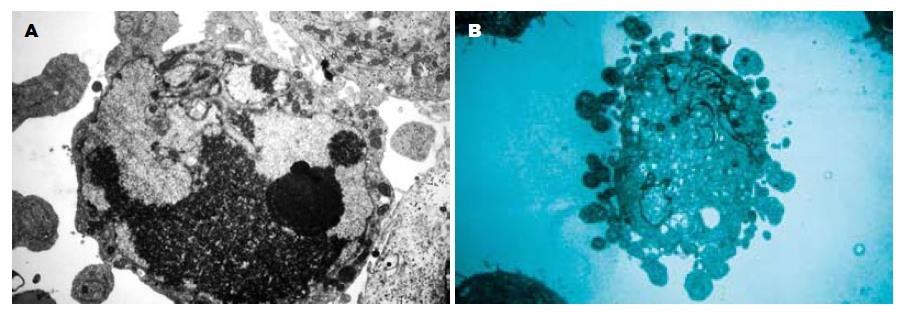
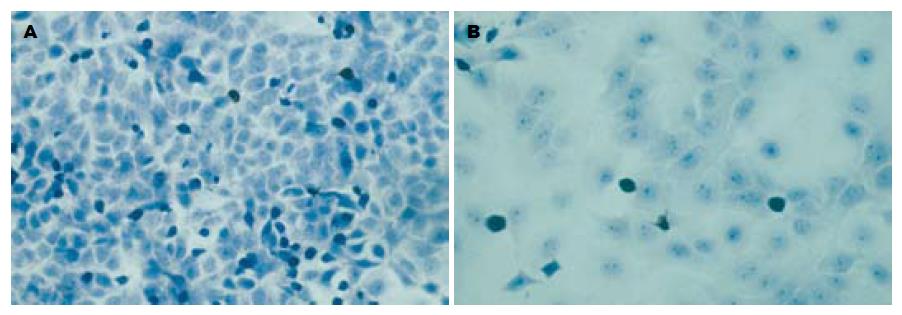
电镜下SGC7901-SVVanti细胞大部分呈凋亡晚期变化, 细胞核收缩变圆, 与周围细胞脱离, 微绒毛消失, 胞质浓缩, 细胞核中染色质边集、皱缩, 密度增高, 集聚于核膜周边(图4A). 而SGC7901组不见上述表现(图4B).
SGC7901-SVVanti和SGC7901组细胞经过染色后分别随机取10个视野计数阳性细胞数, 发现SGC7901-SVVanti组阳性细胞数明显增多(图5), 其AI为0.241, 而SGC7901组为0.083, 经过t检验两组凋亡率具有显著的统计学差异(P<0.01).
分别从SGC7901, SGC7901-neo, SGC7901-SVVanti细胞中提取MDR-1 mRNA, 发现转染anti-pcDNA3-svv的SGC7901-SVVanti其MDR-1 mRNA表达较其他两组明显降低, 而不影响β-actin的表达, 转染空质粒组比对照组MDR-1 mRNA表达亦有下降(图6). 各组MDR指数分别为: 0.196±0.013(SGC7901-SVVanti组), 3.126±0.019(SGC7901组), 2.958±0.024(SGC7901-neo组). 经方差分析, SGC7901-SVVanti与SGC7901-neo、SGC7901细胞的MDR-1 mRNA表达量有非常显著的差异(P<0.01).
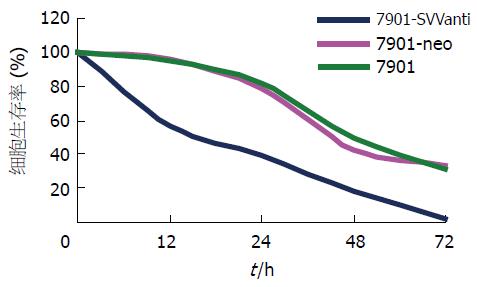
各组细胞随着泰索帝药物浓度的提高, 细胞存活率都呈下降趋势, 但anti-pcDNA3-svv组下降更加明显(表1), 其IC50值为16.7±1.98 μg/L, 而SGC7901-neo组和SGC7901组分别为49.9±1.21 μg/L和55.7±1.89 μg/L, 与SGC7901-neo组和SGC7901组相比, SGC7901-SVVanti组的IC50值明显下降, 经方差分析, 差异具有显著性(P<0.01). 在泰索帝药物浓度为50 μg/L时, SGC7901-SVVanti组细胞存活率也较其他两组明显下降(图7), 统计学分析显示其与其他两组的差异有显著性(P<0.01).
| 分组 | 泰索帝(μg/L) | |||||
| 0 | 1 | 10 | 20 | 50 | 100 | |
| SGC7901 | 100.0 | 98.9 | 79.5 | 65.9 | 48.4 | 7.8 |
| SGC7901-neo | 100.0 | 96.9 | 81.7 | 63.2 | 43.3 | 6.8 |
| SGC7901-SVVanti | 100.0 | 97.8 | 62.6 | 33.4 | 17.6 | 2.3 |
Survivin作为IAP的成员, 最近研究发现, 其在细胞周期调节及凋亡抑制方面发挥着巨大作用[7-10]. 细胞周期的运动受细胞周期调节因子的控制. 在肿瘤细胞中一方面是由于细胞周期正调控因子过表达, 另一方面是细胞周期负调控因子低表达. 细胞周期运动的过程实际上是细胞增殖的过程. Survivin主要在G2/M期表达, 具有严格的细胞周期依赖性. G2/M期控制点负责保持遗传的准确性, 如果增殖细胞的DNA复制不能与中心体的加倍相一致就会不可避免地出现细胞倍型的改变, 产生多核现象, 从而造成染色体核型的改变, 而后者在癌细胞中是很常见的. 这种染色体的改变导致其不稳定, 使已经突变的肿瘤抑制基因的表型表达或使癌基因过表达, 即Survivin有助于肿瘤细胞逃离G2/M期监控点而达到无限增生, 从而促使肿瘤的发生[11-12].
目前已知细胞凋亡有内源性和外源性两条途径. 两条途径最后都通过激活下游效应的Caspase-3和Caspase-7最终使细胞凋亡. Survivin蛋白通过直接抑制凋亡途径中的下游作用点Caspases-3, 7而发挥抗凋亡作用. Survivin过度表达使得P21解离而活化Cdk4, 细胞进入增殖周期. 细胞失去了正常增殖周期中凋亡"开关"(checkpoint)的限制, 大量细胞无限增殖, 增殖与凋亡平衡打破, 造成凋亡减少, 最后导致肿瘤的发生[13-14].
在本研究中反义Survivin核酸转染胃癌细胞后, 随着转染细胞的Survivin蛋白表达明显下降(转染anti-pcDNA3-svv的细胞Survivin蛋白表达是未转染组的29.9%), Survivin对胃癌细胞的凋亡抑制作用减轻, 转染组细胞SGC7901-SVVanti的凋亡率达到0.241, 而SGC7901细胞只有0.083, 两者差异显著. 在电镜下可见转染组细胞SGC7901-SVVanti多呈凋亡晚期变化, 而未转染的SGC7901细胞在电镜下几乎无凋亡变化. 说明我们构建的反义核酸anti-pcDNA3-svv成功的阻断并降低了胃癌细胞内高表达的Survivin基因, 从而在一定程度上抑制了凋亡抑制蛋白Survivin的抗凋亡作用, 激发了胃癌细胞的凋亡程序, 加速了胃癌细胞的凋亡, 使我们从另一个角度认识到了Survivin基因的强大的抗凋亡作用.
近年的研究认为凋亡是化疗药物诱导肿瘤细胞死亡的主要模式, IAP家族在调节肿瘤细胞对凋亡敏感性方面起着核心作用[15]. 多项研究显示Survivin基因在有丝分裂的早期与纺锤体的微管蛋白相连, 干扰Survivin与微管蛋白的作用可使Survivin抗凋亡功能丧失. 阻断了Survivin基因的细胞, 微管相对稳定, 使有丝分裂减慢[16]. 在我们的实验里选择了泰索帝作为研究对象, 这首先是因为泰索帝的抗癌机制是其能够加强微管蛋白的聚合作用和抑制微管解聚作用, 导致形成稳定的非功能性微管束, 因而破坏肿瘤细胞的有丝分裂. 而Survivin蛋白主要与中心粒表面的g微管蛋白结合而发挥抗凋亡作用[17-19], 因此二者具有作用的共同位点; 其次, 泰索帝是新发现的抗肿瘤药物, 又名多西他赛, 他的作用机制虽然和紫杉醇相同, 但是他在细胞内的浓度为紫杉醇的3倍, 而且停滞时间长, 在体外实验中其具有比紫杉醇更强的活性. 在本实验中, 抑制了Survivin蛋白表达的SGC7901细胞对泰索帝的敏感性大大提高, 在药物浓度为50 μg/mL时, Survivin蛋白表达降低的SGC7901-SVVanti较Survivin蛋白表达正常的SGC7901-neo和SGC7901组细胞生存率明显降低, 其IC50值为16.7±1.98 μg/mL, 而SGC7901-neo组和SGC7901组分别为49.9±1.21 μg/mL和45.7±1.89 μg/mL. 即当达到相同细胞生存率(50%)时, SGC7901-SVVanti组是空白对照组(SGC7901)所需药物浓度的36.5%, 在王晓娟et al[20]对反义survivin核酸对逆转紫杉醇耐药性的实验研究中, 在达到相同细胞生存率(50%)时, 实验组是空白对照组所需药物浓度的45%, 说明反义Survivin核酸是泰索帝良好的增敏剂.
国内外已有一些学者发现, 定向阻断肿瘤细胞内Survivin基因的表达后会对多种化疗药物产生增敏作用[21-22], 但是都未对其发生机制作出进一步的研究. 近年来, 越来越多的证据表明, 细胞凋亡与MDR密切相关[23-24]. 许多化疗药物被证明是通过损伤DNA或作用于凋亡相关基因诱导细胞凋亡而发挥抗肿瘤作用. 一旦肿瘤细胞对这些药物发生耐受, 就意味着肿瘤细胞能够抵抗这些药物诱导的凋亡(细胞抵抗凋亡可能是细胞耐药的后果). 如果肿瘤细胞能够抵抗这些药物诱导的调亡, 那么, 肿瘤细胞则肯定对这些药物产生了耐药性, 即MDR. 本实验由此出发, 考虑作为凋亡抑制蛋白家族重要成员的Survivin基因, 其被定向阻断后所出现的胃癌细胞的化疗增敏作用可能与MDR有关, 因此检测了SGC7901, SGC7901-neo, SGC7901-SVVanti细胞中MDR-1的表达. 实验结果表明, MDR-1基因在转染前后有显著差别, 在β-actin的表达一致的情况下, 实验组和对照组MDR-1指数分别为: 0.196±0.013(SGC7901-SVVanti组), 3.126±0.019(SGC7901组), 统计学分析显示具有显著的差异性. 转染后MDR-1基因mRNA表达明显下降. 实验组MDR-1水平下降后对泰索帝更敏感, 细胞生存曲线显示在相同的药物浓度下, 实验组细胞生存率明显低于对照组. 上述实验结果证实了我们的推测, 即Survivin基因表达下降后导致的化疗增敏作用可能与MDR-1下调有关, 并通过促进肿瘤细胞凋亡这一途径来介导.
Notarbartolo et al[25]发现在耐表阿霉素的HL-60细胞中, Survivin基因及MDR-1基因均高表达, 具有显著的相关性. Han et al[26]在研究BBM逆转K562耐药性时也发现, 在耐药细胞中Survivin蛋白与P170蛋白表达均明显升高. 以上说明, 在耐药细胞中, Survivin与MDR-1的表达具有明显相关性. 通过上述实验, 本研究首次证明在阻断Survivin基因表达后, 可以通过降低MDR-1基因的表达而增加SGC7901细胞对泰索帝的敏感性.
胃癌是我国高发肿瘤[27-32]. 尽管根治性胃癌切除手术已经成为胃癌常规的手术方式, 但是胃癌的复发率和转移率仍然很高, 单纯从扩大手术范围出发已经很难提高胃癌的5年生存率. 作为综合治疗的化疗, 已经成为当今治疗胃癌的重要手段之一. 但是胃癌化疗耐药已经成为严重影响胃癌治疗效果的原因之一. 如何逆转耐药是临床学者已经思考并且努力想解决的问题. 我们的研究表明, 降低胃癌细胞内Survivin基因的表达可以促进胃癌细胞的凋亡、增进其对化疗药物泰索帝的敏感性, 并逆转耐药, 提示Survivin基因有望成为胃癌基因治疗的理想靶基因.
Survivin是新发现的IAP家族成员, 在这个家族中, 他具有分子量最小, 抗凋亡作用最强大的功能. 除此之外, Survivin基因的组织分布具有特异性, 在各种肿瘤组织中普遍高表达, 而在分化成熟的正常组织中极低表达或者不表达. 随着反义技术的不断成熟, Survivin基因迅速成为肿瘤反义治疗的新靶点
国内外学者多研究Survivin在肿瘤细胞中抗凋亡的作用及发生机制. 在发现定向阻断Survivin基因的表达可以有效的诱导肿瘤细胞的凋亡后还发现, 降低Survivin的表达后可以增加肿瘤细胞对多种化疗药物的增敏作用, 如阿霉素、紫杉醇、顺铂等. 但是其逆转耐药的机制没有阐明.
大多数学者都发现了降低Survivin的表达可以诱导肿瘤细胞凋亡, 增加肿瘤细胞对化疗药物的敏感性, 但是没有揭示化疗增敏作用发生的机制. 本研究从凋亡与耐药发生的关系出发, 进一步研究了降低Survivin表达后, 多药耐药基因MDR-1的表达的变化, 从而揭示了阻断Survivin表达能增加化疗敏感性可能与降低MDR-1的表达有关, 此点在国内外未见有相关报道.
胃癌是我国的常见病和多发病, 其以对化疗不敏感和容易发生耐药而严重影响了临床的治疗效果. 因此, 如何增加胃癌细胞对化疗药物的敏感性是提高胃癌5年生存率的关键. 此研究为反义Survivin作为基因治疗应用于临床奠定了一定的实验基础.
反义核酸: 指与靶DNA或RNA碱基互补, 并能与之结合的一段DNA或RNA. 反义核酸技术是指利用反义核酸特异地抑制某些基因的表达;
MDR: 在反复接触某种药物后, 肿瘤细胞可以获得对该药物以及其他结构和作用机制不尽相同的多种药物的耐受性, 即多药耐药(multi-durgresistance, MDR).
本文以反义核酸技术抑制Survivin的表达为前提, 而目前对与基因沉默技术而言, 采用RNAi更为先进, 即使在反义核酸技术领域, 使用oligonucleotides也比本文的natualantisense更好一些. 本文的创新之处在于在肿瘤细胞中证明了Survivin的表达量与MDR基因的表达量具有相关性, 因此在这个角度进行深入研究将会有较大的科学意义.
编辑: 潘伯荣 电编:张敏
| 1. | Li YH, Wang C, Meng K, Chen LB, Zhou XJ. Influ-ence of survivin and Caspase-3 on cell apoptosis and prognosis in gastric carcinoma. World J Gastroenterol. 2004;10:1984-1988. [PubMed] |
| 2. | Yang LQ, Fang DC, Wang RQ, Yang SM. Effect of NF-kappaB, survivin, Bcl-2 and Caspase3 on apoptosis of gastric cancer cells induced by tumor necrosis factor related apoptosis inducing ligand. World J Gastroenterol. 2004;10:22-25. [PubMed] |
| 3. | Altieri DC. Survivin, versatile modulation of cell division and apoptosis in cancer. Oncogene. 2003;22:8581-8589. [PubMed] |
| 4. | Altieri DC. Survivin and apoptosis control. Adv Cancer Res. 2003;88:31-52. [PubMed] |
| 5. | Trieb K, Lehner R, Stulnig T, Sulzbacher I, Shroyer KR. Survivin expression in human osteosarcoma is a marker for survival. Eur J Surg Oncol. 2003;29:379-382. [PubMed] |
| 6. | Chang Q, Liu ZR, Wang DY, Kumar M, Chen YB, Qin RY. Survivin expression induced by doxoru-bicin in cholangiocarcinoma. World J Gastroenterol. 2004;10:415-418. [PubMed] |
| 7. | Lin LJ, Zheng CQ, Jin Y, Ma Y, Jiang WG, Ma T. Expression of survivin protein in human colorectal carcinogenesis. World J Gastroenterol. 2003;9:974-977. [PubMed] |
| 8. | Gazzaniga P, Gradilone A, Giuliani L, Gandini O, Silvestri I, Nofroni I, Saccani G, Frati L, Agliano AM. Expression and prognostic significance of LIVIN, SURVIVIN and other apoptosis-related genes in the progression of superficial bladder cancer. Ann Oncol. 2003;14:85-90. [PubMed] |
| 9. | Tomizawa M, Saisho H, Tagawa M. Regulatory regions of growth-related genes can activate an exogenous gene of the alpha-fetoprotein promoter to a comparable degree in human hepatocellular carcinoma cells. Anticancer Res. 2003;23:3273-3277. [PubMed] |
| 10. | Schultz IJ, Kiemeney LA, Witjes JA, Schalken JA, Willems JL, Swinkels DW, de Kok JB. Survivin mRNA expression is elevated in malignant urothe-lial cell carcinomas and predicts time to recurrence. Anticancer Res. 2003;23:3327-3331. [PubMed] |
| 11. | Pennati M, Binda M, Colella G, Zoppe' M, Folini M, Vignati S, Valentini A, Citti L, De Cesare M, Pratesi G. Ribozyme-mediated inhibition of survivin expression increas-es spontaneous and drug-induced apoptosis and decreases the tumorigenic potential of human prostate cancer cells. Oncogene. 2004;23:386-394. [PubMed] |
| 12. | Yang JH, Zhang YC, Qian HQ. Survivin antisense oligodeoxynucleotide inhibits growth of gastric cancer cells. World J Gastroenterol. 2004;10:1121-1124. [PubMed] |
| 13. | Zhu XD, Lin GJ, Qian LP, Chen ZQ. Expression of survivin in human gastric carcinoma and gastric carcinoma model of rats. World J Gastroenterol. 2003;9:1435-1438. [PubMed] |
| 14. | Altieri DC. Survivin in apoptosis control and cell cycle regulation in cancer. Prog Cell Cycle Res. 2003;5:447-452. [PubMed] |
| 15. | Shin S, Sung BJ, Cho YS, Kim HJ, Ha NC, Hwang JI, Chung CW, Jung YK, Oh BH. An anti-apoptotic protein human survivin is a direct inhibitor of Caspase-3 and -7. Biochemistry. 2001;40:1117-1123. [PubMed] |
| 16. | Giodini A, Kallio MJ, Wall NR, Gorbsky GJ, Tognin S, Marchisio PC, Symons M, Altieri DC. Regulation of microtubule stability and mitotic progression by survivin. Cancer Res. 2002;62:2462-2467. [PubMed] |
| 17. | Zangemeister-Wittke U, Simon HU. An IAP in action: the multiple roles of survivin in differentia-tion, immunity and malignancy. Cell Cycle. 2004;3:1121-1123. [PubMed] |
| 18. | Cai Z, Bao HY, Lin MF. Correlation between survivin mRNA expression and homoharringtonine induced apoptosis of malignant hematopoietic cells. Chin Med J (Engl). 2005;118:548-554. [PubMed] |
| 19. | Sanna MG, da Silva Correia J, Ducrey O, Lee J, Nomoto K, Schrantz N, Deveraux QL, Ulevitch RJ. IAP suppression of apoptosis involves distinct mechanisms: the TAK1/JNK1 signaling cascade and Caspase inhibition. Mol Cell Biol. 2002;22:1754-1766. [PubMed] |
| 20. | 王 晓娟, 戴 国仪, 曹 立民, 朱 慧芬, 张 悦, 邵 静芳, 杨 敬, 沈 关心. Survivin反义核酸促进紫杉醇诱导HL-60细胞凋亡. 中华血液学杂志. 2003;24:351-354. |
| 23. | Chandele A, Prasad V, Jagtap JC, Shukla R, Shastry PR. Upregulation of survivin in G2/M cells and inhibition of Caspase 9 activity enhances resistance in staurosporine-induced apoptosis. Neoplasia. 2004;6:29-40. [PubMed] |
| 24. | Vaziri SA, Grabowski DR, Tabata M, Holmes KA, Sterk J, Takigawa N, Bukowski RM, Ganapathi MK, Ganapathi R. c-IAP1 is overexpressed in HL-60 cells selected for doxorubicin resistance: effects on etoposide-induced apoptosis. Anticancer Res. 2003;23:3657-3661. [PubMed] |
| 25. | Notarbartolo M, Cervello M, Dusonchet L, Cusimano A, D'Alessandro N. Resistance to diverse apoptotic triggers in multidrug resistant HL60 cells and its possible relationship to the expression of P-glyco-protein, Fas and of the novel anti-apoptosis factors IAP (inhibitory of apoptosis proteins). Cancer Lett. 2002;180:91-101. [PubMed] |
| 26. | Han YQ, Yuan JY, Shi YJ, Zhu Y, Wu SL. Reversal effect of berbamine on multidrug resistance of K562/A02 cells and its mechanism. Zhongguo Shiyan Xueyexue Zazhi. 2003;11:604-608. [PubMed] |
| 27. | Sun L, Wang X. Effects of allicin on both telomerase activity and apoptosis in gastric cancer SGC-7901 cells. World J Gastroenterol. 2003;9:1930-1934. [PubMed] |
| 28. | Zhao GH, Li TC, Shi LH, Xia YB, Lu LM, Huang WB, Sun HL, Zhang YS. Relationship between inactivation of p16 gene and gastric carcinoma. World J Gastroenterol. 2003;9:905-909. [PubMed] |
| 29. | Zhao XH, Gu SZ, Liu SX, Pan BR. Expression of estrogen receptor and estrogen receptor messenger RNA in gastric carcinoma tissues. World J Gastroen-terol. 2003;9:665-669. [PubMed] |
| 30. | Chen H, Wang LD, Guo M, Gao SG, Guo HQ, Fan ZM, Li JL. Alterations of p53 and PCNA in cancer and adjacent tissues from concurrent carcinomas of the esophagus and gastric cardia in the same patient in Linzhou, a high incidence area for esophageal cancer in northern China. World J Gastroenterol. 2003;9:16-21. [PubMed] |
| 31. | Ding YB, Chen GY, Xia JG, Zang XW, Yang HY, Yang L. Association of VCAM-1 overexpression with oncogenesis, tumor angiogenesis and metasta-sis of gastric carcinoma. World J Gastroenterol. 2003;9:1409-1414. [PubMed] |
| 32. | Li HX, Chang XM, Song ZJ, He SX. Correlation between expression of cyclooxygenase-2 and angio-genesis in human gastric adenocarcinoma. World J Gastroenterol. 2003;9:674-677. [PubMed] |