修回日期: 2006-03-01
接受日期: 2006-03-07
在线出版日期: 2006-04-18
目的: 探讨肝细胞凋亡在扑热息痛(acetamino-phen, AAP)肝损害中作用.
方法: 建立SD大鼠AAP肝损害模型; 分别于给药后3, 6, 12, 24 h处死大鼠, AAP组和对照组测定血清ALT水平, HE染色光镜下观察肝脏病理改变, 原位末端标记(TUNEL)法和透射电镜检测肝细胞凋亡.
结果: AAP组各时间点血清ALT(nkat/L)水平均显著高于对照组(3, 6, 12, 24 h: 1167±151 vs 587±89, 2154±255 vs 573±76, 4221±929 vs 751±82, 13203±1393 vs 780±161, P<0.01), 随时间进行性升高, 24 h达高峰; AAP组可见不同程度肝细胞坏死, 随时间进行性加重, 24 h达高峰, 对照组未见肝细胞坏死; AAP组中央静脉周围可见大量凋亡细胞, 12 h达高峰, 对照组罕见凋亡细胞, AAP组各时间点肝细胞凋亡指数(AI)均显著高于对照组(3, 6, 12, 24 h: 13.1%±2.9% vs 1.8%±0.5%, 24.8%±5.3% vs 1.7%±0.5%, 40.4%±3.7% vs 2.0%±0.4%, 35.3%±3.5% vs 1.92%±0.3%, P<0.01); 透射电镜下观察, AAP组可见明显的肝细胞凋亡现象, 12 h最易见到, 对照组肝组织超微结构基本正常.
结论: AAP肝损害过程中同时存在肝细胞坏死和凋亡, 早期(给药后12 h内)以凋亡为主, 后期(给药后24 h)以坏死为主.
引文著录: 田丰, 李岩, 王颖, 吴作艳, 王学清. 扑热息痛引起肝细胞损害的机制. 世界华人消化杂志 2006; 14(11): 1107-1110
Revised: March 1, 2006
Accepted: March 7, 2006
Published online: April 18, 2006
AIM: To investigate the role of hepatocellular apoptosis in hepatitis induced by acetaminophen (AAP).
METHODS: The Sprague Dawley (SD) rat model of acetaminophen-induced hepatitis was established using AAP. After administration, the rats were killed at the end of 3, 6, 12, and 24 h, respectively. In both AAP and control group, we detected levels of serum alanine transaminase (ALT), observed pathological changes of hematoxylin and eosin (HE) stained liver with light microscope, and detected hepatocellular apoptosis using TUNEL method and electron microscopy.
RESULTS: The level of serum ALT (nkat/L) in AAP group was significantly higher than that in control group (3, 6, 12, 24 h: 1167 ± 151 vs 587 ± 89, 2154 ± 255 vs 573 ± 76, 4221 ± 929 vs 751 ± 82, 13203 ± 1393 vs 780 ± 161, all P < 0.01), which increased progressively and reached the peak at 24 h. In AAP group, different degrees of necrosis was detected and aggravated progressively, and it also reached the peak at 24 h. There were a large number of apoptotic hepatocytes around central veins and they reached the peak at 12 h in AAP group. However, few apoptotic hepatocytes were observed in control group. The apoptotic index (AI) in AAP group was markedly higher than that in control group (3, 6, 12, 24 h: 13.1% ± 2.9% vs 1.8% ± 0.5%, 24.8% ± 5.3% vs 1.7% ± 0.5%, 40.4% ± 3.7% vs 2.0% ± 0.4%, 35.3% ± 3.5% vs 1.92% ± 0.3%, P < 0.01). Electron microscopy indicated that hepatocytes of AAP group demonstrated unequivocal appearance of apoptotic traits, especially at 12 h.
CONCLUSION: Both apoptosis and necrosis exist in AAP-induced hepatocytic injury. Apoptosis was dominant in the early stage (within 12 h) while necrosis was dominant in the late stage (at 24 h).
- Citation: Tian F, Li Y, Wang Y, Wu ZY, Wang XQ. Mechanism of acetaminophen-induced hepatocellular injury. Shijie Huaren Xiaohua Zazhi 2006; 14(11): 1107-1110
- URL: https://www.wjgnet.com/1009-3079/full/v14/i11/1107.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i11.1107
扑热息痛(acetaminophen, AAP)是临床上应用最广泛的解热镇痛药物, 在正常治疗剂量下应用是比较安全的, 但过量使用可以造成人和动物严重的肝损害. 多数学者认为AAP引起肝细胞死亡主要是通过坏死的方式, 而对于在此过程中是否存在细胞凋亡及其地位和作用存在争议[1-2]. 我们建立Sprague Dawley (SD)大鼠AAP肝损害模型, 用原位末端标记(TUNEL)法和透射电镜检测肝细胞凋亡, 探讨细胞凋亡在AAP肝损害中的地位和作用.
5-6周龄SD大鼠, 体质量180-240 g, 购自中国医科大学动物实验中心; AAP购自Sigma公司; 原位细胞凋亡检测试剂盒购自武汉博士德生物工程有限公司; 自动生物化学分析仪(日本岛津公司); 普通光学显微镜(日本Olympus公司); JEM-1200EX透射电镜(日本Olympus公司).
SD大鼠随机分为对照组和AAP组, 每组20只. AAP组给予AAP (1 g/kg) ip[3], 对照组给予等量PBS液ip. 于给药后3, 6, 12, 24 h(每时点各组分别有5只大鼠)用水合氯醛ip麻醉, 心脏穿刺取血, 分离血清, -20 ℃保存; 于肝脏中叶取2块肝组织, 分别置于40 g/L甲醛、25 g/L戊二醛中固定. 血清ALT测定用自动生物化学分析仪进行. 取肝组织, 用40 g/L甲醛溶液固定, 石蜡包埋, 5 μm厚切片, 常规HE染色, 光镜下观察其病理改变, 计算坏死细胞面积百分比(坏死细胞面积/所有细胞面积×100%)[1]. 原位细胞凋亡检测采用TUNEL法. 肝组织切片制作方法同上, 步骤严格按试剂盒说明书进行. 每例标本切片随机选取5个400倍视野, 计算出平均每100个细胞中的凋亡细胞数, 并以百分数表示作为凋亡指数(AI). 取1 mm3肝组织, 25 g/L戊二醛固定, 超薄切片700 Å, 醋酸铀和柠檬酸铅染色, JEM-1200EX透射电镜观察超微结构的形态变化.
统计学处理 SPSS11.0统计软件进行分析, 数据用均数±标准差(mean±SD)表示, 两组均数比较用t检验.
AAP组各时间点血清ALT(nkat/L)水平均显著高于对照组(给药后3, 6, 12, 24 h分别为: 1167±151 vs 587±89, 2154±255 vs 573±76, 4221±929 vs 751±82, 13203±1393 vs 780±161, P<0.01), 随时间进行性升高, 24 h达高峰.
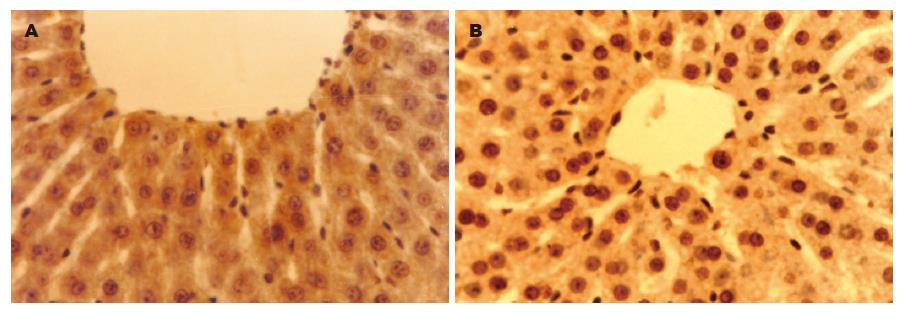
AAP组肝脏明显肿大、充血, 镜下: 轻者表现为肝细胞点状坏死, 重者表现为小叶中心肝细胞广泛的炎性细胞浸润、出血、带状坏死, 随时间进行性加重, 24 h达高峰(各时间点坏死细胞面积百分比分别为: 19.9%±7.0%, 30.2%±6.1%, 46.6%±8.4%, 65.2%±8.1%), 对照组未见肝细胞坏死.
对照组罕见凋亡细胞, AAP组中央静脉周围可见大量凋亡细胞, 12 h达高峰; AAP组各时间点AI均显著高于对照组(P<0.01, 表1, 图1).
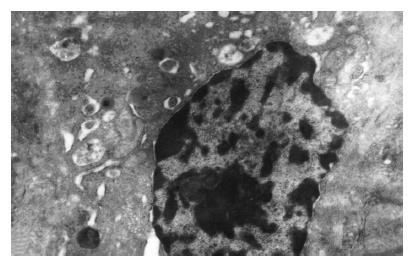
对照组肝组织超微结构基本正常; AAP组可见明显的肝细胞凋亡现象, 如胞质和核浓缩、染色质边聚、凋亡小体形成等, 12 h最易见到(图2).
细胞的死亡方式有: 坏死和程序性细胞死亡(细胞凋亡)两种. AAP肝损害中肝细胞死亡方式存在争议, 一般认为是通过坏死的方式, 但一些报道显示细胞凋亡可能在这一过程中起着重要的作用[4-5]. Ray et al[4]通过生化、病理、超微结构的标准证实, 过量的AAP既可以引起肝细胞坏死也可以引起肝细胞凋亡, AAP肝损害中的细胞死亡40%以上是通过凋亡, 而非坏死, 而另外一些学者持相反意见. Gujral et al[1]证实, AAP肝损害可引起肝细胞凋亡的明显增加, 但90%以上的肝细胞死亡仍然是通过坏死, 而非凋亡; 在细胞凋亡发生、发展过程中, Caspases激活的级联反应起着关键作用, Caspase-3是级联反应下游一个重要的效应器, 体内实验发现[6-8], 在TNF-α和Fas受体介导的肝细胞凋亡中, 很容易发现Caspase-3被激活、活性增强, 阻断其激活可有效的防止受体介导的肝细胞凋亡发生; 而在AAP肝损害中, 未发现Caspase-3被激活、活性增强[1], 阻断其激活也不能阻止肝损害的发生[9]; 实际上, AAP通过损害肝细胞线粒体功能而阻断了通过线粒体的凋亡信号转导, 从而阻止了TNF-α和Fas受体介导的肝细胞凋亡[9]; Adams et al[10]报道, 过量表达的抗凋亡蛋白Bcl-2实际上加重了AAP肝损害.
研究显示, 在AAP引起的肝损害中, 许多细胞同时具备坏死和凋亡的特征, 被称为"迷茫的肝细胞(puzzled hepatocytes)"[11]; 此外, 坏死和凋亡并非两个完全独立的过程, 在存在大量凋亡的情况下, 可能转而发生"继发性坏死(secondary necrosis)", 这与通常意义上的坏死是无法区分的[12-13]. 以上可能是引起AAP肝损害中关于肝细胞死亡方式争议的原因之一. 检测凋亡细胞的方法很多, 但形态改变仍是确定细胞凋亡的最可靠方法. 凋亡细胞的典型形态改变如胞质的固缩, 染色质浓缩成半月形或帽状附于核膜, 核的碎裂和凋亡小体形成等, 在透射电镜下得到最佳体现, 因而通过透射电镜进行细胞超微结构观察是凋亡细胞判定最可靠的依据. TUNEL法是应用最为广泛的检测凋亡细胞方法, 其优点是可用于原位标记, 可用于病理组织, 并可进行定量分析. 我们应用SD大鼠建立AAP肝损害模型, 联合应用上述两种方法进行凋亡细胞检测, 证实AAP肝损害过程中同时存在大量的肝细胞坏死和凋亡, 早期以凋亡为主(12 h), 后期以坏死为主(24 h), 且与ALT水平相平行, 说明在AAP肝损害过程中两者是共存的. 同时我们发现24 h细胞凋亡较12 h有所减少, 而坏死却显著增多, 因而推测给药12 h后在大量细胞凋亡的基础上存在"继发性坏死"的可能.
临床上治疗AAP肝损害的方法只有早期应用N-乙酰半胱氨酸和肝移植, 缺乏其他经济、有效的治疗方法. 今后, 我们打算通过对Caspase-3, Bcl-2, Bcl-L, Bcl-X等与凋亡密切相关蛋白表达的检测, 进一步探讨AAP引起细胞凋亡的机制, 进而为临床提供一条通过抑制细胞凋亡来治疗AAP肝损害的可行方法.
扑热息痛(AAP)过量使用可以造成严重的肝损害. 多数学者认为AAP引起肝细胞死亡主要是通过坏死的方式, 是否存在细胞凋亡存在争议.
本文建立SD大鼠AAP肝损害模型, 用TUNEL法和透射电镜检测肝细胞凋亡, 证实AAP肝损害过程中同时存在大量的肝细胞坏死和凋亡, 早期以凋亡为主, 后期以坏死为主.
本文探讨了肝细胞凋亡在扑热息痛(AAP)肝损害中作用, 有一定的理论和临床价值, 提供了一定的有意义的信息. 研究具有一定的新颖性, 符合伦理学要求.
编辑: 张海宁 电编:张敏
| 1. | Gujral JS, Knight TR, Farhood A, Bajt ML, Jaeschke H. Mode of cell death after acetaminophen over-dose in mice: apoptosis or oncotic necrosis? Toxicol Sci. 2002;67:322-328. [PubMed] |
| 2. | Ray SD, Jena N. A hepatotoxic dose of acetamino-phen modulates expression of BCL-2, BCL-X(L), and BCL-X(S) during apoptotic and necrotic death of mouse liver cells in vivo. Arch Toxicol. 2000;73:594-606. [PubMed] |
| 3. | Bauer I, Vollmar B, Jaeschke H, Rensing H, Kraemer T, Larsen R, Bauer M. Transcriptional activation of heme oxygenase-1 and its functional significance in acetaminophen-induced hepatitis and hepatocellular injury in the rat. J Hepatol. 2000;33:395-406. [PubMed] |
| 4. | Ray SD, Mumaw VR, Raje RR, Fariss MW. Protec-tion of acetaminophen-induced hepatocellular apoptosis and necrosis by cholesteryl hemisuccinate pretreatment. J Pharmacol Exp Ther. 1996;279:1470-1483. [PubMed] |
| 5. | Ferret PJ, Hammoud R, Tulliez M, Tran A, Trebeden H, Jaffray P, Malassagne B, Calmus Y, Weill B, Batteux F. Detoxification of reactive oxygen species by a nonpeptidyl mimic of superoxide dismutase cures acetaminophen-induced acute liver failure in the mouse. Hepatology. 2001;33:1173-1180. [PubMed] |
| 6. | Jaeschke H, Fisher MA, Lawson JA, Simmons CA, Farhood A, Jones DA. Activation of Caspase 3 (CPP32)-like proteases is essential for TNF-alpha-induced hepatic parenchymal cell apoptosis and neutrophil-mediated necrosis in a murine endotoxin shock model. J Immunol. 1998;160:3480-3486. [PubMed] |
| 7. | Bajt ML, Lawson JA, Vonderfecht SL, Gujral JS, Jaeschke H. Protection against Fas receptor-mediated apoptosis in hepatocytes and nonpar-enchymal cells by a Caspase-8 inhibitor in vivo: evidence for a postmitochondrial processing of Caspase-8. Toxicol Sci. 2000;58:109-117. [PubMed] |
| 8. | Bajt ML, Vonderfecht SL, Jaeschke H. Differential protection with inhibitors of Caspase-8 and Caspase- 3 in murine models of tumor necrosis factor and Fas receptor-mediated hepatocellular apoptosis. Toxicol Appl Pharmacol. 2001;175:243-252. [PubMed] |
| 9. | Lawson JA, Fisher MA, Simmons CA, Farhood A, Jaeschke H. Inhibition of Fas receptor (CD95)-induced hepatic Caspase activation and apoptosis by acetaminophen in mice. Toxicol Appl Pharmacol. 1999;156:179-186. [PubMed] |
| 10. | Adams ML, Pierce RH, Vail ME, White CC, Tonge RP, Kavanagh TJ, Fausto N, Nelson SD, Bruschi SA. Enhanced acetaminophen hepatotoxicity in trans-genic mice overexpressing BCL-2. Mol Pharmacol. 2001;60:907-915. [PubMed] |
| 11. | Ray SD, Raje RR. Perplexed mouse hepatocytes. in vivo show signs of both apoptosis and necrosis under the influence of acetaminophen and dimethy-lnitrosamine. Gordon Research Conference on: "Clinical and Experimental Cancer Chemo-therapy'', New Hampshire. 1994;. |
| 12. | Lemasters JJ. V. Necrapoptosis and the mitochon-drial permeability transition: shared pathways to necrosis and apoptosis. Am J Physiol. 1999;276:G1-G6. [PubMed] |
| 13. | Levin S, Bucci TJ, Cohen SM, Fix AS, Hardisty JF, LeGrand EK, Maronpot RR, Trump BF. The nomenclature of cell death: recommendations of an ad hoc Committee of the Society of Toxicologic Pathologists. Toxicol Pathol. 1999;27:484-490. [PubMed] |