修回日期: 2006-03-01
接受日期: 2006-03-11
在线出版日期: 2006-04-18
目的: 建立一种简便、有效、稳定的乙型肝炎病毒(HBV)感染的动物模型, 观察该模型动物体内不同时间点各种HBV标志物的表达情况.
方法: 以流体动力学法尾静脉注射BALB/c小鼠pcDNA3.1-HBV, 1 wk内检测各种HBV标志物, 时间分辨免疫荧光分析法(IFMA)检测血清中HBsAg, HBeAg, 抗HBs, 抗HBe, 抗HBc, 荧光定量PCR法(FQ-PCR)检测血清HBV DNA, 免疫组织化学法检测肝组织HBsAg和HBcAg.
结果: 成功建立一种急性HBV感染动物模型, 第1天血清中HBsAg表达达高峰, 后逐渐降低, HBeAg表达量少, 分别在第4、5、7天检测到抗HBc, 抗HBe, 抗HBs, d1 HBV DNA滴度亦达高峰, 后渐下降, 免疫组织化学示HBsAg呈胞质内弥漫性分布, HBcAg亦主要为胞质型分布.
结论: 以流体动力学法建立的HBV模型是一种新型有效的HBV感染动物模型, 能稳定较高水平表达大部分HBV标志物.
引文著录: 应若素, 范学工, 李宁, 朱才, 刘洪波. 流体动力学法乙型肝炎病毒感染动物模型的建立. 世界华人消化杂志 2006; 14(11): 1052-1057
Revised: March 1, 2006
Accepted: March 11, 2006
Published online: April 18, 2006
AIM: To develop a simple, convenient, efficient and stable animal model of hepatitis B virus (HBV) infection, and observe the dynamic changes of viral replication as well as expression in the model.
METHODS: pcDNA3.1-HBV was delivered into BALB/c mice using the hydrodynamic tail vein injection method. In a week, the levels of HBsAg, HBeAg, anti-HBs, anti-HBe, and anti-HBc were determined with time-resolved immunofluorometric assay (IFMA) kit, and the titers of HBV DNA were analyzed by fluorogenic quantitative polymerase chain reaction (FQ-PCR). In addition, viral specific proteins (HBsAg and HBcAg) in the liver were assayed by immunohistochemical staining.
RESULTS: A mouse model of acute HBV infection was developed successfully. HBsAg expression reached the peak on day 1, and dropped gradually. The level of HBeAg was low, and the level of anti-HBc, anti-HBe, and anti-HBs were first detected on day 4, 5 and 7, respectively. The titers of HBV DNA also peaked on day 1 and declined thereafter. HBsAg was positively scattered in the cytoplasm of hepatocytes, and HBcAg was mainly positively expressed in the cytoplasm of hepatocytes, too.
CONCLUSION: This is a novel and effective animal model of HBV infection, in which HBV can replicate and express stably.
- Citation: Ying RS, Fan XG, Li N, Zhu C, Liu HB. Development of a hepatitis B virus infection animal model by hydrodynamics. Shijie Huaren Xiaohua Zazhi 2006; 14(11): 1052-1057
- URL: https://www.wjgnet.com/1009-3079/full/v14/i11/1052.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i11.1052
据统计, 全球有3-3.5亿人感染乙型肝炎病毒(HBV), 每年约有100万人死于乙型肝炎及其并发症, 而我国则高达9.8%的人为HBV的慢性感染者. HBV的长期存在, 可以导致肝细胞持续损害和肝纤维化, 甚至发展为肝硬化、肝癌[1]. 抗HBV治疗, 阻断肝细胞内肝炎病毒的复制和表达, 仍是目前难题之一. HBV宿主范围狭窄, 且有明显嗜肝性, 建立合适的HBV动物模型非常困难. 目前缺乏理想的HBV模型是限制抗HBV药物发展的主要障碍之一. 我们拟建立一种简便有效HBV感染的动物模型, 观察该模型HBV标志物的表达情况.
BALB/c小鼠, ♀, 6-7 wk, 18-22 g, 购自中国科学院实验动物中心, 在中南大学湘雅医学院实验动物学部清洁级环境中饲养. 含1.3倍HBV全基因组(ayw亚型)真核表达质粒pcDNA3.1-HBV由重庆医科大学病毒性肝炎研究所黄爱龙教授惠赠. HBsAg, HBeAg, 抗HBs, 抗HBe, 抗HBc定量检测试剂盒(苏州新波生物技术有限公司); HBV DNA定量检测试剂盒(上海申友生物技术有限责任公司); 一抗兔抗HBs(英国Oxford公司), 一抗兔抗HBc(武汉博士德公司), PV-6001二步法免疫组化检测试剂盒(二抗山羊抗兔IgG抗体-HRP多聚体, 北京中杉金桥生物技术有限公司).
采用流体动力学方法[2-3]. pcDNA3.1-HBV 60 mg溶于1.8 mL林格注射液(147 mmol/L NaCl, 4 mmol/L KCl, 1.13 mmol/L CaCl2)中, 经45 mm头皮注射针尾静脉4 s内注射完毕, 保持稳定速度注射. 连续观察7 d, 每个时间点5只小鼠, 眼眶后静脉丛采血, 离心分离血清; 肝组织立即40 g/L中性甲醛固定. 同时观察仅注射1.8 mL林格注射液小鼠, 1, 3, 7 d取血分离血清, 肝组织固定. 血清中HBsAg, HBeAg, 抗HBs, 抗HBe, 抗HBc的检测利用时间分辨免疫荧光分析方法(IFMA), 具体方法见说明书. 检测仪器为时间分辨免疫荧光测定仪(美国WALLAC公司). HBV DNA的检测采用荧光定量PCR法(FQ-PCR). 血清中ALT和TBIL的检测采用日本完全自动生化分析仪HITACHI7170A. 肝组织HBsAg和HBcAg的检测采用二步法免疫组织化学方法并进行DAB染色, 苏木素复染, 兔抗HBs以1:200稀释, 兔抗HBc以1:40稀释, 具体方法见说明书. 用光镜检测肝组织中HBsAg和HBcAg, 每只动物取4块肝组织, 每块肝组织观察5个视野, 每个视野计数100个细胞中HBsAg和HBcAg阳性细胞数.
统计学处理 采用SPSS12.0统计分析软件. 所有数据结果用mean±SD表示. ALT和TBIL的测定结果采用t检验.
全部小鼠予流体动力学法注射后, 无1例发生死亡, 1只小鼠发生呼吸困难, 予直立数分钟后缓解. 所有小鼠大剂量溶液注射后, 活动减少, 数十分钟渐活动如常. 与正常对照组比较, 仅注射大剂量林格液后, 第1天ALT明显升高, 肝细胞功能受到损伤, 第3天ALT轻度升高, 肝细胞功能有所恢复, 至第7天完全恢复正常; 注射HBV质粒的小鼠, 第1天和第3天变化同单纯注射林格液组, 而第7天 ALT仍高于正常, 表明此时HBV使肝细胞功能受损, 而之前则由注射的大剂量溶液引起. 所有注射小鼠的TBIL一直保持正常(表1).
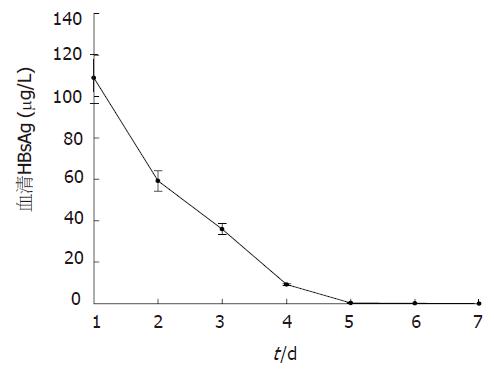
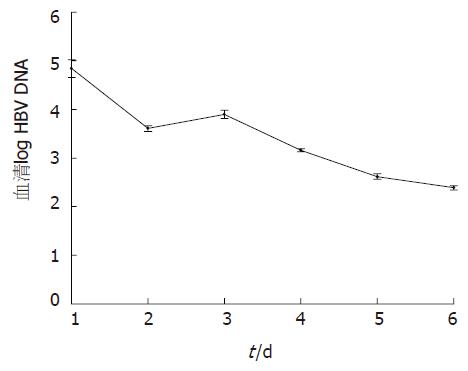
HBsAg在第1天表达达高峰, 为108.9±11.8 mg/L, 后逐渐降低至第7天为0. HBeAg表达量少甚至为0. 分别在第4天, 第5天, 第7天检测到抗HBc, 抗HBe和抗HBs, 抗HBc和抗HBe分别在第5天和第6天达高峰(图1, 表2). 血清HBV DNA滴度第1天亦达高峰, 为7.36×107±2.55×107 copies/L, d2降低, 第3天较d2稍高, 以后逐渐下降, 至第7天为0(图2).
| 抗体 | d 4 | d 5 | d 6 | d 7 |
| 抗HBc(kNCU/L) | 0.52±0.05 | 14.66±0.60 | 0.70±0.07 | 0.61±0.07 |
| 抗HBe(kNCU/L) | 0 | 0.61±0.05 | 1.31±0.09 | 0.68±0.08 |
| 抗HBs(IU/L) | 0 | 0 | 0 | 9.23±0.14 |
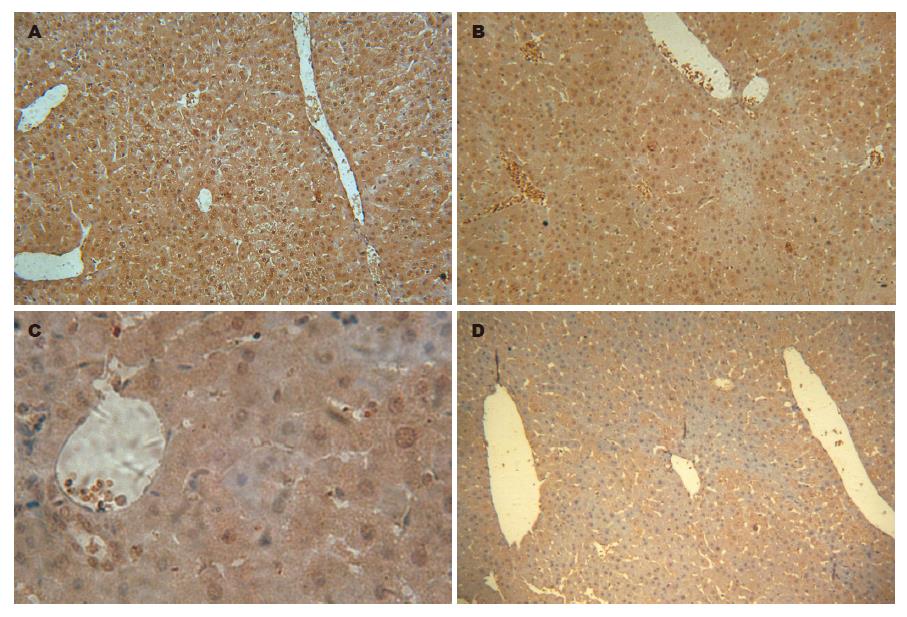
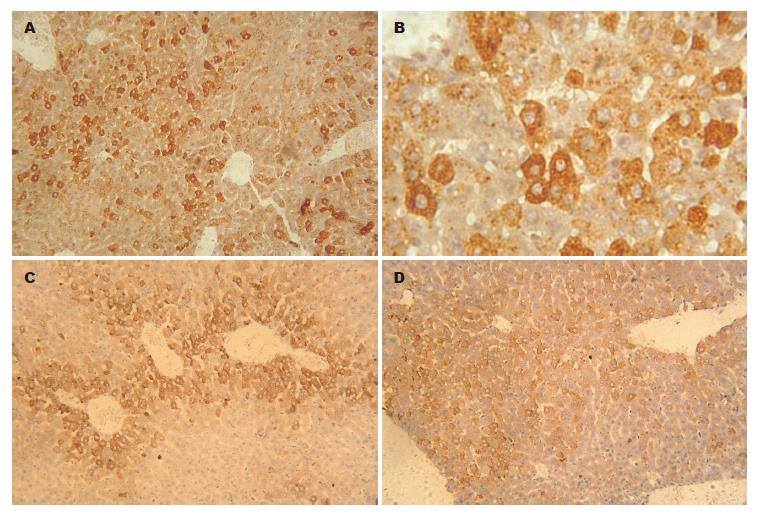
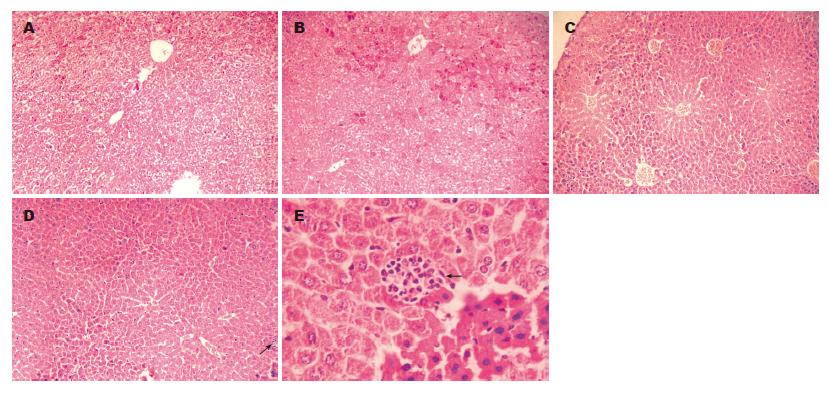
BALB/c小鼠注射质粒第1天, 第3天, 第7天, 均有HBsAg和HBcAg阳性细胞出现. HBsAg第1天表达最强, 呈胞质内弥漫性分布; HBcAg亦主要为胞质型分布(图3-4). 仅注射林格注射液小鼠第1天肝组织疏松, 肝细胞肿胀、空泡变性, 第3天肝组织开始修复, 出现一些再生肝细胞, 细胞核大而染色较深, 有的有双核, 至第7天肝组织基本复常; 注射HBV质粒小鼠肝组织第1天及第3天和上述小鼠类似, 而第7天出现炎性细胞浸润(图5箭头所示).
在人HBV动物模型中, HBV感染黑猩猩模型是很成功的[4], 亦得到公认. 但黑猩猩数量有限、来源困难、价格昂贵, 因此难以推广, 有必要寻找合适的人HBV感染的小动物模型. 而目前应用较多的人HBV转基因小鼠模型[5-10], 与其他已有的动物模型相比具有遗传背景清楚, 相对繁殖周期短, 对HBV单个或多个基因区的整合与表达及致病作用可分层次系统研究等特点. HBV转基因小鼠不仅可以研究HBV感染过程和感染后的免疫病理改变[11], 还有助于发展新的抗病毒治疗方法[12-13]. 但HBV转基因鼠存在一些缺陷, 如HBV是整合在宿主染色体上的, 没有经过和靶细胞受体结合穿透的过程, 与自然感染不同; 操作复杂, 整体费用高等. Liu et al[2-3]用流体动力学法(hydrodynamics)将单纯的未用病毒等载体包装的质粒DNA通过尾静脉注射入小鼠, 短时间内全身各检测器官外源基因均得到有效表达(1 wk内均有表达, 8 h达高峰), 其中肝组织外源基因表达产量最高. 这种方法的技术要点是注射的质粒DNA溶于大剂量生理溶液(约为小鼠体质量的8%-12%, 和整个小鼠的血容量相当), 并于短时间注射完毕(4-8 s). 流体动力学法的原理是快速注射的大剂量溶液量超过了心输出量, 因而溶液储积于上腔静脉, 随之产生高流体静脉压, 使得溶有质粒DNA的溶液较快流向全身各组织; 同时质粒DNA与血液的短时间接触避免了血液中的大量核酶的降解. 而肝脏是机体最大的脏器, 组织结构疏松易于扩张, 因而基因表达产物最丰富. 流体动力学法注射的是质粒DNA, 一般实验室能常规制备, 免除了载体方法转移基因所需的繁琐病毒载体准备、纯化及安全性等问题; 而以前采用的局部注射质粒DNA法, 需定点注射或外科手术[14-20], 并且基因表达产量不高, 因而流体动力学法是一种简便有效的外源基因转移方法, 可广泛用于研究基因功能、基因调节和蛋白表达等许多领域, 尤其对于嗜肝表达基因更显示出优越性.
Yang et al[21]采用流体动力学法注射HBV质粒, 成功构建了急性HBV感染的小鼠模型. 作者同时尾静脉注射pT-MCS-HBV1.3和促进基因整合的转座子质粒pCMV-SB. 注射后第1天, 肝组织各种转录本, 3.5, 2.4和2.1 kb表达达高峰, 伴随着血清中产生高滴度的HBsAg和HBeAg, 5.7%肝细胞HBcAg阳性, 此时肝组织病毒复制中间体(单链DNA)少. 到第4天, 病毒RNA大量减少, 血清中HBsAg和HBeAg的产量随之降低, 而病毒复制中间体(单链DNA)则相当丰富, 是3.5 kb转录本逆转录的结果. HBV RNA和DNA复制中间体的量从第4天到第7天维持稳定的水平, 血清中HBsAg和HBeAg在这期间逐渐减少至消失, 并依次出现了抗HBc、抗HBe和抗HBs(类似于人体HBV自然感染), 因而作者认为后期病毒抗原的减少是抗体出现即动物免疫反应的结果. 血清中HBV DNA在第1天未出现, 第3天约1.5×109 copies/L, 第6天量最多约8×109 copies/L, 而此后渐渐减少. Suzuki et al[22]用同样方法将1.5倍长度adw2亚型HBV基因组注射入5 wk BALB/c♀小鼠, 约3%的肝细胞表达HBcAg; HBV DNA在血液内持续1 wk, HBsAg持续2 wk, 随后可检测到表面抗体. 国内吴莹et al[23]亦用此法建立了急性HBV感染动物模型. 该模型的优点是: 方法简单易行, 各种乙肝标志物表达产量均较高; 区别于Guidotti[10]建立的HBV转基因模型的泛嗜性, 该模型HBV具有肝特异性; 该模型的许多特点类似于人体自然感染HBV的过程, 因而对于深入研究人体对HBV的免疫反应有重要帮助. 但该模型亦存在不足, 他是急性HBV感染的动物模型, 不能用来研究慢性HBV感染者, 另外, 这种小鼠肝组织内也不能测到HBV共价闭合环状DNA(covalently closed circular DNA, cccDNA).
本实验为国内较早采用流体动力学法进行外源基因转移. 尾静脉注射pcDNA3.1-HBV(未注射pCMV-SB), 注射后第1天, 血清中产生的HBsAg和HBV DNA达高峰, 肝细胞HBcAg阳性率远远大于Yang构建的小鼠模型, 平均达到75.0%, 同时观察了HBsAg表达情况, 其阳性率达到89.9%, 与Song et al[24]构建模型的外源基因在肝细胞表达率相似, 这与采用的动物种属、质粒种类等原因有关. 该模型HBeAg表达量少, 可能原因如下: 未同时注射转座子质粒pCMV-SB; Yang采用的真核表达质粒与pcDNA3.1相比能较好促进HBeAg在动物体内表达; 实验动物不同等. 与Yang的模型类似, 随着时间的延长, 血清中的HBsAg逐渐减少至消失, 依次出现了抗HBc, 抗HBe和抗HBs, 但HBV DNA并没有逐渐升高而是降低的, 可能与仅注射HBV质粒有关. 肝细胞HBcAg阳性率在第3天和第7天分别为50.1%和31.8%, 并且可明显观察到HBcAg的分布从第1天小叶周边转向第3天小叶中央静脉周围; HBsAg阳性率在第3天和第7天也很高, 分别为80.0%和59.8%. 并且从第7天开始, 肝组织也出现炎性细胞浸润. 总之, 该模型HBsAg表达丰富; 虽然血清HBeAg表达量低, 但血清HBV DNA滴度较高, 肝组织HBcAg表达丰富, 能较好反应HBV复制水平. 因而, 我们成功构建了一种简便、有效、稳定的HBV感染动物模型, 为进一步研究RNA干扰[25-26]动物体内抗HBV打下坚实的基础.
抗HBV治疗仍是目前难题之一. HBV宿主范围狭窄, 且有明显嗜肝性, 建立合适的HBV动物模型非常困难. 目前缺乏理想的HBV模型是限制抗HBV药物发展的主要障碍之一.
研究者试图寻找合适的人HBV感染的小动物模型. 小干扰RNA抗HBV的作用被越来越多的学者所重视, 但由于HBV动物模型受到限制, 其研究多限于细胞实验研究. 国外已有学者采用流体动力学方法建立HBV感染动物模型, 研究小干扰RNA在此模型中的抗HBV作用.
尝试采用流体动力学法仅注射HBV质粒(国外学者同时注射转座子质粒)即能有效、稳定地表达大部分HBV标志物.
该模型的优点是: 方法简单易行, 各种乙肝标志物表达产量均较高; 该模型HBV具有肝特异性; 该模型的许多特点类似于人体自然感染HBV的过程, 因而对于深入研究人体对HBV的免疫反应有重要帮助. 但该模型亦存在不足, 他是急性HBV感染的动物模型, 不能用来研究慢性HBV感染者, 或许可采用使动物暂时免疫抑制等方法, 诱导慢性或持续性HBV携带状态.
流体动力学法(hydrodynamics): 指将单纯的未用病毒等载体包装的质粒DNA通过尾静脉注射入动物, 短时间内全身各检测器官外源基因均得到有效表达(1 wk内均有表达, 8 h达高峰), 其中肝组织外源基因表达产量最高. 其原理是快速注射的大剂量溶液量超过了心输出量, 产生高流体静脉压, 使得溶有质粒DNA的溶液较快流向全身各组织; 同时质粒DNA与血液的短时间接触避免了血液中的大量核酶的降解. 而肝脏是机体最大的脏器, 组织结构疏松易于扩张, 因而基因表达产物最丰富.
编辑: 潘伯荣 电编:张敏
| 2. | Liu F, Song Y, Liu D. Hydrodynamics-based trans-fection in animals by systemic administration of plasmid DNA. Gene Ther. 1999;6:1258-1266. [PubMed] |
| 3. | Zhang G, Budker V, Wolff JA. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Hum Gene Ther. 1999;10:1735-1737. [PubMed] |
| 4. | Wieland SF, Spangenberg HC, Thimme R, Purcell RH, Chisari FV. Expansion and contraction of the hepatitis B virus transcriptional template in infected chimpanzees. Proc Natl Acad Sci USA. 2004;101:2129-2134. [PubMed] |
| 5. | Chisari FV. Hepatitis B virus transgenic mice: insights into the virus and the disease. Hepatology. 1995;22:1316-1325. [PubMed] |
| 6. | Wirth S, Guidotti LG, Ando K, Schlicht HJ, Chisari FV. Breaking tolerance leads to autoantibody production but not autoimmune liver disease in hepatitis B virus envelope transgenic mice. J Immunol. 1995;154:2504-2515. [PubMed] |
| 7. | Guidotti LG, Matzke B, Schaller H, Chisari FV. High-level hepatitis B virus replication in transgenic mice. J Virol. 1995;69:6158-6169. [PubMed] |
| 8. | Huang SN, Chisari FV. Strong, sustained hepatocell-ular proliferation precedes hepatocarcinogenesis in hepatitis B surface antigen transgenic mice. Hepatology. 1995;21:620-626. [PubMed] |
| 9. | Moriya K, Matsukura M, Kurokawa K, Koike K. In vivo inhibition of hepatitis B virus gene expression by antisense phosphorothioate oligonucleotides. Biochem Biophys Res Commun. 1996;218:217-223. [PubMed] |
| 10. | Guidotti LG, Matzke B, Chisari FV. Hepatitis B virus replication is cell cycle independent during liver regeneration in transgenic mice. J Virol. 1997;71:4804-4808. [PubMed] |
| 11. | Walter E, Keist R, Niederost B, Pult I, Blum HE. Hepatitis B virus infection of tupaia hepatocytes in vitro and in vivo. Hepatology. 1996;24:1-5. [PubMed] |
| 12. | Julander JG, Sidwell RW, Morrey JD. Characterizing antiviral activity of adefovir dipivoxil in transgenic mice expressing hepatitis B virus. Antiviral Res. 2002;55:27-40. [PubMed] |
| 13. | Julander JG, Colonno RJ, Sidwell RW, Morrey JD. Characterization of antiviral activity of entecavir in transgenic mice expressing hepatitis B virus. Antiviral Res. 2003;59:155-161. [PubMed] |
| 14. | Wolff JA, Malone RW, Williams P, Chong W, Acsadi G, Jani A, Felgner PL. Direct gene transfer into mouse muscle in vivo. Science. 1990;247:1465-1468. [PubMed] |
| 15. | Hickman MA, Malone RW, Lehmann-Bruinsma K, Sih TR, Knoell D, Szoka FC, Walzem R, Carlson DM, Powell JS. Gene expression following direct injection of DNA into liver. Hum Gene Ther. 1994;5:1477-1483. [PubMed] |
| 16. | Zhang G, Vargo D, Budker V, Armstrong N, Knechtle S, Wolff JA. Expression of naked plasmid DNA injected into the afferent and efferent vessels of rodent and dog livers. Hum Gene Ther. 1997;8:1763-1772. [PubMed] |
| 17. | Budker V, Zhang G, Knechtle S, Wolff JA. Naked DNA delivered intraportally expresses efficiently in hepatocytes. Gene Ther. 1996;3:593-598. [PubMed] |
| 18. | Meyer KB, Thompson MM, Levy MY, Barron LG, Szoka FC Jr. Intratracheal gene delivery to the mouse airway: characterization of plasmid DNA expression and pharmacokinetics. Gene Ther. 1995;2:450-460. [PubMed] |
| 19. | Li K, Welikson RE, Vikstrom KL, Leinwand LA. Direct gene transfer into the mouse heart. J Mol Cell Cardiol. 1997;29:1499-1504. [PubMed] |
| 20. | Choate KA, Khavari PA. Direct cutaneous gene delivery in a human genetic skin disease. Hum Gene Ther. 1997;8:1659-1665. [PubMed] |
| 21. | Yang PL, Althage A, Chung J, Chisari FV. Hydrody-namic injection of viral DNA: a mouse model of acute hepatitis B virus infection. Proc Natl Acad Sci USA. 2002;99:13825-13830. [PubMed] |
| 22. | Suzuki T, Takehara T, Ohkawa K, Ishida H, Jinushi M, Miyagi T, Sasaki Y, Hayashi N. Intravenous injection of naked plasmid DNA encoding hepatitis B virus (HBV) produces HBV and induces humoral immune response in mice. Biochem Biophys Res Commun. 2003;300:784-788. [PubMed] |