修回日期: 2005-12-22
接受日期: 2005-12-31
在线出版日期: 2006-04-08
大豆及其加工制品不仅是人类植物性蛋白食品的主要来源, 更是畜禽饲料蛋白质的首要来源. 目前, 一方面我国是饲料蛋白资源严重短缺的国家, 年大豆需求量的60%以上依赖于进口; 另一方面大豆中的一些抗营养因子和活性物质的存在方式(如以糖甙形式存在的大豆异黄酮)却不利于动物的消化吸收, 难以发挥其调节宿主生理功能的作用. 因此, 对这些抗营养因子进行转化从而提高大豆及其加工制品的营养价值已经成为共识, 尤其是分离筛选针对不同抗营养因子的特异降解细菌日渐受到研究者的关注. 本文综述了大豆异黄酮的种类、化学结构及其在动物生理中的特殊作用, 尤其是肠道细菌在大豆异黄酮代谢中的关键作用以及目前降解大豆异黄酮细菌菌株的分离筛选情况.
引文著录: 张逊, 姚文, 朱伟云. 肠道大豆异黄酮降解菌研究进展. 世界华人消化杂志 2006; 14(10): 973-978
Revised: December 22, 2005
Accepted: December 31, 2005
Published online: April 8, 2006
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2006; 14(10): 973-978
- URL: https://www.wjgnet.com/1009-3079/full/v14/i10/973.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i10.973
哺乳动物的食物中有很多天然成分不能被动物自身消化酶降解, 但却能被其消化道中的微生物利用. 这些成分不仅可以刺激其降解菌的生长, 使其降解菌成为肠道中的优势菌群, 而且其代谢产物还具有多种生物活性, 对哺乳动物的健康和生长有良好的促进作用. 大豆异黄酮就是这类天然活性物质中的一种. 目前, 在人类健康食谱中, 豆制品是不可或缺的组成部分; 而在动物生产上, 大豆及其加工制品是蛋白质饲料的主要来源. 因此研究哺乳动物肠道细菌对大豆异黄酮的降解机制, 筛选高效的大豆异黄酮降解菌, 可以充分发挥大豆中天然大豆异黄酮的保健和促生长功能, 从而提升大豆及大豆制品的经济附加值.
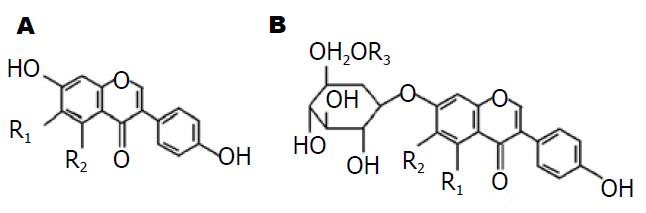
大豆异黄酮是大豆及其加工制品中存在的一类异黄酮类植物雌激素(soybean isoflavones)(图1, 表1), 其中含量占优势的是大豆黄酮和染料木素两种. 这些异黄酮类化合物在天然大豆中的主要存在方式为结合了糖基的糖苷大豆异黄酮, 即糖苷大豆黄酮(daidzin)和糖苷染料木素(genistin).
| 异黄酮种类 | 名称 | R1 | R2 | R3 |
| 游离型苷元 | daidzein | H | H | - |
| glycilein | OCH3 | H | - | |
| genistein | H | OH | - | |
| 结合型糖苷 | daidzin | H | H | H |
| glycilin | H | OCH3 | H | |
| genistin | OH | H | H | |
| 6''-o-acelyldaidzin | H | H | COCH3 | |
| 6''-o-acelylglycilin | H | OCH3 | COCH3 | |
| 6''-o-acelylgenistin | OH | H | COCH3 | |
| 6''-o-malonyldaidzin | H | H | COCH2COOH | |
| 6''-o-malonylglycilin | H | OCH3 | COCH2COOH | |
| 6''-o-malonylgenistin | OH | H | COCH2COOH | |
| 6''-o-succinyldaidzin | H | H | COCH2CH2COOH | |
| 6''-o-succinylglycilin | H | OCH3 | COCH2CH2COOH | |
| 6''-o-succinylgenistin | OH | H | COCH2CH2COOH |
在植物中, 糖苷大豆异黄酮是植物吸引固氮菌的信号传递分子[1]. 在哺乳动物体内, 糖苷形式的大豆异黄酮没有生理活性, 而去除糖基配体后形成的大豆黄酮苷元(daidzein)和染料木素苷元(genistein)及其代谢产物均是弱雌激素样活性物质(图2), 当体内雌激素水平较低时他们可以直接与细胞膜上的雌激素受体结合表现出弱雌激素活性, 而当体内雌激素水平较高时则又可以与内源雌激素竞争受体表现出抗雌激素活性[2].
大豆异黄酮具有多种生物学功能, 从1980年起, 大量医学研究表明, 大豆异黄酮除与雌激素受体结合, 从而有效地预防骨质疏松、乳腺癌、子宫内膜癌外, 还能与雄激素受体结合减少前列腺癌的发生, 并具有抗氧化活性、抗溶血活性和抗真菌活性等[3-5]. 在动物生产上, 国内外大量研究表明大豆异黄酮可以促进雄性动物生长, 增强机体免疫, 改善动物产品品质, 提高生产性能[6-12].
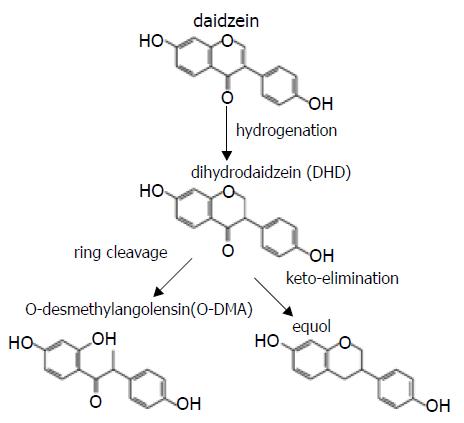
摄入哺乳动物体内的糖苷形式的大豆异黄酮, 不能直接经小肠壁吸收. 有少量的糖苷形式的大豆异黄酮可在小肠中被水解去除糖基, 游离苷元可被小肠吸收. 未吸收的大豆异黄酮可被肠道细菌降解, 高压液相色谱分析结果表明, 极少数的大豆黄酮苷元可以直接被胃肠黏膜吸收, 约5%-20%大豆黄酮苷元受微生物作用开环形成O-脱甲基安哥拉紫檀素(O-demethylangolensin, O-DMA); 约70%的大豆黄酮苷元被微生物还原为双氢大豆黄酮苷元(dihydrodaidzein, DHD), 最后形成稳定的雌马酚(equol)被胃肠黏膜吸收[13-20]. 雌马酚只能由肠道细菌特异性产生[21-22], 与大豆黄酮苷元相比, 雌马酚与雌激素受体结合的亲和力、抗氧化活性、抗前列腺癌作用更强[23-30], 而在血浆中的清除速度更慢[31]. 因此大豆异黄酮的生物活性更多的是由其代谢终产物雌马酚来实现的.
对无菌动物和抗生素处理动物的研究表明, 结肠细菌在大豆异黄酮的体内代谢过程中起着关键性的作用[19-22]. 动物肠道内的真杆菌属(Eubacterium)[32], 丁酸梭菌属(Butyrivibrio)[33], 乳酸杆菌属(Lactobacillus)[34]和梭菌属(Clost-ridium)[35]的一些细菌在大豆黄酮苷元(Daidzein)的降解过程中起着重要作用, 其中对一些人粪源菌株已经进行了分离鉴定.
大豆异黄酮降解菌中研究较为系统的是真杆菌属. 九十年代以来, 德国Blaut领导的小组系统研究报道了一株来自人的真杆菌Eubacterium ramulus可在体外彻底降解染料木素和部分降解大豆黄酮[36-41], 并且根据该菌的16S rRNA全序列设计了用于检测该菌的寡核苷酸探针, 并应用此探针研究了Eubacterium ramulus在人肠道中的分布情况, 以及食物中的大豆异黄酮对人肠道中Eubacterium ramulus的刺激作用. 结果表明, 人肠道来源的Eubacterium ramulus能够降解大豆异黄酮, 大豆异黄酮也能刺激人肠道固有Eubacterium ramulus的生长, 但是外源Eubacterium ramulus在人肠道内能否存活、存活规律及其作用机制等的研究仍十分匮乏.
最新研究表明不同人体内大豆异黄酮降解菌的组成有很大差异, 仅有1/3至1/2的被调查个体能将大豆异黄酮降解为雌马酚[19,42-48]. 目前人用的大豆异黄酮制品都为豆科植物来源的纯提取物, 不仅得率低、价格昂贵, 而且可能正是由于不同人群体内大豆异黄酮降解菌组成的差异导致了临床应用效果的差异, 限制了大豆异黄酮制品的应用. 因此对肠道大豆异黄酮降解菌的研究不仅可阐明大豆异黄酮在体内降解和发挥生理作用的形式及过程, 而且可为拓展大豆异黄酮可应用人群乃至应用方式提供新的思路和方法.
大豆及其加工产品不仅是人类植物性蛋白食品的主要来源, 更是家畜的首要蛋白质饲料来源. 我国目前人畜所需的大豆已不能自给, 据中国海关公布的数据, 2003年中国进口大豆达到2074万吨, 年大豆需求量的60%以上依赖于进口. 一方面畜牧业对大豆的依赖愈来愈强, 另一方面大豆中的一些抗营养因子和活性物质的存在方式(如大豆异黄酮以糖甙形式存在)却不利于动物的消化吸收, 不利于发挥其调节宿主动物功能的作用. 因此预处理大豆(如发酵等)以提高大豆的利用效率已成共识, 但目前大豆发酵所用菌株多为青贮用乳酸菌, 对改善适口性有帮助, 但就提高大豆发酵产品品质和动物利用效率方面意义不大. 因此研究动物肠道大豆异黄酮降解菌对提高大豆发酵产品品质及其经济附加值, 对改善宿主动物健康、提高其生产性能等均有着显著的意义, 而目前这方面的研究相对于人肠道大豆异黄酮降解菌而言几乎是空白. 我们近年来在这方面做了一些探索性的研究, Yao et al[49]体外初步研究了大豆黄酮对哺乳仔猪肠道乳酸杆菌菌群结构及其乳酸产生能力的影响. 结果表明大豆黄酮没有改变体外培养条件下哺乳仔猪乳酸杆菌菌群结构, 但显著增加了培养体系中乳酸杆菌的数量, 并显著提高了培养体系中乳酸的浓度. 这说明在哺乳仔猪肠道内存在着能被大豆黄酮刺激生长的乳酸杆菌菌株, 其机制有待进一步研究.
在肠道大豆异黄酮降解菌菌株的筛选方面, 韩国光州科学研究院的的Hor-Gil Hur和比利时根特大学的Karel Decroos领导的团队各自做了较系统的研究. Hur et al[50]通过对人粪样中细菌进行分离培养, 发现大肠杆菌HGH21和革兰氏阳性菌株HGH6可将糖苷大豆黄酮和糖苷染料木素降解为糖基配体, 大豆黄酮苷元和染料木素苷元. 在厌氧条件下, HGH6可以进一步将大豆黄酮苷元和染料木素苷元转化为双氢大豆黄酮苷元和双氢染料木素苷元. HGH6可以将异黄酮C-2和C-3之间的双键转化为单键, 但却无法转化黄酮类物质apigenin和chrysin中相似的键. HGH6也不能进一步的转化双氢大豆黄酮苷元和双氢染料木素苷元. Hur et al[51]的进一步研究发现一株命名为HGH136的革兰氏阳性厌氧细菌, 可以将大豆黄酮苷元的C-环切除以产生O-DMA, 经分离鉴定属于梭菌属. Wang et al[52]从人粪样中分离出的一株棒状革兰氏阳性厌氧细菌(命名为Julong732), 具有在厌氧条件下将双氢大豆黄酮苷元转化为S-雌马酚的能力. 但其不能从大豆黄酮苷元、四氢大豆黄酮苷元或脱氢雌马酚直接转化成雌马酚. 推测该菌应该是在双氢大豆黄酮苷元的厌氧代谢中起作用, 但在含双氢大豆黄酮苷元的细菌培养物中却检测不到. 在含有外消旋混合双氢大豆黄酮苷元的细菌培养基中使用手性固定相高效液相色谱只能洗提出一种代谢产物, S-雌马酚. 另外Julong732不具有能将R-雌马酚转化为S-雌马酚(或反向转化)的消旋酶. 通过测序比对发现, Julong732的全16S rRNA基因序列(1429 bp)与Eggerthella hongkongenis HKU10具有92.8%的相似性. Decroos et al[34]以四位志愿者的粪样为接种物, 体外研究人粪源微生物降解大豆黄酮苷元的情况. 结果表明仅两位志愿者的粪源微生物具有降解大豆黄酮苷元的能力, 终产物分别为双氢大豆黄酮苷元和O-DMA, 双氢大豆黄酮苷元和雌马酚. 分子指纹分析技术(DGGE)研究表明其中只有三株细菌可以被纯培养, 分别是黏膜乳杆菌EPI2, 粪链球菌EPI1, Finegoldia magna EPI3, 但这些细菌在纯培养中不能产生雌马酚. 结果同时表明氢气以及丁酸、丙酸等结肠中碳水化合物的微生物发酵终产物可以提高混合培养中雌马酚的产量; 而添加果寡糖后, 雌马酚的产生被抑制; 当把该混合培养物接种到原来不能产生雌马酚个体的粪样中时, 可以在培养物中检测到雌马酚.
通过以上的研究表明, 在体内糖苷大豆黄酮首先被b-葡萄糖苷酶作用去除糖基生成大豆黄酮苷元(第一步), 大豆黄酮苷元进一步的代谢途径如图3所示, 先加氢形成双氢大豆黄酮苷元(第二步), 然后通过C-环开环形成O-DMA(第三步A)或是通过去酮形成雌马酚(第三步B).
在已经进行的菌株分离尝试中, 分离出了特异单菌株可以完成第一步(HGH21, HGH6), 第二步(HGH6), 第三步A(HGH136), 第三步B(Julong732). 而Decroos et al[34]报道中的混合菌株可以分别完成第二步+第三步A或第二步+第三步B的过程.
总之, 大豆异黄酮降解菌对大豆异黄酮在宿主体内的降解和利用起着关键的作用, 那么在体内进行大豆异黄酮降解过程是否必须是混合菌株? 从进化的角度考虑应是如此, 各种细菌在动物肠道中形成流动但相对稳定的微生态体系, 能够最大程度地利用彼此的代谢产物完成自己的生理过程, 形成共栖关系. 但并不能排除有单一菌株能够完成从糖苷大豆黄酮生成雌马酚的整个过程这种可能, 这需要进一步通过菌株筛选实验来验证. 同时目前已分离到的大豆异黄酮降解菌大多来源于人肠道, 研究也大多停留在体外阶段. 在体条件下大豆异黄酮降解菌如何协同作用, 以及在其他动物肠道的分布及作用等方面的研究几乎还是空白, 有待于进一步的研究.
大豆及其加工制品不仅是人类植物性蛋白食品的主要来源, 更是畜禽饲料蛋白质的首要来源. 目前, 一方面我国是饲料蛋白资源严重短缺的国家, 年大豆需求量的60%以上依赖于进口; 另一方面大豆中的一些抗营养因子和活性物质的存在方式(如以糖甙形式存在的大豆异黄酮)却不利于动物的消化吸收, 难以发挥其调节宿主生理功能的作用. 因此, 采用一定的技术手段对这些抗营养因子进行转化从而提高大豆及其加工制品的营养价值已经成为共识. 近来筛选针对不同抗营养因子的特异降解细菌备受研究者的关注.
研究动物肠道大豆异黄酮降解菌对提高大豆发酵产品品质及其经济附加值, 对改善宿主动物健康、提高其生产性能等均有着显著的意义. 目前已分离到的大豆异黄酮降解菌大多来源于人肠道, 研究也大多停留在体外阶段. 在体条件下大豆异黄酮降解菌如何作用, 相应细菌在其他动物肠道的分布及作用等方面的研究几乎还是空白.
2000年, Hur et al通过对人粪样中细菌进行分离培养, 发现大肠杆菌HGH21和革兰氏阳性菌株HGH6可将糖苷大豆黄酮和糖苷染料木素降解为糖基配体, 大豆黄酮苷元和染料木素苷元. 在厌氧条件下, HGH6可以进一步将大豆黄酮苷元和染料木素苷元转化为双氢大豆黄酮苷元和双氢染料木素苷元.
2005年, Wang et al从人粪样中分离出的一株棒状革兰氏阳性厌氧细菌(命名为Julong732), 具有在厌氧条件下将双氢大豆黄酮苷元转化为S-雌马酚的能力. 2005年, Decroos et al以人粪样为接种物, 分离出的粪源微生物具有降解大豆黄酮苷元的能力, 终产物分别为双氢大豆黄酮苷元和O-DMA, 双氢大豆黄酮苷元和雌马酚.
本文综述了目前世界范围内分离筛选肠道大豆异黄酮降解菌的进展情况. 已分离到的大豆异黄酮降解菌大多来源于人肠道, 研究也大多停留在体外阶段. 在体条件下大豆异黄酮降解菌如何作用以及大豆异黄酮降解菌在其他动物肠道的分布和作用等方面的研究几乎还是空白.
大豆异黄酮(soy-bean isoflavones): 大豆及其加工制品中存在的一类异黄酮类植物雌激素, 其中含量占优势的是大豆黄酮和染料木素两种. 这些异黄酮类化合物在天然大豆中的主要存在方式为结合了糖基的糖苷大豆异黄酮, 即糖苷大豆黄酮(daidzin)和糖苷染料木素(genistin)
电编: 韩江燕 编辑:张海宁
| 1. | Debelle F, Moulin L, Mangin B, Denarie J, Boivin C. Nod genes and Nod signals and the evolution of the Rhizobium legume symbiosis. Acta Biochim Pol. 2001;48:359-365. [PubMed] |
| 2. | Murkies AL, Wilcox G, Davis SR. Clinical review 92: Phytoestrogens. J Clin Endocrinol Metab. 1998;83:297-303. [PubMed] |
| 3. | Harborne JB, Williams CA. Advances in flavonoid research since 1992. Phytochemistry. 2000;55:481-504. [PubMed] [DOI] |
| 4. | Beck V, Rohr U, Jungbauer A. Phytoestrogens deri-ved from red clover: an alternative to estrogen replacement therapy? J Steroid Biochem Mol Biol. 2005;94:499-518. [PubMed] [DOI] |
| 5. | Magee PJ, Rowland IR. Phyto-oestrogens, their mechanism of action: current evidence for a role in breast and prostate cancer. Br J Nutr. 2004;91:513-531. [PubMed] [DOI] |
| 8. | Payne RL, Bidner TD, Southern LL, Geaghan JP. Effects of dietary soy isoflavones on growth, carcass traits, and meat quality in growing-fini-shing pigs. J Anim Sci. 2001;79:1230-1239. [PubMed] [DOI] |
| 9. | Zarkadas LN, Wiseman J. Influence of processing of full fat soya beans included in diets for piglets. I. Performance. Animal Feed Science and Technology. 2005;118:109-119. [DOI] |
| 10. | Zarkadas LN, Wiseman J. Influence of processing of full fat soya beans included in diets for piglets. II. Digestibility and intestinal morphology. Animal Feed Science and Technology. 2005;118:121-137. [DOI] |
| 11. | Greiner LL, Stahly TS, Stabel TJ. The effect of dietary soy genistein on pig growth and viral rep-lication during a viral challenge. J Anim Sci. 2001;79:1272-1279. [PubMed] [DOI] |
| 12. | Greiner LL, Stahly TS, Stabel TJ. The effect of dietary soy daidzein on pig growth and viral repli-cation during a viral challenge. J Anim Sci. 2001;79:3113-3119. [PubMed] [DOI] |
| 13. | Cassidy A, Brown JE, Hawdon A, Faughnan MS, King LJ, Millward J, Zimmer-Nechemias L, Wolfe B, Setchell KD. Factors affecting the bioavailability of soy isoflavones in humans after ingestion of physiologically relevant levels from different soy foods. J Nutr. 2006;136:45-51. [PubMed] |
| 14. | Day AJ, Canada FJ, Diaz JC, Kroon PA, Mclauchlan R, Faulds CB, Plumb GW, Morgan MR, Williamson G. Dietary flavonoid and isoflavone glycosides are hydrolysed by the lactase site of lactase phlorizin hydrolase. FEBS Lett. 2000;468:166-170. [PubMed] [DOI] |
| 15. | Joannou GE, Kelly GE, Reeder AY, Waring M, Nelson C. A urinary profile study of dietary phytoestrogens. The identification and mode of metabolism of new isoflavonoids. J Steroid Biochem Mol Biol. 1995;54:167-184. [PubMed] [DOI] |
| 16. | Heinonen S, Wahala K, Adlercreutz H. Identifi-cation of isoflavone metabolites dihydro-daidzein, dihydrogenistein, 6'-OH-O-dma, and cis-4-OH-equol in human urine by gas chroma-tography-mass spectroscopy using authentic reference compounds. Anal Biochem. 1999;274:211-219. [PubMed] [DOI] |
| 17. | Setchell KD, Brown NM, Zimmer-Nechemias L, Brashear WT, Wolfe BE, Kirschner AS, Heubi JE. Evidence for lack of absorption of soy isoflavone glycosides in humans, supporting the crucial role of intestinal metabolism for bioavailability. Am J Clin Nutr. 2002;76:447-453. [PubMed] |
| 18. | Day AJ, DuPont MS, Ridley S, Rhodes M, Rhodes MJ, Morgan MR, Williamson G. Deglycosylation of flavonoid and isoflavonoid glycosides by human small intestine and liver beta-glucosidase activity. FEBS Lett. 1998;436:71-75. [PubMed] [DOI] |
| 19. | Rafii F, Davis C, Park M, Heinze TM, Beger RD. Variations in metabolism of the soy isoflavonoid daidzein by human intestinal microfloras from different individuals. Arch Microbiol. 2003;180:11-16. [PubMed] [DOI] |
| 20. | Rafii F, Hotchkiss C, Heinze TM, Park M. Meta-bolism of daidzein by intestinal bacteria from rhesus monkeys (Macaca mulatta). Comp Med. 2004;54:165-169. [PubMed] |
| 21. | Bowey E, Adlercreutz H, Rowland I. Metabolism of isoflavones and lignans by the gut microflora: a study in germ-free and human flora associated rats. Food Chem Toxicol. 2003;41:631-636. [PubMed] [DOI] |
| 22. | Rowland I, Wiseman H, Sanders T, Adlercreutz H, Bowey E. Metabolism of oestrogens and phytoes-trogens: role of the gut microflora. Biochem Soc Trans. 1999;27:304-308. [PubMed] [DOI] |
| 23. | Kostelac D, Rechkemmer G, Briviba K. Phytoes-trogens modulate binding response of estrogen receptors alpha and beta to the estrogen response element. J Agric Food Chem. 2003;51:7632-7635. [PubMed] [DOI] |
| 24. | Muthyala RS, Ju YH, Sheng S, Williams LD, Doerge DR, Katzenellenbogen BS, Helferich WG, Katzenellenbogen JA. Equol, a natural estrogenic metabolite from soy isoflavones: convenient prepa-ration and resolution of R- and S-equols and their differing binding and biological activity through estrogen receptors alpha and beta. Bioorg Med Chem. 2004;12:1559-1567. [PubMed] [DOI] |
| 25. | Mitchell JH, Gardner PT, McPhail DB, Morrice PC, Collins AR, Duthie GG. Antioxidant efficacy of phytoestrogens in chemical and biological model systems. Arch Biochem Biophys. 1998;360:142-148. [PubMed] [DOI] |
| 26. | Brown NM, Setchell KD. Animal models impac-ted by phytoestrogens in commercial chow: impli-cations for pathways influenced by hormones. Lab Invest. 2001;81:735-747. [PubMed] [DOI] |
| 27. | Morito K, Hirose T, Kinjo J, Hirakawa T, Okawa M, Nohara T, Ogawa S, Inoue S, Muramatsu M, Masamune Y. Interaction of phytoestrogens with estrogen receptors alpha and beta. Biol Pharm Bull. 2001;24:351-356. [PubMed] [DOI] |
| 28. | Morito K, Aomori T, Hirose T, Kinjo J, Hasegawa J, Ogawa S, Inoue S, Muramatsu M, Masamune Y. Interaction of phytoestrogens with estrogen receptors alpha and beta (II). Biol Pharm Bull. 2002;25:48-52. [PubMed] [DOI] |
| 29. | Hodgson JM, Croft KD, Puddey IB, Mori TA, Beilin LJ. Soybean isoflavonoids and their metabolic products inhibit in vitro lipo-protein oxidation in serum. J Nutr Biochem. 1996;7:664-669. [DOI] |
| 30. | Arora A, Nair MG, Strasburg GM. Antioxidant activities of isoflavones and their biological meta-bolites in a liposomal system. Arch Biochem Biophys. 1998;356:133-141. [PubMed] [DOI] |
| 31. | Setchell KD, Brown NM, Lydeking-Olsen E. The clinical importance of the metabolite equol-a clue to the effectiveness of soy and its isoflavones. J Nutr. 2002;132:3577-3584. [PubMed] |
| 32. | Schneider H, Schwiertz A, Collins MD, Blaut M. Anaerobic transformation of quercetin-3-glucoside by bacteria from the human intestinal tract. Arch Microbiol. 1999;171:81-91. [PubMed] [DOI] |
| 33. | Krishnamurty HG, Cheng KJ, Jones GA, Simpson FJ, Watkin JE. Identification of products produced by the anaerobic degradation of rutin and related flavonoids by Butyrivibrio sp. C3. Can J Microbiol. 1970;16:759-767. [PubMed] [DOI] |
| 34. | Decroos K, Vanhemmens S, Cattoir S, Boon N, Verstraete W. Isolation and characterisation of an equol-producing mixed microbial culture from a human faecal sample and its activity under gastrointestinal conditions. Arch Microbiol. 2005;183:45-55. [PubMed] [DOI] |
| 35. | Schoefer L, Mohan R, Schwiertz A, Braune A, Blaut M. Anaerobic degradation of flavonoids by Clostridium orbiscindens. Appl Environ Microbiol. 2003;69:5849-5854. [PubMed] [DOI] |
| 36. | Schneider H, Blaut M. Anaerobic degradation of flavonoids by Eubacterium ramulus. Arch Microbiol. 2000;173:71-75. [PubMed] [DOI] |
| 37. | Schneider H, Simmering R, Hartmann L, Pforte H, Blaut M. Degradation of quercetin-3-glucoside in gnotobiotic rats associated with human intestinal bacteria. J Appl Microbiol. 2000;89:1027-1037. [PubMed] [DOI] |
| 38. | Schoefer L, Braune A, Blaut M. A fluorescence quenching test for the detection of flavonoid trans-formation. FEMS Microbiol Lett. 2001;204:277-280. [PubMed] [DOI] |
| 39. | Schoefer L, Mohan R, Braune A, Birringer M, Blaut M. Anaerobic C-ring cleavage of genistein and daidzein by Eubacterium ramulus. FEMS Microbiol Lett. 2002;208:197-202. [PubMed] [DOI] |
| 40. | Simmering R, Kleessen B, Blaut M. Quantification of the flavonoid-degrading bacterium Eubacterium ramulus in human fecal samples with a species-specific oligonucleotide hybridization probe. Appl Environ Microbiol. 1999;65:3705-3709. [PubMed] |
| 41. | Simmering R, Pforte H, Jacobasch G, Blaut M. The growth of the flavonoid-degrading intestinal bacterium, Eubacterium ramulus, is stimulated by dietary flavonoids in vivo. FEMS Microbiology Ecology. 2002;40:243-248. [PubMed] [DOI] |
| 42. | Kelly GE, Joannou GE, Reeder AY, Nelson C, Waring MA. The variable metabolic response to dietary isoflavones in humans. Proc Soc Exp Biol Med. 1995;208:40-43. [PubMed] [DOI] |
| 43. | Karr SC, Lampe JW, Hutchins AM, Slavin JL. Urinary isoflavonoid excretion in humans is dose dependent at low to moderate levels of soy-protein consumption. Am J Clin Nutr. 1997;66:46-51. [PubMed] |
| 44. | Lampe JW, Karr SC, Hutchins AM, Slavin JL. Urinary equol excretion with a soy challenge: influence of habitual diet. Proc Soc Exp Biol Med. 1998;217:335-339. [PubMed] [DOI] |
| 45. | Rowland IR, Wiseman H, Sanders TA, Adlercreutz H, Bowey EA. Interindividual variation in metabo-lism of soy isoflavones and lignans: influence of habitual diet on equol production by the gut microflora. Nutr Cancer. 2000;36:27-32. [PubMed] [DOI] |
| 46. | Setchell KD, Brown NM, Desai P, Zimmer-Neche-mias L, Wolfe BE, Brashear WT, Kirschner AS, Cassidy A, Heubi JE. Bioavailability of pure isoflavones in healthy humans and analysis of commercial soy isoflavone supplements. J Nutr. 2001;131:1362S-1375S. [PubMed] |
| 47. | Akaza H, Miyanaga N, Takashima N, Naito S, Hirao Y, Tsukamoto T, Fujioka T, Mori M, Kim WJ, Song JM. Comparisons of percent equol producers between prostate cancer patients and controls: case-controlled studies of isoflavones in Japanese, Korean and American residents. Jpn J Clin Oncol. 2004;34:86-89. [PubMed] [DOI] |
| 48. | Meyer BJ, Larkin TA, Owen AJ, Astheimer LB, Tapsell LC, Howe PR. Limited lipid-lowering effects of regular consumption of whole soybean foods. Ann Nutr Metab. 2004;48:67-78. [PubMed] [DOI] |
| 49. | Yao W, Zhu WY, Han ZK, Willims BA, Akker-mans ADL, Tamminga . S. Daidzein increased the density but not the composition of the Lactero-bacillus community in piglet digesta during in vitro fermentation as revealed by DGGE and dilution PCR. Reprod. Nutr Dev. 2004;44:S17. |
| 50. | Hur HG, Lay JO Jr, Beger RD, Freeman JP, Rafii F. Isolation of human intestinal bacteria metabolizing the natural isoflavone glycosides daidzin and ge-nistin. Arch Microbiol. 2000;174:422-428. [PubMed] [DOI] |
| 51. | Hur HG, Beger RD, Heinze TM, Lay JO Jr, Freeman JP, Dore J, Rafii F. Isolation of an anaerobic intes-tinal bacterium capable of cleaving the C-ring of the isoflavonoid daidzein. Arch Microbiol. 2002;178:8-12. [PubMed] [DOI] |
| 52. | Wang XL, Hur HG, Lee JH, Kim KT, Kim SI. Enantioselective synthesis of S-equol from dihy-dro-daidzein by a newly isolated anaerobic human intestinal bacterium. Appl Environ Microbiol. 2005;71:214-219. [PubMed] [DOI] |