修回日期: 2006-02-26
接受日期: 2006-03-03
在线出版日期: 2006-04-08
目的: 考察玻璃化法对人胚胰岛冻存复苏后形态功能的影响.
方法: 取胎龄18-28 wk中期水囊引产死胎, 用胶原酶分离胰岛后, 分别采用传统微机程控缓慢降温和玻璃化超快速降温方法冷冻保存胰岛, 复苏后, 从胰岛形态、超微结构、胰岛素分泌功能方面比较两种冻存方法的效果.
结果: 两种方法冷冻保存的胰岛, 复苏后形态保持完整, 电镜下胰岛B细胞分泌颗粒和线粒体丰富, 线粒体嵴规整, 胰岛素释放试验中, 二者的胰岛素水平与冻存前无明显差异(P>0.05), 胰岛素基因表达水平与冻存前相似.
结论: 玻璃化法冷冻保存胰岛能够维持细胞的正常结构和功能, 其冷冻效果与微机程控缓慢降温相比无明显差别.
引文著录: 赵松, 付英梅, 刘连新, 迟月明, 李秀芬. 玻璃化法冷冻保存对人胚胰岛的影响. 世界华人消化杂志 2006; 14(10): 958-962
Revised: February 26, 2006
Accepted: March 3, 2006
Published online: April 8, 2006
AIM: To evaluate the efficiency of cryopre-servation of human fetal islets using vitrification as a potential feasible approach to islets bank establishment.
METHODS: Pancreatic islets of dead foetus aged 18 to 28 weeks induced by water bag were harvest by collagenase digestion. Islets were cultured and cryopreserved by computer programmed slow freezing and vitrification, respectively. The morphology and ultrastructure of thawed islets were studied in the two groups. Function of thawed islets was assessed by glucose-stimulated release of insulin, which was measured by radioimmunoassay. mRNA of insulin gene of the thawed islets was detected by using reversed-transcription polymerase chain reaction.
RESULTS: Morphologic studies of thawed islets demonstrated that both cryopreservation methods retained the integrity of islets. Secretary granule and mitochondria in beta cells were abundant. Analysis of basal insulin secretion and the stimulation release in the two groups showed no significantly difference from pro-cryopreservation (P>0.05 in both).
CONCLUSION: The integrity and function of islets can be retained by vitrification. The efficiency of vitrification in cryopreservation of human fetal islets is similar to the computer programmed slow freezing. Vitrification is a feasible and convenient approach as a substitution of the programmed slow freezing in the islets cell banking.
- Citation: Zhao S, Fu YM, Liu LX, Chi YM, Li XF. Cryopreservation of human fetal islets by vitrification. Shijie Huaren Xiaohua Zazhi 2006; 14(10): 958-962
- URL: https://www.wjgnet.com/1009-3079/full/v14/i10/958.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i10.958
我国糖尿病的发病率逐年上升, 胰岛移植对于纠正Ⅰ型糖尿病患者代谢紊乱是有效的, 甚至可以达到停用胰岛素的目的[1]. 但由于供体来源的不足, 大大限制了胰岛细胞移植在临床治疗的应用和发展. 胎儿组织免疫原性较成人低、再生能力强, 因而成为建立胰岛库的理想组织来源. 在细胞的冷冻保存上, 微机程控降温法能够精确地控制降温速率, 但其昂贵的冷冻仪器和繁杂的操作步骤, 限制了在基层医院的应用, 使得大量细胞资源被浪费. 因而, 探求一种操作简便、经济可靠、冷冻效果良好的冻存方法, 有利于开展大范围的细胞收集和保存工作, 更好地利用我国胚胎细胞资源.
玻璃化冷冻技术的基本原理是高浓度的冷冻保护剂溶液经急速降温后, 由液态转化为外形似玻璃状的非晶体化固体状态, 高浓度的冷冻保护剂和超快速的冷冻速率, 消除了细胞内和细胞外溶液冰晶的形成, 减少了冷冻损伤. 1985年, 玻璃化冷冻鼠胚胎首次获得成功[2]. 目前, 玻璃化冷冻保存细胞已成功应用于卵母细胞、血细胞及胚胎, 对角膜、皮肤、血管等亦有报道[3-6]. 但对以胰岛为代表的内分泌腺细胞的玻璃化保存未有涉及. 本研究在此方面进行了尝试, 报道如下.
胎龄18-28 wk中期水囊引产死胎31例, 由哈尔滨市各大医院妇产科提供, 胎儿死亡时间不超过4 h, 胎儿无畸形及传染病. Ⅴ型胶原酶、DMSO、聚乙二醇、乙酰胺、海藻糖、台盼蓝等购自Sigma公司; Hanks液、RPMI 1640等为Gibco公司产品; 培养瓶、离心管、冻存管等为Invitrogen公司产品. 胎儿娩出后, 热缺血时间1-2 h内, 或冷缺血时间6 h内, 在严格无菌条件下取材: 于无菌冰上解剖, 将胰腺组织剪成1-2 mm3大小的碎块, 加入0.5 g/LⅤ型胶原酶消化20 min, 用冰冷Hanks液终止消化, 120目无菌不锈钢网过滤, 收集于含200 mL/L胎牛血清的RPMI 1640完全培养液中, 于37 ℃含50 mL/L二氧化碳的培养箱中培养3-4 d.
胰岛的冷冻保存: (1)微机程控降温法. 培养3-4 d的胰岛移入含100 g/L DMSO、200 mL/L胎牛血清的RPMI 1640冻存液中, 于4 ℃冰箱平衡30 min后移入预先设定好降温程序的微机程控降温仪冷冻室内, 进入慢速降温程序: 以1 ℃/min降温, 于相变区间加大液氮输入量以阻止相变发生, 保持平稳降温的速率曲线. 程序运行结束后, 迅速将冻存管投入液氮保存. (2)玻璃化降温法. 玻璃化冻存液参照文献[3]和[7]的方法改良而成, 由含200 mL/L胎牛血清的RPMI 1640完全培养液与二甲基亚砜(DMSO)、牛血清白蛋白、聚乙二醇、乙酰胺、海藻糖等按一定比例混合而成. 培养3-4 d的胰岛依次在50%, 75%, 85%, 95%的玻璃化冻存液中冷平衡8-10 min后转入100%玻璃化冻存液中冷平衡20 min, 迅速投入液氮中保存. 复温. 取出冻存管, 迅速投入37 ℃恒温水浴箱中, 不时摇动, 在2 min内使其完全融化, 加入含200 mL/L胎牛血清的RPMI 1640培养液中培养. 冻存前后每天在倒置相差显微镜下观察细胞形态和生活状态并拍摄照片. 分别收集冻存前后生活细胞, 经30 mL/L戊二醛固定后, 透射电镜下观察细胞超微结构. 定期留取冻存前后培养细胞的培养液, 借助于全自动生化分析仪测定培养液中相应胰岛素水平, 同时作胰岛素释放试验. RT-PCR法检测胰岛素表达. 用美国Gibco公司Trizol试剂提取不同实验阶段胰岛细胞总RNA, cDNA合成采用Promega公司逆转录试剂盒, 操作按说明书进行. 根据GenBank人胰岛素基因mRNA(序列号BT006808)序列设计引物: 上游5'GCCTTTGTGAACCAACACCTG3', 下游5'GTTGCAGTAGTTCTCCAGCTG3', 扩增产物大小为261 bp. G3PDH上游引物为5'ACCACAGTCCATGCCATCAC3', 下游引物为5'CCTGCTTCACCACCTTCTT3', 扩增产物大小268 bp. PCR产物用12 g/L琼脂糖凝胶电泳检测.
统计学处理 所得数据以mean±SD表示, 采用SPSS 11.0软件进行统计学分析.
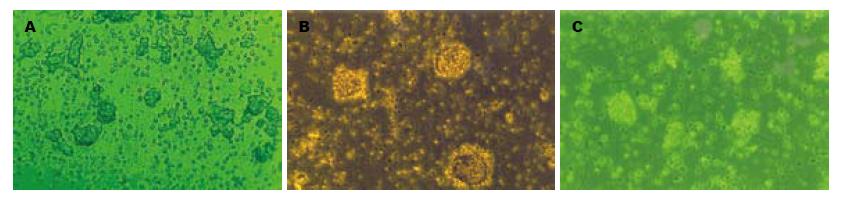
培养初期的胰岛近于球形, 立体感很强, 胰岛体积及形态差异较大, 组成胰岛的细胞完整, 轮廓清晰; 胰岛间分布多量游离外分泌腺细胞(图1A). 玻璃化和微机程控降温法冷冻保存的胰岛, 复苏后在胰岛形态和结构上无差别. 胰岛近于球形, 形态完整, 胰岛间分布多量游离细胞及细胞残片(图1B-C). 高倍镜下, 胰岛结构清晰, 内外层细胞均可见完整胞膜和清晰的细胞核.
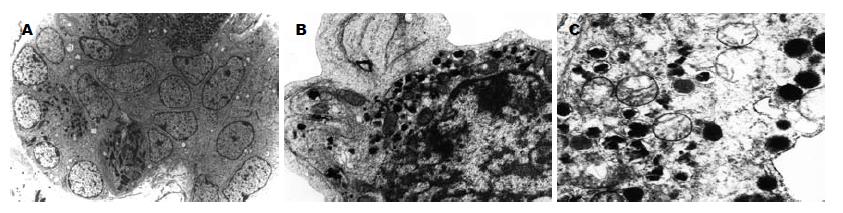
冷冻前B细胞胞质内含有大量胰岛素分泌颗粒, 颗粒内含有高电子密度的不规则形的致密结晶小体,与胰岛A细胞的球形分泌颗粒对比鲜明(图2A). 经两种方法冻存复苏后的人胚胰岛B细胞胞质内胰岛素分泌颗粒和线粒体丰富, 线粒体嵴规整呈平行排列(图2B-C).
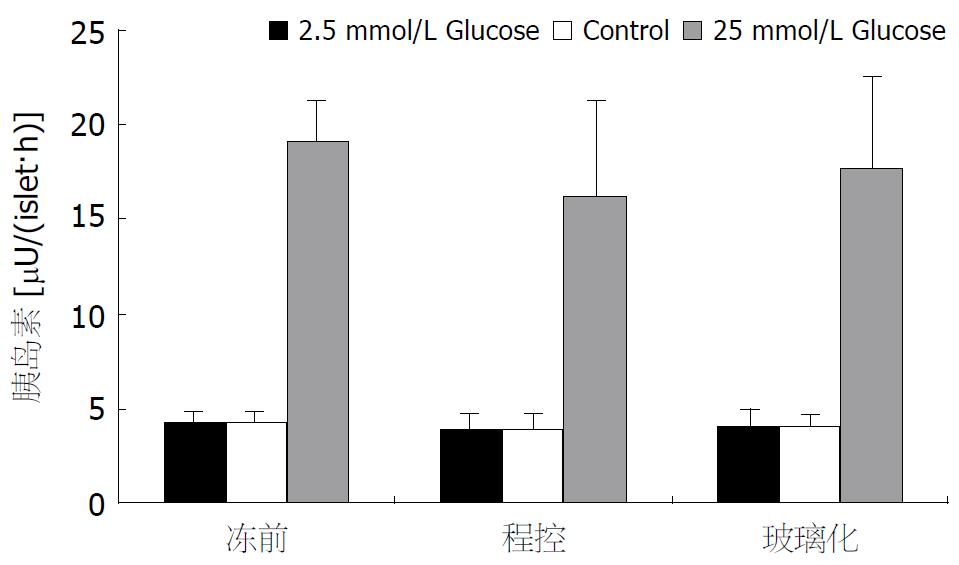
冻存前, 玻璃化组和微机程控降温组培养液胰岛素水平无显著性差异(4.2±0.4 vs 4.1±0.5 mU/(islet·h), t = 1.706, P>0.05), 两组间的胰岛素水平在复苏后2 d(4.1±1.3 vs 3.9±1.0 mU/(islet·h), t = 0.475, P>0.05)和4 d亦无明显差异(3.9±0.5 vs 3.8±0.6 mU/(islet·h), t = 0.998, P>0.05).
在25 mmol/L葡萄糖刺激条件下, 玻璃化和微机程控组胰岛细胞在胰岛素释放上无显著性差异(t = 1.367,P>0.05), 两组细胞在冻存前后亦无明显差异[t(冻前: 程控) = 0.48, P>0.05; t(冻前: 玻璃) = 0.31, P>0.05, 图3].
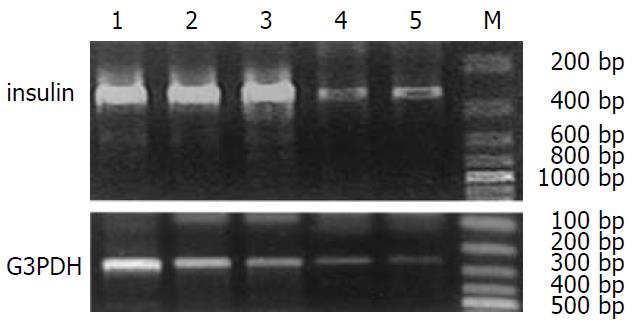
玻璃化冷冻降温和微机程控降温的胰岛细胞复苏后, 于复苏2, 4, 6, 8 d均显示胰岛素mRNA的表达, 凝胶电泳图上显示的表达量与冻存前无明显不同(图4).
近年来, 胰岛移植治疗糖尿病取得了突破性的进展, 然而这种新方法一般需要至少从2-3人的供体胰腺中分离胰岛, 供体的缺乏制约了胰岛移植的广泛应用[8-9], 因此, 建立胰岛细胞库是解决此问题的重要途径. 目前, 制约细胞库发展的技术环节仍然是冷冻过程中对细胞的损伤问题[10], 在这一过程中, 冷冻降温速度和冷冻保护剂的效能是起决定作用的两大因素[11]. 缓慢降温是目前冻存内分泌腺细胞较为流行的降温方法, 由微机程控降温设备控制的冷冻方法, 降温过程平稳而准确, 并可流程化操作[12]. 但缓慢冷冻过程中, 由于细胞外液的水分不断结晶, 未冻的游离水减少, 造成细胞内外渗透压不等, 使得大量的水分由细胞内向细胞外渗出, 逐渐导致细胞内渗透压升高, 造成"溶质性损伤"的负反应[13-14].
"玻璃化"是一个物理学上的概念, 是指水或溶液快速降温达到或低于-100 ℃-110 ℃的温度范围时, 形成一种高黏度的介于液态和固态之间、非晶体的、透明的玻璃态[15]. 玻璃化冷冻技术是快速冷冻与高浓度冷冻保护剂相结合的结果, 由于冷却速度很快, 以至于在低温时形成了透明的玻璃状固体, 冷却过程中黏度很高却没有冰晶形成, 因而避免了冷冻过程中形成的冰晶对细胞脂质膜及细胞骨架结构的损伤, 并保留了细胞内外液体正常的分子和离子分布. 我们测得数据中玻璃化冷冻与微机程控缓慢冷冻之间在统计学上虽然无显著差异, 但玻璃化的数值均比缓慢冷冻稍高, 说明玻璃化冷冻保存胰岛细胞, 能够完好地保持细胞的正常生理活性, 能够用于胰岛细胞的冷冻保存. 但是, 不同的玻璃化方案会对其效果产生不同的影响, 对于同一种组织细胞, 冷冻保护剂的浓度和种类是最重要的一个影响因素[16]. 冬天的青蛙被冷冻得硬如岩石, 但到春暖花开时还能奇迹般的复活并充满活力, 秘密在于其细胞内存在的大量多糖类物质. 受自然界的启发, 目前常用冷冻保护剂主要分两大类: 其中多糖类(蔗糖、海藻糖)及聚乙二醇、BSA、Percoll等大分子物质多用作细胞外冷冻保护剂[17]; 细胞内冷冻保护剂主要是二甲基亚砜、乙二醇、丙三醇等具有良好穿透性的小分子物质[18-19]. 我们吸取前人经验, 采用二甲基亚砜、聚乙二醇、海藻糖、乙酰胺配置玻璃化冷冻保护液, 以四步平衡法玻璃化快速冷冻, 复苏后经对胰岛细胞mRNA及培养液中胰岛素的检测表明, 玻璃化冷冻后胰岛细胞分泌功能未受影响. 结果提示此种冷冻保护剂的选择对胰岛的玻璃化冷冻具有良好效果.
我们证明, 玻璃化保存胰岛可以达到微机冷冻保存的冻存效果, 即可避免或减轻冷冻损伤, 又可以长期保存细胞的理想状态.与常规的慢速冷冻法相比, 玻璃化冷冻可在0 ℃以上的温度下直接操作, 并且不需要昂贵的冷冻仪器和复杂的操控程序, 因而具有操作简单、快速、经济等优点, 是便于普及的一种候选技术. 其进一步的完善并推广, 对于胰岛细胞库的建立必将起到重大作用.
胰岛细胞移植是替代胰岛素治疗糖尿病代谢紊乱的有效手段, 但细胞来源不足的问题严重限制了该疗法在临床的应用. 目前我国具有一定的胚胎胰岛细胞来源, 为有效利用这一资源, 我们尝试用改良的玻璃化快速降温法对人胚胰岛细胞冷冻保存, 取得较好效果.
本文所采用玻璃化法冷冻保存人胚胰岛, 无需昂贵和复杂的设备, 便于在基层推广, 对充分利用胚胎胰岛细胞来源, 建立细胞库具有实际意义.
电编: 张敏 编辑:潘伯荣
| 1. | Shapiro AM, Lakey JR, Ryan EA, Korbutt GS, Toth E, Warnock GL, Kneteman NM, Rajotte RV. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immu-nosuppressive regimen. N Engl J Med. 2000;343:230-238. [PubMed] [DOI] |
| 2. | Rall WF, Fahy GM. Ice-free cryopreservation of mouse embryos at -196 degrees C by vitrification. Nature. 1985;313:573-575. [PubMed] [DOI] |
| 3. | Zhou CQ, Mai QY, Li T, Zhuang GL. Cryopreserva-tion of human embryonic stem cells by vitrification. Chin Med J. 2004;117:1050-1055. [PubMed] |
| 4. | Pegg DE. The role of vitrification techniques of cryopreservation in reproductive medicine. Hum Fertil. 2005;8:231-239. [PubMed] [DOI] |
| 6. | Song YC, Hagen PO, Lightfoot FG, Taylor MJ, Smith AC, Brockbank KG. In vivo evaluation of the effects of a new ice-free cryopreservation process on autologous vascular grafts. J Invest Surg. 2000;13:279-288. [PubMed] [DOI] |
| 9. | 9 Larson-Wadd K, Belani KG. Pancreas and islet cell transplantation. Anesthesiol Clin North America. 2004;22:663-674. [PubMed] [DOI] |
| 10. | Egli RJ, Sckell A, Fraitzl CR, Felix R, Ganz R, Hofstetter W, Leunig M. Cryopreservation with dimethyl sulfoxide sustains partially the biological function of osteochondral tissue. Bone. 2003;33:352-361. [PubMed] [DOI] |
| 11. | Lakey JR, Rajotte RV, Fedorow CA, Taylor MJ. Islet cryopreservation using intracellular preservation solutions. Cell Transplant. 2001;10:583-589. [PubMed] |
| 12. | Miyamoto M, Balamurugan AN, Nozawa Y, Sakurai T, Xu B, Yoshimura S, Tanaka T, Tohyama T, Miyakoshi J, Inoue K. Development of a cryopre-servation procedure employing a freezer bag for pancreatic islets using a newly developed cryopro-tectant. Cell Transplant. 2001;10:363-371. [PubMed] |
| 13. | Matsumoto S, Matsusita M, Morita T, Kamachi H, Tsukiyama S, Furukawa Y, Koshida S, Tachibana Y, Nishimura S, Todo S. Effects of synthetic antifreeze glycoprotein analogue on islet cell survival and fun-ction during cryopreservation. Cryobiology. 2006;52:90-98. [PubMed] [DOI] |
| 14. | Dahl SL, Chen Z, Solan AK, Brockbank KG, Nikla-son LE, Song YC. Feasibility of vitrification as a storage method for tissue-engineered blood vessels. Tissue Eng. 2006;12:291-300. [PubMed] [DOI] |
| 15. | Song YC, Chen ZZ, Mukherjee N, Lightfoot FG, Taylor MJ, Brockbank KG, Sambanis A. Vitrification of tissue engineered pancreatic substitute. Trans-plant Proc. 2005;37:253-255. [PubMed] [DOI] |
| 16. | Arata T, Okitsu T, Fukazawa T, Ikeda H, Kobayashi K, Yong C, Kosaka Y, Narushima M, Matsuoka J, Yamamoto I. Maintenance of glucose-sensitive insulin secretion of cryopreserved human islets with University of Wisconsin solution and ascorbic acid-2 glucoside. Artif Organs. 2004;28:529-536. [PubMed] [DOI] |
| 17. | Tian XH, Xue WJ, Ding XM, Pang XL, Teng Y, Tian PX, Feng XS. Small intestinal submucosa improves islet survival and function during in vitro culture. World J Gastroenterol. 2005;11:7378-7383. [PubMed] [DOI] |
| 18. | Wowk B, Leitl E, Rasch CM, Mesbah-Karimi N, Harris SB, Fahy GM. Vitrification enhancement by synthetic ice blocking agents. Cryobiology. 2000;40:228-236. [PubMed] [DOI] |
| 19. | Kuleshova LL, Lopata A. Vitrification can be more favorable than slow cooling. Fertil Steril. 2002;78:449-454. [PubMed] [DOI] |