修回日期: 2005-09-18
接受日期: 2005-09-30
在线出版日期: 2006-01-08
目的: 探讨β-连环素(β-catenin)在肝癌中的表达及其对cyclin D1表达的影响.
方法: 采用免疫组织化学SP染色法检测38例肝细胞癌, 8例肝硬化以及5例正常肝组织中β-catenin和cyclin D1蛋白的表达水平.
结果: β-catenin在正常肝组织和肝硬化组织中呈微弱的膜表达. 55.2%(21/38)的肝细胞癌组织β-catenin呈异常表达, 异常表达的β-catenin主要位于癌细胞胞质. 低分化、有转移的肝癌其β-catenin异常表达率明显高于高分化、无转移的肝癌. β-catenin异常表达与cyclin D1过表达显著相关(P = 0.017). 38例肝癌中13例(34%)显示β-catenin异常表达伴cyclin D1阳性染色, 15例(39%)显示β-catenin正常表达伴cyclin D1阴性染色.
结论: β-catenin的异常表达与肝癌的进展和转移有关. 其机制可能是通过激活cyclin D1基因的表达, 促使肝细胞增殖和恶性转化而实现.
引文著录: 曾建平, 易继林, 李兴睿, 杨志芳, 王从俊. β-连环素在肝癌中的表达及其与 cyclin D1表达的关系. 世界华人消化杂志 2006; 14(1): 96-99
Revised: September 18, 2005
Accepted: September 30, 2005
Published online: January 8, 2006
AIM: To investigate the expression of β-catenin in hepatocellular carcinoma (HCC) and its effect on the expression of cyclin D1.
METHODS: The immunohistochemical SP staining technique was performed to detect the expression of β-catenin and cyclin D1 in 51 liver tissue samples, including 5 cases of normal liver, 8 cases of liver cirrhosis, and 38 cases of HCC.
RESULTS: In normal and cirrhotic liver, the weak expression of β-catenin was observed in the cell membrane. The aberrant expression of β-catenin, mainly located at the cell cytoplasm, was detected in 21 (55.2%) of the 38 HCC tissues and significantly higher in the tissues with poor differentiation and metastasis than that in the ones with well differentiation and non-metastasis. There was a significant correlation between the aberrant expression of β-catenin and the over expression of cyclin D1 (P = 0.017). Of the 38 HCC tissue samples, 13 were found aberrant expression of β-catenin combined with positive expression of cyclin D1 (34%), and 15 were found normal expression of β-catenin combined with negative cyclin D1 expression (39%).
CONCLUSION: The aberrant expression of β-catenin is related with the progression and metastasis of HCC, and exhibits its effect mainly by the transactivation of cyclin D1 gene.
- Citation: Zeng JP, Yi JL, Li XR, Yang ZF, Wang CJ. Expression of β-catenin in hepatocellular carcinoma and its relation with cyclin D1 expression. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 96-99
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/96.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.96
β-catenin是一种多功能胞内蛋白, 不仅参与细胞与细胞间的黏附, 而且能介导Wnt信号的胞内转导[1]. 对肝癌的研究表明β-catenin存在广泛的基因突变和异常表达[2,3], 但是相关的作用机制目前尚不清楚. 近期对结直肠癌、乳腺癌细胞系的研究表明β-catenin的致瘤作用可能与cyclin D1的表达异常有关[4,5]. 我们通过免疫组化方法检测38例肝癌组织中β-catenin和cyclin D1蛋白的表达, 初步探讨了β-catenin异常表达的临床意义及其对cyclin D1表达的影响.
1.1.1 标本来源: 随机选取同济医院肝胆外科1999-2000年住院患者手术切除后存档标本51例. 其中肝细胞癌38例, 男31例, 女7例. 平均年龄45.63岁. 分化程度按照Edmondson分级标准[6]Ⅰ-Ⅱ级为低分化肝癌(12例), Ⅲ-Ⅳ级为高分化肝癌(26例). 肿瘤直径≤5 cm者11例, >5 cm者27例, 平均直径11.7 cm, 均为单中心肝癌. 13例存在肿瘤转移(包括肝内转移、肝外转移和门静脉癌栓形成). 所有病例术前均未行放化疗. 对照组包括8例门脉性肝硬化组织和5例正常肝组织, 其中男9例, 女4例, 平均年龄44.8岁. 标本均经病理学证实, 采用40 g/L中性甲醛固定, 石蜡包埋, 连续4 mm切片.
1.1.2 试剂: 兔抗人β-catenin单克隆抗体及兔抗人cyclin D1单克隆抗体均购自美国Neomarkers公司, SP试剂盒购自美国ZYMED公司.
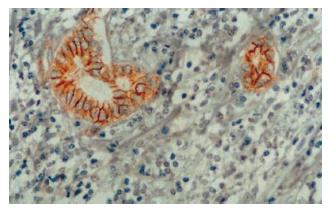
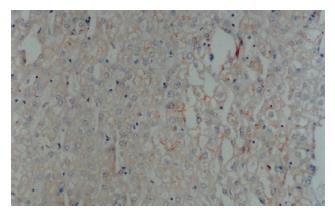
采用免疫组化SP染色法, 染色步骤按说明书进行. β-catenin染色前行微波抗原修复, cyclin D1染色前行高温高压抗原修复. 切片以联苯二胺显色, 苏木素轻度复染. 磷酸盐缓冲液(PBS)代替一抗作为阴性对照, β-catenin染色以肝内胆管上皮作为内部对照. β-catenin阳性染色呈棕黄色颗粒状, 以肝内胆管上皮细胞染色程度为强阳性染色(图1), 将胞质呈中度以上染色或可见胞核染色的细胞定义为阳性细胞. 每张切片随机选取4个高倍镜视野(×400)并计数阳性细胞数, 如切片中≥50%的细胞出现以上胞质型改变或≥20%的细胞出现以上胞核型改变, 则定义为β-catenin异常表达, 否则为β-catenin正常表达[7]. cyclin D1染色以胞核染成棕黄色为阳性, 随机选取4个高倍镜视野并计数, 切片中阳性细胞率>5%为阳性病例.
统计学处理 采用χ2检验或Fisher精确概率检验. P<0.05认为有显著性差异.
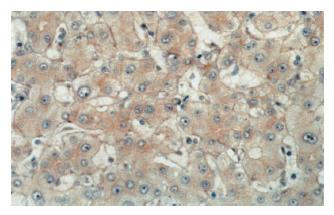
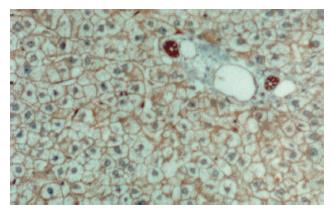
正常肝组织内, 肝细胞可在胞膜的侧面(细胞与细胞的接触面)观察到弱的线型染色, 面向窦间隙的胞膜部分很少着色, 部分肝细胞同时可见微弱的胞质染色. 小叶内胆管上皮细胞可见明显的胞膜染色. 肝硬化组织染色分布与正常肝相似, 但均无明显的胞质和/或核染色(图2, 图3). 肝癌组织染色不同于正常肝和肝硬化组织. 38例肝癌组织中21例存在β-catenin异常表达, 异常表达的β-catenin主要位于癌细胞胞质, 部分细胞同时有核染色. 所有存在胞质积聚的癌细胞同时显示明显的胞膜染色(图4). β-catenin过表达与肿瘤分化程度和转移有关. 低分化、伴转移的肝癌其β-catenin异常表达率明显高于高分化、无转移的肝癌(表1).
| 病理学特性 | n | β-catenin表达 | P | |
| 异常表达 | 正常表达 | |||
| 分化程度 | ||||
| 高分化 | 12 | 3 | 9 | |
| 低分化 | 26 | 18 | 8 | P<0.05 |
| 肿瘤大小 | ||||
| ≤5 cm | 11 | 5 | 6 | |
| >5 cm | 27 | 16 | 11 | P>0.05 |
| 肿瘤转移 | ||||
| 无 | 25 | 10 | 15 | |
| 有 | 13 | 11 | 2 | P<0.05 |
| AFP水平 | ||||
| + | 29 | 19 | 10 | |
| - | 9 | 2 | 7 | P>0.05 |
| 血清HBsAg | ||||
| + | 30 | 18 | 12 | |
| - | 8 | 3 | 5 | P>0.05 |
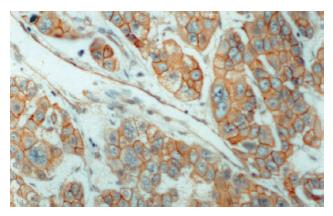
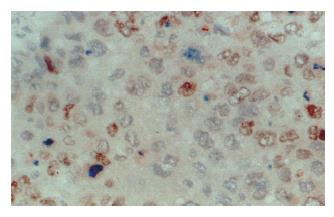
cyclin D1阳性染色主要位于癌细胞核(图5, 图6), 38例HCC中15例cyclin D1染色呈阳性. 34%(15/38)的肝癌表现为β-catenin异常表达伴cyclin D1阳性染色, 39%(23/38)的肝癌显示β-catenin正常表达伴cyclin D1阴性染色. 统计分析证实β-catenin异常表达与cyclin D1过表达显著相关(χ2检验, P<0.05) (表2).
| β-catenin染色 | cyclin D1染色 | n | |
| 阴性 | 阳性 | ||
| 异常表达 | 8 | 13 | 21 |
| 正常表达 | 15 | 2 | 17 |
| 23 | 15 | 38 | |
Wnt信号是胚胎发育期的一种增殖信号, β-catenin是Wnt信号通路中一种关键的下游效应分子. 正常成熟细胞缺乏Wnt信号, 胞质内β-catenin大部分与细胞膜上的E-cadherin结合介导细胞间的初期识别和黏附, 小部分通过磷酸化降解, 因而胞内游离的β-catenin保持在较低水平. 多种机制如β-catenin基因突变、APC基因缺失等能形成异常的Wnt信号, 导致β-catenin在胞质和/或胞核中积聚, 积聚的β-catenin具有转录活性, 通过与Tcf/Lef因子家族成员结合, 激活启动子区包含Tcf/Lef结合位点的基因转录, 参与肿瘤发生[1,8].
基于β-catenin的转录活性与其细胞内定位有关[5], 我们在判断β-catenin的功能时主要以其在胞质和胞核中的表达水平为依据. 本实验中正常肝及肝硬化组织β-catenin染色主要位于肝细胞的胞膜侧面, 反映了β-catenin介导同型细胞黏附的能力. 肝癌染色图谱则明显区别于正常肝及肝硬化组织, 55%的肝癌组织存在β-catenin异常表达, 异常表达的β-catenin主要显示胞质积聚, 显示癌细胞中β-catenin具有较高的转录活性, 积聚的β-catenin通过激活下游靶基因的转录参与了肝细胞的恶性转化以及肿瘤的进展. 与其他研究相比, 我们的研究在β-catenin异常表达率上基本一致. 不同的是我们的研究中没有明显β-catenin核型积聚. 多项研究[9,10]证实β-catenin核表达与其基因突变具有一致性, 而β-catenin基因突变又与丙型肝炎感染密切相关. 因而所选病例的不同肝病背景可能是导致我们的实验结果中核型表达较低的原因.
临床病理学分析表明β-catenin异常表达与肝癌病理分级和转移有关. 这与大多数学者在肝癌中的研究结果一致[2,11]. Brabletz et al[12]的研究证实β-catenin能调节基质金属蛋白酶(MMPs)的转录. MMPs能分解细胞外基质, 促进恶性细胞的浸润性生长和转移[13], 因而β-catenin对肿瘤转移的影响可能与MMPs有关. 检测β-catenin表达水平与分布对肝癌的恶性程度判断及预后的估计可能有一定价值.
重要的是我们证实β-catenin异常表达与cyclin D1过表达存在一致性. 最近的体外研究发现cyclin D1基因启动子区存在一个Tcf结合位点[5]. 基于β-catenin异常表达(胞质或胞核积聚)与其转录活性的关系, 有理由认为积聚的β-catenin能诱导cyclin D1基因的转录从而促进肝癌发生和进展. 以往的研究报导约22-58%的肝癌患者存在cyclin D1过表达[14,15], 然而只有11-13%的病例存在cyclin D1基因的扩增[16]. 我们的结果为这种基因-蛋白分离的现象提供一种新的解释, 即除基因扩增外, β-catenin异常表达所导致的cyclin D1基因转录活性升高可能也是cyclin D1蛋白过表达的原因之一.
总之, 本实验证实β-catenin在肝癌中存在异常的胞质/核积聚. 异常表达的β-catenin与肝癌的进展及转移有关, 其作用可能部分通过调节cyclin D1基因的表达实现. 进一步研究β-catenin的作用机制对于肝癌的治疗具有重要意义.
对肝癌的研究表明β-catenin存在广泛的基因突变和异常表达, 然而异常表达的β-catenin如何通过下游通路发挥致瘤作用目前尚不清楚, 本文通过评估β-catenin与cyclin D1表达关系为β-catenin涉及细胞周期与凋亡提供思路.
早期对于β-catenin的研究主要集中于其介导的细胞黏附作用, 目前对其的研究热点在于β-catenin基因突变和异常表达如何通过下游通路发挥致瘤作用.
本文的创新之处在于首次在肝癌中同时检测β-catenin与cyclin D1的表达, 将β-catenin作为信号通路分子与细胞周期结合, 试图解释其在肝癌中高基因突变与异常表达的致瘤机制.
阐明β-catenin对细胞周期分子的作用将有助于解释β-cateninde致瘤机制, 为进一步开发针对β-catenin的治疗提供思路.
电编: 张敏 编辑:菅鑫妍 审读:张海宁
| 2. | Wong CM, Fan ST, Ng IO. beta-Catenin mutation and overexpression in hepatocellular carcinoma: clinicopathologic and prognostic significance. Cancer. 2001;92:136-145. [PubMed] |
| 3. | Miyoshi Y, Iwao K, Nagasawa Y, Aihara T, Sasaki Y, Imaoka S, Murata M, Shimano T, Nakamura Y. Activation of the beta-catenin gene in primary hepatocellular carcinomas by somatic alterations involving exon 3. Cancer Res. 1998;58:2524-2527. [PubMed] |
| 4. | Tetsu O, McCormick F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature. 1999;398:422-426. [PubMed] |
| 5. | Lin SY, Xia W, Wang JC, Kwong KY, Spohn B, Wen Y, Pestell RG, Hung MC. Beta-catenin, a novel prognostic marker for breast cancer: its roles in cyclin D1 expression and cancer progression. Proc Natl Acad Sci USA. 2000;97:4262-4266. [PubMed] |
| 6. | EDMONDSON HA, STEINER PE. Primary carcino-ma of the liver: a study of 100 cases among 48,900 necropsies. Cancer. 1954;7:462-503. [PubMed] |
| 7. | Asayama Y, Taguchi Ki K, Aishima Si S, Nishi H, Masuda K, Tsuneyoshi M. The mode of tumour progression in combined hepatocellular carcinoma and cholangiocarcinoma: an immunohistochemical analysis of E-cadherin, alpha-catenin and beta-catenin. Liver. 2002;22:43-50. [PubMed] |
| 8. | Hsu SC, Galceran J, Grosschedl R. Modulation of transcriptional regulation by LEF-1 in response to Wnt-1 signaling and association with beta-catenin. Mol Cell Biol. 1998;18:4807-4818. [PubMed] |
| 9. | Mao TL, Chu JS, Jeng YM, Lai PL, Hsu HC. Expre-ssion of mutant nuclear beta-catenin correlates with non-invasive hepatocellular carcinoma, absence of portal vein spread, and good prognosis. J Pathol. 2001;193:95-101. [PubMed] |
| 10. | Huang H, Fujii H, Sankila A, Mahler-Araujo BM, Matsuda M, Cathomas G, Ohgaki H. Beta-catenin mutations are frequent in human hepatocellular carcinomas associated with hepatitis C virus infec-tion. Am J Pathol. 1999;155:1795-1801. [PubMed] |
| 11. | Endo K, Ueda T, Ueyama J, Ohta T, Terada T. Immunoreactive E-cadherin, alpha-catenin, beta-catenin, and gamma-catenin proteins in hepatocell-ular carcinoma: relationships with tumor grade, clinicopathologic parameters, and patients' survival. Hum Pathol. 2000;31:558-565. [PubMed] |
| 12. | Brabletz T, Jung A, Dag S, Hlubek F, Kirchner T. beta-catenin regulates the expression of the matrix metalloproteinase-7 in human colorectal cancer. Am J Pathol. 1999;155:1033-1038. [PubMed] |
| 13. | Maatta M, Soini Y, Liakka A, Autio-Harmainen H. Differential expression of matrix metalloproteinase (MMP)-2, MMP-9, and membrane type 1-MMP in hepatocellular and pancreatic adenocarcinoma: implications for tumor progression and clinical prognosis. Clin Cancer Res. 2000;6:2726-2734. [PubMed] |
| 14. | Ito Y, Matsuura N, Sakon M, Miyoshi E, Noda K, Takeda T, Umeshita K, Nagano H, Nakamori S, Dono K. Expression and prognos-tic roles of the G1-S modulators in hepatocellular carcinoma: p27 independently predicts the recurr-ence. Hepatology. 1999;30:90-99. [PubMed] |
| 15. | Joo M, Kang YK, Kim MR, Lee HK, Jang JJ. Cyclin D1 overexpression in hepatocellular carcinoma. Liver. 2001;21:89-95. [PubMed] |
| 16. | Nishida N, Fukuda Y, Komeda T, Kita R, Sando T, Furukawa M, Amenomori M, Shibagaki I, Nakao K, Ikenaga M. Amplification and overexpression of the cyclin D1 gene in aggressive human hepatocellular carcinoma. Cancer Res. 1994;54:3107-3110. [PubMed] |