修回日期: 2005-10-27
接受日期: 2005-10-31
在线出版日期: 2006-01-08
目的: 观察结肠直肠癌中IGF-2、Survivin、c-Myc蛋白的表达情况, 探讨IGF-2、Survivin、c-Myc蛋白表达的相关性, 阐明IGF-2在大肠癌发生、发展中的作用.
方法: 应用免疫组化SP法分别检测大肠癌及其癌瘤手术切除的切缘组织中IGF-2、Survivin、c-Myc蛋白的单一及联合表达情况.
结果: IGF-2在大肠癌组织中的表达阳性率为27.3%, 在切缘组织中的表达阳性率为5.0%, 两者相比有显著性差异(P<0.05). IGF-2表达阳性与Dukes分期(AB: 16.67% vs CD 83.32%)、淋巴转移(无16.67% vs 有83.33%)有关(P<0.01), 与患者年龄、性别、肿瘤分化程度、肿瘤大小、部位无明显相关性(P>0.05); Survivin、c-Myc表达阳性与IGF-2表达无明显相关(P>0.05).
结论: IGF-2可成为预后判断的指标; IGF-2的过表达促进了结肠直肠癌的发生、发展、浸润和转移.
引文著录: 段琼红, 吕美霞, 卢祖洵, 聂绍发. 大肠癌中 IGF-2蛋白的表达及相关性研究. 世界华人消化杂志 2006; 14(1): 83-86
Revised: October 27, 2005
Accepted: October 31, 2005
Published online: January 8, 2006
AIM: To explore the correlation of the expression of insulin-1ike growth factor 2 (IGF-2), Survivin, and c-Myc protein in colorectal cancer, and to clarify the role of IGF-2 in the occurrence and progression of colorectal cancer.
METHODS: The single and associated expression of IGF-2, Survivin, and c-Myc protein was detected by immunohistochemical SP method in the tissues of colorectal cancer and the marge of the excision part of the tumor.
RESULTS: The positive rate of IGF-2 was 27.3% in the cancer tissue, and 5.0% in the marge tissue. There was significant difference between them (P < 0.05). The positive expression of IGF-2 was significantly related with Duke's staging (A-B: 16.67% vs C-D: 83.32%), lymph metastasis (without metastasis: 16.67% vs with metastasis: 83.33%) of colorectal cancer (P < 0.01), while it was not related with the following factors: the age and gender of the patients, degree of tumor differentiation, and size and location of the tumor. The expression of c-Myc and Survivin was not correlated with the expression of IGF-2 (P > 0.05).
CONCLUSION: The over-expression of IGF-2 promotes the carcinogenesis, progression, infiltration, and metastasis of the colorectal cancer, and it can be used as a marker in the prognosis of the colorectal cancer.
- Citation: Duan QH, Lv MX, Lu ZX, Nie SF. Expression and significance of insulin-1ike growth factor 2 protein in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 83-86
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/83.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.83
胰岛素样生长因子-2(insulin-1ike growth factor 2, IGF-2)是一种非常强的有丝分裂原, 可促进多种细胞的增殖, 抑制细胞凋亡[1], 生存蛋白(Survivin)是凋亡抑制蛋白(inhibition apoptosis protein, IAP)家族的新成员, 是具有抑制细胞凋亡和调节细胞分裂的双功能蛋白[2]. c-Myc基因具有诱导增殖和细胞程序死亡的双相作用[3]. 研究发现, 他们在多种肿瘤组织中存在过量表达, 与肿瘤的发生、发展有密切关系[4-6]. 我们通过观察结肠直肠癌中IGF-2蛋白、Survivin蛋白、c-Myc蛋白的表达情况, 探寻IGF-2、Survivin、c-Myc三者表达的相关性, 探讨IGF-2基因表达在大肠癌发生、发展过程中的作用.
收集44例大肠癌组织和20例大肠癌手术切除的癌缘5 cm以上的切缘组织, 分别来自武汉市一所综合性医院及一所肿瘤专科医院. 全部标本经福尔马林固定, 石蜡包埋, 常规连续切片, 厚度4 µm, 分别做HE及免疫组化染色. 包括男24例, 女20例, 平均年龄53.9岁. 结肠癌16例, 直肠癌28例. 经病理诊断, 组织学类型分为: 腺癌38例(其中高分化腺癌11例, 中分化腺癌17例, 低分化腺癌10例), 黏液腺癌4例, 印戒细胞癌2例. 对肿瘤病理组织做出细胞学分级的诊断(Dukes分期)为A期5例; B期18例; C期17例; D期4例. 所有患者术前均未做放疗、化疗及免疫治疗. c-Myc鼠抗人单克隆抗体、Survivin兔抗人多克隆抗体、SP试剂盒购自北京中杉生物技术有限公司, IGF-2兔抗人多克隆抗体购自武汉博士德生物工程公司.
1.2.1 免疫组织化学染色: 免疫组化采用SP法. IGF-2、c-Myc和Survivin一抗浓度分别为1:150, 1:100, 1:100. 均采用微波抗原修复.
1.2.2 结果判断及半定量方法: 每例每个指标取5个高倍视野(×400), 通过HMIAS-2000型病理图文分析系统(同济千屏影像工程公司出品)处理, 计数其肿瘤平均阳性细胞率. c-Myc阳性判断标准: 阳性细胞率<10%者或背景同阳性对照者为阴性标本, 标本阳性细胞呈黄色或棕色, 并且阳性细胞率≥10%为阳性标本[7]. IGF-2阳性判断标准: 参考Peters et al[5]的标准, 取IGF-2阳性细胞率<5%者为阴性标本, ≥5%为阳性标本. Survivin阳性判断标准: 参考Kawasaki et al[8]报道的方法: 计数5个高倍视野, 将平均阳性细胞率分为5类: 0, <5%; 1, 5%-25%; 2, 25%-50%; 3, 50%-75%; 4, >75%. 根据染色程度将阳性信号分为3类: 染色强度弱, 1分; 中等染色强度, 2分; 染色强度强, 3分; 染色强度×阳性细胞百分数为每个病例染色的综合记分, 综合计分<1为表达阴性, 反之判定为阳性.
统计学处理 阳性率差异比较用χ2检验, 相关分析采用kendall等级相关. P<0.05为显著差异, P<0.01为非常显著差异,P>0.05为无差异. 全部统计分析用SAS 8.10软件包完成.
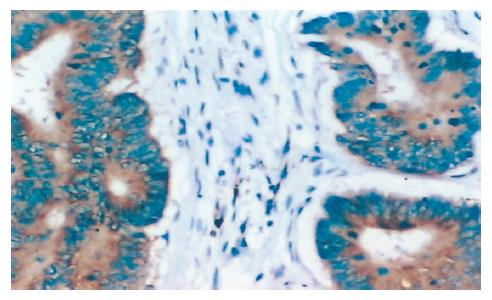
镜下IGF-2主要定位于大肠癌细胞胞质, 为棕黄色颗粒, 呈异质性染色, 少数细胞染色较强(图1). 作为对照, 20例切缘组织阳性率为5.0%(1/20). 表1总结了44例大肠癌组织的IGF-2表达及其与临床病理的关系, 结果显示44例大肠癌患者中IGF-2阳性表达12例, 阳性率27.3%, 与切缘组织相比, 其差异具有显著性(P<0.05). IGF-2表达与患者年龄、性别、肿瘤分化程度、肿瘤大小、部位无明显相关性(P>0.05), 与Dukes分期、淋巴转移显著相关(P<0.05).
| 因素 | n | IGF-2 | P | c-Myc | P | |||
| - (%) | + (%) | - (%) | + (%) | |||||
| 年龄 | <60 | 35 | 26 (81.25) | 9 (75.00) | 0.647 1 | 18 (85.71) | 17 (73.91) | 0.332 4 |
| ≥60 | 9 | 6 (18.75) | 3 (25.00) | 3 (14.29) | 6 (26.09) | |||
| 性别 | 男 | 24 | 16 (50.00) | 8 (66.67) | 0.322 7 | 11 (52.38) | 13 (56.52) | 0.782 9 |
| 女 | 20 | 16 (50.00) | 4 (33.33) | 10 (47.62) | 10 (43.48) | |||
| 大小 | ≤3 cm | 14 | 9 (28.13) | 5 (41.67) | 0.390 4 | 6 (28.57) | 8 (34.78) | 0.658 6 |
| >3 cm | 30 | 23 (71.88) | 7 (58.33) | 15 (71.43) | 15 (65.22) | |||
| 部位 | 直肠 | 28 | 19 (59.38) | 9 (75.00) | 0.337 3 | 12 (57.14) | 16 (69.57) | 0.392 2 |
| 结肠 | 16 | 13 (40.63) | 3 (25.00) | 9 (42.86) | 7 (30.43) | |||
| 分化程度 | 高 | 28 | 20 (62.50) | 8 (66.67) | 0.798 0 | 19 (90.48) | 9 (39.13) | 0.000 4 |
| 低 | 16 | 12 (37.50) | 4 (33.33) | 2 (9.52) | 14 (60.87) | |||
| Dukes分期 | AB | 23 | 21 (65.63) | 2 (16.67) | 0.003 8 | 13 (61.90) | 10 (43.48) | 0.221 6 |
| CD | 21 | 11 (34.38) | 10 (83.32) | 8(38.10) | 13(56.52) | |||
| 淋巴转移 | 无 | 24 | 22 (68.75) | 2 (16.67) | 0.002 0 | 13 (61.90) | 11 (47.83) | 0.348 9 |
| 有 | 20 | 10 (31.25) | 10 (83.33) | 8 (38.10) | 12 (52.17) | |||
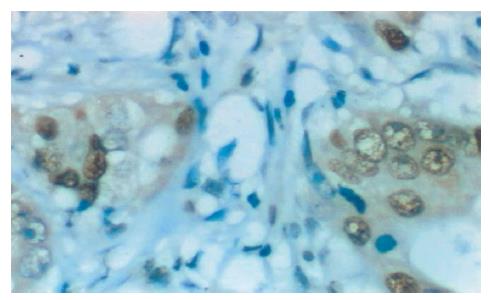
镜下c-Myc主要定位于大肠癌细胞胞核, 为棕黄色颗粒, 在癌组织中, c-Myc阳性细胞以弥漫性分布为主, 少数也可为局灶性分布(图2). 免疫组织化学所有空白对照及替代对照均为阴性. c-Myc在大肠癌组织中的阳性率为52.3%(23/44).
c-Myc表达与患者年龄、性别、肿瘤大小、部位、Dukes分期、淋巴转移无明显相关性(P>0.05), 与肿瘤分化程度明显相关(表1). c-Myc表达阳性与IGF-2表达阳性无明显相关(P>0.05)(表2).
| IGF-2 | r | P | |||
| + | - | ||||
| c-Myc | + | 7 | 16 | 0.0743 | 0.6261 |
| - | 5 | 16 | |||
| Survivin | + | 9 | 19 | 0.1447 | 0.3428 |
| - | 3 | 13 | |||
镜下Survivin主要定位于大肠癌细胞胞质, 为棕黄色颗粒, 呈异质性染色, 少数细胞染色较强. Survivin在大肠癌组织中的阳性率为63.6%. Survivin表达阳性与IGF-2表达阳性无明显相关(P>0.05)(表2).
大肠癌为常见的恶性肿瘤之一. 在一些经济发达的欧美国家发病率甚高, 在亚非等发展中国家的发病率相对较低. 大肠癌在我国恶性肿瘤中发病率占4-6位, 20世纪70年代以来, 我国某些地区, 尤其是大城市, 大肠癌的发病和死亡率有明显升高的趋势[9].
流行病学和实验室研究证明, IGF(insulin like growth factor)系统在大肠癌的发生发展中起重要作用[10-12]. IGFR通过结合IGF-1或者IGF-2激活胞内一系列信号通道, 而作用于肿瘤细胞的生长和增殖. IGF-2基因位于第11号染色体短臂上, 其编码产生的IGF-2蛋白是一种分子量为7.5 ku的单链弱酸性多肽. 作为一种促生长因子, IGF-2在体内、体外都有很强的促进细胞分裂增殖的能力[1]. 研究发现, 在人胎儿期IGF-2的含量远比成年期高, 且出生后IGF-2的表达仅局限于少数组织(如肝脏, 神经组织等)[13], 这说明了IGF-2对组织、细胞的生长发育起着重要的调节作用.
Survivin是凋亡抑制蛋白家族的新成员, 结构独特, 仅含有一个杆状病毒凋亡抑制蛋白重复序列分子, 作用于各种凋亡通路末端效应分子, 是迄今发现的最强的凋亡抑制因子之一[14].
c-Myc癌基因是原癌基因之一, 定位于人染色体8q24, 主要产物是分子量为62 ku的磷蛋白, 简称P62c-Myc[15,16]. 该基因与细胞生长有关.
许多研究表明, 在多种肿瘤组织中均发现IGF-2, Survivin, c-Myc的表达异常增多. 但他们在结肠直肠癌中表达情况及相关性尚不明确, 为此, 我们就他们在结肠直肠癌的表达做一分析.
IGF-2, Survivin, c-Myc蛋白的表达普遍存在于结肠直肠癌细胞中, 其阳性细胞率均显著高于切缘组织, 这说明IGF-2, Survivin, c-Myc的过表达在肿瘤中起着重要的作用. 许多文献报道证实了这一点[6,14,17]. 我们将他们与大肠癌临床病理特征相比较, 发现IGF-2与患者的年龄、肿瘤的部位、大小及分化程度均无关, 而与Dukes分期、淋巴转移有关, c-Myc表达只与肿瘤分化程度明显相关, Survivin表达只与患者的性别明显相关. 三者的表达之间有无关联呢? 我们研究结果表明IGF-2与c-Myc、Survivin呈正相关, 但无统计学意义. 这说明IGF-2蛋白过表达是大肠癌发生中的一种独立事件.
因此我们认为IGF-2的过表达促进了结肠直肠癌的发展、浸润和转移, IGF-2可成为预后判断的指标.
IGF-2是一种非常强的有丝分裂原, 可促进多种细胞的增殖, 抑制细胞凋亡, 生存蛋白(Survivin)是凋亡抑制蛋白, 是具有抑制细胞凋亡和调节细胞分裂的双功能蛋白. c-Myc基因具有诱导增殖和细胞程序死亡的双相作用. 研究发现, IGF-2, Survivin及c-Myc在多种肿瘤组织中存在过量表达, 与肿瘤的发生、发展有密切关系. 但缺乏关于三者关系的研究.
首次研究了IGF-2, Survivin, c-Myc三者表达的相关性.
环境因素通过体内IGF系统促进大肠癌的发生是大肠癌发病机制的新假说, IGF系统主要由IGF-1、IGF-2和IGFBP-3组成. IGF系统在大肠癌的发生、发展中的作用是目前的研究热点.
IGF-2可成为预后判断的指标.
电编: 张敏 编辑:菅鑫妍 审读:张海宁
| 1. | Mohan S, Jennings JC, Linkhart TA, Baylink DJ. Isolation and purification of a low-molecular-weight skeletal growth factor from human bones. Biochim Biophys Acta. 1986;884:234-242. [PubMed] |
| 2. | LaCasse EC, Baird S, Korneluk RG, MacKenzie AE. The inhibitors of apoptosis (IAPs) and their emerg-ing role in cancer. Oncogene. 1998;17:3247-3259. [PubMed] |
| 3. | Watson PH, Pon RT, Shiu RP. Inhibition of c-myc expression by phosphorothioate antisense oligonu-cleotide identifies a critical role for c-myc in the growth of human breast cancer. Cancer Res. 1991;51:3996-4000. [PubMed] |
| 4. | Xu AG, Li SG, Liu JH, Gan AH. Function of apopto-sis and expression of the proteins Bcl-2, p53 and C-myc in the development of gastric cancer. World J Gastroenterol. 2001;7:403-406. [PubMed] |
| 5. | Peters G, Gongoll S, Langner C, Mengel M, Piso P, Klempnauer J, Ruschoff J, Kreipe H, von Wasielew-ski R. IGF-1R, IGF-1 and IGF-2 expression as poten-tial prognostic and predictive markers in colorectal-cancer. Virchows Arch. 2003;443:139-145. [PubMed] |
| 6. | Chen WC, Liu Q, Fu JX, Kang SY. Expression of survivin and its significance in colorectal cancer. World J Gastroenterol. 2004;10:2886-2889. [PubMed] |
| 8. | Kawasaki H, Altieri DC, Lu CD, Toyoda M, Tenjo T, Tanigawa N. Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer. Cancer Res. 1998;58:5071-5074. [PubMed] |
| 10. | Werner H, LeRoith D. The role of the insulin-like growth factor system in human cancer. Adv Cancer Res. 1996;68:183-223. [PubMed] |
| 11. | Duan QH, Wang ZG, Zhu GB, Lu ZX, Shi LY, Nie SF. Study on the relations between serum insulin-like growth factor-1, insulin-like growth factor binding protein-3 and colorectal cancer: a meta-analysis. Zhonghua Liuxingbingxue Zazhi. 2005;26:132-134. [PubMed] |
| 12. | Bustin SA, Jenkins PJ. The growth hormone-insulin-like growth factor-I axis and colorectal cancer. Trends Mol Med. 2001;7:447-454. [PubMed] |
| 14. | Kim PJ, Plescia J, Clevers H, Fearon ER, Altieri DC. Survivin and molecular pathogenesis of colorectal cancer. Lancet. 2003;362:205-209. [PubMed] |
| 15. | Neel BG, Jhanwar SC, Chaganti RS, Hayward WS. Two human c-onc genes are located on the long arm of chromosome 8. Proc Natl Acad Sci USA. 1982;79:7842-7846. [PubMed] |
| 16. | Ramsay G, Evan GI, Bishop JM. The protein encod-ed by the human proto-oncogene c-myc. Proc Natl Acad Sci USA. 1984;81:7742-7746. [PubMed] |
| 17. | Kozma L, Kiss I, Szakall S, Ember I. Investigation of c-myc oncogene amplification in colorectal cancer. Cancer Lett. 1994;81:165-169. |