修回日期: 2005-11-23
接受日期: 2005-12-02
在线出版日期: 2006-01-08
目的: 研究绿茶多酚及表没食子儿茶素没食子酸酯(EGCG)对大鼠酒精性肝损伤的治疗作用, 并探讨其作用机制.
方法: 将48只大鼠随机分为正常对照组、模型组、茶多酚治疗Ⅰ组、Ⅱ组、EGCG治疗Ⅰ组、Ⅱ组, 每组8只大鼠. 以酒精+0.5 mL鱼油灌胃制作酒精性肝病模型. 茶多酚治疗Ⅰ、Ⅱ组另外分别给予200 mg/kg、100 mg/kg茶多酚灌胃治疗, EGCGⅠ、Ⅱ治疗组则分别给予100 mg/kg、50 mg/kg EGCG灌胃治疗. 5 wk后处死大鼠, 观察各组大鼠肝脏病理变化, 并测定血清转氨酶及血浆内毒素水平, 采用ELISA法检测血清TNF-α、IL-1、IL-18水平, 并应用RT-PCR方法检测大鼠肝组织CD14、LBP、TNF-α、IL-1、IL-18 mRNA的表达, 并应用图像分析系统对其进行半定量分析.
结果: 模型组大鼠肝组织表现肝细胞中度脂肪变性, 点状坏死, 炎性细胞浸润, 其血清ALT、TNF-α、IL-1、IL-18及血浆内毒素水平与正常对照组相比, 显著升高(P<0.05或P<0.01); 模型组肝组织CD14、LBP、TNF-α、IL-1、IL-18 mRNA的表达与对照组相比显著增强(P<0.05或P<0.01). 茶多酚、EGCG高低剂量分别同时处理显著降低了酒精性肝损伤大鼠血清ALT、TNF-α、IL-1、IL-18与血浆内毒素水平及肝组织CD14、LBP、TNF-α、IL-1、IL-18 mRNA的表达(P<0.05或P<0.01), 肝组织仍可见肝细胞脂肪变性, 但未见坏死及炎性细胞浸润.
结论: 茶多酚及EGCG可减轻酒精性肝损伤大鼠肝脏的炎症与坏死, 其可能机制包括降低内毒素血症, 抑制Kupffer细胞活性与促炎细胞因子的表达与分泌.
引文著录: 周晓蓉, 龚作炯, 袁光金, 张频. 绿茶多酚对实验性酒精性肝损伤大鼠的治疗作用. 世界华人消化杂志 2006; 14(1): 50-56
Revised: November 23, 2005
Accepted: December 2, 2005
Published online: January 8, 2006
AIM: To investigate the effects of tea polythenols (TP) and epigallocatechin-3-gallate (EGCG) on alcohol-induced liver injury in rats.
METHODS: Forty-eight Sprague-Dawley rats were randomly divided into normal control, model, TP treatment (100, 200 mg/kg), and EGCG treatment (50, 100 mg/kg) groups. Alcoholic liver injury was induced by ethanol plus 0.5 mL fish oil intragastically for 5 wk. Liver injury was assessed by pathological examination and serum alanine aminotransferase (ALT) levels. The plasma endotoxin and serum tumor necrosis factor(TNF)-α, interleukin(IL)-1 and IL-18 levels were measured by enzyme linked immunosorbent assay (ELISA). The expression of CD14, lipopolysaccharide-binding protein (LBP), TNF-α, IL-1 and IL-18 mRNA in the liver were detected by reverse transcription chain reaction (RT-PCR).
RESULTS: Chronic intragastric irrigation of alcohol plus fish oil resulted in the elevated serum ALT, fatty degeneration, focal necrosis and inflammatory cell infiltration in the liver of model rats. These changes were accompanied by increased plasma endotoxin and serum TNF-α, IL-1, IL-18 levels (P < 0.05 or P < 0.01). The expression of CD14, LBP, TNF-α, IL-1, and IL-18 mRNA was also increased in the model rats. However, TP and EGCG treatment improved histological changes, and significantly decreased the levels of plasma endotoxin and serum TNF-α, IL-1, IL-18, as well as the expression of CD14, LBP, TNF-α, IL-1 and IL-18 mRNA (P < 0.05 or P < 0.01). Fatty degeneration was still observed in TP and EGCG treatment group, but focal necrosis and inflammatory cell infiltration disappeared.
CONCLUSION: TP and EGCG can protect liver against necrosis and inflammation induced by alcohol, and the mechanism may involve its effect on the reduction of plasma endotoxia, and inhibition of Kupffer cell activity and proinflammatory cytokine expression and secretion.
- Citation: Zhou XR, Gong ZJ, Yuang GJ, Zhang P. Effects of tea polyphenols on alcoholic liver injury in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 50-56
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/50.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.50
许多研究证明内毒素是酒精性肝损伤的重要致病机制, 已知实验性及人酒精性肝损伤的内毒素浓度增加[1,2], 内毒素通过与存在于kupffer细胞膜上的受体CD14结合而激活Kupffer细胞, 从而促发信号级联反应, 合成和释放大量炎症介质, 从而导致肝损伤[3,4]. 因此, 防止内毒素血症是预防酒精性肝损伤的一个重要措施. 绿茶中含有丰富的多酚化合物儿茶素, 表没食子酸没食子酸儿茶素(EGCG)是儿茶素的主要成分, 具有许多重要的生物功能, 如抗氧化, 抗炎症等作用[5,6]. 文献报道绿茶可保护酒精性肝损伤[7,8], 然而其机制尚未阐明. 我们用鱼油加酒精灌胃制作大鼠酒精性肝损伤模型, 观察茶多酚及EGCG对酒精性肝损伤的影响, 以及对肝组织CD14、LBP、TNF-α、IL-1及IL-18的表达与内毒素血症的影响, 从而探讨其作用机制.
SPF级SD大鼠由武汉大学医学院实验动物中心提供, 体质量150±10 g, ♀. 560 mL/L酒精和鱼油购自武汉华联超市. 茶多酚及EGCG(四川乐山茶叶有限公司), 肝功能试剂盒(柏定生物工程有限公司). 大鼠肿瘤坏死因子α(TNFα)、白介素1(IL-1)、白介素18(IL-18)ELISA试剂盒购自上海森雄科技实业有限公司, 内毒素定量检测试剂盒购自上海伊华临床医学科技公司. TrizoL试剂购自Invitrogen公司; 600 bp DNA ladder Marker购自TaKaRa生物技术有限公司; M-MLV逆转录酶及其缓冲液, 10 mmol/L dNTPS, oligo(dT)15随机引物购自Promega公司; Taq DNA聚合酶及其缓冲液, 核糖核酸酶抑制剂(RNasin)购自Biostar公司; CD14、LBP、TNF-α、IL-1、IL-18及GAPDH的PCR引物由上海赛百盛公司合成.
1.2.1 酒精性肝损伤大鼠模型的建立[9]及药物干预: 48只SD大鼠随机分为6组, 分别为正常对照组, 酒精性肝病模型组, 茶多酚治疗Ⅰ组、Ⅱ组, EGCG治疗Ⅰ组、Ⅱ组, 每组8只大鼠. 大鼠在动物室普食喂养1 wk后开始实验. 除正常对照组外, 其他大鼠每日予酒精+0.5 mL鱼油灌胃, 酒精剂量开始为6 g/kg, 1 wk内递增8 g/kg, 再维持4 wk, 正常对照组大鼠则灌等热量的葡萄糖+0.5 mL鱼油. 茶多酚治疗Ⅰ、Ⅱ组及EGCG治疗Ⅰ、Ⅱ组另外再分别予以200 mg/kg及100 mg/kg茶多酚(溶入0.5 mL水)灌胃及100 mg/kg、50 mg/kg EGCG(溶入0.5 mL水)灌胃, 模型组仅灌等量水. 实验过程中大鼠自由饮水, 进标准饮食, 所有大鼠于第5周末麻醉后处死, 腹主动脉取血, 采集血液标本, 部分血液(约1 mL)用无菌抗凝管收集, 部分血液分离血清-20 ℃保存. 放血后, 立即剖腹取肝脏, 部分肝脏标本放于-70 ℃冻存用于做RT-PCR, 部分放入40 g/L甲醛固定用于组织病理学检测.
1.2.2 组织病理学检测: 将肝组织标本, 剪成大小约0.5 cm×0.5 cm×0.3 cm, 放入40 g/L甲醛固定12-24 h, 然后脱水、透明, 石蜡包埋, 切片, 切成约5 µm厚, HE染色, 评价肝组织的脂肪变性、炎症坏死等病理变化.
1.2.3 血清转氨酶与TNF-α、IL-1、IL-18测定: 血液凝固后, 1 000 r/min离心10 min, 于-20 ℃保存. 血清丙氨酸氨基转移酶(ALT)采用RA1000全自动生化分析仪(日本)测定. 血清TNF-α、IL-1、IL-18测定采用双抗体夹心ABC-ELISA法, 具体操作参照ELISA试剂盒说明书进行, 应用酶标仪在492 nm波长处测A值, 建立回归方程求标本血清中上述因子的浓度.
1.2.4 血浆内毒素测定: 收集于肝素抗凝的无菌试管的血液(约1 mL), 500 r/min离心5 min, 取0.1 mL血浆, 加入无热原生理盐水0.2 mL、Tris-HCl缓冲液0.2 mL混匀, 置于100 ℃水浴加热10 min去除潜在内毒素抑制剂, 然后3 000 r/min离心10 min, 取上清液检测. 具体操作参照参照试剂盒说明书进行, 于545 nm波长处测A值, 建立回归方程求标本中内毒素浓度.
1.2.5 RT-PCR检测肝组织CD14、TNF-α、IL-1、IL-18表达: 按Trizol试剂盒说明书的要求和方法从约50-100 mg冻存肝组织中提纯总RNA. RNA沉淀后, 用无RNAse缓冲液溶解, 使用紫外分光光度计测定A260和A280, 计算RNA的浓度和纯度.
cDNA采用下列方法从总RNA中合成. 2 mg RNA加0.5 mg oligo(dT)15随机引物及DEPC处理水至总体积15 mL 70 ℃孵育5 min, 随后在冰上迅速冷却. 然后依次加入5 mL M-MLV缓冲液, 1.25 mL dNTPS(10 mmol/L), Rnasin 25 U, 200 UM-MLV逆转录酶以及DEPC处理的水至总体积25 mL. 反应在42 ℃中进行60 min, 随后85 ℃ 5 min终止, 并于冰箱中4 ℃保存. 合成的cDNA用作PCR扩增的模板.
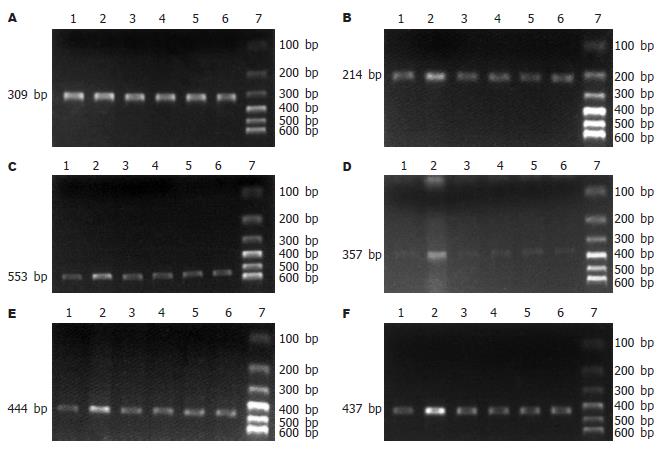
PCR反应体系包括: 10×Taq缓冲液5 mL, dNTP(10 mmol/L)1 mL, 基因特异性引物(表1, 正义链及反义链, 各25 mmol/L)1 mL, 2.0 U Taq DNA聚合酶及cDNA 1 mL, 加水至总体积50 mL. 反应过程如下: 初始94 ℃孵育3 min, 随后35个循环, 包括94 ℃变性45 s, 54 ℃或55 ℃退火45 s, 72 ℃延伸1 min, 最后在72 ℃延伸7 min. 为了保证用于PCR反应的cDNA量一致, 采用看家基因GAPDH作内参照. 将能获得等量的GAPDH PCR扩增产物的cDNA用作扩增目的产物. PCR后, 取产物5 mL在20 g/L琼脂糖凝胶中电泳, 溴乙锭染色, 紫外光下观察. 采用法国VL凝胶成像及分析系统进行PCR产物半定量分析.
| 基因 | 正义链 | 反义链 | 分子量大小 |
| CD14 | 5'-CTTGTTGCTGTTGCCTTTGA-3' | 5'-CGTGTCCACACGCTTTAGAA-3' | 214 bp |
| LBP | 5'-GAGGCCTGAGTCTCTCCATCT-3' | 5'-TCTGAGATGGCAAAGTAGACC-3' | 553 bp |
| TNF-α | 5'-GCCAATGGCATGGATCTCAAAG-3' | 5'-CAGAGCAATGACTCCAAAGT-3' | 357 bp |
| IL-1 | 5'-CAGGATGAGGACCCAAGCACC-3' | 5'-CTGTGCAGACTCAAACTCCAC-3' | 444 bp |
| IL-18 | 5'-ACTGTACAACCGCAGTAATAC-3' | 5'-AGTGAACATTACAGATTTATCCC-3' | 437 bp |
| GAPDH | 5'-TCCCTCAAGATTGTCAGCAA-3' | 5'-AGATCCACAACGGATACATT-3' | 309 bp |
统计学处理 应用SPSS 11.5统计软件进行统计学分析, 计量资料以mean±SD表示, 进行方差齐性检验后采用单因素组间方差分析, P<0.05有统计学意义.
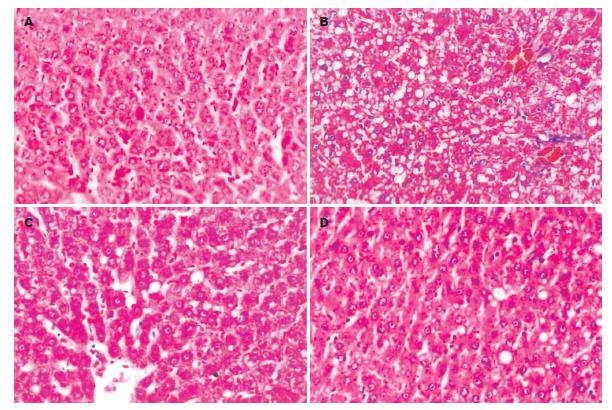
对照组肝脏肝小叶结构正常, 肝细胞条索排列规则有序, 偶见脂肪滴, 但未见炎症与坏死. 模型组肝脏肝小叶结构紊乱, 肝细胞中度脂肪变性, 少量呈点状坏死灶, 间质中有炎性细胞浸润. 四个治疗组较模型组肝组织仍见肝细胞脂肪变性, 但未见炎性细胞浸润及肝细胞坏死, 肝小叶结构正常(图1).
模型组大鼠血清ALT值显著高于对照组及各治疗组(P<0.01), 各治疗组及对照组之间ALT水平差异无统计学意义(P>0.05). 模型组大鼠血清TNF-α、IL-1、IL-18高于对照组及各治疗组(P<0.05或P<0.01), 各治疗组之间及对照组TNF-α、IL-1、IL-18水平差异无统计学意义(P>0.05)(表2).
| 组别 | ALT | TNF-α | IL-1 | IL-18 | 内毒素 |
| 对照组 | 1 002.20±116.36 | 3.80±0.31 | 3.10±0.06 | 41.95±0.09 | 0.08±0.01 |
| 模型组 | 2 729.71±659.30b | 14.60±0.09b | 3.53±0.14a | 45.94±1.88a | 0.31±0.10b |
| 茶多酚Ⅰ组 | 1 234.41±368.57 | 3.70±0.40 | 3.10±0.05 | 42.49±1.62 | 0.14±0.01c |
| 茶多酚Ⅱ组 | 1 194.57±111.02 | 3.90±0.18 | 3.14±0.03 | 41.64±0.82 | 0.17±0.01ac |
| EGCGⅠ组 | 963.53±122.19 | 3.60±0.25 | 3.19±0.01 | 42.25±0.79 | 0.15±0.04c |
| EGCGⅡ组 | 930.19±170.53 | 3.78±0.38 | 3.13±0.12 | 42.95±1.46 | 0.17±0.08ac |
所有组大鼠血浆均可检测到内毒素, 但慢性酒精灌胃后大鼠出现内毒素血症. 对照组大鼠血浆内毒素水平为0.08±0.01×103 EU/L. 酒精组大鼠血浆内毒素水平是0.31±0.05×103 EU/L, 显著高于对照组(4倍升高)(P<0.01). 各治疗组大鼠血浆内毒素水平与酒精组相比明显下降(P<0.01), 但茶多酚治疗Ⅱ组、EGCG治疗Ⅱ组仍高于对照组(P<0.05), 各治疗组间差异无显著性(P>0.05)(表2).
对照组大鼠肝组织有微弱的CD14、LBP、TNF-α、IL-1、IL-18 mRNA表达, 模型组大鼠肝组织CD14、LBP、TNF-α、IL-1、IL-18 mRNA表达水平明显增加(P<0.01). 高、低剂量茶多酚或EGCG同时治疗显著抑制了CD14、TNF-α、IL-1、IL-18 mRNA的表达(P<0.01)(图2, 表3).
| 组别 | CD14 | LBP | TNF-α | IL-1 | IL-18 |
| 对照组 | 0.659±0.082 | 0.591±0.102 | 0.691±0.034 | 0.683±0.078 | 0.504±0.082 |
| 模型组 | 1.007±0.090a | 0.862±0.029a | 1.016±0.087a | 1.014±0.080a | 1.124±0.093a |
| 茶多酚Ⅰ组 | 0.643±0.064 | 0.645±0.075 | 0.684±0.078 | 0.694±0.041 | 0.578±0.102 |
| 茶多酚Ⅱ组 | 0.677±0.101 | 0.626±0.021 | 0.732±0.074 | 0.736±0.070 | 0.563±0.041 |
| EGCGⅠ组 | 0.546±0.096 | 0.626±0.057 | 0.666±0.081 | 0.704±0.082 | 0.522±0.099 |
| EGCGⅡ组 | 0.698±0.083 | 0.650±0.081 | 0.662±0.052 | 0.791±0.053 | 0.597±0.068 |
长期摄入酒精可引起肠源性内毒素血症[10], 本实验结果显示长期酒精灌胃大鼠其体内内毒素水平与对照组相比较显著升高(P<0.01). 内毒素不仅可以直接损害肝细胞, 还与血浆中的内毒素结合蛋白(LBP)结合形成LPS-LBP复合物, 该复合物通过与Kupffer细胞膜上的受体CD14结合激活该细胞. LBP为肝脏合成的一种急性期血清蛋白, 正常情况下合成很少, 应激情况下合成明显增加, Su et al[11]发现LBP、CD14水平增高与酒精性肝损伤的程度有关, LBP抑制肽通过抑制LBP可减少内毒素对巨噬细胞的激活[12]. 本研究结果显示酒精处理大鼠肝组织与对照组相比较其LBP、CD14表达明显增强, 与其他报道相一致[13,14]. Kupffer细胞被激活后可合成和释放大量致炎细胞因子如: TNF-α、IL-1等, 同时也抑制了抗炎细胞因子如: IL-10、IL-4的表达[15], 从而打破肝脏致炎与抗炎细胞因子之间的平衡, 促进了肝损伤[16]. IL-18是新近发现的一种细胞因子, 可诱导Th1细胞产生TNF-α、IL-1等细胞因子[17], 在诱导炎性损伤方面具有十分重要的作用. Rana et al[18]用酒精干预大鼠, 发现其肠组织IL-18表达增高, Takeuchi et al[19]用IL-18中和抗体处理大鼠可阻碍其缺血再灌注损伤. 本研究ELISA结果显示长期酒精灌胃大鼠血清TNF-α、IL-1、IL-18水平升高, 与对照组相比较有统计学意义; RT-PCR结果亦显示, 长期酒精处理大鼠与对照组相比较其肝组织TNF-α、IL-1、IL-18 mRNA表达显著增强, 肝组织细胞因子mRNA表达的变化与血浆细胞因子水平相平行, 该结果与Hill et al[20]的报道相一致. ALT水平升高是肝细胞损伤的标志, 与正常对照组相比较本实验模型组大鼠ALT水平显著升高. 另外, 肝组织病理观察发现模型组肝细胞呈中度脂肪变性, 少量呈点状坏死灶, 间质中有炎性细胞浸润. 以上结果说明酒精处理大鼠后, 内毒素血症激活Kupffer细胞释放一系列促炎细胞因子并抑制抗炎细胞因子表达, 促进了肝损伤.
因此, 防止内毒素血症、阻断枯否细胞激活、抑制促炎细胞因子的表达是预防酒精性肝损伤的重要策略. 既往研究证明: 通过饮食含乳酸杆菌食物或用多黏酶素B或新霉素等抗生素减少内毒素的生成, 明显减轻了实验性酒精性肝病的严重程度[21,22]; 封闭阻断Kupffer细胞阻断内毒素引发的信号级联, 可在很大程度上阻断酒精性肝损伤的发生[23,24]; 应用TNF-α抑制剂降低TNF-α水平可减轻酒精性肝损伤[25,26]. 以上药品可能具有其他毒副作用. 绿茶是一类普遍存在于自然界的黄酮类物质, 茶多酚是茶叶药效的主要活性成分, 占茶叶干质量的20-35%, 其主要组分为儿茶素, 占其总量的80%左右, 其中EGCG含量最高, 占儿茶素的50%左右[27]. 已有研究证实以绿茶为代表的传统饮料有利于人体健康[28], 绿茶萃取物具有许多重要的生物功能, 如抗氧化, 抗炎症等作用[5,6], 安全无明显毒副作用. 据报道, EGCG可抑制LPS诱导巨噬细胞系RAW264.7细胞或小鼠腹腔巨噬细胞的TNF-α的产生[29], Dobrzynsk et al[30]发现绿茶减轻了酒精引起的肝细胞膜结构与功能的变化. 本研究中, 茶多酚及EGCG高、低剂量分别同时处理后, 四个治疗组大鼠与模型组相比较血浆内毒素水平明显降低, CD14、LBP、TNF-α、IL-1、IL-18 mRNA的表达亦显著减弱, 血清细胞因子水平的变化与其mRNA的表达相一致, 纠正了酒精导致的致炎-抗炎细胞因子之间的平衡破坏, 防止了酒精性肝损伤, 表现为血清ALT水平下降、肝细胞坏死消失、炎症减轻, 与其他报道相一致[7,10].
总之, 本研究表明, 茶多酚及EGCG可减轻酒精性肝损伤, 其可能机制包括降低内毒素血症, 抑制Kupffer活性与促炎细胞因子的表达与分泌.
近年来酒精性肝病发病率及死亡率在我国呈增长趋势, 已成为仅次于病毒性肝炎的第二大肝病病种. 而内毒素血症是酒精性肝病的重要致病机制.
绿茶多酚可以减轻酒精对肝脏的损伤, 本文着重研究绿茶多酚减轻酒精性肝损伤所涉及到的部分机制(内毒素、ALT、CD14、LBP、TNF-α、IL-1、IL-18).
1 Baltaziak M, Skrzydlewska E, Sulik A, Famulski W, Koda M. Green tea as an antioxidant which protects against alcohol induced injury in rats - a histopatholo-gical examination. Folia Morphol 2004; 63: 123-126
2 Arteel GE, Uesugi T, Bevan LN, Gabele E, Wheeler MD, McKim SE, Thurman RG. Green tea extract protects against early alcohol-induced liver injury in rats. Biol Chem 2002; 383: 663-670
有文献报道绿茶可减轻酒精性肝损伤, 但未阐明其作用机制. 本文研究了绿茶多酚对内毒素血症、ALT、CD14、LBP、TNF-α、IL-1、IL-18的影响, 以探讨茶多酚的作用机制.
绿茶普遍存在于自然界, 安全无毒副作用, 具有抗氧化、抗炎作用, 绿茶及其成份制剂作为一种肝细胞保护剂可在不久的将来应用于临床.
文章较完整地评价了绿茶多酚对实验性酒精性肝损伤的治疗作用, 具有一定的创新之处.
电编: 张敏 编辑:潘伯荣 审读:张海宁
| 1. | Enomoto N, Ikejima K, Bradford B, Rivera C, Kono H, Brenner DA, Thurman RG. Alcohol causes both tolerance and sensitization of rat Kupffer cells via mechanisms dependent on endotoxin. Gastroenterology. 1998;115:443-451. [PubMed] |
| 2. | Urbaschek R, McCuskey RS, Rudi V, Becker KP, Stickel F, Urbaschek B, Seitz HK. Endotoxin, endotoxin-neutralizing-capacity, sCD14, sICAM-1, and cytoki-nes in patients with various degrees of alcoholic liver disease. Alcohol Clin Exp Res. 2001;25:261-268. [PubMed] |
| 3. | Thurman RG. II. Alcoholic liver injury involves acti-vation of Kupffer cells by endotoxin. Am J Physiol. 1998;275:G605-G611. [PubMed] |
| 4. | Wheeler MD. Endotoxin and Kupffer cell activation in alcoholic liver disease. Alcohol Res Health. 2003;27:300-306. [PubMed] |
| 5. | Higdon JV, Frei B. Tea catechins and polyphenols: health effects, metabolism, and antioxidant functi-ons. Crit Rev Food Sci Nutr. 2003;43:89-143. [PubMed] |
| 6. | Tedeschi E, Suzuki H, Menegazzi M. Antiinflamma-tory action of EGCG, the main component of green tea, through STAT-1 inhibition. Ann N Y Acad Sci. 2002;973:435-437. [PubMed] |
| 7. | Baltaziak M, Skrzydlewska E, Sulik A, Famulski W, Koda M. Green tea as an antioxidant which protects against alcohol induced injury in rats-a histopatho-logical examination. Folia Morphol. 2004;63:123-126. [PubMed] |
| 8. | Arteel GE, Uesugi T, Bevan LN, Gabele E, Wheeler MD, McKim SE, Thurman RG. Green tea extract protects against early alcohol-induced liver injury in rats. Biol Chem. 2002;383:663-670. [PubMed] |
| 9. | Tsukamoto H, Reidelberger RD, French SW, Largman C. Long-term cannulation model for blood sampling and intragastric infusion in the rat. Am J Physiol. 1984;247:R595-R599. [PubMed] |
| 10. | Bode C, Bode JC. Effect of alcohol consumption on the gut. Best Pract Res Clin Gastroenterol. 2003;17:575-592. [PubMed] |
| 11. | Su GL, Rahemtulla A, Thomas P, Klein RD, Wang SC, Nanji AA. CD14 and lipopolysaccharide bind-ing protein expression in a rat model of alcoholic liver disease. Am J Pathol. 1998;152:841-849. [PubMed] |
| 12. | Wu X, Qian G, Zhao Y, Xu D. LBP inhibitory pep-tide reduces endotoxin-induced macrophage activa-tion and mortality. Inflamm Res. 2005;54:451-457. [PubMed] |
| 13. | Zuo G, He S, Liu C, Gong J. Expression of lipopolys-accharide binding protein and lipopolysaccharide receptor CD14 in experimental alcoholic liver disea-se. Zhonghua Ganzangbing Zazhi. 2002;10:207-210. [PubMed] |
| 14. | Dai LL, Gong JP, Zuo GQ, Wu CX, Shi YJ, Li XH, Peng Y, Deng W, Li SW, Liu CA. Synthesis of endo-toxin receptor CD14 protein in Kupffer cells and its role in alcohol-induced liver disease. World J Gastroenterol. 2003;9:622-626. [PubMed] |
| 15. | Ronis MJ, Butura A, Sampey BP, Shankar K, Prior RL, Korourian S, Albano E, Ingelman-Sundberg M, Petersen DR, Badger TM. Effects of N-acetylcysteine on ethanol-induced hepatotoxicity in rats fed via total enteral nutrition. Free Radic Biol Med. 2005;39:619-630. [PubMed] |
| 16. | Nanji AA, Jokelainen K, Rahemtulla A, Miao L, Fogt F, Matsumoto H, Tahan SR, Su GL. Activation of nuclear factor kappa B and cytokine imbalance in experimental alcoholic liver disease in the rat. Hepatology. 1999;30:934-943. [PubMed] |
| 17. | Neighbors M, Xu X, Barrat FJ, Ruuls SR, Churakova T, Debets R, Bazan JF, Kastelein RA, Abrams JS, O'Garra A. A critical role for interleukin 18 in primary and memory effector responses to Listeria monocytogenes that extends beyond its effects on In-terferon gamma production. J Exp Med. 2001;194:343-354. [PubMed] |
| 18. | Rana SN, Li X, Chaudry IH, Bland KI, Choudhry MA. Inhibition of IL-18 reduces myeloperoxidase activity and prevents edema in intestine following alcohol and burn injury. J Leukoc Biol. 2005;77:719-728. [PubMed] |
| 19. | Takeuchi D, Yoshidome H, Kato A, Ito H, Kimura F, Shimizu H, Ohtsuka M, Morita Y, Miyazaki M. Interleukin 18 causes hepatic ischemia/reperfusion injury by suppressing anti-inflammatory cytokine expression in mice. Hepatology. 2004;39:699-710. [PubMed] |
| 20. | Hill DB, D'Souza NB, Lee EY, Burikhanov R, Deaciuc IV, de Villiers WJ. A role for interleukin-10 in alcohol-induced liver sensitization to bacterial lipopolysaccharide. Alcohol Clin Exp Res. 2002;26:74-82. [PubMed] |
| 21. | Adachi Y, Moore LE, Bradford BU, Gao W, Thurman RG. Antibiotics prevent liver injury in rats following long-term exposure to ethanol. Gastroenterology. 1995;108:218-224. [PubMed] |
| 22. | Nanji AA, Khettry U, Sadrzadeh SM. Lactobacillus feeding reduces endotoxemia and severity of exper-imental alcoholic liver (disease). Proc Soc Exp Biol Med. 1994;205:243-247. [PubMed] |
| 23. | Yin M, Bradford BU, Wheeler MD, Uesugi T, Froh M, Goyert SM, Thurman RG. Reduced early alcohol-induced liver injury in CD14-deficient mice. J Immunol. 2001;166:4737-4742. [PubMed] |
| 24. | Enomoto N, Takei Y, Hirose M, Ikejima K, Miwa H, Kitamura T, Sato N. Thalidomide prevents alcoholic liver injury in rats through suppression of Kupffer cell sensitization and TNF-alpha production. Gastroenterology. 2002;123:291-300. [PubMed] |
| 25. | Ponnappa BC, Israel Y, Aini M, Zhou F, Russ R, Cao QN, Hu Y, Rubin R. Inhibition of tumor necrosis factor alpha secretion and prevention of liver injury in ethanol-fed rats by antisense oligonucleotides. Biochem Pharmacol. 2005;69:569-577. [PubMed] |
| 26. | Ohata M, Suzuki H, Sakamoto K, Hashimoto K, Nakajima H, Yamauchi M, Hokkyo K, Yamada H, Toda G. Pioglitazone prevents acute liver injury induced by ethanol and lipopolysaccharide through the suppression of tumor necrosis factor-alpha. Alcohol Clin Exp Res. 2004;28:139S-144S. [PubMed] |
| 27. | Mukhtar H, Ahmad N. Tea polyphenols: prevention of cancer and optimizing health. Am J Clin Nutr. 2000;71:1698S-1702S. [PubMed] |
| 29. | Nanji AA, Miao L, Thomas P, Rahemtulla A, Khwaja S, Zhao S, Peters D, Tahan SR, Dannenberg AJ. Enhanced cyclooxygenase-2 gene expression in alcoholic liver disease in the rat. Gastroenterology. 1997;112:943-951. [PubMed] |
| 30. | Dobrzynska I, Sniecinska A, Skrzydlewska E, Figas-zewski Z. Green tea modulation of the biochemical and electric properties of rat liver cells that were affected by ethanol and aging. Cell Mol Biol Lett. 2004;9:709-721. [PubMed] |