修回日期: 2005-10-28
接受日期: 2005-10-31
在线出版日期: 2006-01-08
目的: 研究L02细胞移植到具有正常免疫活性的大鼠肝内的存活情况.
方法: SD大鼠出生前宫内腹腔注射正常人L02肝细胞, 诱导胎鼠对人L02肝细胞产生免疫耐受, 出生2 wk时经脾移植DiI染色后的人L02肝细胞, 建立人鼠嵌合肝动物模型. 采用免疫荧光、SP免疫组化、DiI荧光示踪等方法, 分别检测人白蛋白、特异性人增殖细胞核抗原PCNA(proliferating cell nuclear antigen)以及在荧光显微镜下观察人L02肝细胞在鼠肝内的分布.
结果: 于移植后1, 2, 4, 6, 8, 10 wk在荧光显微镜下观察到人L02肝细胞在鼠肝内的动态分布; 移植后2, 4, 6, 8 wk大鼠均检测出人白蛋白, 4 wk时分泌最多; 移植后2, 4, 6 wk检测出特异性人增殖细胞核抗原PCNA, 以4 wk发现PCNA阳性细胞最多.
结论: 移植的人L02肝细胞在具有正常免疫活性的免疫耐受鼠体内能够存活、增殖, 并产生人白蛋白.
引文著录: 林沪, 毛青, 王宇明, 蒋业贵, 邓国宏, 李俊刚, 刘国栋. L02 细胞建立人鼠嵌合肝动物模型. 世界华人消化杂志 2006; 14(1): 19-24
Revised: October 28, 2005
Accepted: October 31, 2005
Published online: January 8, 2006
AIM: To investigate whether human L02 hepa-tocytes can survive after implantation to the normal, immunocompetent rats.
METHODS: Human L02 hepatocytes were injected into the peritoneal cavities of fetal Sprague Dawley rats to induce immune tolerance to human L02 hepatocytes. After DiI staining, the hepatocytes were implanted to the 2-week rats via the spleen. Immuno-fluorescent staining, SP immunohistochemistry, and DiI staining were used to detect human albumin and specific proliferating cell nuclear antigen (PCNA) in the rat liver. The distribution of human L02 hepatocytes was observed under fluorescent microscope.
RESULTS: Dynamic distribution of human L02 hepatocytes in the rat livers was observed from 1st to 10th week after implantation. Human albumin was detected at 2, 4, 6, and 8 wk, and the most content appeared at 4 wk. Specific human PCNA was detected in the rat livers from the 2nd to 6th week after implantation. There were the most PCNA positive cells at the 4th week.
CONCLUSION: Human L02 hepatocytes can survive for 10 wk and proliferate after implantation to the normal, immunocompetent rats.
- Citation: Lin H, Mao Q, Wang YM, Jiang YG, Deng GH, Li JG, Liu GD. Establishment of an animal model of tolerant rats with chimeric human livers by human L02 hepatocytes. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 19-24
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/19.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.19
肝炎病毒感染具有明显的种属特异性, 其易感宿主局限于人及黑猩猩等高级灵长类动物, 黑猩猩、猕猴、树鼩以及一些转基因动物模型等因为各种原因而限制了其应用[1]. 肝细胞移植是当前最热门的研究课题, 包括自体肝细胞、同种异体和异种肝细胞移植, 相关技术发展迅速. 人鼠嵌合肝是利用人肝细胞异种移植到受体鼠肝内建立的新型动物模型, 解决了肝炎病毒感染的种属特异性问题, 可应用于已知和未知肝炎病毒感染的研究. 其受体可分为免疫缺陷小鼠[2]或诱导免疫耐受大鼠[3]. 我们采用宫内注射人L02肝细胞, 诱导胎鼠对人L02肝细胞产生免疫耐受, 出生后移植人L02肝细胞, 从而建立人鼠嵌合肝动物模型.
生育期SD大鼠6只, 购自第三军医大学实验动物中心. 交配后孕鼠单独关养. 选择SD大鼠孕龄15-17 d, 体质量250-300 g者为实验对象. SD孕鼠随机分2组, 所产胎鼠各约30只: 实验组胎鼠出生前经L02细胞诱导耐受, 出生2 wk移植L02细胞; 对照组胎鼠出生前经L02细胞诱导耐受, 出生2 wk未移植L02肝细胞, 以及正常生产的大鼠. 人L02细胞属于人正常肝细胞, 购自中国科学院上海细胞生物学研究所, 液氮保存. 实验前置于RPMI 1640培养液, 加入胰酶酶解, 移入离心管, 加入PBS, 1 100 r/min, 离心3 min, 重复2次; 重新混悬于培养液. 于倒置相差显微镜下用血细胞记数板计算肝细胞的数量, 台盼蓝拒染法计算胎肝细胞的存活率, 超过80%的用于实验.
诱导胎鼠免疫耐受. 对孕龄15-17 d的SD大鼠进行乙醚吸入麻醉. 碘复消毒皮肤, 铺巾, 自孕鼠腹白线逐层依次剪开, 暴露子宫. 用1 mL注射器将50 μL人L02细胞培养液(含1×108个细胞)缓慢经孕鼠子宫壁注射到胎鼠腹腔内, 逐层缝合孕鼠腹腔. 至孕鼠自然生产. DiI荧光染色: 用无水乙醇溶解DiI使浓度为1 mmoL/L; 用0.22 μm的一次性过滤器过滤后, 室温密闭避光保存; 用时在1 mL细胞悬液中, 加入5 μL DiI 溶液, 置37 ℃ 50 mL/L CO2孵箱内孵育标记40 min; 将标记细胞进行离心, 1 100 r/min×3 min, 共3次, 弃去上清, 每次均用37 ℃预温PBS液重悬; 经4 g/L台盼蓝染色计数后, 用PBS液调整细胞浓度为1.0×1012/L; 于荧光显微镜诺丹明滤片下进行荧光观察并照相后送移植. 出生2 wk的实验组胎鼠, 乙醚吸入麻醉, 碘复消毒皮肤, 铺巾, 自孕鼠腹白线逐层依次剪开, 暴露脾, 自脾系膜缘进针, 向脾体和脾尾方向, 将100 μL经DiI染色的L02细胞培养液缓慢注入, 轻压注射点, 防止出血和渗液. L02细胞移植后1 wk取标本, 2 wk开始每2 wk取1次标本, 每次每组取4只大鼠收集标本. 大鼠在乙醚吸入麻醉下行肝部分切除术, 新鲜肝组织送冰冻切片, 在荧光显微镜诺丹明滤片下观察; 部分组织用40 g/L中性福尔马林固定, 送石蜡包埋切片做免疫组化染色. 术后大鼠继续喂养.
1.2.1 DiI荧光示踪法: 用DiI染色L02肝细胞后, 移植前于荧光显微镜诺丹明滤片下观察; L02细胞移植后, 大鼠取新鲜肝组织送冰冻切片, 在荧光显微镜下观察.
1.2.2 免疫荧光检测肝组织人白蛋白: 肝部分切除术获取新鲜肝组织, 用冰冻切片4-8 μm, 室温放置30 min后, 入4 ℃丙酮固定10 min, 37 ℃下100 mL/L封闭血清孵育20 min以阻断非特异染色, 滴加鼠抗人白蛋白单克隆抗体(Sigma公司, 滴度1:400), 37 ℃孵育60 min或4 ℃过夜, 然后加荧光标记二抗(FITC标记山羊抗大鼠IgG, 滴度1:100), 37 ℃暗室下孵育45 min. 以上每步均用PBS洗涤. 用900 mL/L缓冲甘油封片, 荧光显微镜下用蓝色滤光片观察. PBS替代一抗作阴性对照.
1.2.3 检测肝组织特异性人PCNA: 采用链霉菌亲生物素-过氧化酶法(SP法)免疫组织化学染色(PV-9000试剂盒, 中山公司). 肝部分切除术获取新鲜肝组织, 用40 g/L中性福尔马林固定, 石蜡包埋后切片, 60 ℃烤箱中烤1-2 h, 脱蜡至水, 加入含0.5 g/L的Triton×100的PBS室温下孵育5 min对细胞打孔, 37 ℃下30 mL/L过氧化氢孵育20 min阻断内源性过氧化物酶, 特异性人增殖细胞核抗原单克隆抗体(Chemicon公司)4 ℃过夜, 然后加聚合物辅助剂和辣根酶标记羊抗鼠IgG多聚体. 底物用DAB显色, 苏木素复染, 中性树胶封片, 光镜下观察. PBS替代一抗作阴性对照.
若实验鼠太小, 无法活体取肝组织且不易继续喂养, 故在实验鼠出生2 wk时经脾移植L02细胞. 实验组1只大鼠因麻醉过量死亡; 对照组2只大鼠因麻醉过量死亡. 其余大鼠营养及生长状况良好.
DiI染色的阳性细胞在绿色滤光片下显示红色荧光, 细胞均匀着色呈圆形或椭圆形, 不能区分胞核与胞质. 实验组的4只实验大鼠1, 2, 4, 6, 8 wk均可检测出(图1), 10 wk有2只大鼠可见较微弱的荧光细胞, 其他2只均阴性, 4只大鼠12 wk均未再检出. DiI荧光示踪显示荧光细胞移植到大鼠肝后, 数目逐渐减少, 亮度逐渐减弱. 移植后1 wk的DiI荧光显示: 荧光染色区域较多, 有的区域密集分布, 荧光亮度大, 提示移植的L02肝细胞较多; 有的区域散在分布, 提示移植的L02肝细胞相对较少. 移植后2 wk和4 wk的DiI荧光显示: 荧光染色区域较多, 未见密集分布, 可见荧光散在分布. 移植后8 wk的DiI荧光显示: 荧光细胞较少, 可见少量荧光点状分布, 荧光亮度明显减弱. 对照组大鼠未见荧光L02细胞.
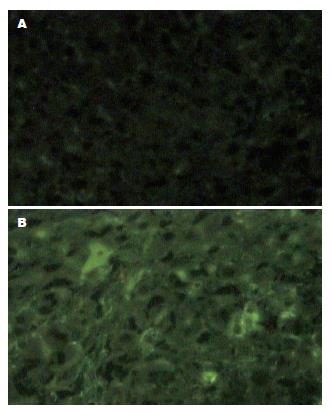
FITC标记荧光二抗, 阳性细胞在蓝色滤光片下显示为绿色荧光. 与周围大鼠肝细胞界限清楚, 胞核未着色. 移植L02细胞后2 wk的大鼠肝组织中即能检测到合成人白蛋白的L02细胞; 实验组的4只实验大鼠2, 4, 6 wk均可检测出合成人白蛋白的L02细胞, 以4 wk发现绿色荧光细胞最多(图2); 8 wk有3只大鼠可见绿色荧光细胞, 1只为阴性. 4只大鼠10 wk均未再检出. 对照组的大鼠未能发现绿色荧光的L02细胞.
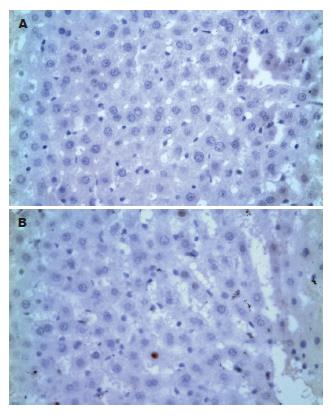
特异性人PCNA阳性的细胞核DAB显色后为棕色. 移植L02细胞后2 wk的大鼠肝组织中能检测到特异性人PCNA; 实验组的4只实验大鼠2, 4, 6 wk均可连续检测出特异性人PCNA, 以4 wk发现PCNA阳性细胞最多(图3). 4只大鼠8 wk均未再检出. 对照组的大鼠未能发现细胞核为棕色的特异性人PCNA.
肝细胞移植后会产生不同程度的排斥反应, 异种肝细胞移植到有免疫活性的动物体内会因宿主免疫系统的T淋巴细胞激活和迟发性超敏反应而排斥供体细胞[4], 为建立长期有效的动物模型, 可选用免疫缺陷鼠, 或在正常免疫系统上诱导针对移植物特异耐受的老鼠. 但是, 因免疫系统在肝炎病毒的发病机制中占重要地位, 免疫缺陷小鼠杂交的紊乱及新生SCID小鼠较高的死亡率, 使其操作较困难[5], 所以, 免疫缺陷鼠因不能应用于机体和病毒作用机制的研究而受限[6]. 目前已有文献报道用宫内注射人造血干细胞的方法建立小鼠、绵羊等嵌合肝动物模型[7-9], 这类动物对于外源基因及其表达产物都产生了免疫耐受[10-12]. 国外近期有报道称生前胚胎免疫耐受的宿主可避免发生免疫排斥反应[13], 由于我们的人鼠嵌合肝模型建立在正常免疫系统上, 嵌合于鼠肝细胞中的是正常人肝细胞, 对多种肝炎致病因子易感, 因此可利用人鼠嵌合肝模型进行已知和未知肝炎致病因子的研究. 动物在胚胎发育时期免疫系统尚未成熟, 接触到外来抗原时, 可能由于"T淋巴细胞克隆消除"的原因[14], 会逐渐对这些抗原产生耐受, 因此, 先用人胎肝细胞诱导胎鼠对人肝细胞产生免疫耐受, 再把人肝细胞移植到正常大鼠肝内, 从而建立针对移植物耐受的动物模型[15]. Ouyang et al[16]采用孕15-17 d大鼠宫内胚胎腹腔注射人胎肝细胞, 出生后经脾移植人胎肝细胞, 首次建立了人鼠嵌合肝模型, 发现人白蛋白阳性持续6 wk, 我们的实验结果与其一致.
应用标记技术, 在荧光显微镜下移植肝细胞与受体肝细胞较易区别, 能直观地监测移植肝细胞的功能与转归、分布与存活. 国内较少使用荧光染料DiI标记肝细胞进行示踪研究. DiI是一种亲脂性碳花青荧光染料, 易嵌入生物质膜内并在膜内作侧向扩散运动, 或者通过胞饮作用进入胞质, 从而标记整个细胞[17]. DiI使用简便, 染色速度快, 一般只需1-20 min就可以使活体细胞均匀着色; 对活体细胞无毒性, 而且不从已标记的细胞转移到未标记的细胞, 且荧光衰减慢[18], 因此, DiI是一种可靠的荧光染料. 1986年Honig et al[19]首先将DiI引入神经系统的研究, 成功地显示了体外培养神经元的胞体和突起, 此后, DiI被广泛应用于神经通路的发育研究. Soriano et al[20]首先发现DiI亦可标记肝细胞, 从肝实质中辨别出被移植的肝细胞. 我们运用DiI对SD大鼠进行脾内肝细胞移植示踪观察, 发现经DiI标记的肝细胞容易从宿主组织中辨认出来, 荧光L02细胞移植到鼠肝后, 数目逐渐减少, 亮度逐渐减弱, 移植8 wk的荧光亮度明显减弱, 荧光点明显减少, 可能因为细胞分裂, 也可能意味着细胞死亡或其碎片为吞噬细胞吞噬. DiI动态显示了L02细胞的分布, 该荧光剂显示时间较长, 较好显示了L02细胞整合后的存活情况. 同时, 通过免疫组化观察发现, 植入肝细胞还表达了合成白蛋白及增殖功能. 该实验显示了DiI标记技术会因移植细胞增殖而造成荧光衰减, 并在我所体外传代实验中证实, 故该标记技术有待进行深入研究.
肝细胞的主要功能之一是合成白蛋白, 所以白蛋白的合成是判断肝细胞功能非常敏感的指标, 采用免疫组化技术从移植后2, 4, 6, 8 wk大鼠肝组织中检测出人白蛋白, 而对照组大鼠肝组织中无表达, 证明L02细胞不仅在大鼠肝组织中存活, 而且具有正常人肝细胞一定的生物学功能. 特异性人增殖期细胞核抗原PCNA又称周期蛋白, 是DNA聚合酶δ的一个亚基, 在静止期细胞中, 其量很少, G1晚期开始增加, S期达到高峰, G2-M明显下降[21]. 一般认为他可作为评价人移植肝细胞增殖状态的指标[22]. 我们从移植后2, 4, 6 wk大鼠肝组织中检出细胞核为棕色的PCNA阳性细胞, 表明此期间嵌合鼠体内有处于增殖期的人肝细胞存在, 说明PCNA单克隆抗体免疫组化研究方法简便, 阳性结果肯定, 用PCNA评价细胞的增殖状态具有实用性和可行性[23].
脾内肝细胞移植为效果比较确切的方法. 肝细胞脾内植入后随即迁移到受体肝窦内, 但大约70%被门静脉血内的巨噬细胞清除, 残留的移植肝细胞在穿过肝窦内皮层时失去其细胞膜缝隙连接, 这些细胞合成血管内皮生长因子及获得细胞膜再生[24], 在移植5 d后可观察到移植的肝细胞与宿主肝细胞间的缝隙连接及胆管样结构的重构, 意味着移植细胞成功整合需要5 d以上[25]. 移植肝细胞与宿主肝整合后, 可表达出白蛋白、胆汁的代谢和酶等功能. 我们在第1周未能测出人白蛋白及特异性人PCNA, 而荧光示踪可见阳性, 提示移植L02细胞虽已转移并整合至鼠肝内, 但尚未具备合成白蛋白和增殖的功能. 我们证实用人L02细胞宫内诱导胎鼠产生免疫耐受, 出生后移植到实验鼠肝内, 可成功建立针对移植物耐受的动物模型. 移植的L02细胞可以在嵌合鼠体内整合、增殖, 并具有一定的生物学功能. 通过不同时相点对4只实验鼠的检测, 发现人L02细胞在正常免疫活性的大鼠肝内存活未超过10 wk, 而国外报道其存活时间超过16 wk[26]. 为提高移植肝细胞在宿主肝内的生存时间和比例, 有待进一步应用倒千里光碱[27-29]等方法促进移植肝细胞的增殖, 从而建立长期有效的动物模型. 构建在正常免疫系统基础上的动物模型, 不再需要宿主的免疫缺陷或实施免疫抑制, 避免了免疫排斥的发生, 能够模拟病毒感染的全过程, 为进一步研究病毒性、代谢性肝病的发病机制、治疗药物及疫苗开发提供新的技术手段, 具有良好的前景与发展意义.
动物模型在了解和发展肝病学中发挥重要作用. 人HBV的易感宿主只局限于人及黑猩猩等高级灵长类动物. 黑猩猩、猕猴、长臂猿、树鼩等动物由于各种原因而受限. 由于肝细胞移植的迅速发展, 人鼠嵌合肝动物模型日益成为热点. 其受体可为免疫缺陷鼠或诱导免疫耐受鼠, 免疫缺陷鼠因不能应用于机体和病毒作用机制的研究而受限, 所以, 建立在正常免疫系统上的人鼠嵌合肝模型备受关注.
肝细胞移植研究是当前最热门的研究课题, 包括自体肝细胞、同种异体和异种肝细胞移植, 相关技术发展迅速. 肝细胞移植后会产生不同程度的排斥反应, 异种肝细胞移植到有免疫活性的动物体内会因宿主免疫系统的T淋巴细胞激活和迟发性超敏反应而排斥供体细胞. 动物在胚胎发育时期免疫系统尚未成熟, 接触到外来抗原时, 可能由于"T淋巴细胞克隆消除"的原因, 会逐渐对这些抗原产生耐受, 因此, 先用人胎肝细胞诱导胎鼠对人肝细胞产生免疫耐受, 再把人肝细胞移植到正常大鼠肝内, 从而建立针对移植物耐受的动物模型.
为进一步了解相关内容, 可查阅近期国外报道的参考文献:
1 Mizuguchi T, Mitaka T, Katsuramaki T, Hirata K. Hepatocyte transplan-tation for total liver repopulation. J Hepatobiliary Pancreat Surg 2005; 12: 378-385
2 Koenig S, Stoesser C, Krause P, Becker H, Markus PM. Liver repopulation after hepatocellular transplan-tation: integration and interaction of transplanted hepatocytes in the host. Cell Transplant 2005; 14: 31-40
诱导免疫耐受的人鼠嵌合肝动物模型在国内报道较少. 本研究进一步完善了对动物模型的检测手段, DiI示踪法动态显示了移植胎肝细胞在受体大鼠体内的生存及分布; PCNA检测了人肝细胞在嵌合肝中的增殖情况; 免疫荧光对人肝组织白蛋白的检测, 以上方法证明了L02细胞在具有正常免疫活性的人鼠嵌合肝内能够存活、增殖, 并具有一定的生物学功能.
构建在正常免疫系统基础上的人鼠嵌合肝动物模型, 可用于已知和未知肝炎致病因子的研究, 为研究病毒感染免疫应答、致病机制、抗病毒治疗和开发强效疫苗提供良好的平台.
"人鼠嵌合肝"是利用人肝细胞异种移植方法建立的新型动物模型, 是人肝细胞移植后在受体鼠体内形成的含有人和鼠两种肝细胞及其立体结构的混合肝. 目前成功应用的是成年人肝细胞或胚胎肝细胞, 受体为免疫缺陷小鼠或诱导免疫耐受大鼠. 二者均能初步建立HBV感染的人鼠嵌合肝动物模型.
电编: 张敏 编辑:潘伯荣 审读:张海宁
| 1. | Dandri M, Burda MR, Gocht A, Torok E, Pollok JM, Rogler CE, Will H, Petersen J. Woodchuck hepato-cytes remain permissive for hepadnavirus infec-tion and mouse liver repopulation after cryopreser-vation. Hepatology. 2001;34:824-833. [PubMed] |
| 2. | Mercer DF, Schiller DE, Elliott JF, Douglas DN, Hao C, Rinfret A, Addison WR, Fischer KP, Churchill TA, Lakey JR. Hepatitis C virus replication in mice with chimeric human livers. Nat Med. 2001;7:927-933. [PubMed] |
| 3. | Wu CH, Ouyang EC, Walton CM, Wu GY. Human hepatocytes transplanted into genetically immuno-competent rats are susceptible to infection by hepa-titis B virus in situ. J Viral Hepat. 2001;8:111-119. [PubMed] |
| 4. | Knolle PA, Gerken G. Local control of the immune response in the liver. Immunol Rev. 2000;174:21-34. [PubMed] |
| 5. | Brass V, Blum HE, Moradpour D. Of mice and men: a small animal model of hepatitis C virus replication. Hepatology. 2002;35:722-724. [PubMed] |
| 6. | Zhu Y, Yamamoto T, Cullen J, Saputelli J, Aldrich CE, Miller DS, Litwin S, Furman PA, Jilbert AR, Mason WS. Kinetics of hepadnavirus loss from the liver during inhibition of viral DNA synthesis. J Virol. 2001;75:311-322. [PubMed] |
| 7. | Casal ML, Wolfe JH. In utero transplantation of fetal liver cells in the mucopolysaccharidosis type VII mouse results in low-level chimerism, but over-expression of beta-glucuronidase can delay onset of clinical signs. Blood. 2001;97:1625-1634. [PubMed] |
| 8. | Huang SZ, Huang Y, Chen MJ, Zeng FY, Ren ZR, Zeng YT. Selection of in vitro produced, transgenic embryos by nested PCR for efficient production of transgenic goats. Theriogenology. 2001;56:545-556. [PubMed] |
| 9. | Noia G, Pierelli L, Bonanno G, Monego G, Perillo A, Rutella S, Cavaliere AF, Straface G, Fortunato G, Cesari E. The intracoelomic route: a new approach for in utero human cord blood stem cell transplantation. Fetal Diagn Ther. 2004;19:13-22. [PubMed] |
| 10. | Tran ND, Porada CD, Zhao Y, Almeida-Porada G, Anderson WF, Zanjani ED. In utero transfer and expression of exogenous genes in sheep. Exp Hematol. 2000;28:17-30. [PubMed] |
| 11. | Tran ND, Porada CD, Almeida-Porada G, Glimp HA, Anderson WF, Zanjani ED. Induction of stable prenatal tolerance to beta-galactosidase by in utero gene transfer into preimmune sheep fetuses. Blood. 2001;97:3417-3423. [PubMed] |
| 12. | Porada CD, Park P, Almeida-Porada G, Zanjani ED. The sheep model of in utero gene therapy. Fetal Diagn Ther. 2004;19:23-30. [PubMed] |
| 13. | Wu CH, Ouyang EC, Walton C, Wu GY. Liver cell transplantation - novel animal model for human hepatic viral infections. Croat Med J. 2001;42:446-450. [PubMed] |
| 14. | Kim HB, Shaaban AF, Milner R, Fichter C, Flake AW. In utero bone marrow transplantation induces donor-specific tolerance by a combination of clonal deletion and clonal anergy. J Pediatr Surg. 1999;34:726-729. [PubMed] |
| 15. | Wu GY, Konishi M, Walton CM, Olive D, Hayashi K, Wu CH. A novel immunocompetent rat model of HCV infection and hepatitis. Gastroenterology. 2005;128:1416-1423. [PubMed] |
| 16. | Ouyang EC, Wu CH, Walton C, Promrat K, Wu GY. Transplantation of human hepatocytes into tolerized genetically immunocompetent rats. World J Gastroenterol. 2001;7:324-330. [PubMed] |
| 17. | Gerashchenko BI, Howell RW. Flow cytometry as a strategy to study radiation-induced bystander effects in co-culture systems. Cytometry A. 2003;54:1-7. [PubMed] |
| 18. | Zhou BJ, Zhong CP, Gu YD, Zhang XH, Liang CM, Wu CQ. Effects of hepatectomized rat serum on the transdifferentiation of adult rat bone marrow cells into hepatocyte-like cells. Zhonghua Ganzangbing Zazhi. 2004;12:730-733. [PubMed] |
| 19. | Honig MG, Hume RI. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. J Cell Biol. 1986;103:171-187. [PubMed] |
| 20. | Soriano HE, Lewis D, Legner M, Brandt M, Baley P, Darlington G, Finegold M, Ledley FD. The use of DiI-marked hepatocytes to demonstrate orthotopic, intrahepatic engraftment following hepatocellular transplantation. Transplantation. 1992;54:717-723. [PubMed] |
| 21. | Majka J, Burgers PM. The PCNA-RFC families of DNA clamps and clamp loaders. Prog Nucleic Acid Res Mol Biol. 2004;78:227-260. [PubMed] |
| 22. | Muskhelishvili L, Latendresse JR, Kodell RL, Henderson EB. Evaluation of cell proliferation in rat tissues with BrdU, PCNA, Ki-67(MIB-5) immu-nohistochemistry and in situ hybridization for histo-ne mRNA. J Histochem Cytochem. 2003;51:1681-1688. [PubMed] |
| 23. | Zhou JM, Zhou JH, Deng ZH, Zheng H, Jiang HY, Cao HQ. Expression of survivin and proliferating cell nuclear antigen in human non-small cell lung cancer. Zhongnan Daxue Xuebao Yixueban. 2005;30:544-548. [PubMed] |
| 24. | Gupta S, Lee CD, Vemuru RP, Bhargava KK. 111Indium labeling of hepatocytes for analysis of short-term biodistribution of transplanted cells. Hepatology. 1994;19:750-757. [PubMed] |
| 25. | Koenig S, Stoesser C, Krause P, Becker H, Markus PM. Liver repopulation after hepatocellular transpl-antation: integration and interaction of transplanted hepatocytes in the host. Cell Transplant. 2005;14:31-40. [PubMed] |
| 26. | Wu CH, Ouyang EC, Walton C, Promrat K, Forouhar F, Wu GY. Hepatitis B virus infection of transplant-ed human hepatocytes causes a bioche-mical and histological hepatitis in immunocopeten-tent rats. World J Gastroenterol. 2003;9:978-983. [PubMed] |
| 27. | Laconi E, Laconi S. Principles of hepatocyte repopu-lation. Semin Cell Dev Biol. 2002;13:433-438. [PubMed] |
| 28. | Laconi S, Pillai S, Porcu PP, Shafritz DA, Pani P, Laconi E. Massive liver replacement by transplanted hepatocytes in the absence of exogenous growth stimuli in rats treated with retrorsine. Am J Pathol. 2001;158:771-777. [PubMed] |
| 29. | Zheng YW, Ohkohchi N, Taniguchi H. Quantitative evaluation of long-term liver repopulation and the reconstitution of bile ductules after hepatocellular transplantation. World J Gastroenterol. 2005;11:6176-6181. [PubMed] |